Повышение эффективности лечения больных раком предстательной железы
Автор: Киприянов Е.А., Важенин А.В., Карнаух П.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 1 (31), 2009 года.
Бесплатный доступ
Описана методика, повышающая эффективность лечения рака предстательной железы. Проанализированы отдаленные результаты лечения 92 больных раком предстательной железы, получивших комплексное лечение - дистанционную лучевую терапию в сочетании с локальной трансуретральной гипертермией, на фоне гормонотерапии, и больных, получивших комбинированное гормонолучевое лечение. Представлены данные трех- и пятилетней выживаемости с локализованным раком предстательной железы. У больных трехлетняя выживаемость в исследуемой группе составила 100 %, в контрольной - 88 %; пятилетняя - 88 % и 34 % соответственно. При III стадии заболевания трехлетняя выживаемость составила в исследуемой группе - 75 %, в контрольной - 62 %. Пятилетняя выживаемость - 72 % и 25 % соответственно. При IV стадии заболевания трехлетняя выживаемость в исследуемой группе составила 78 %, в группе контроля - 35 %, пятилетняя выживаемость в исследуемой группе составила 40 %, в контрольной 0 %.
Рак предстательной железы, дистанционная гамма терапия, локальная гипертермия, отдаленные результаты лечения
Короткий адрес: https://sciup.org/14055115
IDR: 14055115 | УДК: :
Текст научной статьи Повышение эффективности лечения больных раком предстательной железы
Лучевая терапия в последние два десятилетия стала одним из ведущих методов лечения больных РПЖ. Этот метод успешно конкурирует с радикальной простатэктомией. Несомненным преимуществом лучевой терапии при характерной для рака предстательной железы неоднородности морфологического состава опухоли является ее воздействие как на гормонзависи-мые клетки, так и на резистентные к действию гормонов. При ранних стадиях опухолевого процесса лучевое воздействие в СОД 60–70 Гр позволяет достичь местного излечения. Однако при местно-распространенном опухолевом процессе, в котором обычно имеются обширные
Е.А. КИПРИЯНОВ, А.В. ВАЖЕНИН, П.А. КАРНАУХ радиорезистентные гипоксические зоны, у половины больных после лучевой терапии возникают рецидивы или наблюдается продолженный рост опухоли. Попытки увеличения суммарной очаговой дозы выше 65–70 Гр несут в себе вероятность серьезных лучевых повреждений [5, 8, 9]. Для селективного усиления лучевого воздействия на опухоль применяют локальную гипертермию. Установлено, что тепловое воздействие свыше 42ºС повышает чувствительность клеток к действию ионизирующего излучения. Последнее объясняется временной инактивацией ферментов репаративного комплекса или нарушением координации пострадиационных восстановительных процессов в опухоли. Кроме того, гипертермия непосредственно вызывает гибель опухолевых клеток, особенно гипоксических популяций [1, 3].
Цель исследования – установить эффективность лечения больных раком предстательной железы, сочетанием дистанционной лучевой терапии (ДГТ) с микроволновой трансуретральной гипертермией.
Материал и методы
С 2000 г. в Челябинском областном клиническом онкологическом диспансере разработана и применяется оригинальная методика терморадиомодификации (патент № 2238776). Нами проведен ретроспективный анализ результатов лечения 92 больных РПЖ, получивших лучевую терапию на фоне термомодификации. Все пациенты разделены на группы в соответствии с международной классификацией ТNМ: I группа – рак предстательной железы I–II стадии (локализованная форма) – 15 человек; во II группу вошли пациенты с III стадией заболевания – 58 человек; III группа – больные, страдающие РПЖ IV стадии, – 19 человек. Средний возраст составил 66,3 года.
Для морфологической верификации диагноза всем пациентам выполнялась полифокальная биопсия предстательной железы. В последующем назначалась гормонотерапия в режиме МАБ (хирургическая или медикаментозная кастрация + стероидные или нестероидные антиандрогены). Пациентам с I–III стадией заболевания лучевую терапию проводили по СПЛИТ-курсу, в режиме динамического фракционирования:
первые три фракции по 4 Гр, до суммарной очаговой дозы 12 Гр. После этого ДГТ сочетали с микроволновой трансуретральной гипертермией. На первом этапе лечения, по достижении суммарной очаговой дозы 38 Гр, проводили до 5 сеансов гипертермии. После двухнедельного перерыва следовал второй этап лечения, на котором суммарная очаговая доза достигала радикальной (СОД 65–70Гр), в сочетании с пятью сеансами гипертермии. Пациенты с IV стадией заболевания получили паллиативные курсы дистанционной гамма-терапии.
Гипертермия осуществлялась путем введения термального электрода в простатический отдел уретры. Температура контролировалась датчиками, расположенными в четырех точках термального электрода. Воздействие на предстательную железу составляло 40,46 МГц в радиочастотном диапазоне, при этом максимальная мощность достигала 40 Вт. В ткани предстательной железы достигалась температура до 41–43ºC, что было подтверждено прямой термометрией, путем трансректального введения четырех термодатчиков непосредственно в ткань предстательной железы.
Анализ результатов проведенного лечения сравнивали с контрольной группой, состоявшей из 108 пациентов, получивших комбинированное лечение по схеме – ДГТ в сочетании с гормонотерапией. Контрольная группа была сопоставима с основной по возрасту (средний возраст – 67,3 года), дифференцировке первичной опухоли, стадии заболевания (локализованная форма – 20, III стадия – 42, IV стадия – 46 пациентов).
Результаты и обсуждение
Ближайшие результаты лечения оценивались по следующим критериям: уровню общего PSA, объему предстательной железы (первичный очаг), объему остаточной мочи. До лечения уровень общего PSA в исследуемой группе составлял 50 нг/мл, в контрольной – 60 нг/мл; через 3 мес после окончания лечения – 7,5 нг/ мл и 15 нг/мл; через 6 мес – 3,5 нг/мл и 15 нг/мл соответственно. Исходный объем предстательной железы в исследуемой группе в среднем составлял 56,34 см3, в контрольной – 76 см3. Через 3 мес объем простаты в основной группе уменьшился до 25 см3, в контрольной – до 48 см3;
ПОВЫШЕНИЕ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ БОЛЬНЫХ РАКОМ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
через 6 мес – до 15 см3 и 43 см3 соответственно. Объем остаточной мочи в исследуемой группе до лечения составлял в среднем 75 мл, через 3 мес остаточная моча определялась только у 9 пациентов, среднее значение ее равнялось 20 мл. В контрольной группе этот показатель до лечения составлял 80 мл, через 3 мес – 50 мл, через 6 мес – 20 мл.
месяцы
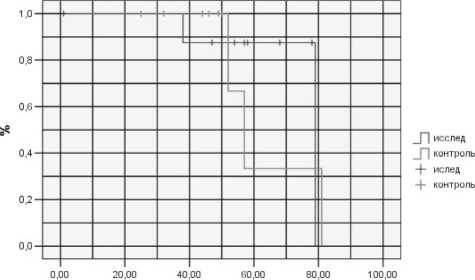
Рис. 1. Показатели отдаленной выживаемости пациентов с локализованной формой РПЖ в зависимости от метода лучевой терапии
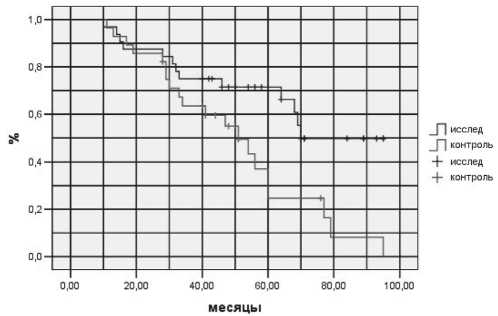
Рис. 2. Показатели отдаленной выживаемости у больных РПЖ III стадии в зависимости от метода лучевой терапии
Отдаленные результаты лечения оценивались путем расчета онкоспецифической выживаемости. У пациентов с локализованной формой РПЖ 3-летняя выживаемость в исследуемой группе составила 100 %, в контрольной – 88 %; 5-летняя – 88 % и 34 % соответственно (рис. 1). У больных с III стадией заболевания 3-летняя выживаемость в исследуемой группе составила 75 %, в контрольной – 62 %, 5-летняя выживаемость – 72 % и 25 % соответственно (рис. 2). Показатели 3-летней выживаемости при терморадиомодификации у больных раком предстательной железы IV стадии составили 78 % против 35 % в контрольной группе, 5-летней выживаемости – 40 % и 0 % соответственно (рис. 3).
Таким образом, комплексное лечение РПЖ, включающее дистанционную гамма-терапию, локальную микроволновую гипертермию, гормонотерапию, ведет к улучшению непосредственных и отдаленных результатов лечения данной категории больных.


