Повышение эффективности опыления капусты белокочанной в случае низкой жизнеспособности пыльцы
Автор: Шумилина Д.В., Батманова А.И., Шмыкова Н.А., Бондарева Л.Л.
Журнал: Овощи России @vegetables
Рубрика: Теория и практика селекции и семеноводства сельскохозяйственных культур
Статья в выпуске: 4 (25), 2014 года.
Бесплатный доступ
В статье отражены результаты исследований по разработке способа повышения эффективности опыления капусты белокочанной в случае низкой жизнеспособности пыльцы. Подобрана оптимальная питательная среда для проращивания пыльцы капусты белокочанной, содержащая Трис, поддерживающий значение рН 8-9, и предложено наносить пыльцу на рыльце пестика в виде суспензии в этой среде. Использование такого приема позволило получить семена у удвоенных гаплоидных растений с частично стерильной пыльцой.
Капуста белокочанная, гаплоиды, опыление, жизнеспособность пыльцы, питательные среды для проращивания пыльцы
Короткий адрес: https://sciup.org/14025111
IDR: 14025111 | УДК: 635.342:581.162.3
Текст научной статьи Повышение эффективности опыления капусты белокочанной в случае низкой жизнеспособности пыльцы
Репродукция растительного материала является центральным вопросом селекции. Генетики, селек- ционеры и семеноводы используют половую и вегетативную репродукцию на различных этапах селекционного процесса, включая создание исходного материала, отбор, поддержание и размножение перспективного сортолинейного материала (Бунин, 2003). Размножение ценного материала является одной из первых задач при работе селек- ционера с удвоенными гаплоидами, полученными в культуре микроспор. Как правило, в результате индукции андрогенного эмбриогенеза из каждой мик- роспоры получается одно растение – регенерант. Поскольку для селекционной работы необходимо иметь большее количество индивидуальных растений, первым этапом становится самоопыление растений-регенерантов для получения семенного потомства – так называемой линии. Успешность самоопыления растений складывается из таких со- ставляющих как самосовместимость, фертильность растения, в частности наличие большого количества зрелой пыльцы в пыльниках на момент их открытия, и жизнеспособность пыльцы, способность прорастать на рыльце пестика.
Довольно часто у капустных культур, в частности у капусты белокочанной, наблюдается самонесовместимость. Как правило, при необходимости самоопыления таких растений селекционеры применяют методику опыления в бу- тонах, то есть пыльцу с раскрывшихся цветков наносят на рыльце пестиков нераскрывшихся бутонов.
Фертильность растений зависит от условий внешней среды и возраста растений. Неблагоприятные почвенные и климатические условия и старение растений увеличивают их стерильность.
Другим фактором, обеспечивающим нормальное оплодотворение и качество завязавшихся семян, является жизнеспособность пыльцы (Френкель Р., 1982). Накопленные данные показывают, что на жизнеспособность и качество пыльцы оказывают влияние такие факторы среды, как влажность, температура, состав атмосферы (Stanley, Linskens, 1974). Жизнеспособность пыльцы снижается у растений, пострадавших от засухи, обезвоживания, теплового стресса и УФ-излучения (Bots, Mariani, 2005). Показатели жизнеспособности пыльцы имеют решающее значение для прогнозирования качества семенной продукции и при проведении работ по гибридизации самонесов-местимых растений. Большое значение для селекционера имеет возможность предварительного определения степени жизнеспособности используемой в его работе пыльцы.
Существует несколько методов определения жизнеспособности пыльцы в лабораторных условиях, наиболее распространенным из которых является проращивание пыльцы на искусственных питательных средах in vitro (Бунин, 2003). Основными компонентами таких питательных сред являются сахароза, борная кислота, хлорид кальция или нитрат кальция, сульфат магния, нитрат калия (Чеботарь и др. 1987; Важнецкая, 1965; Балашова и др., 1995; Степанов и др., 2000; Лях и др., 2000; Matsubara et al., 1999). Для роста пыльцевых трубок некоторых растений в состав искусственной питательной среды вводят экстракт из рыльца пестика. Подбор универсальной среды для проращивания пыльцы является затруднительным, поскольку требования пыльцы к среде изменяются не только в зависимости от вида или разновидности, но и от конкретных условий произрастания исследуемого растения.
Для определения жизнеспособности пыльцы у разных видов рода Brassica предложено несколько вариантов питательных сред, где одним из важных факторов является рН, определенный уровень которого достигается с помощью буферных смесей. Часто в таких случаях используют трис-буфер (трис-гидроксиметиламинометан), который обеспечивает подщелачивание среды, необходимое для проращивания пыльцы растений рода Brassica (Лях, 2000; Matsubara, 1999).
Целью данного исследования являлось повышение эффективности опыления капусты белокочанной в случае низкой жизнеспособности пыльцы. Для этого решалась задача подбора оптимальной питательной среды для проращивания пыльцы и способа нанесения суспензии пыльцы на рыльце пестика.
Материалы и методы исследований
Объект исследований . Объектом исследований служили растения капусты белокочанной сортов Зимовка 1474, Слава грибовская 231, созданных в лаборатории селекции и семеноводства капустных культур ФГБНУ ВНИИССОК, и девять растений удвоенных гаплоидов, полученных методом изолированных микроспор в лаборатории биотехнологии ФГБНУ ВНИИССОК. Растения выращивали в климатической камере при режиме 15°С круглосуточно, 16 ч день/8 ч ночь. Затем растения были высажены в пленочную теплицу и осенью в фазе «20-25 настоящих листьев» пересажены в вегетационные сосуды объемом 5 литров, которые в зимний период были помещены на яровизацию при t= 3…5°С. В весенне-летний период следующего года растения выращивали в пленочной теплице для получения семенников.
Определение фертильности растений. Фертильность растений устанавливали путем окрашивания пыльцевых зерен методом дифференциального окрашивания (Alexander, 1969). Пыльник отделяли от полностью раскрывшегося цветка и помещали в каплю красителя, препаровальными иглами вскрывали пыльник и добивались максимального выхода пыльцевых зёрен, после чего стенки пыльника удаляли из препарата и накрывали пыльцу покровным стеклом. Стерильная пыльца окрашивалась в зеленовато-голубой цвет, фертильная – от розового до интенсивно красного. Наблюдения проводили с помощью микроскопа Axio Imager А2 (Zeiss, Германия).
Подбор сред для проращивания пыльцы . Сбор пыльцы проводили с недавно раскрывшихся цветков капусты белокочанной сорта Зимовка 1474 в период массового цветения. Для определения жизнеспособности пыльцы на предметное стекло наносили пипеткой несколько капель питательной среды. Свежесобранную пыльцу при помощи пинцета равномерно распределяли на поверхности среды. В опыте использовали четыре варианта сред: Т, Т+, 8, 8+ (табл.1). В двух вариантах сред (Т+ и 8+) использовали экстракт пестиков цветков капусты белокочанной сорта Слава грибовская 231. Выбор сорта для получения экстракта был обусловлен показанной ранее совместимостью сортов Слава грибовская 231 и Зимовка 1474 при перекрёстном опылении. Экстракт готовили путём растирания 1 пестика в 1 мл воды и последующим цетрифуги-рованием с целью удаления осадка. К 20 мкл среды добавляли 1 мкл экстракта. Предметные стекла с пыльцой в питательной среде помещали в увлажненные чашки Петри и оставляли в термостате на 2 часа при t=22°С для проращивания. Далее к среде с проросшей пыльцой добавляли несколько капель дифференцирующего красителя и накрывали покровным стеклом. В каждом препарате анализировали не менее 10 полей зрения (увеличение 100х), подсчитывали общее число пыльцевых зерен и число проросших. Проросшими считали пыльцевые зерна, трубки которых по длине превышали диаметр пыльцевого зерна. Жизнеспособность
1. Искусственные среды для проращивания пыльцевых зёрен капусты белокочанной
|
Состав среды |
Среда Т* |
Среда Т+ |
Среда 8** |
Среда 8+ |
|
Сахароза, г |
20 |
20 |
20 |
20 |
|
Бор, мг |
1 |
1 |
10 |
10 |
|
Нитрат кальция, мг |
- |
- |
10 |
10 |
|
Нитрат калия, мг |
10 |
10 |
- |
- |
|
Хлорид кальция x 6 H2O, г |
36,2 |
36,2 |
- |
- |
|
рН |
от 8 до 9 |
от 8 до 9 |
8 |
8 |
|
Трис, мг |
6,7-13,3 |
6,7-13,3 |
- |
- |
|
Экстракт из пестика, сорт Слава |
- |
+ |
- |
+ |
|
Вода, мл |
100 |
100 |
100 |
100 |
* Roberts I. N. et al, 1983.
**Бунин М.С. и др., 2003
пыльцы определяли путем вычисления процента проросших пыльцевых зерен по отношению к общему количеству пыльцевых зерен (Бунин, 2003).
Опыление растений . Для проведения самоопыления опытных растений в пробирку с 1 мл среды Т помещали пыльники с раскрывшихся цветков удвоенных гаплоидов. Далее с помощью вольфрамового пестика проводили измельчение пыльников. Полученную суспензию пыльцевых зёрен сразу переносили на рыльца пестиков в нераскрывшихся бутонах. Опыленные таким образом бутоны отмечались этикетками. Параллельно в качестве контроля проводили самоопыление капусты белокочанной сорта Зимовка 1474 без использования среды.
Статистическая обработка. Статистическую обработку полученных данных проводили в программе Microsoft Exсel 2003 при уровне значимости 0,05.
В таблице 2 и рисунке 2 данные представлены в формате М ± tm, где M – среднее арифметическое, t – критерий Стъюдента, m – ошибка среднего.
Результаты исследований и их обсуждение
Полученные ранее удвоенные гаплоиды капусты белокочанной были высажены в защищенный грунт с целью получения семенного потомства для дальнейшей селекционной работы. В летний период 2014 года были обнаружены трудности при самоопылении этих растений: пыльники плохо раскрывались и содержали малое количество пыльцы.
При цитологическом анализе пыльцевых зёрен методом дифференциальной окраски было показано, что содержание зрелых пыльцевых зерен в пыльниках не превышает 10% (рис. 1).
Для того чтобы получить семенное потомство, необходимо было подобрать питательную среду для проращивания пыльцы, нанесение в которой пыльцевых зёрен на пестики нерас-крывшихся бутонов привело бы к завязыванию семян.
Из-за недостаточного количества пыльцы у растений удвоенных гаплоидов опыты по подбору сред были проведены на сорте Зимовка 1474, растения которого, в числе других, были использованы в качестве родительских при получении удвоенных гаплоидов.
В результате анализа интенсивности прорастания пыльцевых зерен капусты белокочанной сорта Зимовка 1474 на различных средах, была выделена среда Т, на которой было зафиксировано наибольшее число проросших пыльцевых зёрен – 17,46 % (рис.2). Мы предполагаем, что положительное влияние
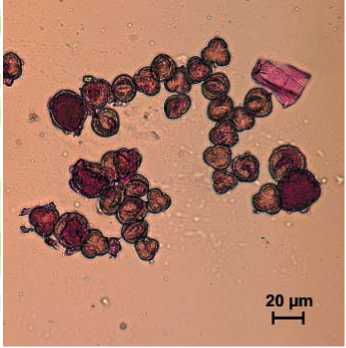
Пыльца удвоенных гаплоидных растений

Жизнеспособные пыльцевые зёрна
Рис. 1. Цитологический анализ пыльцевых зерен капусты белокочанной
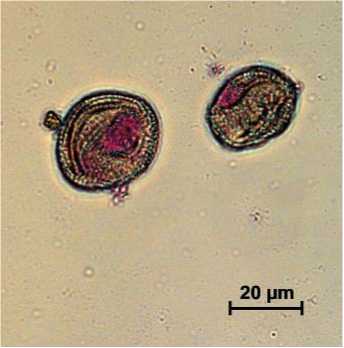
Стерильные пыльцевые зерна
на прорастание оказывает трис-буфер, обеспечивающий поддержание уровня рН (рис.3). Число пыльцевых зёрен, проросших на среде 8, не содержащей буферного раствора, оказалось минимальным. Добавление экстракта пестика в состав среды 8 привело к некоторому увеличению доли проросшей пыльцы, однако разница между средой с добавлением экстракта и без него была статистически не существенной. В то же время, в среде, содержащей трис, при добавлении экстракта пестика наблюдали существенное снижение способности пыльцы к прорастанию. В результате среда Т на основе трис-буфера без экстракта пестика была выбрана для проведения искусственного самоо- пыления девяти растений удвоенных гаплоидов, у которых была отмечена низкая жизнеспособность пыльцы.
Растения удвоенных гаплоидов капусты белокочанной с низкой жизнеспособностью пыльцы были подвергнуты самоопылению в бутонах. Через 2,5 месяца был произведён сбор созревших семян в опыте и контроле. В контрольном варианте, при самоопылении растений сорта Зимовка1474, завязалось в среднем 23 семени на стручок (табл. 2). В вариантах опыта, где опыление удвоенных гаплоидных растений с низкой жизнеспособностью пыльцы проводили без использования среды, завязывания семян не происходило. После опыления таких растений суспензи- ей пыльцы в питательной среде Т завязалось в среднем 7 семян на стручок. Несмотря на то, что завязываемость семян у удвоенных гаплоидов при использовании среды Т оказалась меньшей по сравнению с контрольными растениями капусты белокочанной сорта Зимовка 1474, тем не менее, такое количество семян является достаточным для проведения дальнейшей селекционной работы.
Таким образом, было показано, что использование среды Т для проращивания пыльцевых зерен капусты белокочанной при самоопылении растений с низким содержанием жизнеспособной пыльцы является одним из способов получения семенного потомства.
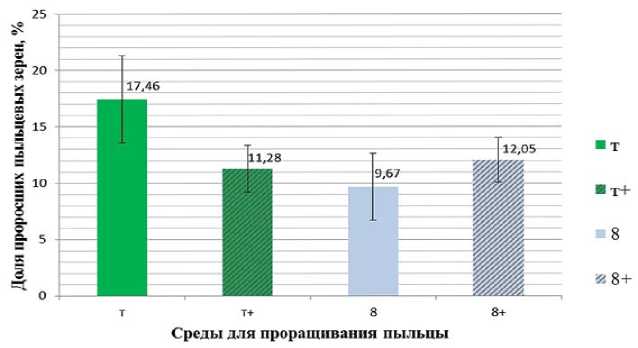
Рис. 2. Влияние различных сред на прорастание пыльцевых зёрен капусты белокочанной сорта Зимовка 1474
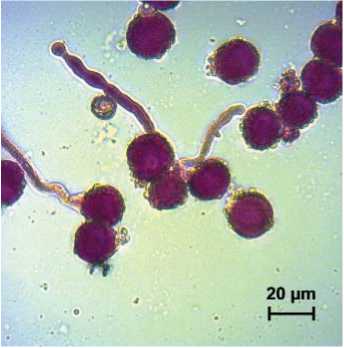
Рис.3. Прорастание пыльцы капусты белокочанной сорта Зимовка в среде Т
Список литературы Повышение эффективности опыления капусты белокочанной в случае низкой жизнеспособности пыльцы
- Балашова Н.Н., Игнатов А.Н., Самохвалов А.Н., Рогачев Ю.Б., Шмыкова Н.А. Жизнеспособность микрогаметофита белокочанной капусты под влиянием возбудителей бактериозов и килы//С.-х. биология. -1995, № 5. -С. 115-118.
- Бунин М.С., Шмыкова Н.А. Степанов В.И., Старцев В.И., Бондарева Л.Л. Методы репродуктивной биологии в селекции овощных культур рода Brassica 1_.//Методические рекомендации. ВНИИССОК. -Москва, 2003.
- Важнецкая Е.Р. Некоторые особенности биологии брюквы и репы в связи с межвидовой гибридизацией. Автореф. дис. канд. с.-х. наук. -Л, 1965.
- Лях В.А., Сорока А.И., Мищенко Л.Ю. Калинова М.Г., Мирошниченко Е.Н. Методы отбора ценных генотипов на уровне пыльцы.//Методические рекомендации. Ин-т масличных культур Укр. Академии аграрных наук. -Запорожье, 2000.
- Степанов В.А., Бунин М.С., Балашова Н.Н. Методические указания по селекции репы японской на холодостойкость с использованием микрогаметофита.//Методические указания по гаметной селекции сельскохозяйственных растений (методология, результаты и перспективы). -М.: 2000. -С.127-149.
- Френкель Р. Механизмы опыления, размножения и селекции растений/Р.Френкель, Э. Гадун -М.: Колос, 1982. -384 с.
- Чеботарь А.А., Челак В.Р. и др. Эмбриология зерновых, бобовых и овоще-бахчевых возделываемых растений. Кишинев, Штиница.1987. -С. 224.
- Alexander M.P. Differential staining of aborted and non-aborted pollen.//Stain technol. 1969. V.44. №3. P.117-122.
- Bots M, Mariani C. Pollen viability in the field. Universitet Nijmegen. 2005. -P. 2-52.
- Matsubara S., Murakami K., Tawara H., Hamamoto Y., Harasawa N. Promoters of in vitro pollen germination of Radish and Brassica campestris.//J. Japan. Soc. Hort. Sci. -1999. -V.68. -№2. -P.421-427.
- Roberts I. N., Gaude T. C., Harrod G., Dickinson H. G. Pollen-stigma interactions in Brassica oleracea; a new pollen germination medium and its use in elucidating the mechanism of self incompatibility. Springer-Verlag. Berlin. -1983. -Р. 231-238.
- Stanley R.G., Linskens H.F. Pollen Biology. Biochemistry and Managements. -1974. -P. 307.


