Предикторы несостоятельности колоректального анастомоза после передних резекций прямой кишки при локализованных злокачественных новообразованиях
Автор: Иванов Ю.В., Смирнов А.В., Давидович Д.Л., Кешвединова А.А., Разбирин Д.В., Станкевич В.Р., Данилина Е.С.
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.15, 2024 года.
Бесплатный доступ
Обоснование. Несостоятельность колоректального анастомоза - наиболее грозное осложнение в хирургии прямой кишки. Предсказание и предотвращение несостоятельности колоректального анастомоза остаётся актуальной задачей. Цель исследования - анализ опыта передней резекции при раке прямой кишки и ректосигмоидного соединения, а также установление факторов риска развития несостоятельности колоректального анастомоза на примере пациентов, пролеченных в ФГБУ ФНКЦ ФМБА России.
Рак прямой кишки, колоректальный рак, илеостома, трансверзостома, превентивная кишечная стома, несостоятельность анастомоза
Короткий адрес: https://sciup.org/143182765
IDR: 143182765 | DOI: 10.17816/clinpract623690
Текст научной статьи Предикторы несостоятельности колоректального анастомоза после передних резекций прямой кишки при локализованных злокачественных новообразованиях
Иванов Ю.В., Смирнов А.В., Давидович Д.Л., Кешвединова А.А., Разбирин Д.В., Станкевич В.Р., Данилина Е.С. Предикторы несостоятельности колоректального анастомоза после передних резекций прямой кишки при локализованных злокачественных новообразованиях. Клиническая практика. 2024;15(1):7–16. doi:
BACKGROUND: Anastomotic leak is the most serious complication in rectal surgery. Predicting and preventing anastomotic leak remains an urgent task. AIM: The purpose of the study is to analyze the 17-year-long experience of the Federal Research Clinical Center of Specialized Medical Care and Medical Technologies of FMBA of Russia in performing an anterior resection of the rectum in patients with cancer of the rectum and rectosigmoid junction and to establish the risk factors for the development of an anastomotic leak. METHODS: The results of the treatment of 492 patients who underwent an anterior resection of the rectum in 2006–2022 have been studied. 21 patients developed an anastomotic leak. A retrospective comparison of the characteristics of two groups of patients was carried out: those with a smooth course of the postoperative period and those with the development of an anastomotic leak. RESULTS: The reliable risk factors for the development of an anastomotic leak were identified and, based on the statistical analysis, a prognostic scoring model was proposed: smoking — 1 point, type 2 diabetes mellitus — 1 point, preoperative chemotherapy — 1 point, blood loss over 50 ml — 2 points, preoperative radiation therapy — 3 points, and the location of the colorectal anastomosis at a distance of up to 5 cm from the anus — 4 points. The sensitivity of the model was 85.6%, with the specificity above 97.4% when using a training set with 8 points or more. CONCLUSION: The following tactics are proposed: in the case of 4 points and above by the developed scale, one should form a preventive intestinal stoma; in the case of 1–3 points, one should install a transanal drainage. The complete abandonment of these two preventive measures is possible only if the patient does not have any of the listed risk factors for the development of an anastomotic leak.
Ivanov YuV, Smirnov AV, Davidovich DL, Keshvedinova AA, Razbirin DV, Stankevich VR, Danilina E.S. Predictors of anastomotic leak after anterior rectal resections for localized malignant neoplasms. Journal of Clinical Practice. 2024;15(1):7–16. doi:
Submitted 21.11.2023
Revised 26.02.2024
Published online 25.03.2024
развития данного осложнения и разработки мер адекватной профилактики.
Цель исследования — проанализировать 17-летний опыт ФГБУ ФНКЦ ФМБА России в выполнении передней резекции прямой кишки у пациентов, страдающих раком прямой кишки и ректосигмоидного соединения, и установить факторы риска развития несостоятельности колоректального анастомоза (НКА).
МЕТОДЫ
Дизайн исследования
Исследование является одноцентровым, ретроспективным, описательным и выполнено в рамках научно-исследовательской работы «Разработка персонифицированного подхода к хирургическому лечению колоректального рака» (регистрационный номер 122041100179-4).
Проанализированы результаты лечения 492 пациентов, которым в 2006–2022 годах в Федеральном научно-клиническом центре специализированных видов медицинской помощи и медицинских технологий ФМБА России выполнены передние резекции прямой кишки по поводу рака прямой кишки (384 пациента) и ректосигмоидного соединения (108 пациентов). Проведено сравнение основных предоперационных и интраоперационных характеристик между двумя группами пациентов, у которых послеоперационный период протекал гладко ( n =471) или развилась НКА ( n =21). Под НКА в нашем исследовании мы понимали несостоятельность классов В и С по классификации Международной исследовательской группы по раку прямой кишки (International Study Group of Rectal Cancer, ISREC), несостоятельность класса А не учитывалась [10].
Критерии соответствия
Критерии включения : возраст от 18 до 80 лет; наличие резектабельной аденокарциномы прямой кишки и ректосигмоидного соединения (стадия заболевания cT1-4N0-2M0-1); расположение нижнего полюса опухоли не менее 4 см от анального канала; отсутствие вовлечения в процесс анальных сфинктеров.
Критерии исключения : плоскоклеточный рак; местнораспространённая форма заболевания; необходимость мультиорганной резекции; рецидив рака прямой кишки; наличие осложнений неоадъювантной химио- и лучевой терапии.
Условия проведения
Все операции выполнены на базе ФГБУ ФНКЦ ФМБА России (Москва).
Продолжительность исследования
Проанализированы результаты передней резекции прямой кишки у пациентов с раком прямой кишки и ректосигмоидного соединения в ФГБУ ФНКЦ ФМБА России за 17 лет — с 2006 по 2022 год включительно.
Описание медицинского вмешательства
Всем пациентам проведена стандартная предоперационная подготовка, включающая коррекцию сопутствующих заболеваний и состояний (гипоаль-буминемии, анемии, водно-электролитных нарушений и т.п.), профилактику тромбоэмболических осложнений, антибиотикопрофилактику. При этом 86 пациентам проводилась пероральная антибио-тикопрофилактика по методике, описанной нами ранее [11]. Техника выполнения хирургического вмешательства была стандартной и не отличалась от описанной ранее [11, 12].
Интраоперационная профилактика несостоятельности сформированного колоректального анастомоза заключалась в особом способе формирования аппаратного анастомоза, когда выдвижение троакара сшивающего аппарата через стенку кишки производили у левого угла культи, чтобы после прошивания и пересечения кишки оставался только один угол (правый) анастомозированной культи прямой кишки. Оставшийся угол ушивали П-образным швом. Во всех случаях проводили интраоперационную оценку герметичности анастомоза с помощью воздушной пробы. В случаях положительной или сомнительной пробы накладывали дополнительные интракорпоральные серозно-мышечные швы атравматической иглой на 2, 4, 6, 8, 10 и 12 часах условного циферблата. В случаях наличия факторов риска (неоадъювантная терапия в анамнезе, гипоальбуминемия, статус N+, анемия) накладывали превентивную трансверзостому, однако решение о её формировании всегда принималось оперирующим хирургом интраоперационно.
Хирургическое вмешательство выполнялось лапароскопическим доступом у 307 (62,4%) пациентов, а лапаротомным — у 185 (37,6%). При наличии метастатического поражения, перенесённого инфаркта миокарда или нарушения мозгового кровообращения давностью до 1 года, наличии открытых хирургических вмешательств, хронической обструктивной болезни лёгких в анамнезе, оценки анестезиологического риска по шкале Американского общества анестезиологов (American Society of Anesthesiologists, ASA) >3 осуществлялся традиционный (лапаротомный) доступ. Частота конверсий составила 6,1% ( n =30): основными причинами были технические трудности при мобилизации кишки, узкий таз, возникшее интраоперационное кровотечение при лимфодиссекции, интимное прилежание новообразования к органам малого таза и невозможность достоверного подтверждения отсутствия инвазии в них. Все оперативные вмешательства были выполнены под комбинированным эндотрахе-альным наркозом, дополнительно осуществлялась постановка катетера для эпидуральной анестезии.
Этическая экспертиза
Проведение исследования одобрено локальным этическим комитетом ФГБУ ФНКЦ ФМБА России в ноябре 2020 года (протокол № 11).
Статистический анализ
Статистический анализ полученных результатов проводили с использованием непараметрических методов. Количественные данные представлены в виде медианы с указанием межквартильного размаха (Ме [Q1; Q3]). Различия между количественными характеристиками определяли с помощью критерия Манна–Уитни. Сравнение качественных характеристик проводили при помощи метода χ 2 (хи-квадрат). Проведены однофакторный анализ логистической регрессии и анализ ROC-кривой. Использовали программное обеспечение IBM SPSS 27. Полученные различия были признаны статистически достоверными при р <0,05 (95% точность).
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Проанализированы результаты лечения 492 пациентов, которым в 2006–2022 годах выполнены


передние резекции прямой кишки по поводу рака прямой кишки ( n =384) и ректосигмоидного соединения ( n =108).
Послеоперационный период протекал гладко в 471 (95,7%) случае, у 4,3% (n=21) пациентов развилась НКА, из них у 38% (n=8) — типа В, у 62% (n=13) — типа С. При НКА класса В, если первичная операция была завершена без превентивной стомы, несостоятельность обязательно формировалась. Основным методом лечения НКА класса В была эндоскопическая вакуумная терапия. При несостоятельностях класса С выполнялись повторные хирургические вмешательства с разобщением анастомоза и выведение колостомы. В группе с НКА летальность составила 19% (n=4) и была связана с развитием сепсиса и полиорганной недостаточности. В группе без НКА умерли 3 (0,6%) пациента, причиной смерти стали массивная тромбоэмболия лёгочной артерии и острая сердечно-сосудистая недостаточность. Общая госпитальная летальность — 1,4% (n=7). Анализ характеристик пациентов и их периоперационные показатели представлены в табл. 1.
Характеристика пациентов и периоперационные показатели / Patient characteristics and perioperative indicators
Таблица 1 / Table 1
|
Показатель |
Группа без НКА, n =471 (%) |
Группа с НКА, n =21 (%) |
p |
|
Пол:
|
248 (52,7) 223 (47,3) |
8 (38,1) 13 (61,9) |
0,192 |
|
Возраст, лет, Ме [Q1; Q3] |
63 [48,5; 69,5] |
57 [48,5; 65,5] |
0,317 |
|
Индекс массы тела, кг/м2:
|
147 (31,2) 262 (55,6) 62 (13,2) |
11 (52,4) 7 (33,3) 3 (14,3) |
0,098 |
|
Сахарный диабет: • да • нет |
56 (11,9) 415 (88,1) |
6 (28,6) 15 (71,4) |
0,025 |
|
Нарушение ритма сердца:
|
75 (15,9) 396 (84,1) |
3 (14,3) 18 (85,7) |
0,841 |
|
ASA
|
288 (61,1) 183 (38,9) |
13 (61,9) 8 (38,1) |
0,945 |
|
Курение
|
226 (48) 245 (52) |
15 (71,4) 6 (28,6) |
0,036 |
|
Неоадъювантная терапия:
|
28 (5,9)/443 (94,1) 9 (1,9)/462 (98,1) |
4 (19)/17 (81) 3 (14,3)/18 (85,7) |
0,018 <0,001 |
|
Пероральная антибактериальная профилактика |
86 (18,6) |
0 (0) |
0,032 |
|
C-реактивный белок после операции, Ме [Q1; Q3] |
150 [74; 186] |
140 [82; 194] |
>0,05 |
|
Лабораторные показатели до операции, Ме [Q1; Q3]:
|
38 [35,3; 40] 66,5 [57; 71] 6,7 [5,6; 7,5] 128 [115; 135] 5,4 [5; 5,6] |
38,5 [36,3; 43,8] 69,5 [63,7; 71,5] 7,95 [5,9; 8,9] 138,5 [125; 146] 5,4 [4,9; 6,3] |
>0,05 |
|
Лабораторные показатели после операции, Ме [Q1; Q3]:
|
35 [34; 36] 56 [47; 59] 11,2 [9; 14] 115 [109; 122] 5,6 [4,6; 6,7] |
33,5 [32,2; 34,8] 60 [56,2; 60,7] 12,3 [7,5; 18,5] 121,5 [107; 130] 6,8 [6,5; 7,5] |
>0,05 |
Примечание. НКА — несостоятельность колоректального анастомоза; ASA — анестезиологическая оценка физического состояния пациента перед операцией по шкале Американского общества анестезиологов.
Note. НКА — colorectal anastomotic leak; ASA (American Society of Anesthesiologists) — anesthetic assessment of the patient’s physical condition before surgery.
При проведении однофакторного анализа установлено, что в нашей практике из совокупности анализируемых факторов значимыми оказались только наличие сахарного диабета 2-го типа, курение, проведение неоадъювантного лечения. Пол, возраст, индекс массы тела, наличие аритмии, операционно-анестезиологический риск по ASA и лабораторные показатели в сравниваемых группах не отличались. Начиная с 2017 года, в отделении хирургии ФГБУ ФНКЦ ФМБА России проводится исследование влияния пероральной антибактериальной профилактики. Ни у одного из 86 пациентов, получавших антибактериальную профилактику перед операцией, НКА не развилась.
При изучении характеристик опухоли и оперативного вмешательства (табл. 2) получено отсутствие различий по таким параметрам, как размер опухоли и стадия онкологического процесса. До- стоверные различия выявлены только по расстоянию расположения анастомоза от ануса: если он располагался менее чем на 5 см, вероятность развития несостоятельности увеличивалась. Тип операционного доступа, а также применение к пациенту мер профилактики в виде формирования кишечной стомы либо трансанального дренирования не влияли на частоту возникновения несостоятельности. При наличии кровопотери свыше 100 мл несостоятельность развивалась чаще. Интересно отметить, что при продолжительности операции менее 180 минут достоверно чаще возникала НКА.
В дальнейшем были выбраны характеристики, показавшие достоверность при проведении однофакторного анализа, и к ним была применена модель логистической регрессии. Полученные отношения шансов и 95% доверительные интервалы (95% ДИ) представлены в табл. 3.
Таблица 2 / Table 2
Характеристики опухоли и оперативного вмешательства / Characteristics of the tumor and surgery
|
Показатель |
Группа без НКА, n =471 (%) |
Группа с НКА, n =21 (%) |
p |
|
Размеры опухоли, см: • <5 • ≥5 |
274 (58,2) 197 (41,8) |
14 (66,7) 7 (33,3) |
0,440 |
|
Расстояние от ануса, см:
|
35 (7,4) 183 (38,9) 253 (53,7) |
11 (52,4) 10 (47,6) 0 |
0,001 |
|
pT-стадия:
|
38 (8,1) 174 (36,9) 249 (52,9) 10 (2,1) |
0 (0) 12 (57,1) 9 (42,9) 0 (0) |
0,196 |
|
pN-стадия:
|
209 (44,4) 262 (55,6) |
10 (47,6) 11 (52,4) |
0,003 |
|
M-стадия:
|
448 (95,1) 23 (4,9) |
18 (85,7) 3(14,3) |
0,060 |
|
Тип операции:
|
292 (62) 179 (38) |
15 (71,4) 6 (28,6) |
0,383 |
|
Превентивная стома |
208 (44,2) |
7 (33,3) |
0,328 |
|
Трансанальный дренаж |
84 (17,8) |
4 (19) |
0,888 |
|
Время операции, мин: • >180 • ≤180 |
363 (77,1) 108 (22,9) |
8 (38,1) 13 (61,9) |
<0,001 |
|
Кровопотеря, мл:
|
268 (56,9) 203 (43,1) |
4 (19) 17 (81) |
<0,001 |
Примечание. НКА — несостоятельность колоректального анастомоза; pT, pN, M — Международная классификация стадий злокачественных новообразований (опухоль, узлы, метастазы).
Note. НКА — colorectal anastomotic leak; pT, pN, M — International classification of the stages of malignant neoplasms (tumor, nodus, metastasis).
Таблица 3 / Table 3


Расчёт отношения шансов (однофакторная логистическая регрессия) / Calculation of odds ratios (univariate logistic regression)
|
Фактор |
Отношение шансов |
95% ДИ |
p |
Количество баллов |
|
Курение |
2,89 |
1,1118–7,5164 |
0,0294 |
1 |
|
Сахарный диабет |
2,96 |
1,1047–7,95390 |
0,0309 |
1 |
|
Предоперационная химиотерапия |
3,72 |
1,1738–11,8068 |
0,0256 |
1 |
|
Кровопотеря свыше 100 мл |
5,6 |
1,8595–16,9297 |
0,0022 |
2 |
|
Предоперационная лучевая терапия |
8,55 |
2,1333–34,3124 |
0,0025 |
3 |
|
Анастомоз до 5 см от ануса |
13,7 |
5,4444–34,4885 |
<0,0001 |
4 |
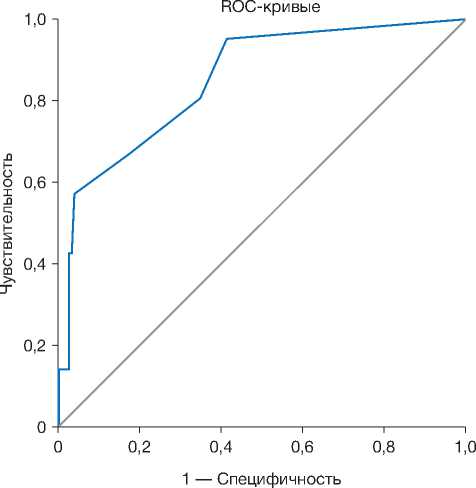
Исходя из полученных значений, данным характеристикам были присвоены следующие баллы: курение, сахарный диабет 2-го типа и предоперационная химиотерапия — по 1 баллу, кровопотеря свыше 50 мл — 2 балла, предшествующая лучевая терапия — 3 балла, расположение анастомоза менее чем в 5 см от ануса — 4 балла. Далее была построена ROC-кривая (рис. 1). Площадь под кривой (area under curve, AUC) составила 0,85, что свидетельствует об очень хорошей диагностической ценности. Чувствительность и специфичность предлагаемой модели при её применении к пролеченным пациентам была следующей: 5–7 баллов — чувствительность 67,1% при специфичности выше 96,6%, 8–11 баллов —
Диагональные сегменты, сгенерированные связями
Рис. 1. ROC-кривая предлагаемой прогностической модели.
Fig. 1. A ROC curve of the proposed predictive model.
чувствительность 85,6% при специфичности выше 97,4%. При наборе 12 баллов гипотетическая вероятность развития несостоятельности приближается к 100%, однако в нашей практике такого показателя не было ни у одного пациента.
ОБСУЖДЕНИЕ
Согласно предложенной классификации ISREC, НКА делят на три степени. К первой (А) степени относят несостоятельности, не требующие проведения активной терапевтической тактики. Они протекают для пациента бессимптомно, не вызывая изменений в лабораторных показателях, и чаще являются случайной находкой при предоперационном контрастном обследовании перед закрытием стомы. При второй (В) степени НКА пациент требует назначения антибактериальной терапии, установки дренажа в малый таз, динамического рентгенологического контроля, при этом лабораторно отмечается повышение уровня лейкоцитов и С-реактивного белка, по дренажу могут обнаруживаться следы мутного либо калового отделяемого в зависимости от размеров дефекта. Несмотря на отсутствие необходимости в хирургическом лечении данных пациентов, их выписка из стационара может быть отложена на длительный период. При третьей (С) степени единственной опцией является повторное хирургическое вмешательство, завершающееся либо обструктивной резекцией по типу Гартмана, либо формированием защитной илеостомы. Тяжесть состояния пациентов в таких случаях обусловлена развитием перитонита, органной дисфункции и сепсиса [10].
Многие исследования продемонстрировали наличие ряда предикторов НКА. Так, G. Brisinda и соавт. [13] отметили, что пациенты с НКА были значительно старше (68,2±10,7 года против 59,7±17,2), имели более низкие уровни альбумина (15,2% против 7,9 при уровне сывороточного альбумина более 35 г/л) и гемоглобина (11,8% против 7 при уровне гемоглобина более 100 г/л). Несостоятельность чаще наблюдается и у пациентов с потерей массы тела (17,3% против 9,1). При этом не обнаружено взаимосвязи развития НКА с полом, возрастом младше либо старше 65 лет, наличием вредных привычек (курение, употребление алкоголя) и сопутствующих заболеваний, проведением неоадъювантной терапии. Хирургический доступ и наличие превентивной илеостомы, по мнению авторов, также не влияют на развитие НКА. При этом больший объём кровопотери (365±50 мл против 175,5±45), продолжительность операции (186,0±40,2 минут против 115±47,8) и диаметр циркулярного сшивающего аппарата (11,8% при 28 мм против 5,4% при 25 мм) сопряжены с НКА [13].
M. Degiuli и соавт. [14] опубликовали результаты общенационального ретроспективного исследования Итальянского общества хирургической онкологии о факторах несостоятельности анастомоза. Среди 5398 пациентов несостоятельность зарегистрирована у 552 (10,2%) человек. Мужской пол, более высокий индекс массы тела к моменту операции, потеря веса более 10% в течение 6 месяцев, выполненные минимальные инвазивные (лапароскопические) хирургические вмешательства, муль-тиорганные комбинированные резекции, а также длительность операции более 3 часов достоверно были связаны с несостоятельностью при передней резекции прямой кишки. Отмечено, что наложение аппаратного, а не ручного анастомоза, а также использование более 1 картриджа степлерного сшивающего аппарата коррелирует с развитием более серьёзных осложнений. Меньшее расстояние опухоли от анального канала, локализация рака в средне- и нижнеампулярном отделе, стадия pT >2 значимо связаны с НКА [14].
R. Li и соавт. [15] при анализе рисков НКА выделили следующие значимые факторы: мужской пол, сахарный диабет, неоадъювантная терапия, расстояние анастомоза до ануса менее 5 см, размеры опухоли ≥5 см, интраоперационная кровопотеря более 50 мл.
D. Naoi и соавт. [16] определяли взаимосвязь высоты скобок сшивающего аппарата и толщины стенки прямой кишки при лапароскопической передней резекции. Анастомоз формировался с использованием техники двойного сшивания с использованием линейного (скобы 1,5, 1,8 и 2 мм) и циркулярного (диаметр 25, 28, 29 мм) аппарата. Выявлено, что в группе пациентов с НКА толщина стенки прямой кишки была больше (6,7 мм против 5,1), и применение линейных степлеров с меньшей высотой скобок сопряжено с развитием несостоятельности анастомоза (25% против 17,3 и 75% против 43,5 для высоты скоб 1,5 мм и 1,8 мм соответственно). Отмечено, что толщина стенки прямой кишки значительно больше у пациентов, перенёсших неоадъювантную терапию, что диктует необходимость использования скоб высотой 2 мм (несостоятельности при этом выявлено не было) [16].
Y. Jiang и соавт. [17] выявили, что частота НКА выше при использовании циркулярного сшивающего аппарата 32 мм по сравнению с 29 — 13,4% против 2,9. Помимо этого, значимыми факторами признаны мужской пол, сахарный диабет в анамнезе, субкомпенсированная кишечная непроходимость. В то же время K. Ando и соавт. [18] обнаружили, что НКА чаще возникает при технике двойного сшивания там, где пересекаются скобы циркулярного и линейного сшивающего аппарата. Поэтому авторы разработали технику однорядного сшивания, которая, по их мнению, является более безопасной. Кроме того, они также отнесли к группе высокого риска НКА пациентов мужского пола, страдающих диабетом, с вредными привычками (курение, употребление алкоголя более 3 раз в неделю), что диктует необходимость формирования у них превентивной стомы.
Признано, что профилактическая (превентивная) стома уменьшает риски развития перитонита, ассоциированного с несостоятельностью анастомоза, путём отведения кишечного содержимого, снижая необходимость в выполнении экстренного оперативного вмешательства. N.Z. Ahmad и соавт. [19] при анализе 5 рандомизированных клинических исследований пришли к выводу, что при отказе от формирования превентивной илеостомы риски развития НКА достоверно повышаются, тогда как частота развития других послеоперационных осложнений снижается. Y. Mu и соавт. [20] также подтверждают снижение частоты развития НКА при наложении илеостомы по сравнению с её отсутствием (4,8% против 10,3). X.N. Yu и соавт. [21] отметили, что при наличии превентивной стомы развитие НКА достоверно ниже: 6,4% против 14,1, при этом у таких пациентов НКА степени В и С клинически встречаются значительно реже — 4,6% против 12,4. В то же время E. Munshi и соавт. [22] привели результаты популяционного когортного ретроспективного исследования, проведённого в Швеции, согласно которым формирование превентивной стомы никак не снижает риски НКА. Вместе с тем мужской пол, ASA класса 3–4, индекс

массы тела более 30 кг/м2, проведение неоадъювантной терапии были значимыми факторами риска несостоятельности анастомоза.
K.Y. Tsai и соавт. [23] исследовали влияние курения у 1246 пациентов, перенёсших переднюю резекцию прямой кишки без формирования стомы. Несостоятельность колоректального анастомоза диагностирована в 5,3% случаев. Выявлено, что частота развития НКА у тех, кто продолжал курить, и тех, кто бросил курить менее 10 лет назад, составляет 9,3% и 12,9, в отличие от тех, кто вообще не курил или бросил курить более 10 лет назад — 3,3% против 4,5 соответственно.
T. Bekki и соавт. [24] к факторам риска несостоятельности при передней резекции прямой кишки с наложением аппаратного анастомоза отнесли следующие факторы: мужской пол, сахарный диабет, соотношение С-реактивного белка/альбумина ≥0,07, прогностический индекс питания менее 40 и низкое наложение анастомоза. Z. Han и соавт. [25] обозначили значимыми параметрами НКА мужской пол, предоперационную химиолучевую терапию, размеры опухоли более 5 см, формирование анастомоза в 5 см или менее от ануса, длительность хирургического вмешательства более 3 часов и проведение интраоперационной гемотрансфузии. M. Fukada и соавт. [26] считают критическим расположение опухоли менее чем в 6 см от ануса, кровопотерю более 50 мл, а количество использованных кассет сшивающего аппарата — более 2. При этом послеоперационными показателями риска несостоятельности анастомоза признаны тахикардия ≥100 ударов в минуту в первый послеоперационный день, повышенный уровень С-реактивного белка (более 15 мг/дл), лихорадка ≥38°С на 3-й послеоперационный день и первая дефекация ранее 3 суток после операции. Примечательно, что в нашем исследовании мы не обнаружили взаимосвязи между повышенным уровнем С-реактивного белка и развитие НКА.
Наконец, S. Zhou и соавт. [27] выделили прогностические факторы риска НКА у пациентов старше 80 лет, перенёсших переднюю резекцию прямой кишки с формированием сигморектоанастомоза «конец-в-конец» и превентивной илеостомы. К ним относится неоадъювантная терапия (50% против 27,5), ишемическая болезнь сердца в анамнезе (46,7% против 17,8), количество срабатываний степлера более 3 раз (60% против 36).
О ценности модели, как правило, судят по следующим значениям площади под ROC-кривой (AUC): 0,6–0,7 — среднее; 0,7–0,8 — хорошее; 0,8–0,9 — очень хорошее; 0,9–1,0 — отличное [28]. Значение 0,85, полученное нами, относит предлагаемую прогностическую шкалу к «очень хорошей».
В своей повседневной практике в настоящий момент времени мы придерживаемся следующей тактики: при наличии 4 баллов и выше — формируем превентивную кишечную стому, при 1–3 баллах — устанавливаем трансанальный дренаж. Полный отказ от этих двух мер профилактики возможен только в случае, если у пациента нет ни одного из перечисленных факторов риска развития несостоятельности анастомоза.
Ограничения исследования
То, что в настоящем исследовании не получено связи развития несостоятельности с выведением превентивной трансверзостомы и трансанальным дренированием, можно отнести к ограничениям работы, поскольку проведение такого сравнения не входило в задачи, и, соответственно, не была сформирована группа контроля.
К ограничениям исследования относится и тот факт, что анализ ROC-кривой был применён на обучающей выборке. Валидация предложенной нами шкалы — задачи дальнейшей работы.
ЗАКЛЮЧЕНИЕ
В настоящем исследовании на основе анализа 17-летнего опыта работы хирургического стационара ФГБУ ФНКЦ ФМБА России были выявлены достоверные факторы риска развития НКА после выполнения передней резекции прямой кишки, и на основе статистического анализа предложена прогностическая балльная модель: курение — 1 балл; сахарный диабет 2-го типа — 1 балл; предоперационная химиотерапия — 1 балл; кровопотеря свыше 50 мл — 2 балла; предоперационная лучевая терапия — 3 балла; расположение колоректального анастомоза на расстоянии до 5 см от ануса — 4 балла. Чувствительность модели на обучающей выборке при наличии 8 баллов и более составила 85,6% при специфичности выше 97,4%. Данная модель ещё требует своей валидации, что и будет являться предметом дальнейших исследований.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Исследование выполнено по государственному заданию ФМБА России в рамках научно-исследовательской работы (НИР) «Разработка персонифицированного подхода к хирургическому лечению колоректального рака», регистрационный номер 122041100179-4.
эактика
Список литературы Предикторы несостоятельности колоректального анастомоза после передних резекций прямой кишки при локализованных злокачественных новообразованиях
- Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3): 209-249. doi: 10.3322/caac.21660
- Feng RM, Zong YN, Cao SM, Xu RH. Current cancer situation in China: Good or bad news from the 2018 Global Cancer Statistics? Cancer Commun (Lond). 2019;39(1):22. doi: 10.1186/s40880-019-0368-6
- Lawson EH, Melvin JC, Geltzeiler CB, et al. Advances in the management of rectal cancer. Curr Probl Surg. 2019;56(11):100648. doi: 10.1016/j.cpsurg.2019.100648
- Yang Y, Wang HY, Chen YK, et al. Current status of surgical treatment of rectal cancer in China. Chin Med J (Engl). 2020;133(22):2703-2711. doi: 10.1097/CM9.0000000000001076
- Wilkinson N. Management of rectal cancer. Surg Clin North Am. 2020;100(3):615-628. doi: 10.1016/j.suc.2020.02.014
- Tinca AC, Ion D, Bolocan A, et al. Low anterior resection: Emergency versus elective surgery in rectal cancer reatement--comparative analysis. Chirurgia (Bucur). 2019;114(2):216-221. doi: 10.21614/chirurgia.114.2.216
- Keller DS, Berho M, Perez RO, et al. The multidisciplinary management of rectal cancer. Nat Rev Gastroenterol Hepatol. 2020;17(7):414-429. doi: 10.1038/s41575-020-0275-y
- Chiarello MM, Fransvea P, Cariati M, et al. Anastomotic leakage in colorectal cancer surgery. Surg Oncol. 2022;40:101708. doi: 10.1016/j.suronc.2022.101708
- Yang SY, Han YD, Cho MS, et al. Late anastomotic leakage after anal sphincter saving surgery for rectal cancer: Is it different from early anastomotic leakage? Int J Colorectal Dis. 2020;35(7):1321-1330. doi: 10.1007/s00384-020-03608-9
- Rahbari NN, Weitz J, Hohenberger W, et al. Definition and grading of anastomotic leakage following anterior resection of the rectum: A proposal by the International Study Group of Rectal Cancer. Surgery. 2010;147(3):339-351. doi: 10.1016/j.surg.2009.10.012
- Иванов Ю.В., Смирнов А.В., Винокуров А.В., и др. Предоперационная механическая очистка кишечника в сочетании с пероральным приемом антибактериальных препаратов в профилактике осложнений хирургического лечения рака прямой кишки и ректосигмоидного соединения // Альманах клинической медицины. 2021. Т. 49, № 7. С. 477-484. [Ivanov YV, Smirnov AV, Vinokurov AV, et al. Preoperative mechanical bowel preparation combined with oral antibacterials in the prevention of complications of surgery for rectal and rectosigmoid junction cancer. Almanac Clin Med. 2021;49(7): 477-484. (In Russ).] doi: 10.18786/2072-0505-2021-49-062
- Иванов Ю.В., Панченков Д.Н., Ломакин И.А., и др. Особенности профилактики несостоятельности аппаратных колоректальных анастомозов при лапароскопических резекциях прямой кишки // Вестник экспериментальной и клинической хирургии. 2022. Т. 15, № 1. С. 10-17. [Ivanov YV, Panchenkov DN, Lomakin IA, et al. Features to prevent failed hardware colorectal anastomoses in laparoscopic rectal resections. Vestnik eksperimentalnoi i klinicheskoi khirurgii. 2022;15(1):10-17. (In Russ).] EDN: JKKBYY doi: 10.18499/2070-478X-2022-15-1-10-17
- Brisinda G, Chiarello MM, Pepe G, et al. Anastomotic leakage in rectal cancer surgery: Retrospective analysis of risk factors. World J Clin Cases. 2022;10(36):13321-13336. doi: 10.12998/wjcc.v10.i36.13321
- Degiuli M, Elmore U, De Luca R, et al. Risk factors for anastomotic leakage after anterior resection for rectal cancer (RALAR study): A nationwide retrospective study of the Italian Society of Surgical Oncology Colorectal Cancer Network Collaborative Group. Colorectal Dis. 2022;24(3):264-276. doi: 10.1111/codi.15997
- Li R, Zhou J, Zhao S, et al. Prediction model of anastomotic leakage after anterior resection for rectal cancer-based on nomogram and multivariate analysis with 1995 patients. Int J Colorectal Dis. 2023;38(1):139. doi: 10.1007/s00384-023-04438-1
- Naoi D, Horie H, Sadatomo A, et al. The effect of staple height and rectal-wall thickness on anastomotic leakage after laparoscopic low anterior resection. Asian J Surg. 2023;46(4):1577-1582. doi: 10.1016/j.asjsur.2022.09.093
- Jiang Y, Chen H, Kong M, et al. Association between circular stapler size and anastomotic leakage after laparoscopic low anterior resection for rectal cancer. J Cancer Res Ther. 2022;18(7):1931-1936. doi: 10.4103/jcrt.jcrt_676_22
- Ando K, Kuriyama N, Fujimoto Y, et al. New anastomosis technique to prevent anastomotic leakage in laparoscopic anterior resection for rectal cancer, especially upper rectal cancer. In Vivo. 2020;34(6):3533-3538. doi: 10.21873/invivo.12195
- Ahmad NZ, Abbas MH, Khan SU, Parvaiz A. A metaanalysis of the role of diverting ileostomy after rectal cancer surgery. Int J Colorectal Dis. 2021;36(3):445-455. doi: 10.1007/s00384-020-03771-z
- Mu Y, Zhao L, He H, et al. The efficacy of ileostomy after laparoscopic rectal cancer surgery: A meta-analysis. World J Surg Oncol. 2021;19(1):318. doi: 10.1186/s12957-021-02432-x
- Yu XN, Xu LM, Bin YW, et al. Risk factors of anastomotic leakage after anterior resection for rectal cancer patients. Curr Med Sci. 2022;42(6):1256-1266. doi: 10.1007/s11596-022-2616-2
- Munshi E, Lydrup ML, Buchwald P. Defunctioning stoma in anterior resection for rectal cancer does not impact anastomotic leakage: A national population-based cohort study. BMC Surg. 2023;23(1):167. doi: 10.1186/s12893-023-01998-5
- Tsai KY, Huang SH, You JF, et al. Smoking cessation for less than 10 years remains a risk factor of anastomotic leakage in mid-to-low rectal cancer patients undergoing sphincterpreserving surgery. Langenbecks Arch Surg. 2022;407(3): 1131-1138. doi: 10.1007/s00423-021-02381-9
- Bekki T, Shimomura M, Adachi T, et al. Predictive factors associated with anastomotic leakage after resection of rectal cancer: A multicenter study with the Hiroshima Surgical study group of clinical oncology. Langenbeck’s Arch Surg. 2023;408(1):199. doi: 10.1007/s00423-023-02931-3
- Han Z, Chen D, Li Y, et al. Development of a risk scoring system for predicting anastomotic leakage following laparoscopic rectal cancer surgery. Ther Clin Risk Manag. 2021;17:145-153. doi: 10.2147/TCRM.S297278
- Fukada M, Matsuhashi N, Takahashi T, et al. Risk and early predictive factors of anastomotic leakage in laparoscopic low anterior resection for rectal cancer. World J Surg Oncol. 2019;17(1):178. doi: 10.1186/s12957-019-1716-3
- Zhou S, Zhou H, Zheng Z, et al. Predictive risk factors for anastomotic leakage after anterior resection of rectal cancer in elderly patients over 80 years old: An analysis of 288 consecutive patients. World J Surg Oncol. 2019;17(1):112. doi: 10.1186/s12957-019-1655-z
- Zweig MH, Campbell G. Receiver-operating characteristic (ROC) plots: A fundamental evaluation tool in clinical medicine. Clin Chem. 1993;39(4):561-577.


