Пред- и послеоперационные факторы риска летальных и нелетальных осложнений атипично локализованных миксом левого предсердия
Автор: Симонян Т.А., Бокерия Л.А., Скопин И.И., Цискаридзе И.М., Кахкцян П.В., Фарулова И.Ю., Спирин Л.В., Ибрагимов М.С.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Кардиоонкология
Статья в выпуске: 2 т.28, 2024 года.
Бесплатный доступ
Актуальность. Миксома — наиболее распространенная доброкачественная опухоль сердца. В левом предсердии ее типичной локализацией является межпредсердная перегородка в области овальной ямки; любое другое расположение считается атипичным. Результаты хирургического лечения миксом достаточно изучены, однако нет данных о результатах лечения атипично локализованных миксом левого предсердия. Цель. Анализ результатов хирургического лечения атипично локализованных миксом левого предсердия с оценкой пред- и послеоперационных факторов риска, эмболических осложнений. Методы. Выполнен ретроспективный обзор результатов хирургического лечения атипично локализованных миксом левого предсердия (n = 52) в период с 2008 по 2022 г. Результаты. Нелетальные госпитальные осложнения развились у 15 пациентов (29 %). Госпитальная летальность составила 6 % (n = 3). Сравнительный анализ данных трансторакальной эхокардиографии перед операцией и на момент выписки продемонстрировал снижение конечного диастолического объема левого желудочка и уменьшение размеров левого предсердия к моменту выписки (p < 0,001). Факторы риска нелетальных осложнений на госпитальном этапе: хроническая сердечная недостаточность III функционального класса по классификации Нью-Йоркской ассоциации кардиологов (ХСН III ФК по NYHA) (p < 0,001), значение по шкале EuroSCORE II (p = 0,03). Факторы риска госпитальной летальности: пожилой возраст (p = 0,03), EuroSCORE II (p = 0,03). Выявлена связь между предоперационными эмболическими осложнениями и локализацией миксомы на задней стенке левого предсердия (p = 0,02), ворсинчатой формой миксомы (p < 0,001), пролабированием миксомы в полость левого желудочка (p = 0,04). Заключение. Непосредственные результаты хирургического лечения атипично локализованных миксом левого предсердия демонстрируют результаты, сравнимые с данными мировой литературы. Предоперационными факторами риска нелетальных осложнений являются ХСН III ФК по NYHA и EuroSCORE II, летальных осложнений — пожилой возраст пациентов и EuroSCORE II. Не обнаружено статистически значимого влияния послеоперационных факторов риска на летальные и нелетальные госпитальные осложнения.
Миксома сердца, ретроспективное исследование, фактор риска, эмболия
Короткий адрес: https://sciup.org/142241019
IDR: 142241019 | DOI: 10.21688/1681-3472-2024-2-30-40
Текст научной статьи Пред- и послеоперационные факторы риска летальных и нелетальных осложнений атипично локализованных миксом левого предсердия
Цитировать: Симонян Т.А., Бокерия Л.А., Скопин И.И., Цискаридзе И.М., Кахкцян П.В., Фарулова И.Ю., Спирин Л.В., Ибрагимов М.С. Пред-и послеоперационные факторы риска летальных и нелетальных осложнений атипично локализованных миксом левого предсердия. Патология кровообращения и кардиохирургия. 2024;28(2):30-40.
Т.А. Симонян, Л.А. Бокерия, И.И. Скопин, И.М. Цискаридзе, https://orcid.
How to cite: Simonyan T.A., Bockeria L.A., Scopin I.I., Tsiskaridze I.M., Kakhktsyan P.V., Farulova I.Yu., Spirin L.V., Ibragimov M.S. Pre- and postoperative risk factors for hospital complications upon atypically localized left atrial myxomas. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2024;28(2):30-40. (In Russ.)
T.A. Simonyan, L.A. Bockeria, I.I. Scopin, I.M. Tsiskaridze, P.V. Kakhktsyan, https://orcid. org/0000-0002-8781-5012
I.Yu. Farulova, L.V. Spirin, M.S. Ibragimov, © 2024 Simonyan et al.
Миксома — наиболее распространенная первичная опухоль сердца. Результаты хирургического лечения миксом достаточно изучены, известно влияние пред- и послеоперационных факторов риска (пол, возраст, локализация и размер опухоли, цереброваскулярные события и др.) на исход операции [1–3]. Чаще всего миксомы локализуются на межпредсердной перегородке со стороны левого предсердия (ЛП) [4; 5]. При других вариантах крепления в ЛП они считаются атипично локализованными [6]. Доля таких миксом составляет до 25 %. Однако за последние 15 лет частота встречаемости миксом с атипичной локализацией достигла 50 % [7]. Несмотря на это, в отечественной литературе сообщения об атипично локализованных миксомах в большинстве случаев представлены клиническими случаями. Выявление возможных пред- и послеоперационных факторов риска летальных и нелетальных госпитальных осложнений позволит улучшить результаты хирургического лечения атипично локализованных миксом сердца, выбрать оптимальную хирургическую тактику.
В предыдущем исследовании мы сравнили атипично и типично локализованные миксомы [7]. Цель настоящей работы — проанализировать результаты хирургического лечения атипично локализованных миксом, оценить пред- и послеоперационные факторы риска, эмболические осложнения.
Методы
Исследуемая популяция
Выполнили ретроспективный обзор результатов хирургического лечения атипично локализованных миксом ЛП с 2008 по 2022 г. В исследование включили 52 пациента (общая группа), которым выполнили изолированную хирургическую резекцию миксомы или сочетанное вмешательство (протезирование аортального клапана, протезирование или реконструкцию митрального клапана, реконструкцию трехстворчатого клапана, реконструкцию купола ЛП, реваскуляризацию миокарда).
Критерии включения: атипичная локализация миксомы в ЛП; возраст пациента от 18 лет. Критерии исключения: сопутствующая злокачественная опухоль; немиксомная доброкачественная первичная опухоль сердца.
Исследование соответствует принципам Хельсинкской декларации. Проведена этическая экспертиза (протокол заседания этического комитета ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» Минздрава России № 1 от 09.02.2023 г.).
Ультразвуковая оценка
Из инструментальных методов исследования всем пациентам проводили трансторакальную эхокардиографию (ЭхоКГ), коронароангиогра-фию, интраоперационную чреспищеводную ЭхоКГ. У большинства больных наблюдалась нормальная фракция выброса левого желудочка (ФВ ЛЖ) (62,73 ± 5,59 %), только у 2 (4 %) она была низкой. Отмечали нормальные показатели левого и правого желудочков, увеличенные размеры ЛП (36,8 ± 18,9 мм). Сопутствующую митральную и трикуспидальную недостаточность не менее 2-й степени имели 18 (35 %) и 21 (40 %) пациент соответственно. В 12 случаях (23 %) миксома обтурировала левое атриовентрикулярное отверстие, в 29 (56 %) — пролабировала в полость левого желудочка. Пациентов с легочной гипертензией в анамнезе было 28 (54 %).
Хирургическая техника
Всем больным выполняли срединную стернотомию, стандартное подключение аппарата искусственного кровообращения по схеме «верхняя и нижняя полые вены – аорта». В качестве кардиоплегического раствора использовали кустодиол (Dr. F. Koehler Сhemie GmbH, Бенсхайм, Германия). Выполняли доступ к левым отделам сердца через межпредсердную перегородку или расширенный двухпредсердный по Гирадону (G.M. Guiraudon).
Интраоперационный материал направляли в отдел патологической анатомии, где макроморфо-логическими, гистологическими и микроскопическими методами подтверждали диагноз «миксома сердца».
Статистический анализ
Статистическую обработку полученных данных выполняли с помощью программы StatPlus версии 8.0 (AnalystSoft Inc., Александрия, США). Количественные данные перед началом анализа проверяли на нормальность критерием Шапиро – Уилка. При распределении данных, близком к нормальному, переменные представляли в виде среднего арифметического (M) и стандартного отклонения (SD). Ненормально распределенные данные представлены в виде медианы (Me) и межквартильного размаха (Q1–Q3). Категориальные величины представлены в виде долей; исходы (госпитальные осложнения и госпитальная летальность) — в виде бинарных переменных. Для сравнения зависимых выборок использовали парный t-критерий Стьюдента. Для выявления переменных со статистически значимой связью построили регрессионную модель, по результатам которой определили отношения шансов
Табл. 1. Клинико-демографические характеристики пациентов
|
Показатель |
Значение |
|
Возраст, лет |
59,12 ± 10,94 |
|
Индекс массы тела, кг/м2 |
28,02 ± 5,02 |
|
Субфебрильная температура, n (%) |
4 (13) |
|
Ишемическая болезнь сердца, n (%) |
6 (12) |
|
Синусовый ритм до операции, n (%) |
46 (89) |
|
Фибрилляция предсердий до операции, n (%) |
6 (12) |
|
Эмболия, n (%) |
8 (15) |
|
Алиментарно-конституциональное ожирение ≥ 1-й степени, n (%) |
18 (35) |
|
Хроническая сердечная недостаточность III функционального класса по NYHA, n (%) |
14 (27) |
|
Сахарный диабет 2-го типа на стадии компенсации, без осложнений, n (%) |
1 (2) |
|
Хроническая обструктивная болезнь легких, n (%) |
3 (6) |
|
Эссенциальная артериальная гипертензия ≥ 1-й степени, n (%) |
29 (56) |
|
Остаточные явления острого нарушения мозгового кровообращения, n (%) |
5 (10) |
|
EuroSCORE II, % |
2,96 (1,78–3,97) |
Примечание. NYHA — New York Heart Association (Нью-Йоркская ассоциация кардиологов). Данные представлены как n (%), M ± SD или как Me (Q1–Q3).
(ОШ) с 95% доверительным интервалом (ДИ) и уровнем значимости p < 0,05. Для оценки корреляции бинарных исходов с непрерывными переменными использовали ROC-анализ с оценкой площади под ROC-кривой (AUC). Качество прогностической модели, полученной данным методом, оценивали исходя из значений AUC со стандартной ошибкой, 95% ДИ и уровнем значимости p < 0,05.
Результаты
Клинико-демографические характеристики пациентов
Медиана возраста пациентов составила 61 (52–66) год. Женщин было больше, чем мужчин: 38 (73 %) и 14 (27 %) соответственно. Средний EuroSCORE II составил 2,96 (1,78–3,97) %. Основные клинико-демографические характеристики представлены в табл. 1.
Эмболические осложнения. Предоперационные эмболические осложнения отметили у 8 (15 %) пациентов. В 87 % из 8 наблюдалась эмболия в мозговые артерии, в 13 % из 8 — в переднюю межжелудочковую артерию. Медиана возраста больных с эмболиями составила 48 (36–48) лет. Остаточные явления перенесенного острого нарушения мозгового кровообращения обнаружили у 5 (61 % из 8) пациентов. У всех 8 больных с эмболиями исходно был синусовый ритм. Только у 2 (25 % из 8) пациентов с эмболическими осложнениями были нарушения свертывающей системы: антифосфолипидный синдром в первом случае, высокий уровень фибриногена (4,6 г/л при референсном значении 1,8–3,4 г/л) во втором. У остальных 6 больных (75 % из 8) эмбо- лии развивались в результате фрагментации опухоли. Медиана размеров миксом у пациентов с предоперационными эмболиями составила 40 (32–75) × 44 (40– 55) мм. В 6 (75 % из 8) случаях миксома имела толстую ножку фиксации. В 5 случаях (62 % из 8) она локализовалась на задней стенке ЛП и по одному случаю (13 % из 8) — на основании передней митральной створки, куполе ЛП, в проекции легочных вен.
Интраоперационные данные
Средняя длина резецированных миксом составила 47,25 ± 31,68 мм, ширина — 41,98 ± 20,16 мм. Выделены следующие атипичные локализации в ЛП: купол — 14 (27 %), задняя стенка — 11 (21 %), митральный клапан — 10 (19 %), легочные вены — 7 (13 %), нижняя стенка — 6 (12 %), боковая стенка — 2 (4 %). В 2 случаях (4 %) встречалась би-атриальная локализация. Основная масса удаленных миксом имела полиповидную форму (34 (65 %)) и толстую ножку фиксации (31 (60 %)) (рис. 1). Во всех 52 (100 %) случаях макроскопических признаков тромбоза опухоли по интраоперационным данным не обнаружили (рис. 2). Двухпредсердный доступ по Гирадону выполняли у 35 (67 %) пациентов. Дополнительные оперативные вмешательства провели 28 (54 %) больным: протезирование митрального клапана в 4 (8 %) случаях, реконструкцию митрального клапана — в 9 (17 %), пластику трехстворчатого клапана по де Вега — 20 (39 %), протезирование аортального клапана — 1 (2 %), пластику купола ЛП ксеноперикардиальной заплатой — 7 (14 %), аортокоронарное шунтирование — 2 (4 %). В 23 (82 % из 28) случаев сочетанных вмешательств
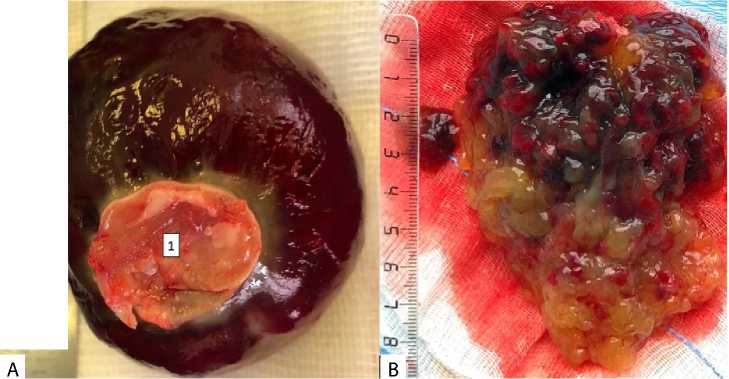
Рис. 1. Интраоперационный материал полиповидной (А), с широкой и толстой ножкой фиксации (1), и ворсинчатой (B) миксомы
потребовался расширенный двухпредсердный доступ по Гирадону. Время искусственного кровообращения составило 94 (77,5–124) мин, время пережатия аорты — 53 (41,5–75,5) мин.
Послеоперационные исходы
Продолжительность искусственной вентиляции легких составила 10 (7–15) ч. Продолжительность пребывания в отделении реанимации и интенсивной терапии (ОРИТ) — 1 (1–1) койко-день. Длительность госпитализации — 11 (8–15) койко-дней. Количество койко-дней, проведенных в ОРИТ, в группе пациентов с предоперационными эмболическими осложнениями и общей группе статистически значимо не различалось (p = 0,74). Также не выявили статистически значимых различий в длительности госпитализации между группой предоперационных эмболических осложнений (15 (8–22,5) дней) и общей группой (p = 0,85).
У 15 (29 %) пациентов развились нелетальные госпитальные осложнения: дыхательная недостаточность ≥ 1-й степени в 11 (21 %) случаях, нарушения ритма сердца — 7 (14 %), систолическая сердечная недостаточность в раннем послеоперационном пе- риоде со снижением ФВ ЛЖ до уровня ≤ 45 % — 5 (10 %), неврологические осложнения — 4 (8 %), кровопотеря > 1-й степени по классификации Американской коллегии хирургов (American College of Surgeons, ACS) 1982 г. — 1 (2 %), острая почечная недостаточность 2-й степени — 1 (2 %), полиорганная недостаточность по шкале MOF (англ. Multiple Organ Failure Score) ≥ 5 баллов — 2 (4 %). Среди пациентов с предоперационной эмболией госпитальные осложнения наблюдались у 3 (37 % из 8) человек: статистически значимых различий с нелетальными госпитальными осложнениями в общей группе не выявили (p = 0,69).
Госпитальная летальность составила 6 % (3 пациента). В табл. 2 представлена характеристика больных, умерших на госпитальном этапе лечения. В двух летальных случаях из трех выполняли сопутствующие оперативные вмешательства.
На момент выписки ФВ ЛЖ составила 62,73 ± 5,59 мл, конечный диастолический объем левого желудочка 116 ± 33 мл, конечный систолический объем левого желудочка 43 ± 13 мл, длина ЛП 56,79 ± 10,34 мм, ширина ЛП 44,29 ± 8,96 мм. Сравнительный анализ (парный двухвыборочный t-кри-
Рис. 2. Микропрепараты миксом левого предсердия ворсинчатой формы (А) и с участками массивного кровоизлияния (B). Окраска гематоксилином и эозином, 100-кратное увеличение
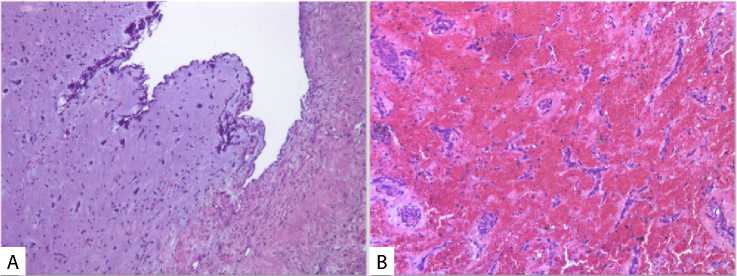
Табл. 2. Характеристика пациентов, умерших на госпитальном этапе лечения
|
Показатель |
Пациент № 1 |
Пациент № 2 |
Пациент № 3 |
|
Возраст, лет |
68 |
79 |
75 |
|
Локализация миксомы |
МК, основание передней митральной створки |
Купол ЛП |
Купол ЛП, задняя стенка ЛП |
|
Сопутствующие заболевания |
Аортальный стеноз, недостаточность МК, недостаточность ТК, ЛГ (ДЛА 47 мм рт. ст.), СН (ФВ ЛЖ 45 %), поликистоз почек |
Ожирение 1-й степени |
Гипертрофия левого желудочка, умеренная ЛГ, хроническая ишемия головного мозга, поликистоз почек |
|
Сопутствующие оперативные вмешательства |
Протезирование аортального клапана, пластика МК, пластика ТК по де Вега |
Нет |
Пластика ТК по де Вега, пластика купола ЛП заплатой |
|
Причина смерти |
СНСВ, кровопотеря 3-й степени по ACS, постперфузионный синдром |
СНСВ, дыхательная недостаточность (РДСВ), неврологические нарушения |
СНСВ |
Примечание. МК — митральный клапан; ЛП — левое предсердие; ТК — трехстворчатый клапан; ЛГ — легочная гипертензия; ДЛА — давление в легочной артерии; СН — сердечная недостаточность; ФВ ЛЖ — фракция выброса левого желудочка; СНСВ — синдром низкого сердечного выброса; ACS — классификация Американской коллегии хирургов; РДСВ — респираторный дистресс-синдром взрослых.
терий Стьюдента) продемонстрировал снижение конечного диастолического объема левого желудочка (p < 0,001) и уменьшение размеров ЛП к моменту выписки (p < 0,001).
Отметим, что возможным предиктором выполнения расширенного двухпредсердного доступа по Гирадону являются сочетанные вмешательства (p = 0,02).
Табл. 3. Предоперационные факторы риска летальных и нелетальных осложнений
|
Показатель |
Госпитальные осложнения, Me (Q1–Q3), n (%) |
p |
Госпитальная летальность, Me (Q1–Q3), n (%) |
p |
||
|
есть (n = 18) |
нет (n = 34) |
есть (n = 3) |
нет (n = 49) |
|||
|
Клинические данные |
||||||
|
Женский пол, 38 (73 %) |
14 (78) |
24 (71) |
0,58 |
3 (100) |
35 (71) |
0,28 |
|
Пожилой возраст, 15 (83 %) |
5 (28) |
10 (29) |
0,89 |
3 (100) |
12 (24) |
0,005 |
|
Алиментарно-конституциональное ожирение ≥ 1-й степени, 18 (35 %) |
10 (55) |
8 (23) |
0,02 |
1 (33) |
17 (35) |
0,96 |
|
ХСН III ФК по NYHA [26], 14 (27 %) |
8 (44) |
6 (18) |
0,03 |
3 (100) |
11 (22) |
0,003 |
|
Фибрилляция предсердий до операции, 6 (12 %) |
2 (11) |
4 (12) |
0,94 |
1 (33) |
5 (10) |
0,22 |
|
Эмболия до операции, 8 (15 %) |
3 (17) |
5 (15) |
0,86 |
0 |
8 (16) |
0,46 |
|
Сахарный диабет 2-го типа на стадии компенсации, без осложнений, 1 (2 %) |
1 (5) |
0 |
0,17 |
0 |
1 (2) |
0,80 |
|
ХОБЛ, 3 (6 %) |
1 (5) |
2 (6) |
0,96 |
0 |
3 (6) |
0,66 |
|
Артериальная гипертензия, 29 (56 %) |
10 (55) |
19 (56) |
0,37 |
1 (33) |
28 (57) |
0,42 |
|
Остаточные явления ОНМК, 5 (10 %) |
1 (5) |
4 (12) |
0,47 |
0 |
5 (10) |
0,56 |
|
Ишемическая болезнь сердца, 6 (12 %) |
1 (5) |
5 (15) |
0,32 |
0 |
6 (12) |
0,52 |
|
Данные трансторакальной эхокардиографии |
||||||
|
Пролабирующая в полость ЛЖ миксома, 29 (56 %) |
12 (67) |
17 (50) |
0,25 |
1 (33) |
28 (57) |
0,42 |
|
Обтурирующая АВ отверстие миксома, 12 (23 %) |
4 (22) |
8 (23) |
0,92 |
0 (33) |
12 (24) |
0,33 |
|
Митральная регургитация ≥ 2-й степени, 18 (35 %) |
6 (33) |
12 (35) |
0,89 |
1 (33) |
17 (35) |
0,96 |
|
Трикуспидальная регургитация ≥ 2-й степени, 21 (40 %) |
7 (39) |
14 (41) |
0,86 |
1 (33) |
20 (41) |
0,80 |
|
Ворсинчатая форма миксомы, 18 (35 %) |
6 (33) |
12 (35) |
0,89 |
1 (33) |
17 (35) |
0,96 |
|
Конечный диастолический объем ЛЖ, мл |
127 (109–146) |
120 (88–128) |
0,33 |
76 (72–94) |
120 (92–135) |
0,06 |
|
Размеры левого предсердия, мм |
57 (52–60) |
57 (49–64) |
0,99 |
52 (49–66) |
57 (50–63) |
0,20 |
|
Размер опухоли, мм |
42 (31–58) |
40 (22–68) |
0,35 |
45 (44–48) |
40 (30–70) |
0,49 |
|
Фракция выброса ЛЖ, % |
63 (60–65) |
62 (60–67) |
0,65 |
58 (51–62) |
62 (60–66) |
0,77 |
Примечание. ХСН — хроническая сердечная недостаточность; ФК — функциональный класс; NYHA — New York Heart Association (Нью-Йоркская ассоциация кардиологов); ХОБЛ — хроническая обструктивная болезнь легких; ОНМК — острое нарушение мозгового кровообращения; ЛЖ — левый желудочек; АВ — атриовентрикулярный.
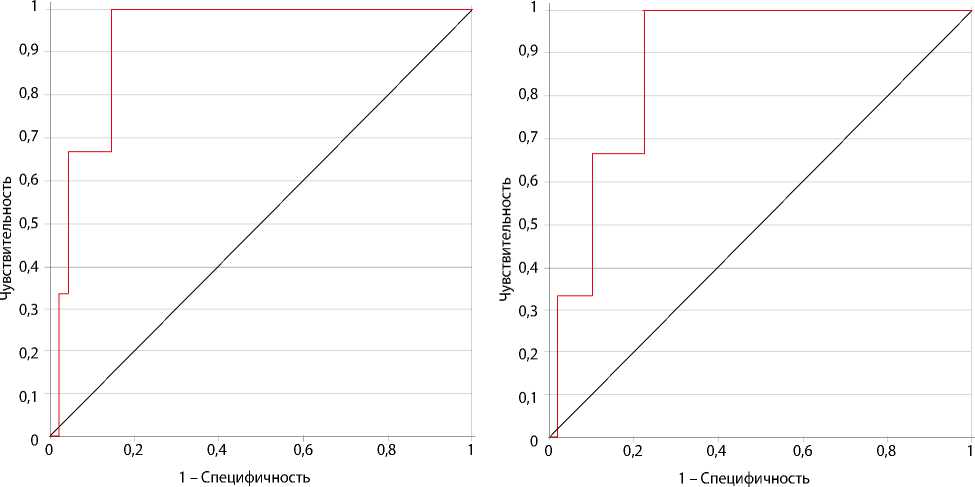
Рис. 4. ROC-кривая, отражающая зависимость госпитальной летальности от EuroSCORE II
Рис. 3. ROC-кривая, характеризующая зависимость госпитальной летальности от возраста
Возможные предикторы эмболических осложнений
Возможными предикторами предоперационных эмболических осложнений являются:
-
• локализация миксомы на задней стенке ЛП (p = 0,02);
-
• ворсинчатая форма миксомы (p < 0,001);
-
• пролабирование миксомы в полость левого желудочка (p = 0,04).
Предоперационные факторы риска госпитальных осложнений
В табл. 3 представлены предоперационные показатели, которые, возможно, повлияли на госпитальные осложнения (летальные и нелетальные). Наиболее частыми госпитальными осложнениями были фибрилляция предсердий, систолическая сердечная недостаточность в раннем послеоперационном периоде со снижением ФВ ЛЖ до уровня ≤ 45 %, поли-органная недостаточность по шкале MOF ≥ 5 баллов, дыхательная недостаточность после операции ≥ 1-й степени, неврологические осложнения, кровопотеря > 1-й степени по классификации ACS.
Подтвердилось влияние хронической сердечной недостаточности III функционального класса по классификации Нью-Йоркской ассоциации кардиологов (ХСН III ФК по NYHA) на переменную дыхательную недостаточность после операции ≥ 1-й степени (p < 0,001). Зависимость других госпитальных осложнений: систолической сердечной недостаточности в раннем послеоперационном периоде со снижением ФВ ЛЖ до уровня ≤ 45 %, полиорган-ной недостаточности по шкале MOF ≥ 5 баллов, неврологических осложнений — от ХСН III ФК по NYHA не подтвердилось.
При изучении методом ROC-анализа влияния EuroSCORE II на неврологические осложнения площадь под ROC-кривой (AUC) составила 0,84 [95% ДИ 0,71–0,98]. При аналогичном анализе влияния возраста на госпитальную летальность получили значение AUC = 0,93 [95% ДИ 0,84–1] (рис. 3). При изучении влияния величины EuroSCORE II на госпитальную летальность — AUC = 0,88 [95% ДИ 0,75–1] (рис. 4).
Послеоперационные факторы риска госпитальных осложнений
Результаты анализа послеоперационных факторов риска госпитальных осложнений представлены в табл. 4. Мы не выявили связи между клиническими данными и госпитальными осложнениями (летальными и нелетальными). Интраоперационные показатели (ворсинчатая форма миксомы, толстая ножка фиксации, место происхождения миксомы) статистически значимо не влияли на летальные и нелетальные госпитальные осложнения. Отсутствует взаимосвязь расширенного доступа по Гирадону и госпитальных осложнений (летальных и нелетальных). Дополнительные оперативные вмешательства тоже не связаны с госпитальными осложнениями, несмотря на два случая летальных исходов с сопутствующими оперативными вмешательствами из трех.
Табл. 4. Послеоперационные факторы риска летальных и нелетальных осложнений на госпитальном этапе лечения
|
Показатель |
Госпитальные осложнения, Me (Q1–Q3), n (%) |
p |
Госпитальная летальность, Me (Q1–Q3), n (%) |
p |
||
|
есть (n = 18) |
нет (n = 34) |
есть (n = 3) |
нет (n = 49) |
|||
|
Клинические данные |
||||||
|
ДН после операции ≥ 1-й степени (J96*) |
11 (61) |
7 (21) |
0,003 |
3 (100) |
15 (31) |
0,01 |
|
Кровопотеря > 1-й степени по ACS (R58*) |
1 (6) |
0 |
0,17 |
1 (33) |
0 |
< 0,001 |
|
Систолическая СН в раннем послеоперационном периоде со снижением ФВ ЛЖ ≤ 45 % (I50.1*) |
5 (28) |
0 |
0,001 |
3 (100) |
2 (4) |
< 0,001 |
|
Полиорганная недостаточность по шкале MOF ≥ 5 баллов (R65.3*) [28] |
2 (11) |
0 |
0,047 |
2 (67) |
0 |
< 0,001 |
|
Неврологические осложнения после операции (G93.1*) |
4 (22) |
0 |
0,004 |
3 (100) |
1 (2) |
< 0,001 |
|
Интраоперационные данные |
||||||
|
Доступ по Гирадону |
14 (78) |
21 (62) |
0,24 |
3 (100) |
32 (65) |
0,21 |
|
Ворсинчатая форма миксомы |
6 (33) |
12 (35) |
0,89 |
1 (33) |
17 (35) |
0,96 |
|
Толстая ножка фиксации |
11 (61) |
20 (59) |
0,18 |
3 (100) |
28 (57) |
0,14 |
|
Сопутствующие оперативные вмешательства |
||||||
|
Сочетанное вмешательство |
10 (56) |
18 (53) |
0,86 |
2 (67) |
26 (53) |
0,65 |
|
Реконструкция МК |
3 (17) |
6 (17) |
0,93 |
1 (33) |
8 (16) |
0,45 |
|
Протезирование МК |
2 (11) |
2 (6) |
0,50 |
0 |
4 (8) |
0,61 |
|
Вмешательство на МК |
5 (28) |
8 (23) |
0,35 |
1 (33) |
12 (24) |
0,73 |
|
Пластика купола ксеноперикардиальной заплатой |
3 (17) |
4 (12) |
0,62 |
1 (33) |
6 (12) |
0,30 |
|
Аортокоронарное шунтирование |
0 |
2 (6) |
0,29 |
0 |
2 (4) |
0,72 |
|
Пластика ТК по де Вега |
7 (39) |
13 (38) |
0,68 |
2 (67) |
18 (37) |
0,30 |
|
Время искусственного кровообращения |
110 (91,5–146) |
88,5 (76–119) |
0,15 |
119 (110–226) |
93 (76–121) |
0,15 |
|
Время пережатия аорты |
60 (46–84) |
48,5 (40,5–71,7) |
< 0,001 |
85 (66–126) |
51 (40–74) |
0,16 |
|
Время нахождения на ИВЛ |
15 (10,5–142,5) |
8,5 (7–10) |
0,002 |
1728 (1404–1844) |
10 (7–13) |
0,004 |
|
Время нахождения в ОРИТ |
1 (1–6,7) |
1 (1–1) |
< 0,001 |
74 (60–77) |
1 (1–1) |
< 0,001 |
|
Время нахождения в стационаре |
15 (12,2–23) |
9 (8–11,75) |
< 0,001 |
75 (63–80) |
11 (8–14) |
0,004 |
Примечание. ДН — дыхательная недостаточность; ACS — классификация Американской коллегии хирургов; СН — сердечная недостаточность; ФВ ЛЖ — фракция выброса левого желудочка; МК — митральный клапан; ТК — трехстворчатый клапан; ИВЛ — искусственная вентиляция легких; ОРИТ — отделение реанимации и интенсивной терапии; * — код по Международной классификации болезней 10-го пересмотра.
По данным ROC-анализа, время нахождения пациентов на искусственной вентиляции легких (AUC = 0,83, 95% ДИ 0,71–0,95) и время нахождения в стационаре (AUC = 0,84, 95% ДИ 0,73–0,95) увеличивают риск нелетальных госпитальных осложнений. Влияние длительности искусственного кровообращения и пережатия аорты на госпитальные осложнения не подтвердилось результатами регрессионного анализа.
Обсуждение
Одним из грозных осложнений миксом сердца являются эмболии. Выделяют предоперационные и периоперационные эмболические осложнения.
В свою очередь, предоперационные по локализации эмбола делятся на центральные (эмболии в мозговые артерии) и периферические (эмболии в периферические артерии). В исследовании C.-X. Jiang и соавт. предоперационные эмболические осложнения составили 14,9 % [8]. В работе P. Vaideeswar и соавт. — 15,6 % [9]. В исследовании R.R. Dias и соавт. — 19,8 %. Авторы не выявили статистически значимой разницы влияния размера опухоли (p = 0,132), предоперационной фибрилляции предсердий в анамнезе (p = 0,206) и места происхождения опухоли (p = 0,121) на эмболию [10]. Y. Liu и соавт. в систематическом обзоре и метаанализе англоязычной литературы установили следующие факторы риска предоперационных эмболических осложнений: ХСН I–II ФК по NYHA (p < 0,01), артериальная гипертензия (p = 0,03), неровная поверхность опухоли (p < 0,01), атипичная локализация (p = 0,01), узкая ножка опухоли (p < 0,01) и повышенный уровень фибриногена в крови (p < 0,01) [11]. K. Amemiya и соавт. определили ворсинчатую форму миксомы как независимый предиктор предоперационных эмболических осложнений (p < 0,01) [ОШ 8,7, 95% ДИ 2,4–42,1] [12]. В нашей работе пациентов с предоперационными эмболическими осложнениями было 8 (15 %).
J.W. Ha и соавт. определили два типа миксом с помощью ЭхоКГ: (1) круглый тип, характеризующийся твердой и круглой формой с неподвижной поверхностью (52 %), и (2) полиповидный тип, характеризующийся мягкой и неправильной формой с подвижной поверхностью (48 %). Регрессионный анализ этих двух типов показал, что полиповидный тип опухоли был единственным независимым предиктором системной эмболии (p = 0,0029) [13]. В нашей работе методом регрессионного анализа удалось выявить три предиктора эмболических осложнений в группе атипично локализованных миксом: локализация миксомы на задней стенке ЛП (p = 0,02), ворсинчатая форма миксомы (p < 0,001), пролабирование миксомы в полость левого желудочка (p = 0,046).
По данным литературы, миксомы, локализующиеся на митральном клапане, сопровождаются частыми эмболическими событиями до операции. Более высокий риск эмболизации связан с движением створок клапана и высоким давлением в левом желудочке [14–16]. D. Fabijanic и соавт. описали случай пациента с миксомой передней створки митрального клапана размером 24 × 11 мм, умершего ночью накануне дня операции. По данным аутопсии выявили обширный инсульт в левой фронтальной области вследствие эмболии миксомой [17]. В нашей выборке из 10 (19 %) случаев миксом, локализованных на митральном клапане, только у одного пациента имелась эмболия в мозговые артерии в анамнезе. При этом выборка больных с предоперационными эмболическими осложнениями по времени пребывания в ОРИТ, койко-дням и нелетальным госпитальным осложнениям не отличалась от основной выборки.
Эмболии миксом в периферические артерии чрезвычайно редки [18; 19]. J. Bernatchez и соавт. занимались поиском таких случаев по данным англоязычной литературы и нашли всего 25 за 50-летний период. Средний возраст пациентов составил 50 лет (от 10 до 79 лет), и только трое были моложе 30 лет. В большинстве случаев локализация окклюзии аор- ты эмболом была инфраренальной. Диагноз «миксома сердца» чаще всего подтверждали трансторакальной или чреспищеводной ЭхоКГ. Летальность, по мнению авторов, связана с церебральной эмболией. Среди других причин летальных исходов встречались полиорганная недостаточность и остановка сердца [18].
T. Zhang и соавт. при лечении пациента с миксомой сердца и множественной эмболизацией брюшной части аорты, нижних конечностей, верхних брыжеечных и почечных артерий описывают метод, сочетающий катетеры Фогарти с чрескожной аспирационной тромбоэмболэктомией, который, по сравнению с традиционными методами, основанными на лапаротомии, менее инвазивен и занимает меньше времени [19]. В нашем исследовании случаев эмболии в периферические артерии не было.
В послеоперационном периоде эмболические осложнения редки: по данным C.-X. Jiang, их частота составляет 2,2 % [8]. В нашей работе среди всех оперированных пациентов с миксомой сердца случаев эмболических осложнений в раннем послеоперационном периоде не выявлено.
Авторы приводят разные данные о частоте нелетальных осложнений на госпитальном этапе: A. Karabinis и соавт. — 17,6 % (n = 153), I.M. Keeling и соавт. — 43 % (n = 49), N.G. Baikoussis и соавт. — 59,3 % (n = 117) [1–3]. В большинстве исследований на первом месте среди нелетальных осложнений — послеоперационные нарушения ритма по типу фибрилляции предсердий. В исследовании K.S. Lee и со-авт. доля этого осложнения составила 4,3 % (n = 93), P.T. Lee и соавт. — 21 % (n = 62), M. Sahin и соавт. — 24 % (n = 44) [20–22]. Среди других нелетальных госпитальных осложнений отмечают синдром малого сердечного выброса с потребностью во внутриаортальной баллонной контрпульсации, дыхательную недостаточность, кровотечение, неврологические осложнения, медиастиниты, посткардиотомный синдром, почечную недостаточность. В нашей работе частота нелетальных госпитальных осложнений составила 29 %; наиболее частыми в обеих группах в порядке убывания являлись: дыхательная недостаточность, нарушения ритма сердца, сердечная недостаточность, неврологические осложнения, кровотечение, рестернотомия, острая почечная недостаточность 2-й степени. Сердечную недостаточность в раннем послеоперационном периоде купировали умеренной кардиотонической поддержкой без внутриаортальной баллонной контрпульсации.
С помощью методов статистического анализа изучили предоперационные факторы риска нелетальных госпитальных осложнений. По данным регрессионного анализа установили влияние:
-
1) ХСН III ФК по NYHA на послеоперационную дыхательную недостаточность;
-
2) величины EuroSCORE II на частоту послеоперационных неврологических осложнений.
По данным литературы, госпитальная летальность после хирургической резекции миксомы составляет от 0,7 до 3,7 %, что несколько ниже в сравнении с результатами настоящего исследования (6 %) [8; 23; 24]. Независимыми предикторами госпитальной летальности в части работ являлись пожилой возраст и множественные хирургические процедуры, ХСН III ФК по NYHA [8; 25]. Мы выявили следующие факторы риска госпитальной летальности:
-
1) предоперационные: пожилой возраст, EuroSCORE II, ХСН III ФК по NYHA;
-
2) периоперационные: сердечная недостаточность, дыхательная недостаточность, неврологические осложнения.
Ограничения
Ограничениями исследования являются ретроспективный дизайн и выполнение вмешательств в одном хирургическом центре.
Заключение
При хирургической резекции миксомы с сопутствующим вмешательством на митральном клапане отдается предпочтение расширенному двухпредсердному доступу по Гирадону для лучшей визуализации опухоли и митрального клапана. Безопасность данного доступа подтверждается отсутствием связи с летальными (p = 0,98) и нелетальными (p = 0,25) осложнениями на госпитальном этапе лечения.
В большинстве случаев (75 %) предоперационные эмболические осложнения опухолевого генеза развивались из-за фрагментации опухоли (показатели свертывающей и противосвертывающей систем в пределах нормы, синусовый ритм до операции, отсутствие тромбов на поверхности опухоли по данным трансторакальной ЭхоКГ перед операцией и интраоперационным данным). Факторами риска дооперационных эмболических осложнений являются: ворсинчатая форма миксомы (p = 0,02), локализация на задней стенке ЛП (p < 0,001), пролабирование миксомы в полость левого желудочка (p = 0,04). При наличии хотя бы одного из этих факторов мы рекомендуем максимально уменьшить время с момента выявления миксомы по данным трансторакальной ЭхоКГ до оперативного вмеша- тельства для минимизации эмболических осложнений.
Предоперационными факторами риска нелетальных госпитальных осложнений являются: ХСН III ФК по NYHA (влияние на послеоперационную дыхательную недостаточность > 1-й степени), EuroSCORE II (влияние на частоту возникновения послеоперационных неврологических осложнений), алиментарно-конституциональное ожирение ≥ 1-й степени (влияние на нелетальные госпитальные осложнения в целом). Пожилой возраст пациентов, EuroSCORE II повышают риск госпитальной летальности. Из послеоперационных факторов риска длительное время нахождения пациентов на искусственной вентиляции легких и время пребывания в стационаре увеличивают риск нелетальных госпитальных осложнений.
Список литературы Пред- и послеоперационные факторы риска летальных и нелетальных осложнений атипично локализованных миксом левого предсердия
- Baikoussis N.G., Papakonstantinou N.A., Dedeilias P., Argiriou M., Apostolakis E., Koletsis E., Dougenis D., Charitos C. Cardiac tumors: a retrospective multicenter institutional study. J Buon. 2015;20(4):1115-1123. PMID: 26416065.
- Karabinis A., Samanidis G., Khoury M., Stavridis G., Perreas K. Clinical presentation and treatment of cardiac myxoma in 153 patients. Medicine (Baltimore). 2018;97(37):e12397. PMID: 30213011; PMCID: PMC6155961. https://doi.org/10.1097/MD.0000000000012397
- Keeling I.M., Oberwalder P., Anelli-Monti M., Schuchlenz H., Demel U., Tilz G.P., Rehak P., Rigler B. Cardiac myxomas: 24 years of experience in 49 patients. Eur J Cardiothorac Surg. 2002;22(6):971-977. PMID: 12467822. https://doi.org/10.1016/s1010-7940(02)00592-4
- Бокерия Л.А., Малашенков А.И., Кавсадзе В.Э., Серов Р.А. Кардиоонкология. М.: Изд-во НЦССХ им. А.Н. Бакулева РАМН, 2003. С. 13-26. Bokeria L.A., Malashenkov A.I., Kavsadze V.E., Serov R.A. Cardiooncology. Moscow: Bakulev Center for Cardiovascular Surgery Publ.; 2003. P. 13-26. (In Russ.)
- Владимиров В.В., Ковалев А.И., Редкобородый А.В., Соколов В.В., Бибкова Н.М., Галанкина И.Е., Муслимов Р.Ш. Хирургическое лечение миксом сердца: анализ 10-летнего опыта. Журнал им. Н.В. Склифосовского «Неотложная медицинская помощь». 2021;10(2):385-392. https://doi.org/10.23934/2223-9022-2021-10-2-385-392 Vladimorov V.V., Kovalev A.I., Redkoborody A.V., Sokolov V.V., Bibkova N.M., Galankina I.E., Muslimov R.Sh. Surgical treatment of heart mixomas: the analysis of 10 years’ experience. Russian Sklifosovsky Journal "Emergency Medical Care". 2021;10(2):385-392. (In Russ.) https://doi.org/10.23934/2223-9022-2021-10-2-385-392
- Sugeng L., Lang R.M. Atypical cardiac myxomas. Echocardiography. 2004;21(1):43-47. PMID: 14717720. https://doi.org/10.1111/j.0742-2822.2004.02124.x
- Симонян Т.А., Бокерия Л.А., Скопин И.И., Цискаридзе И.М., Кахкцян П.В., Фарулова И.Ю., Тевосов Д.Р., Ибрагимов М.С., Шамсиева Д.Г., Сулакадзе Б.А. Непосредственные результаты хирургического лечения атипично локализованных миксом левого предсердия. Бюллетень НЦССХ им. А.Н. Бакулева РАМН. 2023;24(1):50-57. https://doi.org/10.24022/1810-0694-2023-24-1-50-57 Simonyan T.A., Bockeria L.A., Scopin I.I., Tsiskaridze I.M., Kakhktsyan P.V., Farulova I.Yu., Tevosov D.R., Ibragimov M.S., Shamsieva D.G., Sulakadze B.A. Immediate results of surgical treatment of atypically localized left atrial myxomas. The Bulletin of Bakoulev Center. Cardiovascular Diseases. 2023;24(1):50-57. (In Russ.) https://doi.org/10.24022/1810-0694-2023-24-1-50-57
- Jiang C.-X., Wang J.-G., Qi R.-D., Wang W., Gao L.-J., Zhao J.-H., Zhang C.-X., Zhou M.-C., Tu X., Shang M.-S., Yao Y. Long-term outcome of patients with atrial myxoma after surgical intervention. J Geriatr Cardiol. 2019;16(4):338-343. PMID: 31105754; PMCID: PMC6503479.
- Vaideeswar P., Gupta R., Mishra P., Lanjewar C., Raut A. Atypical cardiac myxomas: a clinicopathologic analysis and their comparison to 64 typical myxomas. Cardiovascular Pathology. 2012;21(3):180-187. PMID: 21839650. https://doi.org/10.1016/j.carpath.2011.07.001
- Dias R.R., Fernandes F., Ramires F.J.A., Mady C., Albuquerque C.P., Jatene F.B. Mortality and embolic potential of cardiac tumors. Arq Bras Cardiol. 2014;103(1):13-18. PMID: 25029470; PMCID: PMC4126756. https://doi.org/10.5935/abc.20140096
- Liu Y., Wang J., Guo L., Ping L. Risk factors of embolism for the cardiac myxoma patients: a systematic review and metanalysis. BMC Cardiovasc Disord. 2020;20(1):348. PMID: 32711463; PMCID: PMC7382866. https://doi.org/10.1186/s12872-020-01631-w
- Amemiya K., Yonemoto Y., Ishibashi-Ueda H., Matsumoto M., Ohta-Ogo K., Ikeda Y., Kobayashi J., Fukushima S., Fujita T., Hatakeyama K. Morphological characteristics of cardiac myxoma causing embolism: a series of 40 years of experience at a single institute. Virchows Arch. 2023;482(2):377-384. PMID: 36441241. https://doi.org/10.1007/s00428-022-03461-x
- Ha J.W., Kang W.C., Chung N., Chang B.C., Rim S.J., Kwon J.W., Jang Y., Shim W.H., Cho S.Y., Kim S.S., Cho S.H. Echocardiographic and morphologic characteristics of left atrial myxoma and their relation to systemic embolism. Am J Cardiol. 1999;83(11):1579-1582. PMID: 10363879. https://doi.org/10.1016/s0002-9149(99)00156-3
- Chakfe N., Kretz J.G., Valentin P., Geny B., Petit H., Popescu S., Edah-Tally S., Massard G. Clinical presentation and treatment options for mitral valve myxoma. Ann Thorac Surg. 1997;64(3):872-877. PMID: 9307503. https://doi.org/10.1016/s0003-4975(97)00695-4
- Choi B.W., Ryu S.J., Chang B.C., Ryu S.J., Chang B.C., Chou K.O. Myxoma attached to both atrial and ventricular sides of the mitral valve: report of a case and review of 31 cases of mitral myxoma. Int J Cardiovasc Imaging. 2001;17(5):411-416. PMID: 12025955. https://doi.org/10.1023/a:1011986001058
- Zachura M., Kurzawski J., Urbaniak A., Piątek Ł., Janion M. Myxoma originating from the anterior mitral valve leaflet in a young patient with neurological manifestations. Heart Lung Circ. 2017;26(6):e29-e31. PMID: 28118960. https://doi.org/10.1016/j.hlc.2016.11.014
- Fabijanic D., Carević V., Bečić T., Pešutić-Pisac V. Cardiac myxoma: benign, but deadly disease. Med Ultrason. 2022;24(2):248-249. PMID: 35617612. https://doi.org/10.11152/mu-3678
- Bernatchez J., Gaudreault V., Vincent G., Rheaume P. Left atrial myxoma presenting as an embolic shower: a case report and review of literature. Ann Vasc Surg. 2018;53:266.e13-266.e20. PMID: 30012450. https://doi.org/10.1016/j.avsg.2018.04.024
- Zhang T., Zhang X., Zhang X., Jiang J., Chen J., Zhou B. Management of multiple embolization arising from atrial myxoma. Ann Thorac Surg. 2012;94(2):646-649. PMID: 22818313. https://doi.org/10.1016/j.athoracsur.2011.12.090
- Lee K.S., Kim G.S., Jung Y., Jeong I.S., Na K.J., Oh B.S., Ahn B.H., Oh S.G. Surgical resection of cardiac myxoma — a 30-year single institutional experience. J Cardiothorac Surg. 2017;12(1):18. PMID: 28347356; PMCID: PMC5368917. https://doi.org/10.1186/s13019-017-0583-7
- Lee P.T., Hong R., Pang P.Y., Chua Y.L., Ding Z.P. Clinical presentation of cardiac myxoma in a Singapore national cardiac centre. Singapore Med J. 2021;62(4):195-198. PMID: 32227792; PMCID: PMC8801822.
- Sahin M., Tigen K., Dundar C., Ozben B., Alici G., Demir S., Kalkan M.E., Ozkan B. Postoperative atrial fibrillation in patients with left atrial myxoma. Cardiovasc J Afr. 2015;26(3):120-124. PMID: 26592907; PMCID: PMC4538910. https://doi.org/10.5830/CVJA-2014-069
- Барбухатти К.О., Антипов Г.Н., Фаримов В.А., Терман Е.А., Порханов В.А. Восьмилетний опыт хирургического лечения миксом сердца. Грудная и сердечно-сосудистая хирургия. 2011;(3):23-27. Barbukhatti K.O., Antipov G.N., Farimov V.A., Terman E.A., Porkhanov V.A. Eight years' experience with surgical treatment for cardiac myxomas. Russian Journal of Thoracic and Cardiovascular Surgery. 2011;(3):23-27. (In Russ.)
- Garatti A., Nano G., Canziani A., Gagliardotto P., Mossuto E., Frigiola A., Menicanti L. Surgical excision of cardiac myxomas: twenty years experience at a single institution. Ann Thorac Surg. 2012;93(3):825-831. PMID: 22296980. https://doi.org/10.1016/j.athoracsur.2011.11.009
- Elbardissi A.W., Dearani J.A., Daly R.C., Mullany C.J., Orszulak T.A., Puga F.J., Schaff H.V. Survival after resection of primary cardiac tumors: a 48-year experience. Circulation. 2008;118(14 Suppl):S7-S15. PMID: 18824772. https://doi.org/10.1161/CIRCULATIONAHA.107.783126
- Bredy C., Ministeri M., Kempny A., Alonso-Gonzalez R., Swan L., Uebing A., Diller G.-P., Gatzoulis M.A., Dimopoulos K. New York Heart Association (NYHA) classification in adults with congenital heart disease: relation to objective measures of exercise and outcome. Eur Heart J Qual Care Clin Outcomes. 2018;4(1):51-58. PMID: 28950356. https://doi.org/10.1093/ehjqcco/qcx031
- Nashef S.A.M., Roques F., Sharples L.D., Nilsson J., Smith C., Goldstone A.R., Lockowandt U. EuroSCORE II. Eur J Cardiothorac Surg. 2012;41(4):734-744; discussion 744-745. PMID: 22378855. https://doi.org/10.1093/ejcts/ezs043
- Lefering R., Goris R.J.A., van Nieuwenhoven E.J., Neugebauer E. Revision of the multiple organ failure score. Langenbecks Arch Surg. 2002;387(1):14-20. PMID: 11981679. https://doi.org/10.1007/s00423-001-0269-3


