Предварительные итоги исследования безопасности и эффективности плазмы реконвалесцентов в терапии COVID-19
Автор: Баклаушев Владимир Павлович, Аверьянов Александр Вячеславович, Сотникова Анна Геннадиевна, Перкина Анастасия Сергеевна, Иванов Александр Владимирович, Юсубалиева Гаухар Маратовна, Новикова Оксана Николаевна, Шикина Валентина Евгеньевна, Дупик Николай Васильевич, Кедрова Анна Генриховна, Санжаров Андрей Евгеньевич, Ширшова Елена Вениаминовна, Балионис Ольга Игоревна, Валуев-Эллистон Владимир Треворович, Закирова Наталья Фанисовна, Глазов Ярослав Николаевич, Панюхина Ирина Анатольевна, Соловьв Николай Алексеевич, Винокуров Алексей Георгиевич, Иванов Юрий Викторович, Васильев Валентин Николаевич, Клыпа Татьяна Валерьевна, Троицкий Александр Витальевич
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.11, 2020 года.
Бесплатный доступ
Обоснование. Отсутствие эффективной этиотропной терапии COVID-19 побудило исследователей всего мира к поиску различных средств элиминации SARS-CoV-2, в том числе с помощью вируснейтрализующих антител, содержащихся в плазме реконвалесцентов. Цель - изучить безопасность и эффективность терапии COVID-19 плазмой реконвалесцентов, содержащей специфические антитела к рецепторсвязывающему домену (RBD) S-белка SARS-CoV-2 в титре не менее 1:1000. Методы. Одноцентровое рандомизированное проспективное клиническое исследование с участием 86 пациентов, которые были стратифицированы в две группы. Первую группу составили 20 пациентов в крайне тяжелом состоянии, находящихся на искусственной вентиляции легких (ИВЛ), вторую группу - 66 пациентов со среднетяжелым и тяжелым течением COVID-19, находящихся на спонтанном дыхании. Пациенты второй группы были рандомизированы в две когорты в соотношении 2:1. В первой когорте (n=46) выполняли трансфузию патогенредуцированной плазмы реконвалесцентов (по 320 мл, двукратно, с интервалом один день), во второй когорте (n=20) переливали аналогичное количество неиммунной свежезамороженной плазмы. Результаты. Применение плазмы реконвалесцентов у пациентов с COVID-19 в крайне тяжелом состоянии на фоне острой дыхательной недостаточности и проведения ИВЛ не оказало влияния на исход заболевания. Летальность в данной группе составила 60%, что соответствовало летальности пациентов контрольной группы, находящихся на ИВЛ. Среди пациентов второй группы, получивших иммунную и неиммунную плазму, клиническое улучшение было отмечено в 75 и 51% соответственно. Из 46 человек, получивших антиковидную плазму, в дальнейшем на ИВЛ были переведены 3 (6,5%) пациента, двое из них скончались: у одного из умерших был декомпенсированный миелобластный лейкоз, у другого на фоне тяжелого течения COVID-19 после введения плазмы развился некардиогенный отек легкого. В группе, получившей неиммунную плазму, потребность в проведении ИВЛ возникла также у 3 (15%) пациентов, из них двое скончались. Госпитальная летальность в группе, получившей плазму реконвалесцентов, составила 4,3%, что достоверно ниже общей госпитальной летальности в нашем стационаре, определенной по всем законченным случаям (6,73%), и более чем в 2 раза ниже летальности в ретроспективно оцененной контрольной группе (n=150), подобранной по тяжести состояния, возрасту и сопутствующей патологии (12,0%). Заключение. На сегодняшний день можно сделать вывод об ограниченной безопасности применения плазмы переболевших COVID-19 и эффективности такой терапии как минимум с точки зрения выживаемости госпитализированных больных с тяжелой дыхательной недостаточностью, не находящихся на ИВЛ. В отсутствие биоинженерных вируснейтрализующих антител и эффективной этиотропной терапии применение гипериммунной плазмы реконвалесцентов является наиболее простым и эффективным средством специфической этиопатогенетической терапии тяжелых форм COVID-19.
Плазма реконвалесцентов, антитела к rbd s-белка, острый респираторный дистресс-синдром, искусственная вентиляция легких
Короткий адрес: https://sciup.org/143172653
IDR: 143172653 | DOI: 10.17816/clinpract35168
Текст научной статьи Предварительные итоги исследования безопасности и эффективности плазмы реконвалесцентов в терапии COVID-19
СПИСОК СОКРАЩЕНИЙ
ИВЛ — искусственная вентиляция легких
КТ — компьютерная томография
КТ0–КТ4 — классификация рентгенологических проявлений COVID-19
ОРИТ — отделение реанимации и интенсивной терапии
ОРДС – острый респираторный дистресс-синдром
ПЦР — полимеразная цепная реакция
РНК — рибонуклеиновая кислота
СРБ — С-реактивный белок
ACE2 (angiotensin-converting enzyme 2) — ангиотензинпревращающий фермент
COVID-19 (от англ. Coronavirus Disease 2019) — новая коронавирусная инфекция, вызываемая SARS-CoV-2
Ig (immunoglobulin) — иммуноглобулин
IL (interleukin) — интерлейкин
INFγ (interferon gamma) — интерферон гамма
MERS (Middle East Respiratory Syndrome) — ближневосточный респираторный синдром)
SatO2 — сатурация (насыщение) кислородом артериальной крови
SARS (Severe Acute Respiratory Syndrome) — тяжелый острый респираторный синдром)
SARS-CoV-2 (Severe Acute Respiratory Syndrome, Coronavirus-2) — новый штамм коронавируса из рода бетакоронавирусов (Betacoronavirus)
RBD (receptor-binding domain) — рецепторсвязывающий домен
TNFα (tumor necrosis factor alpha) — фактор некроза опухоли альфа
TRALI (Transfusion-Related Acute Lung Injury) — трансфузионно-ассоциированное повреждение легких
ОБОСНОВАНИЕ
Пандемия COVID-19, волной прокатившаяся из Китая через Европу на Запад — в США, Бразилию — и на Восток — в Россию и страны постсоветского пространства, стала вызовом для всего медицинского сообщества. В отсутствии этиотропной терапии поиск эффективных методов лечения, по сути, осуществлялся в режиме глобального эксперимента и подчас базировался на не имеющих адекватной доказательной базы сообщениях из стран, первыми пострадавших от эпидемии [1]. Сказанное в полной мере касается гипериммунной плазмы реконвалесцентов, имеющей более чем столетнюю историю применения с тем или иным успехом при пандемии гриппа («испанка», H1N1 [2, 3]), кори, полиомиелите и ряде других заболеваний, включающих и коронавирусные инфекции SARS и MERS [4, 5], но по состоянию на апрель 2020 года не имеющей доказанной эффективности в отношении COVID-19.
Исследования эффективности плазмы реконвалесцентов при терапии MERS, характеризуемого значительно более высокой летальностью, чем COVID-19, показали, что принципиальное значение имеет титр вируснейтрализующих антител, нарушающих нормальный цикл проникновения вируса в клетки-мишени [5]. У нового коронавируса SARS-CoV-2 проникновение в клетку осуществляется посредством взаимодействия шипикового S-белка c рецептором к ангиотензинпревращающему ферменту-2 (ACE2), поэтому нейтрализующие антитела должны прочно связываться с рецепторсвязы-вающим доменом S-белка, вытесняя его из связи с ACE2 [6].
Наличие в применяемой плазме вируснейтра-лизующих антител важно еще и с точки зрения профилактики потенциальных нежелательных явлений. Опыт исследований иммунного ответа на различные серотипы возбудителя лихорадки Денге и результаты некоторых доклинических исследований по MERS свидетельствовали о том, что наличие антител, не обладающих нейтрализующей активностью, может не только не способствовать защите от инфекционного агента, а наоборот, вызывать феномен усиления инфекционности и значимо утяжелять течение заболевания [7, 8].
Высокий титр вируснейтрализующих антител наблюдается далеко не у всех, кто перенес COVID-19 [6; собственные данные], хотя в целом иммунный ответ на SARS-CoV-2 вполне активный: к 15-му дню заболевания у подавляющего большинства паци- ентов присутствуют IgM и IgG (у 94,3 и 79,8% заболевших соответственно) [9].
Первые сообщения об эффективности анти-ковидной плазмы при COVID-19 пришли из Китая и выглядели обнадеживающе, хотя и были выполнены в формате серии клинических случаев. Было показано, что плазма реконвалесцентов приводит к клиническому улучшению, нормализации сатурации O2 и регрессу острого респираторного дис-тресс-синдрома (ОРДС), в том числе у пациентов в критическом состоянии и на искусственной вентиляции легких (ИВЛ) [10–12]. Во всех перечисленных исследованиях каких-либо серьезных побочных эффектов не зафиксировано, однако, учитывая размер выборки, сделать достоверные заключения о безопасности и эффективности трансфузии гипериммунной плазмы при COVID-19 не представлялось возможным. Более того, имелись отдельные сообщения, в которых наряду с потенциальной эффективностью отмечалась также возможность развития жизнеугрожающих осложнений при переливании плазмы, особенно у пациентов в критическом состоянии [13]. Вместе с тем, с учетом отсутствия эффективной этиотропной терапии против SARS-CoV-2, во всем мире в настоящее время проводятся клинические исследования плазмы реконвалесцентов I/II фазы [14–17], предварительные результаты которых позволили включить терапию плазмой в последнюю версию временных методических рекомендаций Минздрава РФ по COVID-19 [18].
Цель данной работы — изучить безопасность и эффективность трансфузии одногруппной гипериммунной плазмы реконвалесцентов пациентам с COVID-19 в виде полисегментарной пневмонии с дыхательной недостаточностью и ОРДС.
МЕТОДЫ
Дизайн исследования
Открытое проспективное рандомизированное одноцентровое сравнительное исследование безопасности и эффективности патогенредуциро-ванной иммунной плазмы реконвалесцентов, перенесших COVID-19, и свежезамороженной плазмы здоровых доноров.
Критерии соответствия
Критерии включения:
-
• подписанное информированное согласие пациента или его законного представителя, если пациент в бессознательном состоянии;
клиническая; 20
Том 121 №02
-
• мужчины или женщины в возрасте старше 18 лет (женщины фертильного возраста могут быть включены в исследование вне зависимости от наличия беременности);
-
• наличие COVID-19, подтвержденного с помощью исследования мазка на РНК SARS-CoV-2 из верхних дыхательных путей методом полимеразной цепной реакции (ПЦР) и/или клинико-рентгенологически (наличие характерной клинической картины и характерных признаков полисегментарной вирусной пневмонии COVID-19 при компьютерной томографии (КТ) грудной клетки);
-
• наличие не менее трех из следующих показателей:
-
— уровень SpO2< 93% на атмосферном воздухе;
-
— лихорадка ≥ 38,5°С в течение последних 3 сут;
-
— лимфопения < 0,85 х 10 9 /л;
-
— концентрация С-реактивного белка (СРБ) > 50 мг/л;
-
— концентрация ферритина > 600 мкг;
-
— повышение в течение последних 3 сут в ≥ 3 раза концентрации одного из показателей: IL6, IL2, TNF α , INF γ ;
-
— наличие неблагоприятных факторов тяжелого течения COVID-19 (возраст 65+, сахарный диабет, гипертоническая болезнь, ожирение, хронические заболевания с нарушением функции жизненно важных органов, другие коморбидные состояния, ухудшающие прогноз для выздоровления);
-
— респираторный индекс ≤ 300;
-
— прием иммуносупрессивных препаратов в настоящий момент или в течение последних 2 нед.
Критерии невключения:
-
• наличие противопоказаний к трансфузии донорской иммунной плазмы;
-
• продолжительность ИВЛ > 48 ч;
-
• наличие хронических заболеваний легких с хронической дыхательной недостаточностью;
-
• потребность в постоянной кислородотерапии в домашних условиях до начала настоящего заболевания;
-
• уровень креатинина в сыворотке крови > 150 мкмоль/л;
-
• наличие заболевания с прогнозом выживания < 1 года;
-
• лечение моноклональными антителами к IL6, IL2, IL1, TNF α .
Критерии исключения
Критериями досрочного прекращения участия пациентов в исследовании являлись:
-
• отзыв пациентом информированного согласия;
-
• впервые выявленные состояния и/или заболевания, описанные в критериях невключения;
-
• возникновение серьезных нежелательных явлений;
-
• нежелательные явления, не отвечающие критериям серьезности, при развитии которых, по мнению исследователя, дальнейшее участие в исследовании может оказаться пагубным для здоровья или благополучия пациента;
-
• административные причины (прекращение исследования спонсором или регуляторными органами), а также грубые нарушения протокола, способные повлиять на результаты исследования;
-
• пациент получает/нуждается в дополнительном лечении, которое может повлиять на результат исследования или безопасность пациента;
-
• индивидуальная непереносимость препаратов исследования.
Условия проведения
Исследование выполнено на базе ФГБУ ФНКЦ ФМБА России в период с 28.04. по 30.06.2020, во время работы инфекционного стационара по терапии COVID-19.
Описание медицинского вмешательства Заготовка гипериммунной плазмы
В исследовании добровольно и безвозмездно приняли участие 695 реконвалесцентов, перенесших COVID-19, из которых отобрали 146 потенциальных доноров гипериммунной антиковидной плазмы с высоким титром вируснейтрализующих антител к рецепторсвязывающему домену (RBD) S-белка SARS-CoV-2. Титр антител определяли методом иммуноферментного анализа с помощью тест-системы, разработанной в ФГБУ «НМИЦ гематологии» Минздрава России. Плазму заготавливали от доноров без гемотрансмиссивных заболеваний, с нормальными биохимическими показателями и коагулограммой, имеющих титр антител к RBD не ниже 1:1000. Заготовка осуществлялась методом плазмафереза, объем заготавливаемой плазмы составлял 640 мл за одну до- нацию, донации повторяли каждые 2 нед, до трех раз, с обязательным повторным определением титра антител.
Схема терапии
Введение свежеразмороженной одногруппной патогенредуцированной антиковидной плазмы или неиммунной плазмы осуществляли двукратно с интервалом 24 ч по следующей схеме:
-
• I день: 320 мл, внутривенно, медленно, после проведения пробы на биосовместимость;
-
• II день: 320 мл, внутривенно, медленно.
С целью профилактики возможных аллергических и гипертермических реакций каждый раз перед введением плазмы внутривенно вводили 8 мг дексаметазона.
Исходы исследования
Основные конечные точки:
-
• для пациентов, госпитализированных по поводу тяжелого течения COVID-19 и находящихся на самостоятельном дыхании: частота перевода на ИВЛ в течение 7 дней после первого введения плазмы и летальность в течение 30 дней;
-
• для пациентов с крайне тяжелым течением, находящихся на ИВЛ, — летальность в течение 30 дней.
Вторичные конечные точки:
-
• частота развития ОРДС;
-
• длительность пребывания в отделении реанимации и интенсивной терапии;
-
• общая длительность госпитализации;
-
• клинический статус, оцениваемый в соответствии с рекомендациями Всемирной организации здравоохранения;
-
• длительность пребывания на ИВЛ;
-
• длительность потребности в кислородотерапии;
-
• повышение титра антител к SARS-CoV-2 в плазме крови;
-
• динамика уровня сатурации кислорода (газов артериальной крови);
-
• динамика цитокинов IL6, IL10, TNF α ;
-
• динамика уровня СРБ;
-
• динамика уровня лихорадки;
-
• частота возникновения показаний для введения моноклональных антител к рецептору IL6.
В данном сообщении будут представлены результаты по достижению первичных конечных точек, а также вторичных конечных точек в виде динамики уровня лихорадки и СРБ.
Этическая экспертиза
Протокол исследования был одобрен Локальным этическим комитетом ФНКЦ (протокол заседания № 4 от 28.04.2020) и размещен в международном регистре клинических исследований Clinicaltrials.gov (NCT04392414). В исследование было рекрутировано 86 пациентов с COVID-19 и 146 доноров антиковидной плазмы. Все участники исследования, находящиеся на момент рекрутирования в сознании, подписали информированное согласие. Пациенты в крайне тяжелом, бессознательном состоянии были включены в исследование решением консилиума и врачебной комиссии в соответствии с временными рекомендациями Минздрава России [18] с целью переливания гипериммунной плазмы по жизненным показаниям. Рандомизация в последнем случае не проводилась.
Статистический анализ
Статистическая обработка данных проводилась для всех пациентов, которым проведена хотя бы одна инфузия плазмы и которые имеют хотя бы одну оценку после исходной по параметрам безопасности и эффективности.
Обработка данных проводилась в электронной базе данных (Excel) c использованием программы IBM SPSS Statistics 23.0. Анализ динамики параметрических данных проводили с использованием двухфакторного ANOVA для параметрических показателей, а также с помощью непараметрических методов и сравнения результатов на основе таблиц сопряженности (критерий согласия χ 2 Пирсона).
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
В исследование включено 86 пациентов с COVID-19. Пациентов рекрутировали в соответствии с критериями включения из числа вновь поступивших в инфекционный стационар с клинической картиной вирусной пневмонии, подтвержденным РНК SARS-CoV-2 и/или характерной рентгенологической картиной при КТ грудной клетки. Рекрутированные пациенты были стратифицированы в две группы: I группа ( n = 20) — пациенты с ОРДС в крайне тяжелом состоянии, находящиеся на ИВЛ; II группа ( n = 66) — пациенты c COVID-19 среднетяжелого ( n = 27) и тяжелого ( n = 39) течения на самостоятельном дыхании. Вторая группа была рандомизирована в 2 когорты в соотношении 2:1. Первая когорта (нечетные
<линическая’2п20 п эакти ка Том 11 №2
рандомизационные номера) получала в качестве терапии гипериммунную патогенредуцирован-ную антиковидную плазму ( n = 46), вторая когорта ( n = 20) по той же схеме получала неиммунную свежезамороженную плазму. В исследовании также были проанализированы две дополнительных группы ретроспективного контроля (РК1 и РК2) из пациентов с COVID-19, которые проходили лечение в ФНКЦ в тот же период времени, получая ту же стандартную терапию, но без плазмы. Группу РК1 составили 70 пациентов ОРИТ с крайне тяжелым течением COVID-19, которым проводилась ИВЛ. Группу РК2 составили 150 пациентов стационарных отделений, сопоставимых по возрасту с пациентами группы II, состояние которых на момент госпитализации расценивалось как средней тяжести (45%) и тяжелое (55%).
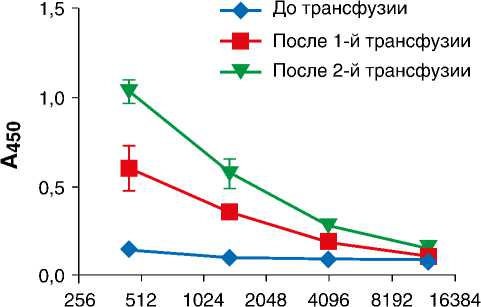
Всем пациентам, начиная с первых суток после переливания иммунной плазмы, проводили определение титра нейтрализующих антител. Это исследование еще не завершено, однако предварительные результаты показали, что после трансфузии наблюдается существенное повышения титра анти-RBD антител (до 1:1000 и выше), детектируемое не менее 3 сут после последней трансфузии ( рис. 1 ). До введения иммунной плазмы нейтрализующие антитела у рекрутированных пациентов в сыворотке крови не детектировались.
Пациенты группы I получили трансфузию плазмы реконвалесцентов, находясь на ИВЛ в течение не более 48 ч. Один из пациентов группы I с развернутой картиной ОРДС получил плазму, будучи на самостоятельном дыхании, однако, уже имея показания для проведения высокопоточной кис-лородотерапии (SatO2 90% на потоке 15 л О2/мин в прон-позиции). В течение 12 ч он был интубирован
Рис. 1. Определение титра вируснейтрализующих антител к RBD S-белка SARS-CoV-2 у пациента после трансфузии двух доз плазмы.
и переведен на ИВЛ, в связи с чем было принято решение отнести его к пациентам группы I, у которых тяжелый ОРДС уже развился. Средний возраст пациентов группы I составил 62,9 ± 14,6 года (табл. 1 ); 12 из 20 пациентов имели сопутствующую патологию в виде гипертонической болезни, сахарного диабета, стенокардии или цереброваскулярных заболеваний. Вместе с тем в группе с крайне тяжелым течением заболевания было 6 молодых мужчин (30%) с нормальным индексом массы тела, не имеющих никакой клинически значимой сопутствующей патологии. У всех пациентов группы I на фоне ОРДС и тяжелой дыхательной недостаточности имели место лабораторные признаки «цитокиново-го шторма»: выраженная лимфопения (0,85 ± 0,21), очень высокий СРБ (166 ± 44 мг/мл), значительно повышенный IL6 (102 ± 18 пг/мл) (см. табл. 1 ). Подавляющее большинство пациентов в данной группе (15 из 20) на момент начала терапии плазмой имели субтотальное поражение легких (КТ3 или КТ4).
Пациенты группы II были несколько моложе (средний возраст 55,3 ± 10,6 и 57,4 ± 12,3 года в первой и второй когортах соответственно); более чем у 80% наблюдалась коморбидная патология (табл. 2). У всех пациентов группы II наблюдались признаки острой воспалительной реакции (лимфопения, повышение СРБ, ферритина, умеренное по-вышенние IL6) и подтвержденная с помощью КТ по-лисегментарная вирусная пневмония с характерной рентгенологической картиной (участки «матового стекла», консолидации). Признаки дыхательной недостаточности (ДН3) имели 59 и 60% пациентов 1-й и 2-й когорты соответственно, что позволило классифицировать их состояние как тяжелое.
Основные результаты исследования
У пациентов группы I, находящихся на ИВЛ, серьезных нежелательных явлений не зарегистрировано. При переливании свежезамороженной плазмы пациентам группы II клинически значимых реакций также не наблюдалось (подробнее см. в нашей работе, посвященной анализу безопасности терапии плазмой реконвалесцентов [19]). Наиболее частыми побочными эффектами у всех пациентов, получивших как иммунную, так и неиммунную плазму, были сыпь по типу крапивницы — у 7 (10,8%) и 1 (5%), а также фебрильные негемолитические реакции — у 5 (7,6%) и 2 (10%) пациентов соответственно. У одного пациента группы II с тяжелым течением COVID-19, получившего антиковидную плазму, спустя час после трансфузии возник некардиогенный
Таблица 1
Общая характеристика и основные клинико-лабораторные показатели пациентов группы I, получавших терапию плазмой реконвалесцентов ( n = 20)
|
№ |
Показатель |
Значение, M ± STD |
|
|
1 |
Возраст, М ± STD (min; max), лет |
62,9 ± 14,6 (35; 89) |
|
|
2 |
Пол, м/ж |
13/7 |
|
|
3 |
Индекс массы тела, кг/м2 |
28,5 ± 4,2 (26; 31) |
|
|
4 |
Время от начала заболевания, дни |
7 (5; 11) |
|
|
5 |
SpO2 на момент поступления в ОРИТ, Mе (min; max) |
87 (83; 89) |
|
|
6 |
Респираторная поддержка на момент введения плазмы |
ВПКТ — 5 (25%) ИВЛ — 15 (75%) |
|
|
7 |
Длительность ИВЛ до начала терапии плазмой, сут, n (%) |
1 сут — 7 (35) 2 сут — 8 (40) |
|
|
8 |
Продолжительность ИВЛ, М ± STD (min; max), сут |
14,9 ± 7 (6; 28) |
|
|
9 |
ПЦР-подтвержденное наличие SARS-CoV-2, n (%) |
16 (80) |
|
|
10 |
Стадия по компьютерной томографии, n (%) |
КТ2 — 5 (25) КТ3 — 11 (55) КТ4 — 4 (20) |
|
|
11 |
CРБ, мг/л |
166 ± 44 |
|
|
12 |
Количество лимфоцитов, 1 х 10 9 /л |
0,85 ± 0,21 |
|
|
13 |
Ферритин, мг/л |
874 ± 214 |
|
|
14 |
Глюкоза, ммоль/л |
7,14 ± 1,2 |
|
|
15 |
Уровень IL6, пг/мл |
102 ± 18 |
|
|
16 |
Наличие сопутствующей патологии, ухудшающей прогноз заболевания, n (%) |
12 (60) |
|
|
17 |
Распределение по группам крови, n (%) |
O (I) — 6 (30) A (II) — 10 (50) B (III) — 3 (15) AB (IV) — 1 (5) |
Примечание. ОРИТ — отделение реанимации и интенсивной терапии, ВПКТ — высокопоточная кислородотерапия, ИВЛ — искусственная вентиляция легких, СРБ — С-реактивный белок.
Таблица 2
Общая характеристика и основные клинико-лабораторные показатели пациентов группы II
Том 121 №02
Таблица 2. Окончание
|
№ |
Показатель |
Иммунная плазма n = 46 |
Неиммунная плазма n = 20 |
|
9 |
Длительность лихорадки ≥ 38,0°C, дней, Mе (min; max) |
5 (4; 8) |
5 (3; 7) |
|
10 |
Положительный ПЦР-тест на РНК SARS-CoV-2 перед терапией плазмой, n (%) |
38 (83) |
17 (81) |
|
11 |
Стадия по компьютерной томографии, n (%) |
КТ1 — 5 (11) КТ2 — 18 (39) КТ3 — 20 (44) КТ4 — 3 (6) |
КТ1 — 2 (10) КТ2 — 13 (65) КТ3 — 5 (25) КТ4 — 0 |
|
12 |
CРБ, M ± STD, мг/л |
89,4 ± 12,4 |
80,6 ± 19,9 |
|
13 |
Количество лимфоцитов, 1 х 10 9 /л |
1,01 ± 0,36 |
1,06 ± 0,60 |
|
14 |
Ферритин, мг/л |
863,4 ± 678,1 |
823,0 ±429,9 |
|
15 |
Глюкоза, ммоль/л |
7,11 ± 2,96 |
6,44 ± 1,95 |
|
16 |
Уровень IL6, пг/мл |
44 ± 11 |
38 ± 11 |
|
17 |
Распределение по группам крови, n (%) |
0 (I) — 14 (30) A (II) — 23 (50) B (III) — 5 (11) AB (IV) — 4 (9) |
0 (I) — 5 (25) A (II) — 9 (45) B (III) — 4 (20) AB (IV) — 2 (10) |
|
18 |
Наличие сопутствующей патологии, ухудшающей прогноз заболевания, n (%) |
40 (87) |
16 (80) |
Примечание. ПЦР — полимеразная цепная реакция, СРБ — С-реактивный белок.
отек легкого, что было расценено как проявление синдрома острого посттрансфузионного повреждения лeгких (TRALI). Всего нежелательные явления в группе антиковидной плазмы (суммарно в отделении реанимации и интенсивной терапии и линейных отделениях) наблюдались у 14 пациентов, что составило 21,5% общего количества пациентов в группе, в то время как у получивших свежезамороженную плазму — лишь у 3 (15%).
У большинства пациентов группы I после введения антиковидной плазмы, несмотря на определяющийся титр нейтрализующих антител, наблюдалось дальнейшее увеличение сывороточной концентрации СРБ и ферритина, прогрессирование лимфопении. Каких-либо других клинико-лабораторных признаков эффективности терапии плазмой в первые трое суток после введения у пациентов на ИВЛ мы не обнаружили. Тридцатидневная летальность пациентов группы I, получивших антиковидную плазму, составила 60%, что практически полностью соответствует средней летальности пациентов на ИВЛ в группе РК1, определенной по 70 законченным случаям в нашем стационаре, — 57,9% [20] ( рис. 2 ).
У подавляющего большинства пациентов группы II (75%) после трансфузии плазмы реконвалес- центов в течение 1–5 сут наступало клиническое улучшение, характеризуемое регрессом лихорадки, уменьшением дыхательной недостаточности, нормализацией лабораторных показателей. В подгруппе пациентов, получивших неиммунную плазму, клиническое улучшение в течение первых 5 сут наступило в 51% случаев.
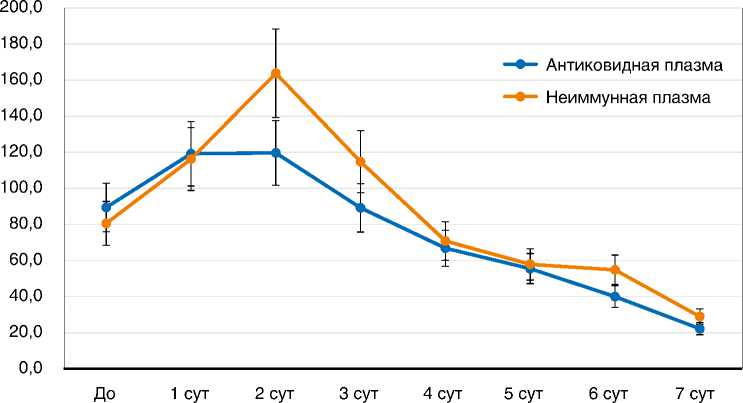
У большинства пациентов группы II, получивших трансфузию иммунной и неиммунной плазмы, наблюдался значимый антипиретический эффект. При этом в группе иммунной плазмы температура нормализовалась несколько быстрее, но разница с группой свежезамороженной плазмы не достигла статистически значимого уровня (рис. 3). Аналогичная тенденция несколько большей эффективности гипериммунной плазмы наблюдалась при анализе динамики концентрации СРБ (рис. 4): на 2-е сут после трансфузии иммунной и неиммунной плазмы различия почти достигли уровня статистической значимости ( p = 0,07).
Из 46 пациентов первой подгруппы группы II, получивших антиковидную плазму, на ИВЛ в течение первых 2 сут после трансфузии были переведены 3 (6,5%) пациента, двое из которых скончались. Причиной смерти одного пациента была коронавирусная пневмония на фоне декомпенсирован-

Рис. 2. Кумулятивные кривые выживания пациентов, получивших иммунную и неиммунную плазму
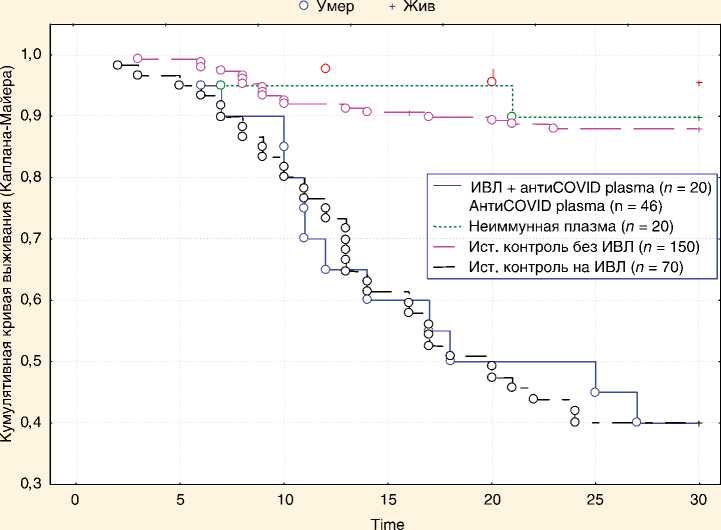
Примечание. ИВЛ — искусственная вентиляция легких.
Рис. 3. Динамика температуры тела у пациентов после переливания плазмы, °С
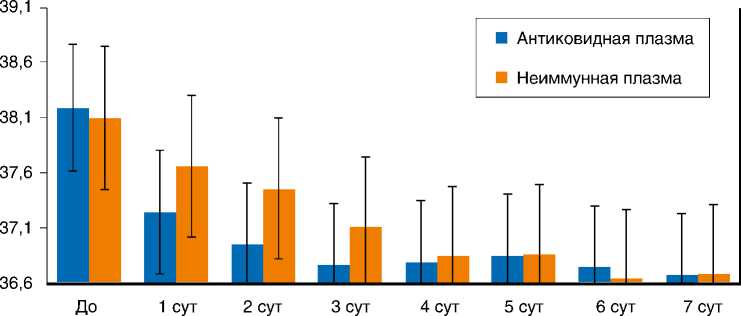
Рис. 4. Динамика концентрации С-реактивного белка в сыворотке крови у пациентов после переливания плазмы, мг/л
<линическая’2п20
п эакти ка Том 11 №2
ного миелобластного лейкоза, у другого на фоне тяжелого течения COVID-19 после введения плазмы развился некардиогенный отек легкого.
В группе, получившей свежезамороженную плазму, потребность в проведении ИВЛ также возникла у 3 (15%) пациентов, из которых двое скончались. Таким образом, госпитальная летальность в группе, получившей плазму реконвалесцентов, составила 4,3%, что достоверно ниже общей госпитальной летальности, определенной по всем законченным случаям в нашем стационаре (6,73%). В ретроспективно оцененной контрольной группе РК2, соответствующей группе антиковидной плазмы по тяжести состояния, возрасту и сопутствующей патологии, госпитальная летальность составляла 12,0% (18 пациентов из 150) (см. рис. 2 ). Таким образом, терапия плазмой реконвалесцентов позволила снизить показатель госпитальной летальности у среднетяжелых и тяжелых пациентов на самостоятельном дыхании более чем в 2 раза.
ОБСУЖДЕНИЕ
Данное клиническое исследование было инициировано нами на пике роста заболеваемости COVID-19 в городе Москве вследствие отсутствия эффективной этиотропной терапии и острейшей необходимости разработки средства экстренной помощи пациентам с тяжелым течением заболевания. Вместе с тем мы отдавали себе отчет в том, что переливание такой биологически активной субстанции, как донорская плазма, особенно плазма реконвалесцентов, может сопровождаться серьезными нежелательными явлениями, и решение о проведении трансфузии каждый раз должно приниматься только в случаях, когда риск прогрессирования и летального исхода заболевания значимо перевешивает возможные риски осложнений лечения. С учетом отсутствия доказательной базы эффективности терапии плазмой на момент начала наших исследований был выбран рекомендованный FDA формат открытого рандомизированного клинического исследования [21], которому предшествовало популяционное исследование по подбору доноров гипериммунной плазмы. Наш опыт показал, что среди потенциальных доноров, перенесших COVID-19, высокий титр антител к RBD S-белка (1:1000 и выше) имеют лишь 21% обследованных. Увеличить долю гипериммунных доноров можно лишь путем отбора тех, кто перенес тяжелую пневмонию (КТ2, КТ3) не более 2 мес назад, поскольку титр нейтрализующих антител спустя означенное время может существенно снижаться (но совсем не обязательно).
Первые работы по оценке безопасности и эффективности плазмы реконвалесцентов в лечении COVID-19 уже завершены, а результаты опубликованы, при этом несколько десятков исследований, включая представленное, продолжаются или находятся на этапе анализа полученных результатов. Стоит заметить, что один из первых отчетов об успешном лечении 5 критически тяжелых пациентов с COVID-19, находившихся на ИВЛ, получивших по 2 инфузии плазмы объемом 200–250 мл, вдохновил многих исследователей и врачей [10]. Еще одно исследование из Китая с участием 10 тяжелых больных, трое из которых находились на ИВЛ, показало клиническое и лабораторное улучшение после переливания в течение 3 дней наблюдения у всех пациентов, а также быструю редукцию КТ-симптомов [11]. Однако дальнейшие более представительные и тщательно спланированные исследования не подтвердили оптимистических выводов об эффективности плазмы реконвалесцентов у больных в критическом состоянии. Совсем недавно, уже после завершения набора пациентов в наше исследование, были опубликованы результаты одного из первых открытых рандомизированных мультицентровых исследований безопасности и эффективности плазмы реконвалесцентов, проведенного L. Li и соавт., с участием 103 пациентов в семи медицинских центрах Ухани [22]. Согласно этим данным, сравнивавшим пациентов, получавших плазму ( n = 52) или стандартную терапию ( n = 51), достоверных различий в частоте клинического улучшения и в 28-дневной летальности не обнаружено, хотя вирусная нагрузка после терапии плазмой уменьшалась достоверно быстрее, чем в контрольной группе. Вместе с тем, проанализировав раздельно подгруппы пациентов в тяжелом и крайне тяжелом состоянии с проведением ИВЛ, обнаружили, что исходы у пациентов, которые получили плазму до развития критического состояния и начала ИВЛ, достоверно лучше при сравнении с соответствующим контролем, в то время как применение плазмы в критическом состоянии никак не влияет на исход [22].
Практически одновременно были опубликованы результаты исследователей из США, где в нескольких медицинских центрах Нью-Йорка также провели рандомизированное исследование безопасности и эффективности плазмы реконвалесцентов [23]. Т. Sean и соавт. наблюдали эффект от плазмы только у тех пациентов, которые еще не были интубированы, хотя многие из них получали высокопоточную кислородотерапию [23]. Таким образом, данные нашего исследования, в котором мы не обнаружили достоверного влияния терапии плазмой на исход заболевания у пациентов, находящихся на ИВЛ, полностью соответствуют результатам мультицентровых исследований из Ухани и Нью-Йорка. Следует добавить, что у этой категории пациентов с развернутым тяжелым ОРДС и субтотальным поражением легких уже не эффективны не только плазма реконвалесцентов, но и моноклональные антитела против рецепторов IL6 и другие иммуносупрессивные препараты. Коварство COVID-19 заключается в том, что данная стадия заболевания может развиться очень быстро — в течение считанных часов, что требует от лечащего врача незамедлительного реагирования при первых признаках «цитокинового шторма».
Ключевым результатом, достигнутым нами, является более чем двукратное по сравнению с контрольными группами увеличение выживаемости пациентов, находящихся на самостоятельном дыхании после терапии плазмой. При этом в нашем исследовании было показано, что уменьшение летальности пациентов после введения плазмы не связано с неспецифическим действием иммуноглобулинов плазмы, поскольку достоверное снижение летальности не наблюдается после трансфузии неиммунной свежезамороженной плазмы. Эти результаты свидетельствуют, что снижение летальности после переливания гипериммунной плазмы, вероятнее всего, обусловлено действием вируснейтрализующих антител, инактивирующих возбудителя и вызывающих перелом в течение заболевания. Вместе с тем анти-пиретическое и противовоспалительное действие трансфузии иммунной и неиммунной плазмы отличалось недостоверно и, по всей вероятности, обусловлено действием неспецифических иммуноглобулинов и других факторов, присутствующих в нормальной плазме.
Следует отметить, что практически все исследования отмечали хорошую переносимость терапии плазмой реконвалесцентов, побочные эффекты были редкими и нетяжелыми, TRALI ни в одном случае не зафиксирован. К сожалению, наш опыт показал, что нежелательные явления при переливании гипериммунной плазмы возникают чаще, чем при переливании неиммунной свежезамороженной плазмы. С учетом возникновения у одного из пациентов с тяжелым течением COVID-19 TRALI, делать заключение о том, что переливание гипериммунной плазмы полностью безопасный метод не приходится.
ЗАКЛЮЧЕНИЕ
Таким образом, на сегодняшний день можно сделать вывод об ограниченной безопасности применения плазмы переболевших COVID-19 и эффективности такой терапии как минимум с точки зрения двукратного повышения выживаемости госпитализированных пациентов с тяжелой дыхательной недостаточностью, не находящихся на ИВЛ. В отсутствие биоинженерных вируснейтрализующих антител и эффективной этиотропной терапии применение гипериммунной плазмы реконвалесцентов является наиболее простым и эффективным средством специфической этиопатогенетической терапии тяжелых форм COVID-19.
Авторы благодарят руководителя ФМБА России В.И. Скворцову за помощь в организации НИОКР «Плазма-Антиковид».
Авторы благодарны руководителю службы крови ФМБА России О.В. Эйхлер за поддержку на этапе заготовки плазмы реконвалесцентов.
Авторы признательны руководителю лаб. трансплантационного иммунитета ФГБУ «НМИЦ гематологии» Г.А. Ефимову за помощь в выполнении им-муноферментного анализа.
Авторы благодарят А.С. Филатова (НИИ иммунологии ФМБА России) и С.А. Кулемзина (Институт молекулярной и клеточной биологии СО РАН) за помощь в оценке вируснейтрализующей активности антител.
Авторы признательны сотрудникам ФНКЦ О.А. Лебенковой и О.А. Филипповой за помощь с оформлением ИРК.
Авторы благодарят сотрудников Центра крови ФМБА России, принявших участие в заготовке плазмы реконвалесцентов.
Авторы благодарят всех доноров антиковидной плазмы, принявших участие в данном исследовании, за бескорыстную помощь медикам в борьбе с COVID-19 в тяжелый период пандемии в Москве.
Авторы выражают искреннюю благодарность и признательность всем врачам и медсестрам «красной зоны» ФНКЦ, принявшим участие в исследовании.
<линическая’2п20 п эакти ка Том 11 № 2
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Работа выполнена за счет средств государственного задания ФМБА России (шифр «Плаз-ма-Антиковид»).
Список литературы Предварительные итоги исследования безопасности и эффективности плазмы реконвалесцентов в терапии COVID-19
- Баклаушев В.П., Кулемзин С.В., Горчаков А.А., и др. COVID-19. Этиология, патогенез, диагностика и лечение // Клиническая практика. 2020;11(1):7-20. DOI: 10.17816/clinpract26339
- Luke TC, Kilbane EM, Jackson JL, Hoffman SL. Meta-analysis: convalescent blood products for Spanish influenza pneumonia: a future H5N1 treatment? Ann Intern Med. 2006;145(8):599-609. DOI: 10.7326/0003-4819-145-8-200610170-00139
- Hung IF, To KK, Lee CK, et al. Convalescent plasma treatment reduced mortality in patients with severe pandemic influenza A (H1N1) 2009 virus infection. Clin Infect Dis. 2011;52(4):447-456. DOI: 10.1093/cid/ciq106
- Cheng Y, Wong R, Soo Y, et al. Use of convalescent plasma therapy in SARS patients in Hong Kong. Eur J Clin Microbiol Infect Dis. 2005;24(1):44-46. DOI: 10.1007/s10096-004-1271-9
- Ko JH, Seok H, Cho S, et al. Challenges of convalescent plasma infusion therapy in Middle East respiratory coronavirus infection: a single centre experience. Antivir Ther (Lond). 2018;23(7):617-622. DOI: 10.3851/IMP3243
- Bin Ju, Qi Zhang, Jiwan Ge, Ruoke Wang, Jing Sun, Xiangyang Ge et al. Human neutralizing antibodies elicited by SARS-CoV-2 infection. 2020.
- DOI: 10.1038/s41586-020-2380-z
- Sridhar S, Luedtke A, Langevin E Effect of dengue serostatus on dengue vaccine safety and efficacy. N Engl J Med. 2018;379(4):327-340.
- DOI: 10.1056/NEJMoa1800820
- Wan Y, Shang J, Sun S, et al. Molecular mechanism for antibody-dependent enhancement of coronavirus entry. J Virol. 2020;94(5):e02015-19.
- DOI: 10.1128/JVI.02015-19
- Zhao J, Yuan Q, Wang H, et al. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019. Clin Infect Dis. 2020;ciaa344.
- DOI: 10.1093/cid/ciaa344
- Zhang B, Liu S, Tan T, et al. Treatment with convalescent plasma for critically ill patients with SARS-CoV-2 infection. Chest. 2020. pii: S0012-3692(20)30571-7.
- DOI: 10.1016/j.chest.2020.03.039
- Duan K, Liu B, Li C, et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc Natl Acad Sci U S A. 2020. pii: 202004168.
- DOI: 10.1073/pnas.2004168117
- Shen C, Wang Z, Zhao F, et al. Treatment of 5 critically ill patients with COVID-19 with convalescent plasma. JAMA. 2020.
- DOI: 10.1001/jama.2020.4783
- Dzik S. COVID-19 convalescent plasma: now is the time for better science. Transfus Med Rev. 2020.
- DOI: 10.1016/j.tmrv.2020.04.002
- Hyperimmune plasma for critical patients with COVID-19 (COV19-PLASMA). ClinicalTrials.gov; 2020. NCT04321421.
- Convalescent plasma to limit coronavirus associated complications. ClinicalTrials.gov; 2020. NCT04325672.
- Anti-SARS-CoV-2 inactivated convalescent plasma in the treatment of COVID-19. ClinicalTrials.gov; 2020. NCT04292340.
- Safety in convalescent plasma transfusion to COVID-19. ClinicalTrials.gov; 2020. NCT04333355.
- Временные методические рекомендации "Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)". Версия 7 (утв. Министерством здравоохранения РФ 3 июня 2020 г.). Доступно по: https://base.garant.ru/74212510/. Ссылка активна на 12.06.2020.
- Аверьянов А.В., Перкина А.С., Сотникова А.Г., и др. Исследование безопасности плазмы реконвалесцентов в терапии COVID-19 // Медицина экстремальных ситуаций. - 2020 (принято в печать).
- Клыпа Т.В., Бычинин М.В., Мандель И.А., и др. Клиническая характеристика пациентов с COVID-19, поступающих в отделение интенсивной терапии. предикторы тяжелого течения // Клиническая практика. - 2020. - Т.11. - №2.
- DOI: 10.17816/clinpract34182
- Food and Drug Administration. Recommendations for Investigational COVID-19 Convalescent Plasma. [cited 2020 May 1]. Available from: https://www.fda.gov/vaccines-blood-biologics/investigational-new-drug-ind-or-device-exemption-ide-process-cber/recommendations-investigational-covid-19-convalescent-plasma.
- Li L, Zhang W, Hu Y, et al. Effect of convalescent plasma therapy on time to clinical improvement in patients with severe and life-threatening COVID-19: a randomized clinical trial. JAMA. 2020;e2010044.
- DOI: 10.1001/jama.2020.10044
- Sean TH Liu, Hung-Mo Lin, Ian Baine, et al. Convalescent plasma treatment of severe COVID-19: A matched control study. medRxiv. 2020. Available from: https://www.medrxiv.org/content/.
- DOI: 10.1101/2020.05.20.20102236v1


