Преимущество ретроюгулярного мини-продольного доступа с альтернативным дренированием раны при выполнении каротидной эндартерэктомии
Автор: Закиржанов Н.Р., Валиахметов Р.В., Хазова Е.B.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.40, 2025 года.
Бесплатный доступ
В настоящее время при проведении каротидной эндартерэктомии (КЭЭ) прослеживается тенденция к достижению безопасности, малотравматичности, сохранению качества жизни пациента. Особое внимание после проведенного хирургического лечения на сонной артерии уделяется ятрогенным локальным осложнениям, таким как нейропатия черепно-мозговых нервов, гематома послеоперационной раны, кровотечение, тромбоз в области анастомоза с развитием инфаркта мозга, косметический изъян. Активно обсуждается вопрос каротидного доступа и дренирования раны, учитывая локальные осложнения, послеоперационное качество жизни. В данном исследовании предложен способ активного дренирования через основную рану в комбинации с малоинвазивным ретроюгулярным доступом к бифуркации сонной артерии. Проведены сравнительные расчеты между разными доступами к сонной бифуркации, сопоставлены ранние и поздние послеоперационные осложнения с учетом доступа. Результаты. При «классическом» доступе к каротидной бифуркации в сравнении с «позадияремным» доступом отмечалась большая частота неврологических симптомов, в том числе гипостезия кожи (3,8 и 33,3%, р = 0,01). Риск основных неблагоприятных сердечно-сосудистых событий (major adverse cardiovascular events – MACE) в течение 9 мес. увеличивался в 8,18 раза (HR = 8,181; 95% ДИ: 2,086–32,086; р = 0,003) по сравнению с антегулярным мини-доступом. Разработана модель прогнозирования послеоперационной нейропатии черепных нервов – увеличение длины разреза на 1 см повышает вероятность достижения вторичной конечной точки (OR = 2,264; 95% ДИ: 1,300–3,943; р = 0,004). Заключение. Проведенное исследование демонстрирует меньшую длительность и частоту послеоперационных поражений подкожных веток шейного сплетения в виде гипостезии шеи, гематом, отека шеи при комбинации малоинвазивного разреза с ретроюгулярным доступом к сонным артериям и альтернативным активным дренированием через основную рану, чем при «классическом» и мини-продольном антегулярном доступе к сонным артериям. «Классический» способ операции каротидной эндартерэктомии сопряжен с увеличением риска МАСЕ в 8,18 раза в позднем послеоперационном периоде (р = 0,003).
Каротидная эндартерэктомия, альтернативный способ дренирования раны, ретроюгулярный мини-продольный доступ
Короткий адрес: https://sciup.org/149148583
IDR: 149148583 | УДК: 616.127-005.8:616.12-008.318:615.275.4(048.8) | DOI: 10.29001/2073-8552-2025-40-2-62-70
Текст научной статьи Преимущество ретроюгулярного мини-продольного доступа с альтернативным дренированием раны при выполнении каротидной эндартерэктомии
В настоящее время в мировой практике при выполнении хирургической коррекции стеноза сонной артерии превалирует каротидная эндартерэктомия (КЭЭ) [1–3]. Тенденция современной каротидной хирургии – это стремление к четкости, безопасности, малотравматично-сти, сохранению качества жизни пациента. Согласно данным Российского общества ангиологов и сосудистых хирургов, в 2018 г. было проведено 21 972 вмешательства на сонных артериях [4]. Тем не менее, с каждым годом количество подобных операций в нашей стране только возрастает, а частота таких периоперационных осложнений, как «инсульт + летальность», которые являются основными показателям результативности, значительно снижается [4, 5].
Особое внимание после проведенного хирургического лечения на сонной артерии уделяется ятрогенным локальным осложнениям, таким как нейропатия черепно-мозговых нервов, гематома послеоперационной раны, кровотечение, тромбоз в области анастомоза с развитием инфаркта мозга. Отлично выполненный основной этап реконструкции на сонной артерии с развитием локальных осложнений существенно снижает эффективность самой операции и качество жизни пациента, где немаловажен и косметический изъян.
Однако дискуссии по поводу универсального доступа в хирургическом лечении сонных артерий и правильного дренирования раны по-прежнему продолжаются. Выполнение стандартного разреза при небольшой атеросклеротической бляшке (АСБ) внутренней сонной артерии
(ВСА) клинически не оправдано. Преимущество остается за применением менее инвазивных, так называемых мини-доступов. Установка одного активного дренажа через контрапертуру имеет свои недостатки, так как вызывает появление новой раны, которая иногда может стать самостоятельным источником кровотечения с последующим образованием острой гематомы. Она может выполнять функцию «дополнительных ворот» инфицирования области операции. В отдаленном послеоперационном периоде место выхода дренажа посредством дополнительной раны закроется рубцовой тканью, что может способствовать формированию косметического дефекта. В представленной работе проведено сравнение комбинации кожного разреза (мини-продольного < 5 см) в сочетании с доступом по отношению к внутренней яремной вене с альтернативным активным дренированием послеоперационной раны, дана оценка периоперационных осложнений.
Цель работы: оценить преимущества малоинвазивного ретроюгулярного доступа к каротидной бифуркации с активным дренированием через основную рану при выполнении КЭЭ.
Материал и методы
Объектом исследования были асимптомные пациенты и пациенты после перенесенного острого нарушения мозгового кровообращения (ОНМК) без признаков неврологического дефицита ( n = 91), которым в период с января 2022 по декабрь 2022 гг. была выполнена эверсионная КЭЭ в отделении сосудистой хирургии ГАУЗ «Городская клиническая больница № 7 им. М.Н. Садыкова» (Казань). У всех пациентов в рамках рутинной практики исследовались следующие лабораторные параметры: общий и биохимический анализы крови, в том числе липидный спектр, глюкоза натощак, креатинин с последующим расчетом скорости клубочковой фильтрации (СКФ) по формуле CKD-EPI, коагулограмма. Оценивались основные структурно-функциональные параметры сердца посредством трансторакальной эхокардиоскопии, включая фракцию выброса левого желудочка (ЛЖ) по Симпсону. Перед хирургическим вмешательством проводилось ультразвуковое исследование брахиоцефальных артерий с определением локализации бифуркации общей сонной артерии. В зависимости из применявшихся видов хирургического доступа пациенты были разделены на три группы: группа I – 52 (57,1%) пациента, которым операция произведена из позадияремного мини-продольного разреза кожи (менее 5 см) с выделением каротидной бифуркации по задней поверхности яремной вены («позадияремный» доступ) с ее медиальным отведением. Всем пациентам данной группы активное дренирование осуществлялось через основную рану (рис. 1 А, Б).
В группе II 27 (29,7%) пациентам операция выполнена из мини-продольного разреза кожи (менее 5 см) с выделением каротидной бифуркации по передней поверхности внутренней яремной вены с ее латеральным отведением и активным дренированием раны через контрапертуру. В группе III у 12 (13,2%) пациентов операция проведена традиционным доступом, где продольный разрез кожи составил больше 5 см, с активным дренированием раны через контрапертуру (рис. 2 А, Б).
По большинству параметров межгрупповых различий среди пациентов не установлено (табл. 1).
Пациенты анализируемых групп были сопоставимы по характеру поражения сонных артерий (табл. 2).
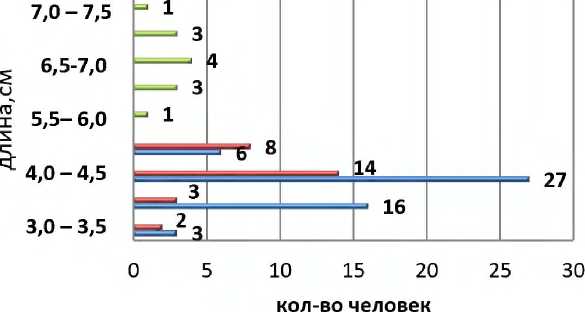
Кожный разрез выполняли по намеченной линии по переднему краю грудино-ключично-сосцевидной мышцы (рис. 3) длиной 3,5–8,0 см, предварительно определив локализацию бифуркации общей сонной артерии с помощью аппарата ультразвукового исследования Philips HD XE.
Сонные артерии по отношению к яремной вене выделяли двумя доступами: 1-й доступ – «классический», когда лицевую вену лигировали с прошиванием в области устья и пересекали, а яремную вену отводили лате-рально; 2-й доступ – «позадияремный», когда выделяли заднюю стенку внутренней яремной вены на всем протяжении и отводили медиально. Эверсионную КЭЭ проводили по методике, предложенной R. Kieny в 1984 г.: ВСА иссекали в устье, затем стенку артерии по медиальной поверхности рассекали продольно на протяжении 5–6 мм, артерию в субадвентициальном слое выворачивали в дистальном направлении и после удаления АСБ имплантировали в изначальное устье. Последовательность выполнения методики эверсионной КЭЭ у всех пациентов не различалась и не зависела от протяженности бляшки ВСА. Активный дренаж после КЭЭ устанавливали через контрапертуру по методике, предложенной А.В. Покровским [6], или через основную рану.
Все оперативные вмешательства выполняли под инфильтрационной проводниковой анестезией шейного сплетения. В зависимости от длины кожного разреза учитывали анальгезирующий результат, оценку которого проводили при помощи числовой рейтинговой шкалы боли (numeric rating scale for pain) [7]. После операции все пациенты были проконсультированы оперирующим хирургом, неврологом, оториноларингологом. Для выявления повреждения черепных нервов проводили неврологическое тестирование, ларингоскопию (прямую и непрямую), измеряли максимальную фонацию гласных звуков, а также длину кожного разреза.
Срок наблюдения в послеоперационном периоде составил 9 мес. Критериями оценки результативности после КЭЭ были случаи основных неблагоприятных сердечно-сосудистых событий (major adverse cardiovascular events – MACE), к которым относили нефатальный инфаркт миокарда (ИМ), приступ стенокардии, ОНМК, смерть. Достижение МАСЕ устанавливали путем телефонного опроса пациента. Вторичными конечными точками считали послеоперационный тромбоз ВСА, послеоперационную нейропатию черепных нервов, косметические дефекты. Вторичную конечную точку оценивали при очном приеме пациента в послеоперационном периоде.
Косметический эффект определяли с помощью шкалы субъективной и объективной оценки рубца (Patient and Observer Scar Assessment Scale — POSAS), состоящей из шкалы оценки рубца пациентом, в том числе его внешнего вида, причиняемого дискомфорта, и шкалы оценки рубца оперирующим хирургом. Обе шкалы состоят из 6 параметров, сумма которых отражается в общем балле по шкале наблюдателя и пациента POSAS [8]. Все параметры сравнивали с нормальной кожей на соответствующем анатомическом месте.
Статистическую обработку данных проводили в программе StatTech v.3.1.3 (ООО «Статтех», Россия). Для проверки нормальности распределения количественных показателей применяли критерий Шапиро – Уилка. Нор-
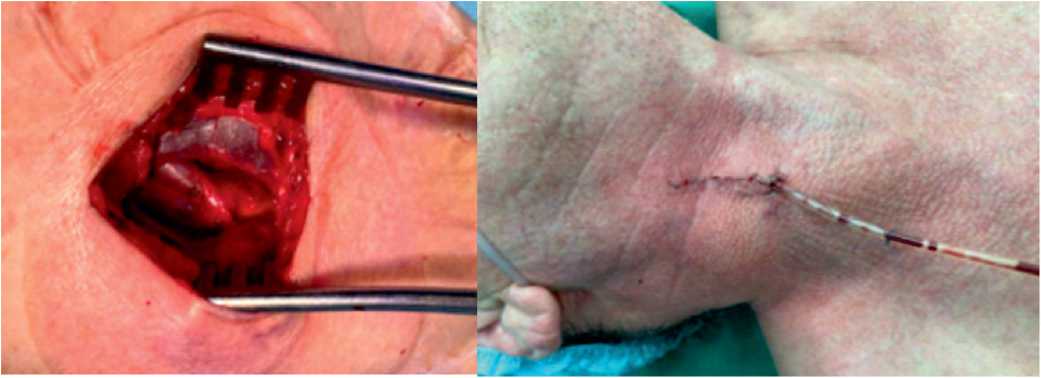
Рисунок 1. Ретроюгулярный мини-продольный доступ бифуркации общей сонной артерии справа: А – каротидная бифуркация сонной артерии после реконструкции через ретроюгулярный доступ; Б – мини-продольный доступ (длина разреза кожи 4,0 см) и активное дренирование через основную рану
Figure 1. Retrojugular mini longitudinal access to the bifurcation of the common carotid artery on the right: A – carotid bifurcation of the carotid artery after reconstruction through retrojugular access; Б – mini-longitudinal access (skin incision length 4.0 cm) and active drainage through the main wound
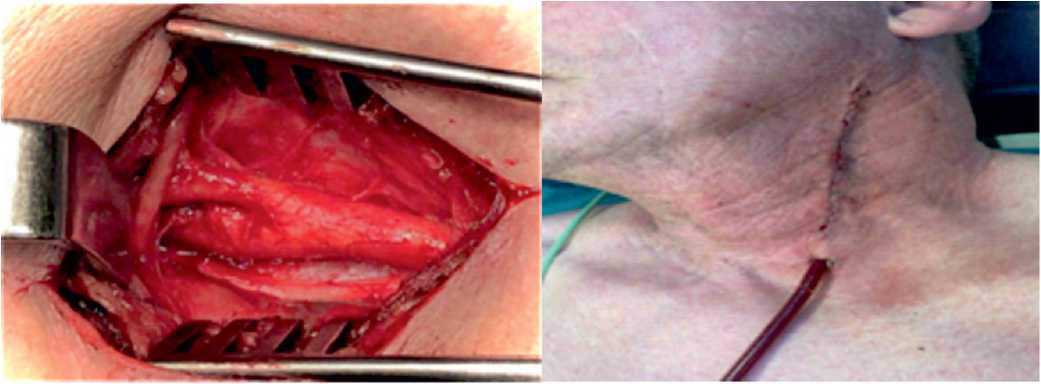
Рисунок 2. «Классический» доступ бифуркации общей сонной артерии справа: А – выделение каротидной бифуркации по передней поверхности внутренней яремной вены с ее латеральным отведением; Б – дренирование послеоперационной раны через контрапертуру
Figure 2. The “classical” access to the bifurcation of the common carotid artery on the right: A – isolation of carotid bifurcation along the anterior surface of the internal jugular vein with its lateral abduction; Б – drainage of the postoperative wound through a contraperture
□ Группа III й Группа II йГруппа I
Рисунок 3. Длина кожного разреза
Figure 3. The length of the skin incision
Таблица 1 . Характеристика пациентов, включенных в исследование
Table 1 . Characteristics of the patients included in the study
|
Показатели |
Группа I, n = 52 |
Группа II, n = 27 |
Группа III, n = 12 |
р |
|
Возраст, лет, M (SD) |
66 (9) |
67 (10) |
68 (10) |
p I–II = 0,96 p II–III = 0,69 p I–III = 0,625 |
|
Мужчины, абс. (%) |
36 (69,2) |
22 (81,5) |
5 (41,7) |
p I–II = 0,24 p II–III = 0,023* p I–III = 0,099 |
|
Женщины, абс. (%) |
16 (30,8) |
5 (18,5) |
7 (58,3) |
|
|
Анамнез, отягощенный по сердечно-сосудистым заболеваниям, абс. (%) |
8 (15,4) |
3 (11,1) |
3 (25,0) |
0,540 |
|
Курение, абс. (%) |
9 (17,3) |
6 (22,2) |
1 (8,3) |
0,573 |
|
Постинфарктный кардиосклероз, абс. (%) |
18 (34,6) |
6 (22,2) |
2 (16,7) |
0,317 |
|
Предыдущий инсульт / ТИА, абс. (%) |
10 (19,2) |
5 (18,5) |
0 |
0,255 |
|
ХОБЛ, абс. (%) |
3 (5,8) |
2 (7,4) |
2 (16,7) |
0,442 |
|
САД, мм рт. ст., M (SD) |
137 (16) |
145 (25) |
134 (16) |
0,236 |
|
ДАД, мм рт. ст., Me [Q1–Q3] |
72 [66–80] |
78 [70–90] |
80 [80–82] |
0,087 |
|
ФП, абс. (%) |
1 (1,9) |
1 (3,7) |
2 (20,0) |
pI–II = 1,0 p II–III = 0,172 p I–III = 0,065 |
|
Сахарный диабет, абс. (%) |
11 (21,6) |
1 (3,7) |
6 (50,0) |
pI–II = 0,049 p II–III = 0,002 pI–III = 0,07 |
|
Длительность ХСН, абс (%) |
||||
|
Менее 5 лет, абс. (%) |
4 (7,7) |
4 (14,8) |
7 (58,3) |
pI–II = 0,436 pII–III = 0,011 p I–III <0,001 |
|
5 10 лет, абс. (%) |
18 (34,6) |
11 (40,7) |
4 (33,3) |
|
|
Более 10 лет, абс. (%) |
30 (57,7) |
12 (44,4) |
1 (8,3) |
|
|
ИМТ, кг/м2, Me [Q1–Q3] |
25,7 [23,8–27,3] |
27,9 [25,3–31,3] |
23,5 [21,5–25,7] |
pI–II = 0,005 p II–III = 0,002 p I–III = 0,037 |
|
ЛПНП, ммоль/л, Me [Q1–Q3] |
3 [2–3] |
2 [2–3] |
3 [3–4] |
0,135 |
|
Фракция выброса ЛЖ (%), Me [Q1–Q3] |
58 [54–60] |
51 [28–58] |
43 [32–54] |
pI–II = 0,005 p II–III = 0,973 pI–III = 0,007 |
|
СД в ЛА мм рт. ст., Me [Q1–Q3] |
24 [16–35] |
31 [28–46] |
39 [30–50] |
pI–II = 0,048 pII–III = 0,552 p I–III = 0,015 |
Примечание: *здесь и далее жирным шрифтом отмечены значимые различия между группами. ТИА – транзиторная ишемическая атака; ХОБЛ – хроническая обструктивная болезнь легких; САД – систолическое артериальное давление; ДАД – диастолическое артериальное давление; ФП – фибрилляция предсердий; ХСН – хроническая сердечная недостаточность; ИМТ – индекс массы тела; ЛПНП – липопротеиды низкой плотности, ЛЖ – левый желудочек, СД – систолическое давление; ЛА – легочная артерия.
Таблица 2 . Сравнение параметров ультразвукового исследования сонных артерий
Table 2 . Comparison of parameters of ultrasound examination of carotid arteries


1 xn oorjuiyui
9 'етрсхоп |рныи мини досп и Pl Лнтгп дорный мини доспи
Ф Кмсааи
Рисунок 4. Длительность выполнения каротидной эндартерэктомии с учетом вида доступа
Figure 4. The duration of carotid endarterectomy accounting the type of access
критерия Данна с поправкой Холма. Категориальные данные указаны в виде абсолютных значений и процентных долей. Процентные доли сравнивали по критерию χ 2 Пирсона (при значениях ожидаемого явления более 10), точному критерию Фишера (при значениях ожидаемого явления менее 10). Апостериорные сравнения выполняли с помощью критерия χ 2 Пирсона с поправкой Холма. Анализ достижения МАСЕ проводили по методу регрессии Кокса, подразумевающему прогнозирование риска наступления события для рассматриваемого объекта и оценку влияния заранее определенных независимых переменных (предикторов) на этот риск. Построение прогностической модели вероятности определенного исхода выполняли при помощи метода логистической регрессии. Мерой определенности, указывающей на ту часть дисперсии, которая может быть объяснена с помощью логистической регрессии, служил коэффициент R² Найджел-керка.
Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применяли метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определяли по наивысшему значению индекса Юдена. Различия считали статистически значимыми при p < 0,05.
Результаты
В группе I мужчин было в 2 раза больше, чем женщин (см. табл. 1); у 21,6% пациентов был сахарный диабет. Обращает на себя внимание большая медиана индекса массы тела (ИМТ) (25,7 [23,8–27,3] и 23,5 [21,5–25,7] кг/м2, p = 0,037) у пациентов группы I по сравнению с группой III. Доля лиц с длительностью хронической сердечной недостаточности (ХСН) более 10 лет в группе I превышала данный показатель в группе III (57,7 и 8,3%; p < 0,001). У пациентов группы I в сравнении с группой III медиана систолического давления (СД) в легочной артерии (ЛА) была меньше (24 [16–35] и 39 [30–50] мм рт. ст. соответственно, p = 0,015) Медиана фракции выброса ЛЖ регистрировалась в пределах референсных величин (58 [54–60] %), тогда как в группе III наблюдалось ее снижение (43 [32–54] %; p = 0,007).
В группе II по сравнению с группой III было больше мужчин ( р = 0,023), а также лиц с длительностью ХСН более 10 лет ( p = 0,011), с большей медианой ИМТ (27,9 [25,3–31,3] и 23,5 [21,5–25,7] кг/м2, p = 0,002). Сахарный диабет диагностирован у 3,7% пациентов, тогда как в группе III – у каждого второго пациента ( p = 0,002).
Проведен сравнительный анализ длительности опе- рации в зависимости от вида доступа и длины разреза. Медиана длительности оперативного вмешательства у пациентов группы II на 8 мин превышала таковую у пациентов группы I (48 [45–55] и 40 [37–45] мин соответственно, p < 0,001), (рис. 4).
Наблюдение за пациентами в послеоперационном периоде выявило большую частоту неврологической симптоматики, оцениваемой врачом неврологом по наличию асимметрии лица, осиплости голоса, гипостезии шеи, при «классическом» доступе к каротидной бифуркации. Поражение кожных ветвей шейного сплетения (гипостезия кожи) реже наблюдалось у пациентов группы I, чем группы III (3,8 и 33,3% соответственно, p = 0,01), (табл. 3).
Оценка достижения конечных точек в зависимости от вида доступа продемонстрировала в группе I по сравнению с группой III меньшую частоту таких местных осложнений, как послеоперационная гематома в раннем послеоперационном периоде (7,7 и 41,7%; χ 2 = 16,466; p = 0,011), отек шеи (11,5 и 33,3%; χ 2 = 16,466; p = 0,011) (табл. 4, рис. 5 А, Б).
Оценка косметического эффекта по шкале POSAS проведена врачом и пациентом. Медианный балл по шкале POSAS составил 8 [7–10] баллов при оценке врачом, 7 [6–9] баллов – при оценке пациентом. Согласно оценке врача, толщина рубца по шкале POSAS пациентов группы II была больше в сравнении с пациентам групп I и III (2 [1–2] балла; 1 [1–1] балл, p < 0,001; 1 [1–2] балл соответственно, p = 0,047). Выраженность косметического дефекта в раннем послеоперационном периоде может быть обусловлена рассечением m.digastricus при удлинении разреза в случае антегулярного доступа для визуализации ВСА.
Следующим этапом работы была оценка достижения конечных точек пациентами после КЭЭ. МАСЕ достигли 12,1% пациентов, из них у 2,1% пациентов был зарегистрирован смертельный исход. Причиной смерти с равной частотой явились ИМ и ОНМК. В структуре нефатальных сердечно-сосудистых событий ИМ регистрировали у 2,2%, приступ стенокардии напряжения – у 6,7%, ОНМК – у 1,1% пациентов. Вторичную конечную точку достигли 14,3% пациентов, из них у 3,3% пациентов отмечался тромбоз ВСА, у 11% – нарушение функции черепных нервов.
Межгрупповое сравнение риска МАСЕ свидетельствовало о 4-кратном превышении частоты достижения МАСЕ в группе III в сравнении с группой I (41,7 и 9,6%; р = 0,012) и о 11-кратном превышении в сравнении с группой II (41,7 и 3,7%; p = 0,007). При оперировании клас-
Таблица 3 . Структура послеоперационных неврологических осложнений у пациентов после каротидной эндартерэктомии в зависимости от вида доступа
Table 3 . The structure of postoperative neurological complications in patients after carotid endarterectomy, depending on the type of access
|
Местные осложнения |
Группа I, n = 52 |
Группа II, n = 27 |
Группа III, n = 12 |
р * |
χ 2 |
|||
|
Абс. |
% |
Абс. |
% |
Абс. |
% |
|||
|
Асимметрия лица |
1 |
1,9 |
1 |
3,7 |
1 |
8,3 |
0,003 p I-III = 0,010 p II-III = 0,018 |
20,016 |
|
Осиплость голоса |
1 |
1,9 |
1 |
3,7 |
1 |
8,3 |
||
|
Гипостезия шеи |
2 |
3,8 |
0 |
0 |
4 |
33,3 |
||
|
Всего |
4 |
7,7 |
2 |
7,4 |
6 |
50 |
< 0,001* p I–III < 0,001 p II–III = 0,005 |
16,365 |
Примечание: *сравнение процентных долей при анализе многопольных таблиц сопряженности осуществлялось с помощью критерия χ 2 Пирсона. Апостериорные сравнения выполнялись с помощью критерия χ 2 Пирсона с поправкой Холма.
Таблица 4 . Частота локальных осложнений после каротидной эндартерэктомии
Table 4 . The frequency of local complications after carotid endarterectomy
|
Показатели |
Категории |
Группы |
χ 2 |
p |
||
|
Группа I, n = 52 |
Группа II, n = 27 |
Группа III, n = 12 |
||||
|
Локальные осложнения, абс. (%) |
Нет |
40 (76,9) |
16 (59,3) |
3 (25,0) |
16,466 |
0,011 |
|
Гематома |
4 (7,7) |
6 (22,2) |
5 (41,7) |
|||
|
Серома |
2 (3,8) |
2 (7,4) |
0 (0,0) |
|||
|
Отек шеи |
6 (11,5) |
3 (11,1) |
4 (33,3) |
|||
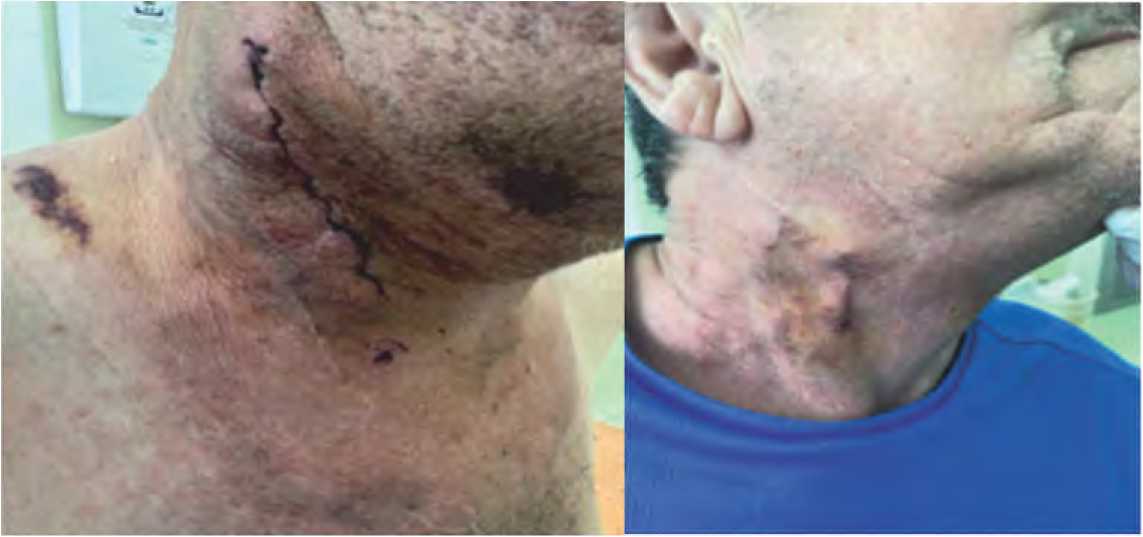
Рисунок 5. Послеоперационная рана на 4-е сутки после реконструктивной операции на сонной артерии справа: А – «классический» доступ с образованием подкожной гематомы, косметический изъян; Б – мини-продольный доступ с альтернативным дренированием через основную рану Figure 5. Postoperative wound on the 4th day after reconstructive surgery on the right carotid artery: A – “classic” access with the formation of a subcutaneous hematoma, cosmetic defect; B – mini-longitudinal access with alternative drainage through the main wound
сическим способом риск МАСЕ увеличивался 8,18 раза (HR = 8,181; 95% ДИ: 2,086–32,086; p = 0,003) по сравнению с антегулярным мини-доступом. Мужчины достигали МАСЕ в 3,95 раза реже, чем женщины (HR = 0,253; 95% ДИ: 0,075–0,853; p = 0,027).
Вторичная конечная точка чаще регистрировалась у пациентов группы III по сравнению с группами I и II (50; 7,7; 7,4%, р < 0,001 и р = 0,005 соответственно). Построена модель однофакторной бинарной логистической регрессии для определения вероятности достижения вто- ричной конечной точки (послеоперационная нейропатия черепных нервов) в зависимости от длины разреза:
P = 1/(1 + e–z), z= –5,858 + 0,817×X, где P – вероятность достижения вторичной конечной точки, X – длина разреза.
Полученная регрессионная модель является статистически значимой (p = 0,004). Исходя из значения коэффициента детерминации Найджелкерка, модель объ- ясняет 17,1% наблюдаемой дисперсии вторичной точки. При увеличении длины разреза на 1 см вероятность достижения вторичной конечной точки повышается в 2,264 раза (ОШ = 2,264; 95% ДИ: 1,300–3,943). Площадь под ROC-кривой составила 0,694; 95% ДИ: 0,504–0,884. Пороговая вероятность (cut-off) по критерию Юдена равнялась 0,217; чувствительность и специфичность модели 50,0 и 92,5% соответственно.
Обсуждение
Проведенное исследование демонстрирует меньшую длительность и частоту послеоперационных поражений подкожных веток шейного сплетения в виде гипостезии шеи, гематом, отека шеи при комбинации малоинвазивного разреза с ретроюгулярным доступом к сонным артериям и альтернативным активным дренированием через основную рану, чем при «классическом» и мини-продольном антегулярном доступе к сонным артериям.
Необходимым условием успешной операции является правильное дренирование раны после КЭЭ с целью профилактики развития осложнений в области вмешательства. Такие осложнения, как напряженная гематома, могут привести к ревизии послеоперационной раны, что неизбежно вызовет повторную травматизацию тканей.
В настоящем исследовании установлено, что при оперировании классическим способом увеличивается риск достижения первичной и вторичной конечных точек, что обусловлено большей длительностью операции. При мини-продольном разрезе с ретроюгулярным доступом к сонной артерии ткани травмируются в меньшей степени. При протяженной бляшке ВСА при мини-продольном доступе можно применить технику «тоннельного» доступа к дистальным отделам ВСА, разработанную Н.Г. Хоревым. Данная методика заключается в сохранении целостности шилоподъязычной мышцы (а в ряде случаев и заднего брюшка двубрюшной мышцы) и отказе от мобилизации языкоглоточного нерва при антегулярном доступе. В результате сочетания этого доступа операционное поле выглядит как тоннель. Боковыми стенками тоннеля являются бранши ранорасширителя, верхней стенкой – ши-лоподъязычная и двубрюшная мышцы, языкоглоточный нерв и ветви лицевого нерва, нижней стенкой – участок оперируемой ВСА [9]. Сам мини-продольный доступ не исключает возможности расширения для более широкого контроля сонных артерий.
Недостатками любого доступа к сонным артериям является возможные проявления периферической нейропатии (изменение голоса, перекос лица, затруднение глотания, нарушение чувствительности и движений языка и др.), являющиеся следствием интраоперационного контакта с нервными структурами на шее. Частота возникновения таких осложнений, по данным различных авторов, колеблется от 2 до 23% [8, 9]. В проведенном исследовании частота осложнений после КЭЭ с использованием мини-доступа составила в группе I – 7,6%, в группе II – 7,4%.
Используемый нами мини-продольный ретроюгуляр-ный доступ к сонным артериям, заключающийся в выделении латеральной стенки внутренней яремной вены с отведением последней медиально, позволяет уменьшить тракцию основных нервных стволов и необходимость перевязки лицевой вены при выделении сонных артерий, исключая возможность кровотечения несостоятельности лигатуры лицевой вены.
Ретроюгулярный мини-продольный доступ с активным дренированием через основную рану показал хорошие косметические результаты, согласно оценке врача и пациента по шкале POSAS.
Согласно сравнительным расчетам, применяемый нами альтернативный способ активного дренирования через основную рану лишен вышеописанных отрицательных качеств в силу следующих причин:
-
1. Отсутствует контрапертура при выведении единственной дренажной трубки. Использование рассасывающего шовного материала при зашивании раны и фиксации дренажа обеспечивает комфортное пребывание пациента в послеоперационном периоде за счет отсутствия дополнительных манипуляций для снятия швов и менее травматичное заживление раны.
-
2. Дополнительный отток жидкости из места удаления дренажной трубки ведет к профилактике напряженной гематомы и образования косметического дефекта в виде рубцовой ткани в отдаленном послеоперационном периоде.
-
3. При данном способе дренажная трубка лежит более физиологично вдоль раневой поверхности, не образуя перегибов и углов.
Установлено, что использованный нами мини-продольный ретроюгулрярный доступ к сонным артериям достоверно безопаснее, чем «классический», так как в группе пациентов с мини-продольным ретроюгулрярным доступом и активным дренированием через основную рану значимо реже встречаются послеоперационные осложнения в виде поражения черепных и шейных нервов, послеоперационной гематомы и отека шеи; не выявлено ни одного случая инсульта и ТИА.
Кроме этого, данный вид открытого хирургического вмешательства может быть применен в любом стационаре с минимальными затратами для выполнения в сравнении с робот-ассистированными технологиями, где необходимо дорогостоящее оборудование, расходный материал, а также специально подготовленный персонал.
Заключение
Таким образом, комбинация малоинвазивного разреза и ретроюгулярного доступа с активным дренированием через основную рану, примененная в данном исследовании, позволила сократить время операции ( р < 0,001), что играет важную роль при оперативном лечении тяжелых коморбидных пациентов. В группе I в раннем послеоперационном периоде наблюдалось меньше таких осложнений, как послеоперационная гематома ( p = 0,011), отек шеи, косметический изъян, нейропатия черепных нервов, что способствовало быстрой реабилитации и сокращению дней пребывания пациента в стационаре. Классический способ операции КЭЭ сопряжен с увеличением риска МАСЕ в позднем послеоперационном периоде в 8,18 раза ( р = 0,003).
Разработанная модель позволяет прогнозировать развитие послеоперационной нейропатии черепных нервов по выполненной длине разреза ( p = 0,004).


