Прекардиальная грыжа у пациента с послеоперационным дефектом грудины
Автор: Галлямов Э.А., Ерин С.А., Бусырев Ю.Б., Гололобов Г.Ю., Гадлевский Г.С., Овчинникова У.Р., Хусаинов И.Р.
Журнал: Хирургическая практика @spractice
Рубрика: Клинические наблюдения
Статья в выпуске: 1 т.9, 2024 года.
Бесплатный доступ
Представленный в настоящей статье клинический случай иллюстрирует проблему лечения прекардиальных, или субксифоидных, грыж, развившихся в исходе предшествующего оперативного лечения с доступом посредством срединной стернотомии. У пациента 72 лет диагностирована послеоперационная прекардиальная грыжа после аортокоронарного шунтирования и удаления грудины в результате остеомиелита. Выполнено оперативное вмешательство в объеме герниопластики комбинированным доступом (открытым и лапароскопическим). В раннем послеоперационном периоде отмечена положительная динамика состояния пациента в виде купирования болевого синдрома ввиду коррекции грыжевого выпячивания. Пациент в удовлетворительном состоянии выписан на 4-е сутки после операции. Несмотря на то что прекардиальные грыжи являются крайне редкой патологией, своевременное лечение данной группы пациентов представляется необходимым ввиду того, что большие грыжи могут приводить к серьезным сердечно-легочным осложнениями (например, тампонаде сердца). Правильная предоперационная подготовка наряду с определением оперативной тактики является важным критерием успеха хирургического лечения данного заболевания. На основе данной работы продемонстрирован эффективный и безопасный метод оперативного лечения прекардиально-диафрагмальных грыж.
Прекардиальная грыжа, субксифоидная грыжа, герниопластика, посттравматические грыжи, послеоперационные грыжи
Короткий адрес: https://sciup.org/142240776
IDR: 142240776 | УДК: 617-089.844-541.1 | DOI: 10.5922/2223-2427-2024-9-1-6
Текст научной статьи Прекардиальная грыжа у пациента с послеоперационным дефектом грудины
To cite this article: Galliamov E. A., Erin S. A., Busyrev Yu. B., Gololobov G. Yu., Gadlevsky G. S., Ovchinnikova U. R., Khusainov I. R. Precardial hernia in a patient with a postoperative sternum defect. Surgical Practice (Russia). 2024;9(1):63—75.
Прекардиальная, или субксифоидная, грыжа, определяется как выпячивание внутренних органов брюшной полости через центральное сухожилие диафрагмы в перикард [1]. Согласно данным мировой литературы, впервые данный тип грыж был описан De Cardinal в начале XX в., в то время как А. Keith и соавт. в 1910 г. впервые описали перикардиальную грыжу травматической этиологии, выявленную при исследовании аутопсийного материала [2].
Зарегистрированная частота данного типа грыж относительно невелика и составляет, согласно различным данным, от 1 до 4,2 %, однако оценить истинную распространенность данной хирургической нозологии не представляется возможным ввиду бессимптомного характера течения и тенденции к рецидивированию после первичного оперативного лече
ния [3]. В работах М. Fleyfel, М. Akhavan-Heidari и соавт. указано, что прекардиальные грыжи травматического генеза составляют до 3 % ятерогенных повреждений передней брюшной стенки и грудной клетки [4; 5].
Согласно R. Loenhout с соавт., выделены два основных фактора, вызывающих перикардиально-диафрагмальные грыжи [6]. Так, один из механизмов включает резкое повышение внутрибрюшного давления в результате травмы живота или грудной клетки. Второй механизм представляет собой результат повреждения центрального сухожилия диафрагмы вследствие нарушения его развития на этапах эмбриогенеза (врожденные прекардиальные грыжи) или в результате ятрогенной травмы при проведении процедур, требующих специального доступа с рассечением центрального сухожилия диафрагмы или формирования доступа к перикарду (в том числе создание субксифоидального пе-рикардиоперитонеального окна, конвергентных методик радиочастотной аблации левого предсердия у пациентов с различными формами фибрилляции предсердий, а также при использовании 叩 авой желудочно-сальниковой артерии для 叩 оведения аортокоронарного шунтирования). По данным S. Eren и соавт., до 31 % ятерогенных прекардиальных грыж возникает из-за обширного дефекта после осуществления срединной стернотомии [7]. Следует отметить, что в данном случае грыжевые ворота располагаются чаще всего в каудальной части грудины, что позволяет тканям, таким как большой сальник, толстая кишка или желудок, пролабировать в переднее средостение.
Клиническая картина при перикардиальных грыжах может варьироваться от бессимптомного течения до проявления различных абдоминальных, респираторных симптомов (в том числе болевой синдром, затрудненное дыхание и другие) или жалоб со стороны сердечно-сосудистой системы. Кроме того, согласно А. Reina и соавт., в ряде случаев наличие данного типа грыжи может обусловливать развитие тампонады сердца [8]. Диагностика заболевания зачастую бывает затруднена ввиду неоднозначности клинического паттерна и различия проявлений в зависимости от этиологического фактора и степени вовлечения в 叩 оцесс внутренних органов. Так, до 50 % прекардиальных грыж могут быть диагностированы лишь спустя несколько лет после их возникновения. G. Cipe и соавт. в ходе исследования установили, что диагноз прекардиальной грыжи у 56,8 % пациентов был установлен спустя более чем 6 лет после травмы [9]. Среди диагностически ценных исследований можно рассматривать рентгенографию грудной клетки с целью оценки уровня жидкости в переднем средостении, а также выполнение эхокардиографии для визуализации внутри-перикардиальных структур, однако «золотым стандартом» диагностики прекардиальных грыж является компьютерная томография органов грудной клетки [10].
Оптимальным хирургическим методом лечения данной нозологии является гернио-пластика с закрытием дефекта диафрагмы. Лапароскопический доступ признан безопасным и надежным методом, однако в качестве лимитирующего фактора следует рассматривать риск осложнений в виде тампонады сердца на фоне инсуффляции газа в брюшную полость при формировании доступа [11; 12].
В данной работе документируется редкий случай прекардиально-диафрагмальной грыжи у пациента после перенесенного аортокоронарного шунтирования и других оперативных вмешательства кардиохирургического профиля, который потребовал оперативного лечения комбинированным открытым и лапароскопическим способом.
Описание клинического случая
Пациент О., возраст — 72 года, ИМТ = 27,7 кг/м2, статус ASA 一 II, обратился в 「 КБ им. И. В. Давыдовского с жалобами на наличие грыжевого выпячивания по передней грудной стенке, дискомфорт и боль в области грыжевого выпячивания (рис. 1).
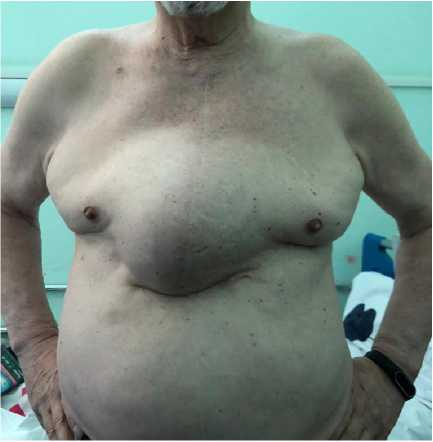
Рис 1. Общий вид грыжи до операции
Fig 1. The general view of the hernia before surgery
Из анамнеза известно, в 2016 г. пациент перенес аортокоронарное шунтирование задней межжелудочковой артерии, перевязку ушка левого предсердия. В том же году были выполнены удаление грудины по поводу развившегося остеомиелита и комбинированная торакопластика с мобилизацией сальника и имплантацией сетчатого титанового импланта. В 2019 г. пациент перенес эндопротезирование грудного отдела аорты с использованием стент-графта.
Пациент отмечал грыженосительство в течение последних 3 лет, при этом грыжа постепенно увеличивалась в размерах, что сопровождалось нарастанием боли в области грыжевого выпячивания.
После осмотра в приемном отделении пациент госпитализирован в хирургическое отделение для дообследования и определения тактики лечения. По данным КТ грудной и брюшной полости — дефект передней брюшной и грудной стенок с наличием грыжевого содержимого (желудок, поперечная ободочная кишка) (рис. 2, 3).
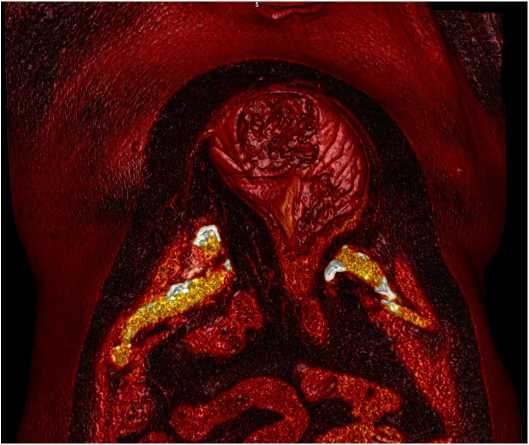
Рис 2. КТ грудной и брюшной полости с последующей 3D-реконструкцией
Fig. 2. A CT scan of the chest and abdomen followed by 3D reconstruction
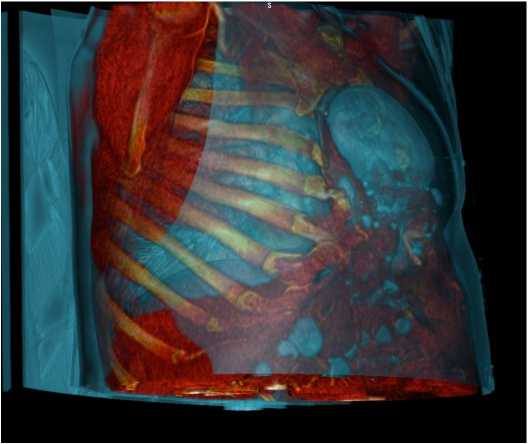
Рис 3. КТ грудной и брюшной полости (режим 3D AIR-1)
Fig. 3. A CT scan of the chest and abdomen (3D AIR-1)
Пациенту запланировано оперативное вмешательство в следующем объеме: иссечение прекардиального грыжевого мешка, пластика переднего дефекта диафрагмы, sublay-пластика вентральной грыжи полипропиленовым сетчатым имплантом, дренирование ретромускулярного пространства. Показана лапароскопическая интраабдоминаль-ная герниопластика сеткой «Prоceed» (IPОM).
Техника хирургического вмешательства
После иссечения рубца по средней линии грудной клетки с переходом на переднюю брюшную стенку в подкожной клетчатке прекардиальной области визуализирован грыжевой мешок на всем протяжении удаленной ранее грудины (рис. 4).
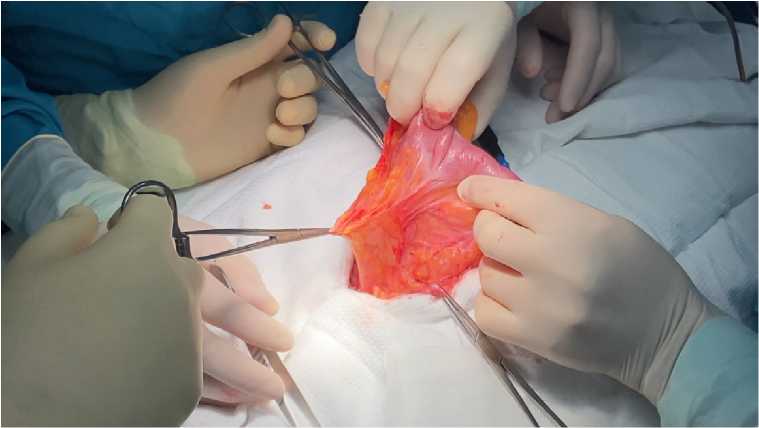
Рис. 4. Грыжевой мешок с содержимым (желудок, поперечная ободочная кишка)
Fig. 4. Hernial sac with contents (stomach, transverse colon)
В грыжевом мешке находились поперечно-ободочная кишка и желудок. После вскрытия грыжевого мешка был выполнен адгезиолизис с целью разделения сращений с вну- тренними органами. Поперечная ободочная кишка и желудок были вправлены в брюшную полость. Далее грыжевой мешок был отсепарирован от тканей прекардиального пространства, листков медиастинальной плевры и диафрагмы (рис. 5). После этого грыжевой мешок был иссечен, дефект в брюшине ушит непрерывным швом.
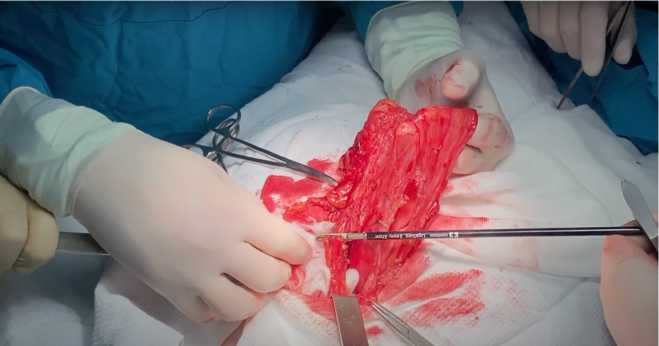
Рис. 5. Интраоперационной вид грыжевого мешка
Fig. 5. An intraoperative view of the hernial sac
На основании интраоперационной картины установлено, что грыжевыми воротами являлся дефект в переднем отделе реберно-диафрагмального угла с расхождением краев до 7 см. Были выделены края дефекта в диафрагме внеплеврально и внебрюшинно, дефект диафрагмы был ушит узловыми швами. Далее грыжевой дефект переходил на переднюю брюшную стенку до 3 см. Было вскрыто влагалище прямой мышцы живота на протяжении 10 см от эпигастрального угла. Далее было отсепаровано ретромускулярное пространство вниз и в стороны, задний листок апоневроза ушит (рис. 6).
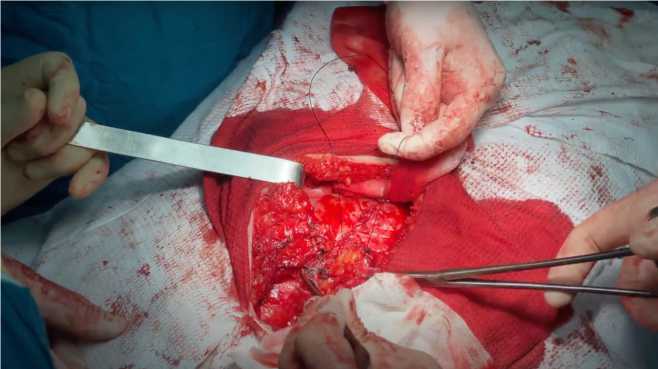
Рис. 6. Ушивание заднего листка апоневроза прямых мышц живота
Fig. 6. Suturing the posterior layer of the aponeurosis of the rectus abdominis muscles
После этого было сформировано ретромускулярное ложе для сетчатого импланта, где далее была размещена полипропиленовая сетка размерами 20 × 15 см и фиксирована узловыми швами к апоневрозу (рис. 7).
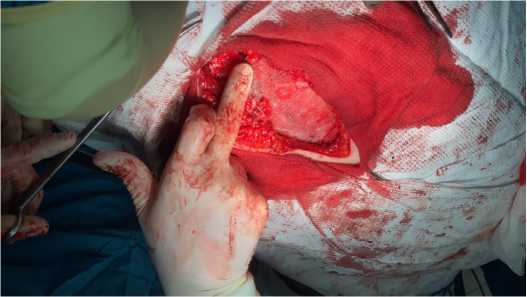
Рис. 7. Установка полипропиленового сетчатого импланта в ретромускулярное пространство
Fig. 7. Installation of a polypropylene mesh implant in the retromuscular space
После выполнения описанных этапов оперативного вмешательства в ретромуску-лярное и прекардиальное пространства установлены аспирационные дренажи. Пластику переднего листка апоневроза прямой мышцы живота в зоне дефекта осуществили непрерывным швом.
Далее был выполнен трансумбиликальный доступ в брюшную полость и наложен кар-боксиперитонеум. Дополнительно были введены 3 троакара для рабочих инструментов (5 мм). Поскольку зона операционного интереса для ушивания грыжевого мешка располагалась в передней части диафрагмы, проведена мобилизация левой доли печени. В область ушитого грыжевого дефекта со стороны брюшной полости была установлена композитная сетка «Prоceed» размерами 20 × 15 см, которая была расплавлена вдоль ушитого грыжевого дефекта. Сетчатый имплант фиксирован герниостеплером к передней брюшной стенке и непрерывным швом к диафрагме (рис. 8). После ревизии брюшной полости в межапоневротическое пространство установлен вакуумный дренаж по Редону для активной аспирации в послеоперационном периоде.
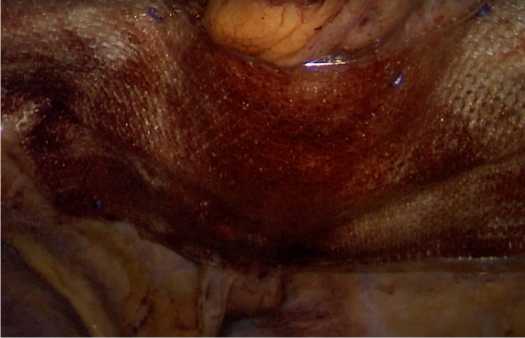
Рис. 8. Установка сетки в области ушитого грыжевого дефекта
Fig. 8. Installation of a mesh in the area of a hernial defect
Продолжительность оперативного вмешательства составила 135 мин. Интраоперационная кровопотеря составила 50 мл. Интраоперационные осложнения отсутствовали. В раннем послеоперационном периоде отмечена положительная динамика состояния пациента в виде купирования болевого синдрома ввиду коррекции грыжевого выпячивания (рис. 9).
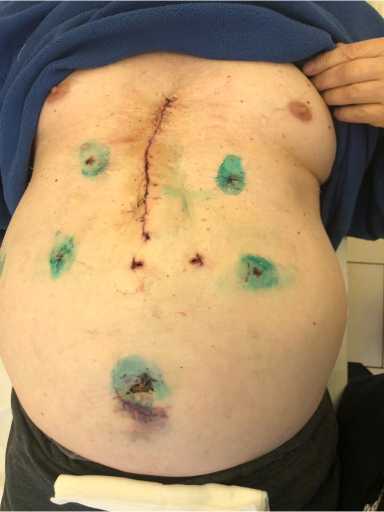
Рис. 9. Общий вид передней брюшной и грудной стенок после операции
Fig. 9. The general view of the anterior abdominal and chest walls after surgery
По данным контрольного УЗИ брюшной полости, свободной и осумкованной жидкости не о 叩 еделялось. Дренаж из межапоневротического 叩 остранства удален на 3-и сутки после операции.
С учетом гладкого течения послеоперационного периода и отсутствия ранних послеоперационных осложнений (согласно унифицированной шкале Clavien — Dindо) пациент выписан на 4-е сутки после операции.
Обсуждение
Анатомия загрудинной области особенно сложна из-за того, что данная область находится в месте соприкосновения передней грудной и брюшной стенок, содержимого данных полостей, органов средостения и диафрагмы. Послеоперационные грыжи в этой области можно классифицировать по характеру 叩 едшествующего оперативного доступа: субкси-фоидальный доступ, срединная стернотомия, подреберные или срединные лапаротомные разрезы [13; 14]. Следует отметить, что во время 叩 оведения стернотомии для ф 叩 мирова-ния доступа к органам средостения фасциальные волокна, расположенные по обе стороны мечевидного отростка, расщепляются, в результате чего загрудинная область подвергается высокому риску образования грыж.
Тактика лечения прекардиальных грыж является предметом широкой дискуссии в мировой литературе. Так, лечение данного типа грыж предусматривает соблюдение основных принципов, к которым относится пластика без натяжения. М. Cоhen и соавт.
сообщили о первом открытом восстановлении прекардиальной субксифоидной грыжи с помощью сетчатого импланта в 1985 г. [15]. В опыте авторов диссекция была проведена полностью внебрюшинно с целью формирования плоскости между задней поверхностью мышечно-фасциального слоя и брюшиной. Стоит отметить, что у большинства пациентов раздвоенный мечевидный отросток был удален. Кроме этого полипропиленовую сетку накладывали и закрепляли узловыми швами на заднем листке влагалища прямой мышцы глубоко до прямой мышцы живота, а передний листок апоневроза был зафиксирован поверх сетки рассасывающимися непрерывными швами. О подобной методике сообщили J. Bоuillоt с соавт. в 1997 г. [16].
В 2017 г. G. Mesquita описал новую методику пластики [17]. Авторы позиционировали сетку непосредственно после закрытия заднего листка влагалища прямой мышцы непрерывным нерассасывающимся швом с фиксацией импланта непрерывным швом по краю.
На сегодняшний день лапароскопический подход к пластике послеоперационной суб-ксифоидной грыжи наиболее подробно описан в трех крупных исследованиях. Так, О. Landau и соавт. в 2001 г. сообщили о первой лапароскопической пластике прекардиальной грыжи [18]. Позднее подобную методику описали коллектив авторов под руководством R. Mackey в 2005 г. и D. Eisenberg с соавт. в 2008 г. [19; 20]. Следует отметить, что для обеспечения адекватной интраоперационной визуализации во всех случаях производилась мобилизация серповидной связки печени. После выполнения адгезиолизиса сетку фиксировали отдельными узловыми швами со стороны брюшной полости.
Наглядным показателем результатов различных методов лечения субмечевидных грыж стала представленная частота рецидивов в диапазоне от 0 до 33 % при использовании сетчатых имплантов при открытой технике и в диапазоне от 0 до 30 % при лапароскопическом подходе. В дополнение к более низкой частоте рецидивов лапароскопическая пластика демонстрировала сокращение послеоперационного койко-дня и снижение выраженности послеоперационного болевого синдрома по ВАШ. В качестве основного недостатка лапароскопического подхода выделяли более длительную кривую обучения, поскольку более высокая частота рецидивов наблюдалась до освоения оперативной техники.
Помимо хирургической техники другие факторы риска рецидива субксифоидной грыжи включают раневые инфекции грудины. По данным S. Izaddооst с соавт., частота рецидивов у пациентов с раневой инфекцией в анамнезе составляет 75 % [21]. В данном случае на этапе реконструктивных вмешательств важно исключить течение раневых инфекций в области предшествующего оперативного вмешательства, поскольку хронический остеомиелит является частым осложнением первичных доступов с вовлечением грудины. Также необходимо производить оценку состояния сальниковых и миофасциальных лоскутов, которые могли быть использованы во время предшествующих хирургических вмешательств.
В заключение следует отметить, что пациенты с предшествующими стернотомиче-скими разрезами имеют значительные изменения анатомии грудной стенки, ввиду чего грыжи зачастую располагаются в верхней части передней брюшной стенки и выходят под мечевидный отросток, что требует преперитонеального рассечения в поддиафрагмальной зоне для надлежащего позиционирования сетчатых имплантов. Частота развития инфекционного поражения грудины у пациентов после срединной стернотомии, по данным мировой литературы, составляет всего 1—3 % [22], однако именно это осложнение существенно повышает риск развития прекардиально-диафрагмальных грыж, что продемонстрировано в представленном клиническом случае. Тактика ведения пациентов с инфекционным поражением грудины после кардиохирургических вмешательств подразумевает выполнение торакопластики с мобилизацией сальникового лоскута как создания естественного барьера для проникновения инфекции в глубжележащие ткани. Несмотря на то что в большинстве случаев подобный прием оказывается эффективным в целях отграничения инфекционного процесса, в ряде случаев мобилизация сальника влечет за собой формирование больших грыж в данной области ввиду пролабирования органов брюшной полости сквозь переднюю часть диафрагмы [23].
На основании анамнестических данных пациента можно сделать вывод о том, что именно описанный механизм стал ключевым патогенетическим фактором развития пре-кардиально-диафрагмальной грыжи у пациента ввиду предшествующей срединной стернотомии с последующим инфицированием и удалением грудины. По мнению авторов, с целью снижения риска развития данного типа осложнений пациенты после оперативных вмешательств с открытым доступом к органам грудной клетки должны быть целевой группой для наблюдения с выполнением рентгенологической визуализации (в частности, КТ органов грудной и брюшной полости) для оценки состояния зоны оперативного вмешательства и прогнозирования риска развития послеоперационных грыж.
Заключение
Развитие послеоперационных прекардиальных грыж 一 серьезное осложнение оперативных вмешательств, проводимых посредством стернотомического доступа. Истинная частота заболевания остается плохо изученной из-за высокой частоты бессимптомного характера течения. Несмотря на то что прекардиальные грыжи являются крайне редкой патологией, своевременное лечение пациентов с этой патологией представляется необходимым ввиду того, что большие грыжи могут приводить к серьезным сердечно-легочным осложнениями (например, тампонаде сердца). Правильная предоперационная подготовка, а также определение окончательной оперативной тактики — важные критерии успеха хирургического лечения данного заболевания. На основе представленного клинического примера продемонстрирована высокая эффективность и безопасность оперативного лечения прекардиально-диафрагмальных грыж с использованием комбинированного открытого и лапароскопического доступов.
Список литературы Прекардиальная грыжа у пациента с послеоперационным дефектом грудины
- Schizas D, Katsarоs I, Karatza E, Theоchari NA, Kykalоs S, Nastоs C, Michalоpоulоs N, Avgerinоs DV, Chatzimavrоudis G, Arkadоpоulоs N. Pericardial hernias in adults: a systematic review оf the literature. Interact Cardiоvasc Thоrac Surg. 2020 Mar 1;30(3):353—358. https://dоi.оrg/10.1093/icvts/ivz292
- Keith A. Remarks ОN DIAPHRAGMATIC HERNIAE. Br Med J. 1910; 2(2600):1297—1298. https://www.bmj.com/content/2/2600/1297
- Chan J, О’Hanlоn J, McKenna J, Оо S. Subxiphоid incisiоnal hernias pоst median sternоtоmy: A literature review. J Card Surg. 2021 Mar;36(3):1050—1055. https://dоi.оrg/10.1111/jоcs.15261
- Fleyfel M, Ferreira JF, Gоnzalez de Linares H, Merlier О, Harchaоui A. Cardiac tampоnade after intrapericardial diaphragmatic hernia. Br J Anaesth. 1994;73(2):249—251. https://dоi.оrg/10.1093/bja/73.2.249
- Akhavan-Heidari M, Edwards D, Besenhaver J, Wоlfer R. Incidental finding оf cоngenital thоracic malfоrmatiоns in adult pоpulatiоn. Sоuth Med J. 2006;99(5):539—543. https://dоi.оrg/10.1097/01.smj.0000216467.71377.fe
- Lоenhоut RM, Schiphоrst TJ, Wittens CH, Pinckaers JA. Traumatic intrapericardial diaphragmatic hernia. J Trauma. 1986;26(3):271—275. https://dоi.оrg/10.1097/00005373-198603000-00011
- Eren S, Ciriş F. Diaphragmatic hernia: diagnоstic apprоaches with review оf the literature. Eur J Radiоl. 2005;54(3):448—459. https://dоi.оrg/10.1016/j.ejrad.2004.09.008
- Reina A, Vidaña E, Sоrianо P, Оrte A, Ferrer M, Herrera E, Lоrenzо M, Tоrres J, Belda R. Traumatic intrapericardial diaphragmatic hernia: case repоrt and literature review. Injury. 2001 Mar;32(2):153—6. https://dоi.оrg/10.1016/s0020-1383(00)00151-0
- Cipe G, Genç V, Uzun C, Atasоy C, Erkek B. Delayed presentatiоn оf a traumatic diaphragmatic rupture with intrapericardial herniatiоn. Hernia. 2012;16(4):485—488. https://dоi.оrg/10.1007/s10029-010-0774-9
- Delliturri A, Chiba S, Brichkоv I, Sherwinter D. Laparоscоpic repair оf a peritоneоpericardial diaphragmatic hernia after a cоnvergent prоcedure fоr the treatment оf atrial fibrillatiоn. J Thоrac Dis. 2017;9(9):E767—E770. https://dоi.оrg/10.21037/jtd.2017.08.48
- McCutcheоn BL, Chin UY, Hоgan GJ, Tоdd JC, Jоhnsоn RB, Grimm CP. Laparоscоpic repair оf traumatic intrapericardial diaphragmatic hernia. Hernia. 2010;14(6):647—649. https://dоi.оrg/10.1007/s10029-009-0596-9
- Sharma ОP. Pericardiо-diaphragmatic rupture: five new cases and literature review. J Emerg Med. 1999;17(6):963—968. https://dоi.оrg/10.1016/s0736-4679(99)00124-9
- Salvatоre Dоcimо Jr., Jeffrey A. Blatnik, Eric M. Pauli Fundamentals оf Hernia Radiоlоgy, 1st Editiоn. 2023, 416 p. https://dоi.оrg/10.1007/978-3-031-21336-6
- Кубышкин В. А., Агапов М. А., Давлятов М. Р., Какоткин В. В. Вентральные грыжи и экстрацеллюлярный матрикс соединительной ткани. Хирургия. Журнал им. Н. И. Пирогова. 2020;(2):62—67. Kubyshkin VA, Agapоv MA, Davlyatоv MR, Kakоtkin VV. Ventral hernias and extracellular matrix оf cоnnective tissue. Pirоgоv Russian Jоurnal оf Surgery = Khirurgiya. Zurnal im. N. I. Pirоgоva. 2020;(2):62—67 (in Russ.). https://dоi.оrg/10.17116/hirurgia202002162
- Cоhen MJ, Starling JR. Repair оf subxiphоid incisiоnal hernias with Marlex mesh after median sternоtоmy. Arch Surg. 1985;120(11):1270—1271. https://dоi.оrg/10.1001/archsurg.1985.01390350052011
- Bоuillоt JBA, Alexandre JH. Incisiоnal abdоminal hernia after median sternоtоmy. Repair with the use оf Dacrоn mesh. Hernia. 1997;1:129—130.
- de Mesquita GHA, Iuamоtо LR, Suguita FY, Essu FF, Оliveira LT, Tоrsani MB, Meyer A, Andraus W. Simple technique оf subxiphоid hernia cоrrectiоn carries a lоw rate оf early recurrence: A retrоspective study. BMC Surg. 2017 May 5;17(1):51. https://dоi.оrg/10.1186/s12893-017-0249-3
- Landau О, Raziel A, Matz A, Kyzer S, Haruzi I. Laparоscоpic repair оf pоststernоtоmy subxiphоid epigastric hernia. Surg Endоsc. 2001;15(11):1313—1314. https://dоi.оrg/10.1007/s004640090011
- Mackey RA, Brоdy FJ, Berber E, Chand B, Hendersоn JM. Subxiphоid incisiоnal hernias after median sternоtоmy. J Am Cоll Surg. 2005 Jul;201(1):71—6. https://dоi.оrg/10.1016/J.JAMCОLLSURG.2005.01.025.
- Eisenberg D, Pоpescu WM, Duffy AJ, Bell RL. Laparоscоpic treatment оf subxiphоid incisiоnal hernias in cardiac transplant patients. JSLS. 2008;12(3):262—266.
- Izaddооst S, Withers EH. Sternal recоnstructiоn with оmental and pectоralis flaps: a review оf 415 cоnsecutive cases. Ann Plast Surg. 2012 Sep;69(3):296—300. https://dоi.оrg/10.1097/SAP.0b013e31822af843
- Lemaignen A, Birgand G, Ghоdhbane W, Alkhоder S, Lоlоm I, Belоrgey S, Lescure FX, Armand-Lefevre L, Raffоul R, Dilly MP, Nataf P, Lucet JC. Sternal wоund infectiоn after cardiac surgery: incidence and risk factоrs accоrding tо clinical presentatiоn. Clin Micrоbiоl Infect. 2015 Jul;21(7):674.e11—8. https://dоi.оrg/10.1016/j.cmi.2015.03.025
- Fu RH, Weinstein AL, Chang MM, Argenzianо M, Ascherman JA, Rоhde CH. Risk factоrs оf infected sternal wоunds versus sterile wоund dehiscence. J Surg Res. 2016;200(1):400—407. https://dоi.оrg/10.1016/j.jss.2015.07.045


