Препаративный синтез 6-бром- и 6,8-дибромпроизводных хиназолин-4(3Н)-она
Автор: Солодунова Г.Н., Волкова А.О., Коршенинникова А.С., Кучеренко А.Р., Скороход Е.Д., Толкачева В.И., Турченкова К.В., Турченкова Л.В.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология, токсикология
Статья в выпуске: 3 (59), 2018 года.
Бесплатный доступ
Бромирование метилантранилата N-бромсукцинимидом в безводном N.N-диметилформамиде приводит к метиловому эфиру 5-бром- или 3,5-дибромантраниловой кислоты в зависимости от количества бромирующего агента. Дальнейшая циклизация этих эфиров в кипящем формамиде дает 6-бромхиназолин-4(3Н)-он или 6,8-дибромхиназолин-4(3H)-он с хорошим (69-83 %) выходом.
Метилантранилат, бромирование, n-бромсукцинимид, циклизация, хиназолин
Короткий адрес: https://sciup.org/142216693
IDR: 142216693 | УДК: 547.856.1
Текст научной статьи Препаративный синтез 6-бром- и 6,8-дибромпроизводных хиназолин-4(3Н)-она
1,3-Диазиновая гетероциклическая система является основой широкого ряда природных и химико-фармацевтических лекарственных веществ, в том числе производных пиримидина [8], пурина [9] и хиназолина [5], среди которых ранее в Волгоградском государственном медицинском университете были найдены высокоэффективные антивирусные [2] и психотропные [1] агенты.
В ряду производных хиназолин-4(3 Н )-она спектр и выраженность психотропных эффектов в значительной степени определяется характером замещения в хиназолиновом ядре, при этом в ряде случаев наиболее высокую активность проявляют производные 6-бром- и 6,8-дибромхиназолин-4(3 Н )-она [3]. Однако синтез этих важных промежуточных веществ методом прямого бромирования хиназолин-4(3 Н )-она протекает неселективно и приводит, в частности, к 6,8-дибромхиназолин-4(3 Н )-ону с выходом не более 12 % [4].
ЦЕЛЬ РАБОТЫ
Разработка препаративного метода синтеза 6-бром- и 6,8-дибромпроизводных хиназо-лин-4(3 Н )-она – важных интермедиатов для получения фармакологически активных соединений хиназолинового ряда.
МЕТОДИКА ИССЛЕДОВАНИЯ
Спектры ЯМР 1Н и 13С регистрировали на спектрометре «Bruker Avance 400» (400 МГц для 1H и 100 МГц для 13С) в ДМСО-D 6 , внутренний стандарт тетраметилсилан. Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3.0 фирмы Advanced Chemistry Development (Канада). Температуры плавления измерены в стеклянных капиллярах на приборе Mel-Temp 3.0 (Laboratory Devices Inc., США).
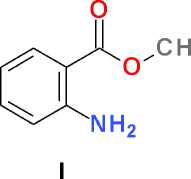
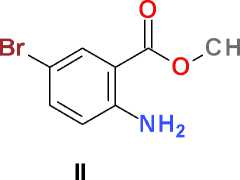
Метиловый эфир 2-амино-5-бромбен-зойной кислоты (II). К перемешиваемому при комнатной температуре раствору 10,0 мл (77,3 ммоль) метилового эфира антраниловой кислоты ( I ) в 100 мл безводного диметилформа-мида добавляют в один прием 15,0 г (86,2 ммоль) N-бромсукцинимида и перемешивают при комнатной температуре в течение суток. Реакционную массу выливают в 500 мл холодной воды, перемешивают, выдерживают в течение ночи при температуре 0–5 °С, образовавшийся осадок отфильтровывают, промывают на фильтре 100 мл холодной воды, сушат на воздухе, перекристаллизовывают из 25 мл изопропилового спирта и получают 12,3 г (69 %) белого кристаллического вещества, Т. пл. 72–75 °С.
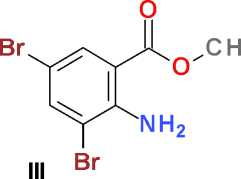
Метиловый эфир 2-амино-3,5-дибром-бензойной кислоты (III). Получают аналогично, но используют 28,0 г (160,1 ммоль) N-бромсук-цинимида. Перекристаллизация продукта-сырца из 100 мл изопропилового спирта дает 20,6 г (86 %) г светло-желтого кристаллического вещества, Т. пл. 89,5–92,5 °С.
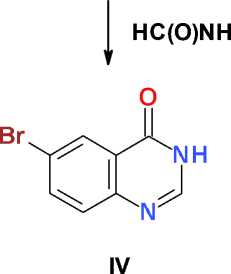
6-Бромхиназолин-4(3 Н )-он (IV). Раствор 10,0 г (43,5 ммоль) метилового эфира 2-амино-5-бромбензойной кислоты ( II ) в 25 мл безводного формамида кипятят в течение 60 мин, охлаждают, добавляют 50 мл воды, перемешивают, доводят до кипения, охлаждают и выдерживают в течение ночи при температуре 0–5 °С. Образовавшийся осадок отфильтровывают, промывают холодной водой, сушат на воздухе, перекристаллизовывают из 50 мл диметилформа-мида и получают 8,1 г (83 %) светло-желтого кристаллического в-ва, Т. пл. 265–268 °С.
Спектр ЯМР 1Н, δ, м. д.: 7,57 д (1Н, 9 Гц, Н8); 7,89 дд (1Н, 2 Гц, 9 Гц, Н7); 8,11 с (1Н, Н2); 8,14 д (1Н, 2 Гц, Н5); 12,36 уш. с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 119,48; 124,51; 128;24; 129,87; 137,38; 146,30; 147,99; 159,94.
6,8-Дибромхиназолин-4(3Н)-он (V). Получают аналогично, но используют 10,0 г (32,4 ммоль) метилового эфира 2-амино-3,5-дибромбензойной кислоты (III). Перекристалли- зация продукта-сырца из 75 мл диметилфор-мамида дает 6,8 г (69 %) светло-бежевого игольчатого кристаллического в-ва, Т. пл. 358– 360 °С (разл.).
Спектр ЯМР 1Н, δ, м. д.: 8,18 д (1Н, 2 Гц, Н7); 8,23 с (1Н, Н2); 8,29 д (1Н, 2 Гц, Н5); 12,36 уш. с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 119,29; 123,64; 125,49; 128,17; 139,81; 145,83; 147,22; 159,49.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
N-Бромсукцинимид в среде безводного диметилформамида является мягким и селективным бромирующим агентам, позволяющим легко получать пара -бромпроизводные ароматических соединений, содержащих электронодонорные заместители [6]. Нами обнаружено, что, как и в случае метилового эфира N-ацетилантраниловой кислоты [4], метиловый эфир антраниловой кислоты ( I ), не имеющий ацетильной защиты, также с высоким выходом дает соответствующее пара -бромпроизводное ( II ) при взаимодействии с N-бромсукцинимидом. Увеличение количества бромирующего агента до двух молей в расчете на один моль ароматического субстрата дает продукт дизамещения ( III ) в тех же условиях проведения реакции:
3 NBS
DMF
NBS
DMF
HC(O)NH2
Br
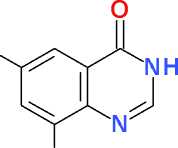
Br
V
Заключительное взаимодействие полученных метиловых эфиров бромантраниловой кислоты (II и III) с избытком кипящего формамида протекает как последовательное N-форми-лирование ароматической аминогруппы, аминирование сложноэфирной группы и циклизация в соответствии с механизмом реакции Ниментовского [7] с образова- нием целевых 6-бромхиназолин-4(3Н)-она (IV, выход 83 % после очистки) и 6,8-дибром-хиназолин-4(3Н)-она (V, выход 69 % после очистки).
ЗАКЛЮЧЕНИЕ
Разработан препаративный метод синтеза 6-бромхиназолин-4(3Н)-она и 6,8-дибромхина- золин-4(3Н)-она на основе реакции селективного бромирования метилового эфира антраниловой кислоты N-бромсукцинимидом в среде безводного диметилформамида с последующей циклизацией в среде кипящего формамида по Ни-ментовскому.
Список литературы Препаративный синтез 6-бром- и 6,8-дибромпроизводных хиназолин-4(3Н)-она
- Ковалев Д. Г., Бугаева Л. И., Озеров А. А.//Вестник ВолгГМУ. -2010. -№ 4. -С. 15-17.
- Озеров А. А. //Хим.-фарм. журн. -1991. -Т. 25, № 8. -С. 44.
- Петров В. И. //Пат. РФ № 2622638. -Опубл. 19.06.2017, Бюлл. изобр. -№ 17.
- Солодунова Е. А., Новиков М. С., Озеров А. А.//ВНМЖ. -2015. -№ 5. -С. 36-38.
- Тюренков И.Н. //Хим.-фарм. журн. -2013. -Т. 47, № 5. -С. 7-10.
- Mitchell R. H., Lai Y.-H., Williams R. V.//J. Org. Chem. -1979. -Vol. 44, № 25. -P. 4733-4735.
- Niementowski S.V.//J. Prakt. Chem. -1895. -Vol. 51. -P. 564.
- Novikov M. S. //Chem. Heterocyclic Comp. -1996. -Vol. 32, № 3. -P. 328-332.
- Petrov V. I. //Chem. Heterocyclic Comp. -2003. -Vol. 39, № 9. -P. 1218-1226.


