Причины и последствия высоких цен на лекарственные препараты в США. Пути решения
Автор: Айтян Т.В.
Журнал: Ars Administrandi. Искусство управления @ars-administrandi
Рубрика: Зарубежный опыт государственного управления и международные отношения
Статья в выпуске: 1 т.10, 2018 года.
Бесплатный доступ
Введение: стоимость лекарств в США сильно завышена по сравнению с европейскими странами и последние годы продолжает показывать высокие темпы роста. Вопросы ценообразования лекарственных препаратов вызывают беспокойство у всего населения страны, включая пациентов, врачей и политиков. Цель: проанализировать причины и последствия высоких цен на лекарства на рынке США и сформулировать возможные государственные меры, способные сдержать их стоимость. Методы: общенаучные, такие как системный анализ, конкретно-исторический, структурный и сравнительный анализ. Информационно-теоретической основой исследования послужили законодательные и нормативные документы, статистические материалы международных баз данных по отрасли за период 2008-2017 годов. Результаты: расходы на рецептурные препараты на душу населения в США в среднем более чем в 2 раза превышают расходы в других странах ОЭСР. Наиболее серьезным фактором, стимулирующим подобное ценообразование в США, является рыночная эксклюзивность, защищенная монопольными правами компаний и патентами; сдерживание своевременного выпуска дженериков; ограничение права плательщиков в переговорах по цене. Выводы: стоимость препаратов в США не всегда может быть оправдана высокими расходами на НИОКР, ценообразование скорее зависит от предельных возможностей плательщика. В краткосрочном периоде следующие меры были бы способны сдержать высокие цены: ужесточение требований к присуждению прав на эксклюзивность; усиление конкуренции путем поддержки дженериковых препаратов; предоставление больших прав в рамках переговоров по цене для государственных плательщиков; требование весомых доказательств сравнительной экономической эффективности новых препаратов. Ряд обозначенных мер могут быть актуальны для реформирования российского фармацевтического рынка.
Фармацевтическая отрасль, государственное управление, ценообразование, расходы на здравоохранение, сша, европа, страхование, инновации
Короткий адрес: https://sciup.org/147204269
IDR: 147204269 | УДК: 338.45:615(7) | DOI: 10.17072/2218-9173-2018-1-168-180
Текст научной статьи Причины и последствия высоких цен на лекарственные препараты в США. Пути решения
В Соединенных Штатах высокая стоимость препаратов, отпускаемых по рецепту, вызывает большую обеспокоенность среди пациентов, врачей, плательщиков и политиков.
В 2016 году было проведено исследование по сравнению цен на 30 инновационных лекарственных препаратов на момент регистрации в ряде европей- ских стран и США. Цены на одни и те же лекарственные препараты оказались самыми высокими в Соединенных Штатах – в среднем на 67 %, по сравнению с фармацевтическими рынками ЕС. Цены на лекарства в Германии, как правило, были самыми высокими (индекс = 35,0), а во Франции, как правило, самыми низкими (индекс = 27,1). В Соединенном Королевстве, Италии и Испании цены на лекарства находились примерно на одном уровне (рис. 1).
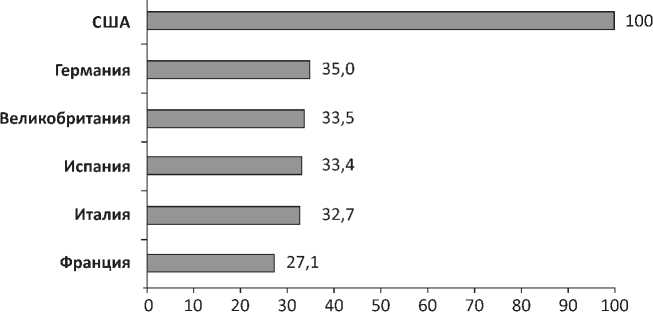
Рис. 1. Средняя цена на 30 инновационных лекарственных препаратов в странах ЕС и США, 2016 год / Fig. 1. The average price of 30 innovative drugs in EU countries and US, 2016
Источник: составлено автором по (Reinaud et al., 2017).
Интересно отметить, что, несмотря на уже высокий уровень цен, средняя стоимость зарегистрированных инновационных препаратов с течением времени показывает рост (в среднем на 23 %), в то время как в европейских стра-
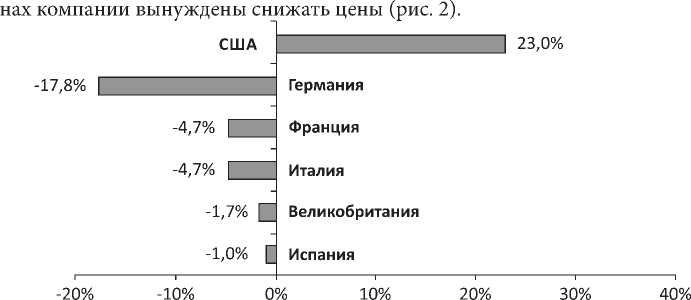
Рис. 2. Среднее изменение цены на 30 инновационных лекарственных препаратов в странах ЕС и США с момента регистрации по январь 2017 года, в % /
Fig. 2. The average deviation of price on 30 innovative drugs in EU countries and US, % (since registration until January 2017)
Источник: составлено автором по (Reinaud et al., 2017).
По показателю затрат на лекарственные препараты на человека США демонстрируют лидерство – 1 162 долл. на чел., лидером среди европейских стран является Швейцария (982 долл. на чел.), далее следуют Германия, Ирландия, Бельгия, Франция. Средний показатель среди 31 страны ОЭСР составляет 553 долл.1
В период с 2013 по 2015 год чистые расходы на отпускаемые по рецепту лекарства увеличились приблизительно на 20 % в Соединенных Штатах2, при общем увеличении совокупных расходов на здравоохранение на 11 % (Keehan et al., 2015, p. 1410). С момента появления программы Medicare в 2006 году государственные структуры оплатили в среднем 40 % затрат от общего объема расходов на отпускаемые по рецепту лекарственные сред-ства3. Несомненно, некоторые дорогостоящие лекарственные препараты представляют собой серьезные клинические достижения, но есть немалая часть лекарственных средств, цены на которые трудно обосновать как затратоэффективные по результатам вклада в лечение пациентов (Frakt et al., 2008; Hemphill, 2011).
В дополнение к негативному вкладу в расходы на здравоохранение, высокие цены могут привести к самостоятельному снижению пациентами дозировок в рамках терапии, а также отказу некоторых больных от лечения. Так, например, на 2016 год 18 % пациентов старше 65 лет не имели возможности оплатить лекарства, которые были ранее выписаны им врачами. Если рассмотреть данный показатель в европейских странах, то в Великобритании, Германии, Норвегии и Франции таких пациентов насчитывается не более 4 %4.
В свете вышесказанного исследование причин высокого уровня цен в США и доступных государственных мер для их решения становится крайне актуальной темой.
В ходе исследования использовались работы ведущих международных авторов в сфере государственного регулирования фармацевтической отрасли и принципов стимулирования НИОКР в данной отрасли, таких как Р. Оpборн, А. Фракт, С. Кихан, Л. Бланк, Дж. Димаси, Г. Дж. Грабовски и Р. Хансен.
Несмотря на высокую актуальность темы эффективности методов регулирования фармацевтической отрасли в странах Европы и США, на данный момент она недостаточно разработана в российской литературе, в особенности это касается области исследования ценообразования на лекарственные препараты. Основные наблюдения базируются зачастую на устаревших данных и редко носят систематический характер.
Между тем в рамках реализуемой в последние годы в России проекта Стратегии развития фармацевтической промышленности Российской Федерации на период до 2020 года опыт регулирования фармацевтической отрасли, в т.ч. в вопросах ценообразования, на наиболее крупных рынках мира, таких как США, представляется полезным для дальнейшей разработки системы мер эффективного лекарственного обеспечения в России. Таким образом, обозначение мер, которые могли бы сдержать неоправданно высокие цены на американском рынке, поможет выстроить правильные ориентиры для развития фармацевтического рынка в России.
МЕТОДОЛОГИЯ ИССЛЕДОВАНИЯ
В рамках настоящего исследования использовались общенаучные принципы, такие как системный анализ, конкретно-исторический, а также общенаучные методы структурного и сравнительного анализа. Информационнотеоретической основой исследования послужили законодательные и нормативные документы, статистические материалы международных баз данных по отрасли за период 2008–2017 годов, включая отчеты IMS Health и DSM, отчеты и доклады Европейской комиссии, Всемирного общества здравоохранения (WHO), Европейской федерации фармацевтической промышленности и ассоциаций (EFPIA), Организации экономического сотрудничества и развития (OECD) и др.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Основной причиной увеличения расходов на лекарства является высокая стоимость оригинальных препаратов. Хотя на данную группу лекарственных средств приходится лишь 10 % всех выданных рецептов, их доля в стоимостном выражении составляет 72 % расходов5. В промежутке между 2008 и 2015 годами цены на наиболее часто используемые оригинальные препараты увеличились на 164 %, многократно превысив индекс потребительских цен (12 %)6.
Стоимость препаратов в Соединенных Штатах выше, чем в остальных промышленно развитых странах, так как в отличие от большинства стран, государство позволяет производителям устанавливать свою цену (Bellanger, 2011) .
Показателен опыт европейских стран, таких как Германия, Франция, Великобритания, где выстроена национальная система медицинского страхования с делегированием ответственной организации права переговоров по цене, в зависимости от уровня затратоэффективности препаратов (Blanc, 2015, p. 34). Новые препараты проходят строгую оценку по профилям эффективности и безопасности и сравнение с уже существующими методами лечения.
Если новый препарат не имеет значимой дополнительной пользы по эффективности или безопасности, его стоимость не может быть выше зарегистрированных аналогов. Таким образом европейские страны контролируют ценообразование препаратов, возмещаемых страховой системой, оптимизируя расходы на здравоохранение.
Способность фармацевтических компаний поддерживать высокие цены формируется благодаря двум факторам: повышенной защите от конкуренции со стороны государства и ограничению переговорной силы (Pani et al., 2016; Conti and Rosenthal, 2016).
Самый важный фактор, который позволяет изготовителям установить высокий уровень цен, – длительная защита патентами (Duguet, 2012, p. 410). Новые мелкомолекулярные (small-molecule) лекарственные препараты автоматически получают гарантированный период от 5 до 7 лет, прежде чем другие компании смогут запустить дженерики на рынок, а новые биологические препараты защищены от конкуренции в течение 12 лет (Greene et al., 2016). Существует также другой тип эксклюзивной лицензии, который дает право на защиту изобретений от конкуренции на 20 лет и более. Он действует для изобретений, которые являются «новаторскими», «полезными» и «неочевидными».
Несмотря на существующие нормативные ограничения на срок действия патентов, их фактический срок намного длиннее. Компании имеют право на продление срока патента: при учете длительного периода рассмотрения препарата в рамках регистрации – до 5 лет, при учете половины времени на клинические испытания – до 14 лет. В результате средний срок фактической эксклюзивности составляет 12,5 лет для широко используемых препаратов и 14,5 лет – для новаторских, первых в своем классе препаратов (Grabowski et al., 2016).
Помимо продления патентов, производители также зачастую обращаются к практике патентования незначительно усовершенствованных версий препаратов, чей срок действия патента в скором времени истекает (Hennessy et al., 2010; Eichler et al., 2015). Это дает им возможность плавного перехода с одного препарата на другой, избегая провалов продаж из-за истекающей эксклюзивности. В этих целях ведется активная, а иногда и агрессивная, рекламная кампания среди врачей по обоснованию уникальности и важности новых качеств препарата, даже если изменения по сути были незначительными.
Подобная практика возможна лишь по причине второго важного фактора в системе лекарственного обеспечения США: роли пациентов, фармацевтов, врачей и плательщиков полностью разделены. Врачи выписывают рецепты, ориентируясь на собственный опыт и рекламные обещания компаний, а не на стоимость терапии, фармацевты продают их, а пациенты или их страховщики оплачивают (Grabowski et al., 2016).
Единственная форма конкуренции, которая последовательно и существенно способна снизить отпускные цены на препараты, – выход на рынок дженериков после истечения срока действия патента (Gastala et al, 2016; Godman et al., 2011).
В некоторых штатах дженерики могут заместить 90 % доли оригинального препарата уже в течение первого года после их выхода. Уровень замещения зависит от штата, поскольку 30 штатов имеют законы о выборе лекарственных препаратов, которые позволяют, но не требуют, чтобы фармацевты выполняли общую замену; в 26 штатах фармацевты должны получить согласие пациента перед заменой на схожий по активному веществу препарат. Если обратиться к усредненной статистике, то цены на лекарства снижаются примерно до 55 % от стоимости оригинального препарата в случае появления двух дженериков; до 33 % – с пятью производителями и до 13 % – с пятнадцатью производителями и более7.
На 2015 год доля дженериков в США составляла 86 % в упаковках и 28 % в денежном выражении (рис. 3).
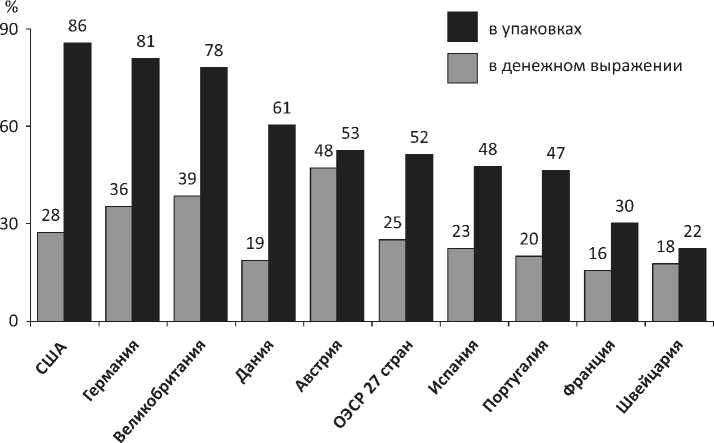
Рис. 3. Доля дженериков на фармацевтическом рынке в денежном выражении и в упаковках на 2015 год, в % / Fig. 3. The share of generics in the pharmaceuticals market by 2015, in value and volume, %
Источник: составлено автором на основе статистических данных Организации экономического сотрудничества и развития (OECD)8.
Но как ранее было отмечено, запуск дженериковых препаратов максимально задерживается компаниями, производящими оригинаторы, благодаря механизмам продления патента, а иногда и дополнительным выплатам компаниям, производящим дженерики, за задержку запуска или его отмену (Ferrario, 2015, p. 41). Например, в случае патентной заявки, связанной с антибиотиком Ципрофлоксацин, потенциальный производитель дженерика на данный продукт получал авансовые квартальные платежи на общую сумму 398 млн долл. в рамках урегулирования и согласился задержать выход своего продукта на рынок (Hemphill, 2011).
Помимо особенностей конкуренции на рынке рецептурных препаратов нельзя не отметить роль государственных и частных плательщиков в формировании высоких цен на лекарства (Kantarjian and Rajkumar, 2015; Light and Lexchin, 2012).
В период патентной защиты оригинальных препаратов основным противовесом в вопросах ценообразования является плательщик. Medicare охватывает около 40 млн взрослого населения, в основном в возрасте 65 лет и старше, покрывая расходы на стационарное лечение (часть В) и амбулаторное (часть D). Medicaid, федеральная и межштатная программа медицинского страхования для лиц с низкими доходами, покрывает расходы на отпускаемые по рецепту лекарства еще для 72 млн граждан9. Между тем частные страховые компании покрывают расходы для 177 млн человек, а более 29 млн человек не имеют ни государственной, ни частной страховки на лекарственное обеспечение (Obama, 2016).
Аналогичным образом действующая в различных штатах программа Medicaid обязана, по закону, покрывать все одобренные препараты, даже в случае, когда конкретный препарат имеет альтернативы, обладающие более безопасным и эффективным профилем или более низкой стоимостью. Однако Medicaid также имеет право на получение скидки не менее 23,1 % от номинальной цены производителя лекарств и защищена от повышения цен выше уровня инфляции (Frakt et al., 2008, p. 1101).
В ответ на критику со стороны плательщиков фармацевтическая промышленность утверждает, что высокие цены на лекарства отражают затраты на исследования и разработки, которые компания понесла в рамках запусков новых препаратов. Многие исследования показывают, что расходы на разработку новых лекарственных средств с каждым годом только растут и на данный момент каждый новый препарат может обойтись в среднем в 2,6 млрд долл. Между тем пропорция доходов крупных фармацевтических компаний, которые инвестируют в исследования и разработки, составляет от 10% до 20%.
Если же рассмотреть только инновационные разработки, представляющие собой радикальные или значимые инновации, эта пропорция значительно ниже (DiMasi et al., 2016, p. 30). Более того, государственные программы зачастую предоставляют значительную финансовую поддержку для исследовательских центров, когда речь идет о серьезных открытиях и разработках (Kroneman and de Jong, 2015; Megerlin et al., 2013). Не говоря уже о мерах налогового стимулирования. И наконец, высокие затраты на НИОКР не объясняют сравнительно более низкую стоимость тех же препаратов, включенных в программы лекарственного возмещения, в европейских странах.
Несомненно, компании должны быть вознаграждены за инновационные препараты, чтобы иметь дальнейшие стимулы для разработок. Между тем, предоставление им больших нормативных и налогово-бюджетных стимулов, в случае США, является контрпродуктивным (Nicod and Kanavos, 2012; Hawkins and Scott, 2011).
В последние годы были также введены соплатежи для пациентов, поэтому даже в случае страхового покрытия возникает необходимость личных затрат на дорогостоящие лекарства. По причине высокой стоимости назначенной терапии и невозможности замены на альтернативы большая доля пациентов склонна нарушать режим приема, уменьшая дозировки и кратность приема, или вовсе отказываться от лечения (Osborn et al., 2016). А это неминуемо ведет к последующим повышенным затратам на медицинские услуги и расходам на здравоохранение со стороны государства и страховщиков.
ОБСУЖДЕНИЕ
По результатам проведенного исследования автором могут быть определены возможные меры в части ограничения установления высоких цен на лекарственные средства в рамках центрального правительства и штатов. Часть из них, несмотря на значимые различия систем государственного управления и в целом государственного устройства, могут быть универсальны также для более молодых фармацевтических рынков, например, российского.
На федеральном уровне возможно применение следующих мер:
-
1. Патентование: ограничить вторичные патенты на незначимые изменения запатентованной молекулы, которые представляют собой улучшающие инновации. В данном вопросе полезен опыт европейских стран, где каждое новое лекарство, которое потенциально должно войти в систему страхового возмещения, оценивается по параметрам дополнительного вклада в безопасность и эффективность по сравнению с существующими средствами.
-
2. Строгое ограничение антиконкурентных стратегий, применяемых компаниями-производителями оригинальных препаратов (например, оплата за задержку).
-
3. Право на согласование цен: разрешить Medicare договариваться о ценах на лекарства для категории лекарств D и исключить страховое покрытие для продуктов, которые представляют незначимую дополнительную клиническую пользу.
-
4. Стимулирование рынка дженериков: выделить дополнительные ресурсы для рассмотрения типовых заявок на лекарства в целях содействия
конкуренции; в случае нехватки производителей ускорить рассмотрение новых препаратов и разрешить временный ввоз из хорошо отрегулированных фармацевтических рынков; обязать компании-производители оригинальных препаратов предоставлять в кратчайшие сроки образцы продукции для исследования на биоэквивалентность новых дженериков.
На уровне штатов могут быть использованы следующие меры:
-
1. Внести изменения в законы о выборе лекарств: заменить разрешительные политики в области замещения на аналоги на обязательные.
-
2. Ценовое согласование: ввести оценку затратоэффективности на лекарственные средства в модель возмещения для Medicaid.
Организациям в области здравоохранения может быть рекомендовано:
-
1. Запустить разработку новых формуляров с рациональной оценкой затратоэффективности препаратов, взяв в качестве примера существующие формуляры в ведущих европейских странах.
-
2. Видоизменить существующую систему сооплат для пациентов, чтобы она не сказывалась негативно на терапии.
-
3. Инициировать программы по информированию специалистов здравоохранения о преимуществах тех или иных лекарственных препаратов на основе доказательной медицины.
Среди вышеуказанных мер выделим ключевые универсальные практики, полезные также для России в рамках выстраивания эффективной системы регулирования ценообразования:
-
– стимулирование рынка дженериков посредством упрощения и ускорения системы рассмотрения заявок;
– предварительная детальная оценка текущих потребностей различных категорий населения в лекарственном обеспечении, уровня их дохода и расходов на фармацевтику для дальнейшего формирования критериев страхового лекарственного обеспечения и справедливых условий сооплаты;
– если препараты включаются в систему государственного возмещения (федеральная и региональная льгота), то они в обязательном порядке должны пройти оценку затратоэффективности. Это позволит сформировать списки для возмещения, содержащие наиболее качественные препараты по оптимальным ценам и предотвратить систематические перерасходы бюджета;
– запуск разработки новых формуляров с рациональной оценкой затра-тоэффективности препаратов на примере ведущих европейских стран.
ЗАКЛЮЧЕНИЕ
Таким образом, в рамках настоящего анализа было установлено, что высокие цены на лекарства являются результатом не столько ежегодно увеличивающихся расходов на НИОКР, сколько в значительной степени подхода США к предоставлению своего рода монополии и эксклюзивности производителям лекарственных средств, одновременно с ограничением ценового регулирования, что совершенно нехарактерно для ведущих промышленно развитых стран. Меры по урегулированию могут включать: ограничение возможности недостаточно обоснованного предоставления патентов и уси- ление патентной защиты; повышение конкуренции на рынке посредством обеспечения своевременного доступа дженериков; предоставление плательщикам широких возможностей для ценовых переговоров; запуск государственной системы оценки сравнительной затратоэффективности препаратов и активное информирование врачей и пациентов о результатах сравнения. Как показывает опыт европейских стран, подобные меры способны сократить расходы на лекарственное обеспечение и повысить общую доступность качественной лекарственной терапии, но при этом не лишить фармацевтические компании стимулов для дальнейших инвестиций в НИОКР.
Исследование основных причин высоких цен на фармацевтическом рынке США и определение возможных путей дальнейшего регулирования отрасли позволили выработать полезные рекомендации для российского рынка, который переживает сегодня процесс реформирования и нуждается в грамотной адаптации опыта других стран.
Список литературы Причины и последствия высоких цен на лекарственные препараты в США. Пути решения
- Bellanger, M. (2011), "Health. Great Tendencies", La Découverte, vol. 5, pp. 69-75.
- Blanc, L. (2014), Transnational Corporations Strategies, the Case of the Pharmaceutical Industry, College of Europe, Brussels, Belgium.
- Conti, R. and Rosenthal, M. (2016), "Pharmaceutical Policy Reform -Balancing Affordability with Incentives for Innovation", The New England Journal of Medicines, vol. 374, no. 8, pp. 703-706, DOI: 10.1056/NEJMp1515068
- DiMasi, J., Grabowski, H. and Hansen, R. (2016), "Innovation in the Pharmaceutical Industry: New Estimates of R&D Costs", Journal of Health Economics, vol. 47, pp. 20-33, doi: https://doi.org/10.1016/j.jhealeco.2016.01.012.
- Duguet, E. (2012), "The Effect of the Incremental R&D Tax Credit on the Private Funding of R&D: An Econometric Evaluation of French Firm-level Data", Revue d'economie politique, vol. 122, no. 3, pp. 405-435.
- Eichler, H. G., Baird, L. G., Barker, R., Bloechl-Daum, B., Børlum-Kristensen, F., Brown, J., Chua, R., Del Signore, S., Dugan, U., Ferguson, J., Garner, S., Goettsch, W., Haigh, J., Honig, P., Hoos, A., Huckle, P., Kondo, T., Le Cam, Y., Leufkens, H., Lim, R., Longson, C., Lumpkin, M., Maraganore, J., O'Rourke, B., Oye, K., Pezalla, E., Pignatti, F., Raine, J., Rasi, G., Salmonson, T., Samaha, D., Schneeweiss, S., Siviero, P. D., Skinner, M., Teagarden, J. R., Tominaga, T., Trusheim, M. R., Tunis, S., Unger, T. F., Vamvakas, S. and Hirsch, G. (2015), “From Adaptive Licensing to Adaptive Pathways: Delivering a Flexible Life-Span Approach to Bring New Drugs to Patients”, Clinical Pharmacology and Therapeutics, vol. 97, no. 3, pp. 234-246, DOI: 10.1002/cpt.59
- Ferrario, A. (2015), "Dealing with Uncertainty and High Prices of New Medicines: A Comparative Analysis of the Use of Managed Entry Agreements in Belgium, England, the Netherlands and Sweden", Social Science & Medicine, vol. 124, no. 1, pp. 39-47, doi: https://doi.org/10.1016/j.socscimed.2014.11.003.
- Frakt, A., Pizer, S. and Hendricks, A. (2008), "Controlling Prescription Drug Costs: Regulation and the Role of Interest Groups in Medicare and the Veterans Health Administration", Journal of Health Politics, Policy and Law, vol. 33, no. 6, pp. 1079-1106, DOI: 10.1215/03616878-2008-032
- Gastala, N., Wingrove, P., Gaglioti, A., Petterson, S. and Bazemore, A. (2016), "Medicare Part D: Patients Bear the Cost of "Me Too" Brand-Name Drugs", Health Affairs, vol. 35, no. 7, pp. 1237-1240, DOI: 10.1377/hlthaff.2016.0146
- Godman, B., Shrank, W., Andersen, M., Berg, Ch., Bishop, I., Burkhardt, Th., Garuoliene, K., Herholz, H., Joppi, R., Kalaba, M., Laius, O., Lonsdale, Ju., Malmström, R. E., Martikainen, J. E., Samaluk, V., Sermet, C., Schwabe, U., Teixeira, I., Tilson, L., Tulunay, F. C., Vlahović-Palčevski, V., Wendykowska, K., Wettermark, B., Zara, C. and Gustafsson, L. L. (2011), "Policies to Enhance Prescribing Efficiency in Europe, Findings and Future Implications", Frontiers in Pharmacology, vol. 1, pp. 1-16, DOI: 10.3389/fphar.2010.00141
- Grabowski, H., Long, G., Mortimer, R. and Boyo, A. (2016), "Updated Trends in US Brand-Name and Generic Drug Competition", Journal of Medical Economics, vol. 19, no. 19, pp. 836-844, DOI: 10.1080/13696998.2016.1176578
- Greene, J., Anderson, G. and Sharfstein, J. (2016), "Role of the FDA in Affordability of Off-Patent Pharmaceuticals", Journal of the American Medical Association, vol. 315, no. 5, pp. 461-462, DOI: 10.1001/jama.2015.18720
- Hawkins, N. and Scott, D. (2011), "Reimbursement and value-Based Pricing: Stratified Cost Effectiveness Analysis May Not Be the Last Word", Health Economics, vol. 20, no. 6, pp. 688-698, DOI: 10.1002/hec.1625
- Hemphill, C. S. (2011), "Paying for Delay: Pharmaceutical Patent Settlement as a Regulatory Design Problem", New York University Law Review, vol. 81, pp. 1553-1623.
- Hennessy, S., Leonard, C. E. and Platt, R. (2010), "Assessing the Safety and Comparative Effectiveness of Follow-On Biologics (Biosimilars) in the United States", Clinical Pharmacology and Therapeutics, vol. 87, no. 2, pp. 157-159, DOI: 10.1038/clpt.2009.249
- Kantarjian, H. and Rajkumar, S. (2015), "Why are Cancer Drugs So Expensive in the United States, and What Are the Solutions?", Mayo Clinic Proceedings, vol. 90, no. 4, pp. 500-504, DOI: 10.1016/j.mayocp.2015.01.014
- Keehan, S. P., Cuckler, G. A., Sisko, A. M., Madison, A. J., Smith, S. D., Stone, D. A., Poisal, J. A., Wolfe, C. J. and Lizonitz, J. M. (2015), "National Health Expenditure Projections, 2014-24: Spending Growth Faster than Recent Trends", Health Affairs, vol. 34, no. 8, pp. 1407-1417, DOI: 10.1377/hlthaff.2015.0600
- Kroneman, M. and de Jong, J. D. (2015), "The basic Benefit Package: Composition and Exceptions to the Rules", Health Policy, vol. 119, no. 3, pp. 245-251, DOI: 10.1016/j.healthpol.2015.01.013
- Light, D. W. and Lexchin, J. R. (2012), "Pharmaceutical Research and Development: What Do We Get for All That Money?", BMJ, vol. 345, pp. 43-48, DOI: https://doi.org/10.1136/bmj.e4348
- Megerlin, F., Lopert, R., Taymor, K. and Trouvin, J. (2013), "Biosimilars and the European Experience: Implications for the United States", Health Affairs, vol. 32, no. 10, pp. 1803-1810, DOI: 10.1377/hlthaff.2009.0196
- Nicod, E. and Kanavos, P. (2012), "Commonalities and Differences in HTA Outcomes: A Comparative Analysis of Five Countries and Implications for Coverage Decisions", Health Policy, vol. 108, no. (2-3), pp. 167-177, DOI: 10.1016/j.healthpol.2012.09.012
- Obama, B. (2016), "United States Health Care Reform: Progress to Date and Next Steps", Journal of the American Medical Association, vol. 316, no. 5, pp. 525-532, DOI: 10.1001/jama.2016.9797
- Osborn, R., Squires, D., Doty, M. M., Sarnak, D. O. and Schneider, E. C. (2016), "In New Survey of Eleven Countries, US Adults Still Struggle with Access to and Affordability of Health Care", Health Affairs, vol. 35, no. 12, pp. 2327-2336.
- Pani, L. Montilla, S., Németh, G., Russo, P., Viceconte, G. and Vogler, S. (2016), "Balancing Access to Medicines and Sustainability in Europe: An Analysis from the Network of Competent Authorities on Pricing and Reimbursement (CAPR)", Pharmacological Research, vol. 111, pp. 247-250, DOI: 10.1016/j.phrs.2016.05.022
- Reinaud, F., Ando, G. and Lockwood, C. (2017), "Pharmaceutical prices in the US versus Europe: how do different types of us prices compare?" , available at: https://www.ispor.org/research_pdfs/55/pdffiles/PHP18.pdf (Accessed December 5, 2017).


