Придание волокнистым поликапроамидным материалам ионообменных свойств химически инициированной привитой сополимеризацией
Автор: Жуковский В.А., Хохлова В.А., Филипенко Т.С., Анущенко Т.Ю.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Химическая технология
Статья в выпуске: 1 (91), 2022 года.
Бесплатный доступ
Изучение видов и свойств хирургических нитей, а также опыта производства шовного хирургического материала и его использования показывает, что наиболее перспективными для хирургической практики являются нити с антимикробными свойствами. Из способов закрепления лекарственных соединений химическими связями для шовных материалов наиболее целесообразным является присоединение их по реакции ионообменного взаимодействия. Поскольку поликапроамид (ПКА) практически не содержит функциональных групп, то для придания ПКА волокнистым материалам ионообменных свойств необходима стадия предварительной модификации. Одной из таких стадий модификации является процесс привитой полимеризации метакриловой кислоты (МАК) с целью создания активных групп на волокне, например, пероксидных или гидропероксидных. Модификация химических волокон путем привитой сополимеризации с иногенными мономерами является одним из распространенных способов получения волокнистых ионитов. Разработаны принципы, новые подходы и технологии придания волокнистым поликапроамидным материалам ионообменных свойств химически инициированной привитой сополимеризацией. Выявлены закономерности получения волокнистых ПКА сорбционно активных материалов путем химического инициирования окислительно-восстановительной системой (Fe2++Н2О2), находящейся в модифицирующей ванне, а также в результате предварительного окисления ПКА волокна с целью создания пероксидных и гидропероксидных групп на волокне.
Поликапроамидные волокна, ионообменные свойства, привитая сополимеризация, хирургические нити, антимикробные свойства
Короткий адрес: https://sciup.org/140293764
IDR: 140293764 | УДК: 691.175:678(075.8)
Текст научной статьи Придание волокнистым поликапроамидным материалам ионообменных свойств химически инициированной привитой сополимеризацией
Создание новых полимерных материалов и изделий медицинского назначения на их основе с использованием технологий придания им специальных свойств в значительной мере определяет дальнейший прогресс практической хирургии. Так, качество, химический состав и структура шовных материалов, сетчатых эндопротезов и других имплантатов, а также реакция на них окружающих тканей в существенной степени влияют на исход оперативных вмешательств. Следовательно, хирургические полимерные имплантаты должны отвечать медико-техническим требованиям в отношении
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
прочностных и манипуляционных характеристик, минимальной материалоёмкости с учетом условий функционирования в организме, биологической инертности, а в ряде случаев биологической активности для целенаправленного воздействия на окружающую микрофлору. Имплантированные в организм полимерные материалы (хирургические нити, сетчатые эндопротезы для пластики опорных мягких тканей и др.) достаточно быстро колонизируются микрофлорой, образующей на поверхности изделия биопленку, защищающую их от воздействия как факторов иммунной защиты организма, так и антимикробных препаратов. С учетом этой ситуации целесообразно воздействие на микроорганизмы изнутри, т. е. непосредственно с поверхности имплантата, содержащего соответствующие лекарственные препараты, что позволяет снизить их концентрацию в организме и локализовать воздействие [1–8].
Поскольку поликапроамид (ПКА) практически не содержит функциональных групп, то для придания ПКА волокнистым материалам ионообменных свойств необходима стадия предварительной модификации ПКА волокон. Модификация включает процесс привитой полимеризации метакриловой кислоты с целью введения в волокна карбоксильных групп. Привитая полимеризация является наиболее эффективным метод модификации волокон с целью придания им ионообменных свойств [9].
Цель работы – выявление закономерностей процесса привитой полимеризации метакриловой кислоты (МАК) к поликапроамидным (ПКА) волокнам.
Материалы и методы
В качестве исследуемых объектов были использованы ПКА крученые нити с линейной плотностью 15,6 текс. Контроль за процессом привитой сополимеризации производили по статистической обменной емкости (СОЕ) нити, а за конкурирующим процессом гомополимеризации – по количеству полиметакриловой кислоты (ПМАК), осаждаемой ацетоном из модифицирующей ванны.
Результаты и обсуждение
Присоединение мономера к полимерной матрице осуществляют по механизму радикальной или ионной полимеризации, а также поликонденсации. Наибольшее применение для синтеза волокон с привитыми полимерами находит радикальная полимеризация, в основу которой положен принцип создания в макромолекуле «активного центра», начинающего реакцию привитой сополимеризации.
Синтез привитых сополимеров состоит в прививке к реакционноспособным группам основного полимера боковых звеньев сополимера, обладающего иными свойствами. В результате таких модификаций волокна приобретают свойства, характерные как для основного полимера, так и для дополнительного полимера, например, улучшение окрашивания, повышение эластичности, упругости, гигроскопичности, износостойкости, огнестойкости, бактерицид-ности и т. д. [10, 11].
Как правило, чем больше эффективность прививки, тем выше коэффициент прививки, когда используемый мономер является постоянным. В этом случае более высокая производительность может быть достигнуто. По этой причине некоторые исследования оплачивались очень дорого.
Повысить эффективность привитой полимеризации возможно за счет поиска подходящих инициаторов [12].
Привитая сополимеризация МАК к ПКА волокнам возможна с использованием окислительно-восстановительной системы Fe2++H2O2, оба компонента которой находятся в модифицирующей ванне, либо в результате предварительного создания пероксидных и гидропероксидных групп на волокне [13–15] (рисунок 1).
В первом случае прививку проводили путем обработки ПКА нити 5–20% растворами МАК в течение 15–120 минут при температуре 40–100 C и модуле ванны (МВ) 100. Учитывая негативное влияние кислой среды, создаваемой МАК, на прочностные показатели ПКА нитей (снижение до 20%), pH ванны регулировали в пределах 2,2–10,0 добавлением едкого натра.
c=o
№), он,
CH2 + H2O2 + Fe“ +n|CH2=C]
NH COOH
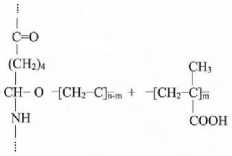
Рисунок 1. Прививка МАК к поликапроамидной нити с использованием окислительно-восстановительной системы Fe 2 ++Н 2 О 2 , оба компонента которой находятся в модифицирующей ванне
-
Figure 1. Grafting of MAA to polycaproamide yarn using a redox system Fe 2 ++Н 2 О 2 , both components of which are in a modifying bath.
Концентрация пероксида водорода составляла 0,1%, а содержание в ванне ионов двухвалентного железа (в пересчете на соль Мора) варьировалась от 0,01 до 0,2%. После обработки нить отмывали от гомополимера 5% раствором едкого натра, а следов железа – 5% раствором щавелевой кислоты и затем дистиллированной водой.
Полученные данные показывают, что с увеличением концентрации МАК модифицирующей ванне и продолжительности процесса, закономерно увеличивается количество привитого полимера.
Однако, при концентрациях МАК выше 15% резко возрастает содержание гомополимера в ванне. Нецелесообразно также увеличивать длительность процесса более 60 минут, т. к. при этом не происходит заметного повышения выхода привитого сополимера, а гомополимеризация продолжается.
Увеличение температуры до 40–60 °C приводит к росту СОЕ модифицированных нитей. При дальнейшем повышении температуры до 80–100 °C выход привитого сополимера несколько снижается и одновременно увеличивается количество образующегося гомополимера.
Присутствие ионов двухвалентного железа оказывает существенное влияние на реакцию привитой сополимеризации, но в значительно большей степени на гомополимеризацию МАК, способствуя снижению количества образующегося гомополимера в 2,0–2,5 раза. При концентрации соли Мора в растворе более 0,05% наблюдается определенное снижение количества привитой МАК, что может быть обусловлено увеличением скорости рекомбинации радикалов и макрорадикалов.
По результатам приведенных исследований можно предложить следующий режим прививки МАК к ПКА [16,17]: концентрация мономера 15%, температура 60 °C; продолжительность обработки 60 мин; pH раствора – 4,5; концентрация Fe2+ – 0,05%; концентрация Н 2 О 2 –0,1%; МВ – 100. В данных условиях СОЕ нити достигает значений 2,1–2,3 ммоль/г.
Основным недостатком рассмотренного процесса является образование значительного количества гомополимера в растворе даже в присутствии ионов двухвалентного железа. Существенным образом уменьшить скорость реакции гомополимеризации можно в случае введения одного из компонентов окислительновосстановительной системы непосредственно в полимер нити.
С этой целью привитую сополимеризацию МАК к ПКА нитям инициировали пероксидны-ми и гидропероксидными группами, которые предварительно вводили в полимер окислением системой Fe3++Н2 О2 (рисунок 2). Преимуществом данного метода, с одной стороны, является существенное уменьшение вероятности образования гомополимера, а с другой – сохранение физико-механических свойств нитей [13, 16].
СО I (СН2)4 сн,
СН-ОНСН2-Ск
NH СООН
I
со со
(СИЛ (СН2)« СН3
I I р-2*
СН2 + Н2О:-И-* СН-ООН+пСН2 = С-^-*
I на I |
NH NH СООН
I I
Рисунок 2. Прививка МАК к ПКА нити с использованием окислительно-восстановительной системы Fe 3 ++Н2 О2, один компонент которой окисляет полимер нити
-
Figure 2. Grafting of MAA to PCA filament using the Fe 3 ++Н2 О2 redox system, one component of which oxidizes the filament polymer
Для введения пероксидных и гидропе-роксидных групп ПКА нить последовательно обрабатывали раствором хлорного железа в разбавленной соляной кислоте и водным раствором пероксида водорода. Контроль за процессом окисления осуществляли по содержанию активного кислорода в образцах [9, 18].
Как видно, на рисунке 3, кислая среда способствует набуханию ПКА, в результате чего увеличивается число пероксидных и гид-ропероксидных групп, образующихся в более глубоких слоях элементарных нитей.
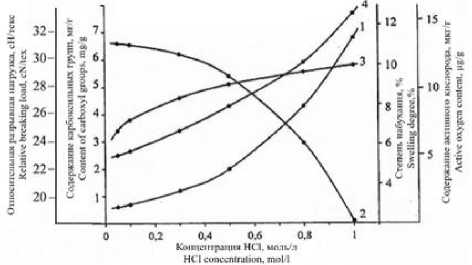
Рисунок 3. Зависимости степени набухания (1), относительной разрывной нагрузки (2), содержания карбоксильных групп (3) и активного кислорода (4) в окисленной поликапроамидной нити от концентрации соляной кислоты в ванне
Figure 3. Dependences of the degree of swelling (1), relative breaking load (2), the content of carboxyl groups (3) and active oxygen (4) in the oxidized polycaproamide thread on the concentration of hydrochloric acid in the bath
Повышение концентрации кислоты более 0,3 моль/л нецелесообразно, т. к. при этом усиливается гидролитическая деструкция поликапроамида, на что указывает увеличение количества концевых карбоксильных групп в полимере, рассчитанное по СОЕ, и, как следствие, резкое падение прочности ПКА нитей [19, 20].
При изучении условий окисления ПКА нити установлено, что содержание в ней активного кислорода, ответственного за инициирование привитой сополимеризации, непрерывно возрастает с увеличением концентрации хлорного железа (рисунок 4).
Однако, при концентрациях хлорного железа выше 5% наблюдается интенсивное образование гидрата окиси железа. Поэтому последующие обработки осуществляли при концентрации хлорного железа в ванне 5%. За оптимальную температуру и продолжительность обработок по данным полученных зависимостей приняты соответственно 60 °C и 40 мин, поскольку дальнейшее повышение этих параметров не приводит к существенному увеличению количества пероксидных и гидро-пероксидных групп в ПКА.
ПКА нитей пероксида водорода, то повышение его концентрации более 10% и температуры обработки свыше 40 °C фактически не влияет на количество активного кислорода в полимере. Реакция в этих условиях практически заканчивается за 20–30 минут. Содержание активного кислорода при обработке нитей в данном режиме 6,4–6,7 мкг/г (рисунок 5).
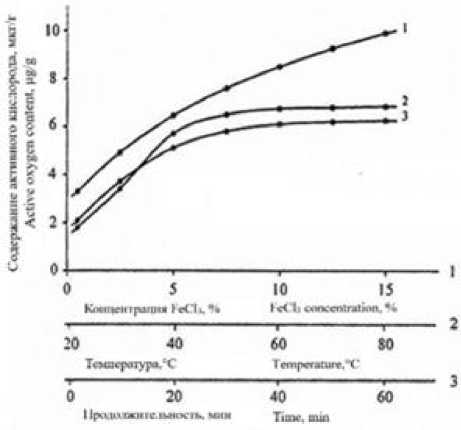
Рисунок 4. Зависимость содержания активного кислорода в ПКА нити от концентрации (1), температуры (2) и продолжительности (3) при обработках растворами хлорного железа
Figure 4. Dependence of the content of active oxygen in the PCA filament on the concentration (1), temperature (2) and duration (3) during treatment with ferric chloride solutions
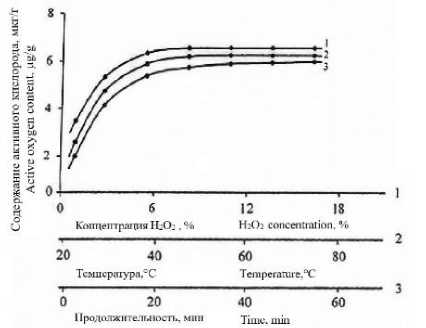
Рисунок 5. Зависимость содержания активного кислорода в ПКА нити от концентрации (1), температуры (2) и продолжительности (3) при обработке раствором пероксида водорода
Figure 5. Dependence of the content of active oxygen in the PCA thread on the concentration (1), temperature (2) and duration (3) when treated with a solution of hydrogen peroxide
К обработанным таким образом нитям после тщательной промывки прививали МАК, осуществляя реакцию в 5–10% водных растворах мономера при pH 4,2–4,5 в присутствии промотора – ионов двухвалентного железа.
Как известно, разложение гидроперок-сидных групп, инициирующих реакцию полимеризации, начинается уже при 40 °C. Однако скорость их разложения при этой температуре относительно невелика даже в присутствии промотора. В связи с этим представляло интерес выяснить влияние температуры и продолжительности реакции на СОЕ модифицированной нити. С этой целью реакцию осуществляли в интервале температур от 50 до 60 °C и МВ 30.
Результаты исследований, приведенные на рисунке 5 показывают, что наиболее интенсивно реакция протекает в течение первых 30–60 мин. Наблюдаемое снижение СОЕ при повышении температуры до 60 °C связано с ускорением распада гидроперекисных групп в ПКА нити и реакцией передачи цепи на мономер.
Заключение
Разработаны принципы, новые подходы и технологии придания волокнистым полика-проамидным материалам ионообменных свойств химически инициированной привитой сополимеризацией.
Выявлены закономерности получения волокнистых ПКА сорбционно активных материалов путем химического инициирования окислительно-восстановительной системой (Fe2++Н2О2), находящейся в модифицирующей ванне, а также в результате предварительного окисления ПКА волокна с целью создания перок-сидных и гидропероксидных групп на волокне.
Список литературы Придание волокнистым поликапроамидным материалам ионообменных свойств химически инициированной привитой сополимеризацией
- Li H., Wang Z., Robledo-Lara J.A. et al. Antimicrobial Surgical Sutures: Fabrication and Application of Infection Prevention and Wound Healing // Fibers Polym. 2021. V. 22. P. 2355-2367.
- Jones R.D., Jampani H.B., Newman J.L., Lee A.S. Triclosan: a review of effectiveness and safety in health care settings // Am J Infect Control. 2000. V. 28. № 2. P. 184-96.
- Malone D.L., Genuit T., Tracy J.K., Gannon C. et al. Surgical site infections: reanalysis of risk factors // J Surg Res. 2002. V. 103. № 1. P. 89-95.
- Berrios-Torres S.I., Umscheid C.A., Bratzler D.W., Leas B. et al. Centers for disease control and prevention guideline for the prevention of surgical site infection, 2017 // JAMA surgery. 2017. V. 152. №. 8. P. 784-791. doi: 10.1001/jamasurg.2017.0904
- Matz D., Teuteberg S., Wiencierz A. et al. Do antibacterial skin sutures reduce surgical site infections after elective open abdominal surgery? Study protocol of a prospective, randomized controlled single center trial // Trials. 2019. V. 20. №. 1. P. 1-8. doi: 10.1186/s13063-019-3492-3
- James B., Ramakrishnan R., Aprem A.S. Development of environmentally safe biodegradable, antibacterial surgical sutures using nanosilver particles // Journal of Polymers and the Environment. 2021. V. 29. №. 7. P. 2282-2288. doi: 10.1007/s10924-021 -02048-y
- Попов Д.А., Анучина Н.М. Оценка Антимикробной Активности Шовного Материала, Импрегнированного Триклозаном // Бюллетень НЦССХ им. А.Н. Бакулева РАМН. Сердечно-сосудистые заболевания. 2010. Т. 11. № S3. С. 152.
- Мохов Е.М., Хомулло Г.В., Сергеев А.Н., Александров И.В. Экспериментальная разработка новых хирургических шовных материалов с комплексной биологической активностью // Бюллетень экспериментальной биологии и медицины. 2012. Т. 153. № 3. С. 391-396.
- Ершов И.П., Сергеева Е.А., Зенитова Л.А., Абдуллин И.Ш. Модификация синтетических волокон и нитей. Обзор // Вестник Казанского технологического университета. 2012. Т. 15. №. 18. С. 136-143.
- Котоменкова О.Г. Биодеструкция материалов специального назначения в процессе хранения // Проблемы экономики и управления в торговле и промышленности. 2013. №. 2. С. 73-81.
- Закирова Ж.Э. Особенности промышленности химических волокон // Вестник магистратуры. 2016. №. 12-4 (63). С. 49-50.
- Li M., Zhu Z., Jin E. Graft copolymerization of granular allyl starch with carboxyl-containing vinyl monomers for enhancing grafting efficiency // Fibers and polymers. 2010. V. 11. №. 5. P. 683-688. doi: 10.1007/s12221-010-0683-7
- Жуковский В.А. Проблемы и перспективы разработки и производства хирургических шовных материалов // Химические волокна. 2008. № 3. С. 31-38.
- Жуковский В.А., Хохлова В.А., Коровичева С.Ю. Хирургические шовные материалы с антимикробными свойства // Химические волокна. 2007. № 2. С. 37-43.
- Пат. № 1231663, RU, А6^ 17/00. Хирургический шовный материал (его варианты) и способ его получения (его варианты) / Вольф Л.А., Заикин Ю.Я., Трапезников Н.Н., Юшков С.Ф., Клименков А.А., Гаврилова Т.Н., Искандеров Ф.И., Смолянская А.З. № 82 3438591; Заявл. 14.05.1982.
- Мохов Е.М., Хомулло Г.В., Сергеев А.Н., Александров И.В. Экспериментальная разработка новых хирургических шовных материалов с комплексной биологической активностью // Бюллетень экспериментальной биологии и медицины. 2012. Т. 153. №. 3. С. 391-396.
- Yu X., Biedrzycki A.H., Khalil A.S., Hess D. et al. Nanostructured mineral coatings stabilize proteins for therapeutic delivery // Advanced materials. 2017. V. 29. №. 33. P. 1701255. doi: 10.1002/adma.201701255
- Baygar T., Sarac N., Ugur A., Karaca I.R. Antimicrobial characteristics and biocompatibility of the surgical sutures coated with biosynthesized silver nanoparticles // Bioorganic Chemistry. 2019. V. 86. P. 254-258. doi: 10.1016/j.bioorg.2018.12.034
- Fan L., Cai Z., Zhang K., Han F. et al. Green electrospun pantothenic acid/silk fibroin composite nanofibers: Fabrication, characterization and biological activity // Colloids and surfaces b: biointerfaces. 2014. V. 117. P. 14-20. doi: 10.1016/j.colsurfb.2013.12.030
- Scaffaro R., Botta L., Sanfilippo M., Gallo G. et al. Combining in the melt physical and biological properties of poly (caprolactone) and chlorhexidine to obtain antimicrobial surgical monofilaments // Applied microbiology and biotechnology. 2013. V. 97. №. 1. P. 99-109. doi: 10.1007/s00253-012-4283-x


