Применение аллогенных мультипотентных мезенхимальных стволовых клеток при лечении переломов костей голени у кошек
Автор: Сергеев М.А., Амиров Д.Р.
Статья в выпуске: 2 т.230, 2017 года.
Бесплатный доступ
Целью настоящего исследования явилось опробование метода лечения переломов трубчатых костей с дефектом костной ткани у кошек с применением аллогенного остеопластического материала «Лиопласт» (ООО «Лиоселл», Россия) в качестве импланта для замещения дефекта костной ткани и носителя для мультипотентных мезенхимальных стволовых клеток (ММСК). В связи с возникшими после операции осложнениями нам не удалось оценить влияние аллогенных ММСК на процессы остеорегенерации у кошек.
Перелом бедренной кости, кошки, мультипотентные мезенхимальные стволовые клетки, остеорегенерация, оsteoregeneration
Короткий адрес: https://sciup.org/14288921
IDR: 14288921 | УДК: 619:615.36:616.71-001.5:636.8
Текст научной статьи Применение аллогенных мультипотентных мезенхимальных стволовых клеток при лечении переломов костей голени у кошек
С проблемой переломов конечностей чаще всего сталкиваются домашние животные небольшого размера. Половина из всех встречающихся переломов у представителей семейства кошачьих приходится именно на конечности, затем следуют переломы таза и хвоста, потом - позвоночника и реже всего кошки повреждают кости черепа.
Целью данного исследования было опробование метода лечения переломов трубчатых костей с дефектом костной ткани у кошек с применением аллогенного остеопластического материала «Лиопласт» (ООО «Лиоселл», Россия) в качестве импланта для замещения дефекта костной ткани и носителя для мультипотентных мезенхимальных стволовых клеток (ММСК). Аллогенные ММСК адипогенного происхождения in vivo использовались в качестве альтернативы аутогенным ММСК для стимуляции процессов регенерации. Костные отломки фиксировались двумя различными способами.
Материал и методы. Объектом исследования были четыре домашние беспородные кошки, самки, в возрасте от 3 до 5 лет. Животные были поделены на 2 группы (n=2) в зависимости от способа фиксации костных отломков.
Диагноз ставили на основании анамнестических данных, клинических признаков, а также рентгенографии, которую выполняли в боковой и прямой проекциях на рентгеновском аппарате «Dongmun DIG-360» (Корея) с рентгенографической пленкой «Kodac» (США).
Донорские ММСК были получены нами из подкожно-жировой клетчатки кошки по описанной ранее методике [7].
Общую потенцированную инъекционную анестезию начинали с премедикации путем подкожного введения 0,1% раствора атропина сульфата 0,05 мл/кг массы тела, за 20-30 минут до общей анестезии. Затем за 30 минут до общей анестезии подкожно вводили «Кетофен» 0,2 мл/кг массы тела. За 10-15
минут до общей анестезии внутримышечно вводили 2% раствор ксилазина гидрохлорида в дозе 0,2 мл/кг массы тела. Общая анестезия достигалась путем внутривенного введения раствора «Золетил» в дозе 2 мг/кг массы тела, для продления состояния общей анестезии - в дозе 1 мг/кг.
Оперативное вмешательство проводили с соблюдением правил асептики и антисептики. Всем животным был проведен медиальный доступ к костям голени, произведена открытая репозиция отломков. Между отломками в момент репозиции для замещения травматического дефекта костной ткани была помещена смесь 3 млн ММСК с крошкой материала «Лиопласт», склеивающим компонентом был фибриновый клей Tissucol® Kit (BAXTER AG, Austria). В 1-й группе животных с целью фиксации отломков был выполнен интрамедуллярный метало-стеосинтез спицами Киршнера диаметром 2 мм. Спица была проведена через костномозговой канал большеберцовой кости. Животным 2-й группы был выполнен чрезкостный металлостеосинтез с проведением 4-5 спиц Киршнера диаметром 1 мм через длинник большеберцовой кости и осуществлена внешняя фиксация их концов самотвердевающей пластмассой «Протакрил-М».
После оперативного вмешательства с целью профилактики хирургической инфекции в течение 7 дней проводилась антибиотикотерапия, а также противовоспалительная терапия. Спицы были удалены через 4 недели.
За животными ежедневно вели наблюдение. Оценивали общее состояние, скорость восстановления функции травмированной конечности. Рентгенографию, с целью оценки регенерации костной ткани в зоне перелома, выполняли еженедельно в течение двух месяцев, а также через полгода.
Кровь у животных брали из наружной яремной вены в вакуумные пробирки до остеосинтеза, спустя 24 часа после и далее еженедельно в течение 1,5 месяцев. В сыворотке крови определяли концентрацию общего белка, общего кальция, неорганического фосфора, а также активность щелочной фосфатазы (ЩФ).
Результаты исследований. Все под- имели нарушение функции поврежденной конечности. При пальпации данной конечности была выражена болезненность, костная крепитация, подвижность вне сустава, отек мягких тканей. На рентгенограммах были обнаружены полные диафизарные переломы костей голени со смещением и дефектом костной ткани (рис. 1А). Кошки не опирались на данную конечность.
опытные кошки, при первичном осмотре
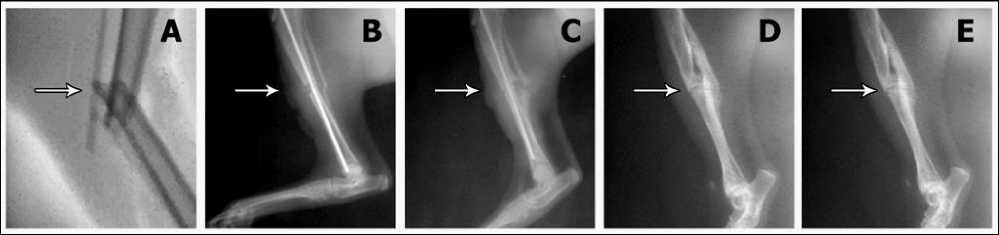
Рис.1 - Рентгеновские снимки травмированной лапы кошки 1 группы в динамике: А) при поступлении, В) через 7 суток С) через 35 дней, D) через 60 дней, E) через 6 мес.
Спустя двое суток после оперативного вмешательства общее состояние животных улучшалось, появлялся аппетит. Кошки начинали активно передвигаться.
Кошки 1-й группы начинали включать конечность в опорную функцию постепенно -через две недели, при этом присутствовала хромота, исчезновение которой отмечалось только к 30 дню после операции.
На 7 сутки после оперативного вме- шательства на рентгенограмме вокруг зоны перелома просматривалась слабая периостальная реакция (рис. 1В).
На 14-20 день после операции на медиальной поверхности голени у всех животных данной группы (n=2) сформировались свищевые ходы, которые самопроизвольно закрылись в течение месяца.
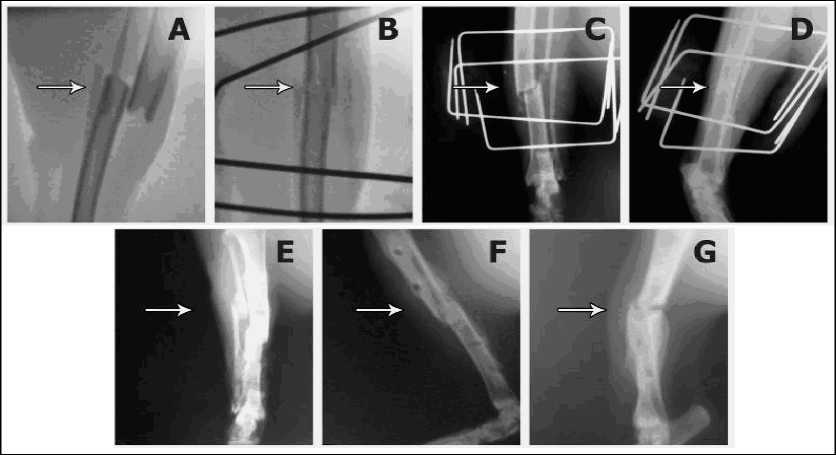
Рис.2 - Рентгеновские снимки травмированной лапы кошек 2 группы в динамике: А) при поступлении, В) после операции, С) через 7 дней, D) зона перелома через 35 дней у кошки без смещения костных отломков, Е) выраженная консолидация отломков кости, животное со смещением костных отломков, F) выраженная консолидация отломков кости, животное без смещения костных отломков через 6 мес).
Через 35 дней - линия перелома просматривалась слабо, однако была хорошо выражена периостальная реакция и утолщение кости, костный дефект был заполнен периостальной костной мозолью (рис. 1С).
Через 60 дней была хорошо выражена консолидация отломков. По задней поверхности диафиза визуализировалась эндостальная мозоль (рис. 1D).
Через 6 месяцев – произошла полная консолидация отломков, зона перелома просматривалась слабо (рис. 1Е).
Животным 2-й группы для фиксации отломков кости был поставлен аппарат внешней фиксации (рис. 2А, 2В).
Через 6 месяцев произошла консолидация отломков (рис. 2G).
Динамика биохимических показателей крови у кошек при регенерации костной ткани отражена в таблице 1.
Обсуждение результатов исследований. Переломы длинных костей, сопровождающиеся дефектом костной ткани, относятся к категории наиболее сложных повреждений. Общепринятым методом лечения травматических дефектов является пластика аутотрансплантантом. Использование аллогенных взрослых клеток - предшественников остеогенеза в достаточном количестве в комбинации с подходящей матрицей может быть более результативным, чем применение традиционной аутологичной пересадки костной ткани [4, 6].
Таблица 1 - Изменения биохимических показателей сыворотки крови кошек
|
Показатели |
Группы кошек |
Общий белок, г/л |
Общий кальций, ммоль/л |
Неорг. фосфор, ммоль/л |
Щелочная фосфатаза, Ед/л |
|
|
До операции |
1 |
67,0 |
2,64 |
1,75 |
41,5 |
|
|
2 |
59,0 |
2,42 |
1,96 |
45,0 |
||
|
cd Ё s о о о с |
24 ч. |
1 |
66,5 |
2,29 |
1,35 |
44,0 |
|
2 |
59,0 |
2,25 |
1,67 |
56,0 |
||
|
7 дн. |
1 |
69,7 |
2,26 |
1,29 |
47,0 |
|
|
2 |
64,0 |
2,25 |
1,67 |
57,0 |
||
|
14 дн. |
1 |
69,5 |
2,15 |
1,12 |
47,5 |
|
|
2 |
65,1 |
2,23 |
1,05 |
58,5 |
||
|
21 дн. |
1 |
69,5 |
2,05 |
1,11 |
49,0 |
|
|
2 |
77,5 |
2,16 |
1,47 |
68,5 |
||
|
28 дн. |
1 |
69,5 |
2,00 |
1,23 |
55,5 |
|
|
2 |
77,5 |
2,14 |
1,56 |
49,0 |
||
|
35 дн. |
1 |
80,5 |
2,07 |
1,31 |
89,5 |
|
|
2 |
85,0 |
2,00 |
1,66 |
48,0 |
||
|
42 дн. |
1 |
80,5 |
2,03 |
1,25 |
45,0 |
|
|
2 |
81,0 |
2,12 |
1,63 |
44,0 |
||
Остеосинтез является в большинстве случаев предпочтительным методом лечения переломов трубчатых костей. Существуют разные методы фиксации костных отломков. При использовании интрамедуллярного остеосинтеза внутрикостный фиксатор нарушает систему кровообращения медуллярного канала, ослабляя тем самым регенераторный процесс. Для удаления фиксатора требуется дополнительная операция.
При остеосинтезе спицами и полимером используют быстротвердеющую пластмассу, которой соединяют спицы. Основными плюсами этого метода являются простая техника наложения, низкая себестоимость, высокая надёж-ность конструкции и прочность фиксации отломков. Удаление фиксатора проходит без наркоза. Данный вид остеосинтеза сохраняет костный мозг, что создаёт благоприятные условия, для сращения по первичному типу [3].
Выбор нами способа регенерации дефектов трубчатых костей у кошек был основан на том, что остеопластический материал «Лиопласт» является деминерализованной костной тканью. Экспериментальными работами доказано положительное влияние пластических материалов «Лиопласт» на регене- рацию костной ткани крыс [1]. Так как биологические эффекты аутогенных и аллогенных ММСК in vivo практически не отличаются [5], поэтому нами были использованы донорские ММСК.В нашем случае, при интрамедуляр-ном остеосинтезе, как и описывается в литературе, включение конечности в опорную функцию произошло на более позднем сроке, по сравнению с внешней фиксацией. Однако на сроке 14-20 дней произошло образование свищей. Их появление мы связываем с отторжением материала «Лиопласт».
У кошек 2-й группы функциональное нагружение оперированного сегмента, ещё до полного сращения, привело к смещению отломков кости у одного животного. Развитию этого осложнения, возможно, способствовала ненадежная фиксация отломков и раннее включение конечности в опорную функцию. Также данные рентгенографии указывают на то, что материал «Лиопласт» оказал отрицательное воздействие на процессы остеорегенерации.
Не смотря на все возникшие осложнения у всех кошек к 6 месяцу после операции произошла консолидация отломков кости. При этом у кошек 2-й группы более четко, чем у животных 1-й группы, просматривалась зона перелома и сохранялась периостальная реакция по поверхности диафиза.
Известно, что по изменению активности ЩФ у кошек можно косвенно судить об активности регенеративных процессов в костной ткани [2]. Мы считаем, что в нашем случае увеличение активности ЩФ в послеоперационный период было связано с повышением активности остеобластов. Показатели общего кальция и неорганического фосфора на всех сроках исследований не выходили за пределы физиологической нормы, что свидетельствует о физиологической регенерации костной ткани в зоне перелома (табл.1). Значения общего белка крови за весь период наблюдения также колебались в пределах физиологической нормы.
Заключение. Исходя из полученных результатов исследований можно сделать вывод, что при поперечном диафизарном переломе костей голени у кошек интрамедуллярное проведение спицы Киршнера в костномозговой канал кости обеспечивает более надежную фиксацию отломков, по сравнению с чрезкостным остеосинтезом. Однако опорная функция конечности при такой фиксации костей восстанавливается на более поздних сро- ках.
Мы предполагаем, что применение материала «Лиопласт» в качестве носителя для ММСК при замещении дефекта костной ткани во время репозиции костей у кошек вызывает воспалительную реакцию с отторжением материала и образование свищей. Следовательно, применение материала «Лиопласт» для восстановления дефектов костной ткани у кошек требует дополнительных исследований.
В связи с возникшими послеоперационными осложнениями мы не смогли оценить влияние аллогенных ММСК на регенерацию костной ткани у кошек.
Резюме
Целью настоящего исследования явилось опробование метода лечения переломов трубчатых костей с дефектом костной ткани у кошек с применением аллогенного остеопластического материала «Лиопласт» (ООО «Лиоселл», Россия) в качестве импланта для замещения дефекта костной ткани и носителя для мультипотентных мезенхимальных стволовых клеток (ММСК).
В связи с возникшими после операции осложнениями нам не удалось оценить влияние аллогенных ММСК на процессы остеорегенерации у кошек.
Список литературы Применение аллогенных мультипотентных мезенхимальных стволовых клеток при лечении переломов костей голени у кошек
- Белозерцева, Е.А. Механизмы рассасывания биоимплантатов серии «Лиопласт» и их влияние на регенераторные процессы в опорных тканях реципиентов: дисс. канд. мед. наук: 14.00.15/Белозерцева Екатерина Александровна.-Самарский гос. мед. университет Федерального агентства по здравоохранению и социальному развитию, Россия, 2006. -240с.
- Ваден, Ш. Полное руководство по лабораторным и инструментальным исследованиям у собак и кошек/Ваден Ш., Нолл Д., Смит Ф., Тиллей Л.-Москва: Аквариум, 2013.-С.56.
- Петровская, Н. Чрескостный остеосинтез при переломах костей предплечья у декоративных пород собак/Н. Петровская, А. Еманов, М. Степанов//Ветеринарная клиника. -2006. -№ 1. -С. 26 -32.
- Швец, А. Лечение переломов длинных костей с костным дефектом/А. Швец, В. Ивченко, А. Самойленко, Д. Ивченко//«ТРАВМА» 2. -2011.-Т.12.-С.120 -126.
- D.-In Jung. A comparison of autologous and allogenic bone marrow-derived mesenchymal stem cell transplantation in canine spinal cord injury/D.-In Jung, J. Ha, B.-T. Kang, Ju-Won Kim, F.-S. Quan, J.-H. Lee, E.-J. Woo, H. Myung//Park J of the neurological sciences.-2009.-Т. 285. -№ 1-2. -С. 67-77.
- Markoski, М. Advances in the Use of Stem Cells in Veterinary Medicine: From Basic Research to Clinical Practice/М. Markoski//Scientifica. -2016.
- Zakirova, E. Transplantation of allogeneic mesenchymal stromal cell for treating corneal ulcers in cats/E. Zakirova, Valeeva A., Faizullina R., Akhmetshina R., Nefedovskaya L., Rizvanov A.//Gens&cells. -2015. -Т. 10 -№ 3.-С. 49 -53.


