Применение антител к лимфоцитам человека для профилактики острого отторжения после трансплантации органов при хронической почечной недостаточности
Автор: Арзуманов С.В., Митиш А.Е., Яровой С.К., Уфимцева В.Ю., Грамотнев А.К.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Нефрология
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Введение. В статье проанализированы результаты использования трех схем индукционной иммуносупрессивной терапии с применением различных препаратов поли- и моноклональных антител при родственной трансплантации почки. Материалы и методы. В основе исследования лежат результаты 107 первичных родственных трансплантаций почки, выполненных с января 2012 по март 2015 гг. в НИИ урологии Минздрава России. Включенные в исследование реципиенты (107 чел.) были рандомизированы на группы, согласно назначенным препаратам антител: иммуноглобулин антитимоцитарный (Атгам) 10 мг/кг, 7 сут.; иммуноглобулин антитимоцитарный (Тимоглобулин) в дозировке 1 мг/кг, 7 сут.; иммуноглобулин антитимоцитарный (Атгам) 250 мг/сут независимо от массы тела, 4 сут, в сочетании с моноклональными антителами к рецептору интерлейкина-2 (CD25) лимфоцитов человека базиликсимабом (Симулект) 20 мг/сут, 2 сут. Кроме этого все пациенты получали такролимус, микофеноловую кислоту и метилпреднизолон. Результаты. По частоте эпизодов острого отторжения трансплантата в раннем и позднем послеоперационном периоде изучаемые подходы к индукционной иммуносупрессии при родственной пересадке почки оказались соизмеримы. Отмечен более благоприятный профиль безопасности четырехкомпонентной схемы, включающей такролимус, микофеноловую кислоту, метилпреднизолон и иммуноглобулин антитимоцитарный (Тимоглобулин), по сравнению с другими изучаемыми схемами, заключающийся в достоверном уменьшении частоты токсической тромбоцитопении. Выводы. При проведении трансплантации почки несенсибилизированному реципиенту для профилактики острого отторжения предпочтительнее использовать иммуноглобулин антитимоцитарный (Тимоглобулин) в дозировке 1 мг/кг, 7 сут.
Трансплантация почки, антитела к лимфоцитам человека, профилактика острого отторжения трансплантированного органа
Короткий адрес: https://sciup.org/142188145
IDR: 142188145
Текст научной статьи Применение антител к лимфоцитам человека для профилактики острого отторжения после трансплантации органов при хронической почечной недостаточности
есмотря на значительный прогресс в области иммунологии и иммуносупрессии, острое и хроническое отторжение является важнейшей причиной потери функции пересаженных органов. Актуальность адекватной профилактики данного явления не вызывает сомнения.
Лечебные антитела являются одной из наиболее динамично развивающихся фармакологических групп. Антитела, относящиеся биотерапев-тическим средствам, имеют существенные отличия от классических им-муносупрессантов. Антителам свойственна высокая избирательность действия и сравнительно низкая токсичность. Эффект антител, как правило, развивается очень быстро – в течение суток, а иногда и за несколько часов, при этом основной проблемой является не риск побочных действий, а чрезмерное подавление иммунитета («гиперсупрессия»), которое может сопровождаться ак- тивизацией возбудителей всевозможных инфекционно-воспалительных осложнений [1]. Попытки управлять терапией посредством уменьшения дозировки антител в большинстве случаев сопровождались непредсказуемым снижением эффективности. Таким образом, можно отметить, что второй проблемой лечебных антител является нелинейная зависимость дозировка/эффективность, что сильно затрудняет лечебный процесс [2]. Побочные действия антител в большинстве своем связаны с разрушением большого количества клеток (синдром выброса цитокинов). Изредка имеют место реакции по типу сывороточной болезни, в основе которой лежит иммунизация чужеродным белком.
Многочисленные следствия чрезмерного угнетения иммунитета, такие как рецидивирующие бактериальные и вирусные инфекции, поверхностные и глубокие микозы, злокачественные новообразования, отраженные инструкциях по приме- нению лекарственных средств изучаемой группы, а также в специализированной литературе, не могут расцениваться как побочные действия, так как в их основе лежит прямое и желательное действие препарата – избирательное и практически тотальное подавление клеток, несущих соответствующий антиген [2].
Другой особенностью не только антител, но и вообще всех биотера-певтических средств является размытость понятия действующего начала, как вещества с определенной химической структурой и обладающего определенным фармакологическим эффектом. Очень часто действие биопрепарата зависит от особенностей методики его получения, поэтому несмотря на регистрационные документы, антитела, например, ан-титимоцитарные, различных производителей отнюдь не являются «воспроизведенными аналогами». Если в отношении химиотерапевтических средств фирма может воспроизвести конкретную молекулу и тем самым заявить о воспроизведенном аналоге, то в отношении биопрепаратов воспроизводится не молекула и даже не технология изготовления, а конечный результат, может быть с некоторыми ограничениями по механизму действия препарата. Вполне очевидно, что антитела в CD3+ лимфоцитам человека, к примеру, мышиные и кроличьи, несмотря на заявленный одинаковый терапевтический эффект, с точки зрения фармакологии будут иметь существенные различия. Поэтому оценка биопрепаратов разных производителей в современных условиях более чем актуальна.
Трансплантология является одной из первых областей клинической медицины, в которой стали применяться антитела для лечения пациентов. Это произошло в середине 80-х годов прошлого века. Разработанный в США миннесотский антилимфоци-тарный иммуноглобулин (MALG) явился прорывом в области иммуносупрессивной терапии, по значимости соизмеримым с внедрением первого ингибитора кальцинейрина циклоспорина А. Первоначально анти-лимфоцитарные антитела применялись для лечения кризов отторжения, однако в дальнейшем эти препараты стали применяться и с профилактической целью [3].
Как показали лабораторные исследования и клиническая практика, индукционная терапия с помощью антител к лимфоцитам человека позволяет значительно снизить тяжесть ишемического консервационно-ре-перфузионного повреждения почечного трансплантата и трансплантата поджелудочной железы, уменьшая, таким образом, вероятность развития дистрофии и некроза канальцев трансплантированной почки и развитие тяжелого деструктивного панкреатита пересаженной поджелудочной железы, что может привести к потере трансплантатов в раннем послеоперационном периоде [4,5]. Такой положительный эффект на первичную функцию почечного и панкреатодуоденального трансплантатов достигается благодаря тому, что антитела к лимфоцитам человека вызывают апоптоз периферических Т-лимфоцитов, ингибируя их адгезию к экспрессированным антигенам главного комплекса гистосовместимости, и снижая выработку цитокинов, ответственных за повреждение трансплантата [6].
Высокая эффективность поликлональных антител в профилактике острого отторжения позволяет применять схемы поддерживающей иммуносупрессивной терапии, исключающие глюкортикоиды, и назначать ингибиторы кальцинейрина отсрочено и в более низких дозировках. Эти группы препаратов обладают высокой дозозависимой диабетогенностью. Таким образом, снижение дозировок этих препаратов позволяет продлить функционирование эндокринного аппарата трансплантированной поджелудочной железы. С другой стороны, более низкие концентрации ингибиторов кальцинейрина в крови позволяют получить лучшие показатели скорости клубочковой фильтрации у компрометированных почечных трансплантатов, что связано со снижением их нефротоксического воздействия.
Однако, несмотря на все усовершенствования иммуносупрессивной терапии, разработку новых препаратов антител, основные проблемы этой фармакологической группы по-прежнему актуальны – плохая управляемость эффектом и инфекционно-воспалительные осложнения, проистекающие от «гиперсупрессии». Одним из путей минимизации этих рисков является разработка комбинированных протоколов иммуносупрессии, в которых конкретный препарат антител привязывается к конкретному ингибитору кальцинейрина (в настоящем исследовании такролимус) и конкретной клинической ситуации, в данном случае к профилактике острого отторжения после родственной трансплантации почки.
МАТЕРИАЛЫ И МЕТОДЫ
В основе исследования лежат результаты 107 первичных родственных трансплантаций почки, выполненных с января 2012 по март 2015 гг. в НИИ урологии и интервенционной радиологии Минздрава России. Среди реципиентов мужчины составили 63%, женщины – 37%. Основной причиной терминальной хронической почечной недостаточности у включенных в исследование пациентов был хронический гломерулонефрит (84%), реже – диабетическая нефропатия (8%), рефлюкс-нефропатия (2%), поликистоз почек (6%).
Средний возраст живых родственных доноров составил 56,2 года. Средняя скорость клубочковой фильтрации у живых родственных доноров до момента изъятия органа – 82,4 мл/мин по формуле MDRD (Modification of diet in renal disease).
Все реципиенты получали базовую трехкомпонентную иммуносупрессивную терапию. Такроли-мус назначался в стартовой дозе 2 мг/кг/сутки. Целевой сывороточной концентрацией такролимуса в первый месяц после трансплантации почки было 8-12 нг/мл крови. Микофеноловая кислота назначалась в дозировке 1440 мг/сутки в течение двух недель, с последующим снижением до 720 мг/сутки. Метилпреднизолон назначался независимо от веса в стартовой дозировке 16 мг/сут с последующим постепенным снижением до 4 мг/сут ко второму месяцу после трансплантации почки.
Всем ключенным в исследование пациентам проводилась профилактика острого отторжения с помощью антител к лимфоцитам человека. Первое введение антител осуществлялось интраоперационно, до начала реперфузии органа.
Реципиенты были рандомизированы на группы, согласно назначенным препаратам антител:
-
I группа – иммуноглобулин ан-титимоцитарный (Атгам, Фармация и Апджон Кампани, США) 10 мг/кг, 7 суток (n=67);

-
II группа – иммуноглобулин ан-титимоцитарный (Тимоглобулин, Им-тикс-Сангстат, Франция) в дозировке 1 мг/кг, 7 сут. (n=30);
III группа – иммуноглобулин ан-титимоцитарный (Атгам, Фармация и Апджон Кампани, США) 250 мг/сут независимо от массы тела, 4 сут., в сочетании с моноклональными антителами к рецептору интерлейкина-2 (CD25) лимфоцитов человека бази-ликсимабом (Симулект, Новартис Фарма Штейн, Швейцария) 20 мг/сут, 2 сут. (n=10).
Всем реципиентам проводилась антибактериальная профилактика цефалоспорином III поколения цефтриаксоном (1,0 в/в 2 раза/сут. в течение 7 суток). Кроме того, с целью профилактики активизации ВГЧ-5 (цитомегаловируса) назначался валган-цикловир (450 мг 2 раза/сут. в течение 180 суток).
Срок наблюдения за реципиентами составлял 6-26 месяцев после трансплантации.
В случае дисфункции почечного трансплантата выполнялась пункционная биопсия с последующим гистологическим и иммуногистохимическим исследованием биоптата. Все случаи острого отторжения были подтверждены морфологически.
В работе были применены следующие методы статистической обработки данных: критерий χ2 для таблиц сопряженности признаков, в том числе с использованием поправки Бонферрони в случае необходимости; критерий согласия Пирсона для проверки на нормальность распределений; сравнительный анализ переменных с помощью критерия Вилкоксона-Манна-Уит-ни. Для автоматизации статистической обработки использовали статистический пакет БИОСТАТИСТИКА (BIOSTAT.EXE).
РЕЗУЛЬТАТЫ
Частота кризов отторжения
Среди 107 включенных в исследование реципиентов почечных трансплантатов от живого родст- венного донора наблюдалось 5 случаев острого криза отторжения (4,7%). Все они отмечены в группе пациентов, получавших Атгам (7,5%). Из них 4 эпизода острого отторжения развились в течение трех недель после трансплантации.
В группах реципиентов, получавших Тимоглобулин, а также комбинированную терапию, включавшую Aтгам и Симулект, острых кризов отторжения трансплантата не было.
Отсроченная функция трансплантата наблюдалось у двух (1,8%) реципиентов – по одному пациенту в группах, получавших Атгам и Ти-моглобулин.
Побочные действия
В I группе реципиентов, получавших Атгам, отмечена высокая частота развития тромбоцитопении (<100x109/л) – 65,4%. У 2,7% пациентов тромбоцитопения достигла критического уровня (<30x109/л), что сопровождалось угрозой спонтанных кровотечений. В гематологической практике такой уровень тромбоцитопении расценивается как жизнеугрожающее состояние. В II группе пациентов, которые получавших Тимоглобулин, транзиторная тромбоцитопения (<100x109/л) отмечена у 26% больных. В III группе реципиентов, получавших комбинированную терапию, включавшую Aтгам и Симулект частота тромбоцитопении (<100x109/л) составила 60%, включая 10% тяжелой степени (<30x109/л). Частота развития тробоцитопении в группе пациентов, получавших Тимоглобулин, оказалась достоверно меньше по сравнению с анало-
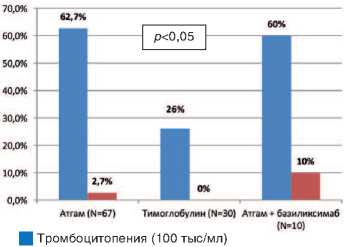
Tяжелая тромбоцитопения (100 тыс/мл)
Рис. 1. Частота развития тромбоцитопении при различных видах иммуносупрессивной терапии.
гичными группами больных, получавших Aтгам, а также комбинированную терапию, включавшую Aтгам и Симулект ( p <0,05).
Содержание тромбоцитов в периферической крови самостоятельно восстанавливалось до исходных цифр в течение 7 суток после отмены препаратов антител, при этом специфической терапии не требовалось.
Инфекционно-воспалительные осложнения
Среди неспецифических инфекционно-воспалительных осложнений наблюдалась раневая инфекция, а также обострение хронического цистита, простатита. Частота развития неспецифических инфекционно-воспалительных осложнений в группах пациентов, получавших Атгам, Тимоглобулин, а также комбинированную терапию, включавшую Aтгам и Симулект, составила соответственно 16,7%, 13,3% и 20%. Статистически значимых по частоте развития неспецифических инфекционно-воспалительных осложнений между изучаемыми группами реципиентов не выявлено ( p >0,05).
Всем реципиентам на 14-21 сутки после трансплантации определялось наличие ДНК ВЧГ-5 в крови методом ПЦР. Не смотря на профилактическое назначение валганцик-ловира, частота выявления бессимптомной ЦМВ-виремии в группах пациентов, получавших Атгам, Тимог-лобулин, а также комбинированную терапию, включавшую Aтгам и Си-мулект составила соответственно 6,2%, 6,6% и 10%. Статистически значимых по частоте развития бессимптомной ЦМВ-виремии между изучаемыми группами реципиентов выявлено было ( p >0,05).
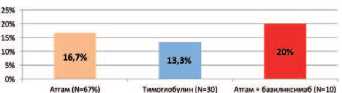
Рис. 2. Частота развития нежизнеугрожающей инфекции при различных типах иммуносупрессивной терапии
В группах больных, получавших Тимоглобулин и комбинированную терапию, включавшую
Aтгам и Симулект, было отмечено по одному случаю цитомегаловирусная пневмонии в раннем послеоперационном периоде, которые были успешно пролечены. У одного пациента, получавшего Атгам, на 4-м месяце после трансплантации развилась рецидивирующая пневмоцистная пневмония с нестойким эффектом от терапии сульфаметоксазо-лом/триметопримом, приведшая к смерти пациента на 6-м месяце пос-
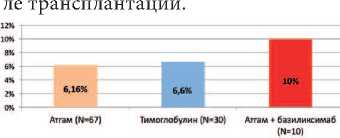
Рис. 3. Число случаев ЦМВ-виремии при различных типах иммуносупрессивной терапии
Синдром выброса цитокинов, заключающийся в лихорадке до 380С, зарегистрирован у 15,5% реципиентов, получавших Атгам, у 6% пациентов, получавших Тимоглобу-лин, у 10 % пациентов, получавших комбинацию Aтгама и Симулекта. Статистически значимых по частоте развития синдрома выброса цитокинов между изучаемыми группами реципиентов не выявлено ( p >0,05).
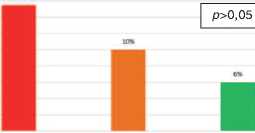
АТГАМ АТГАМ ♦ Смулект Тимоглобулин
Рис. 4. Число случаев выброса цитокинов при различных типах иммуносупрессивной терапии
ОБСУЖДЕНИЕ
Результаты проведенного ис следования демонстрируют высо- кую эффективность антител к лимфоцитам человека для профилактики острого отторжения после трансплантации. Отсутствие эпизодов острого отторжения при применении Тимоглобулина и комбинированной терапии, включающей Симулект и Атгам, возможно свидетельствует о более высокой эффективности, однако для подтверждения этого предположения требуется специальное исследование с существенно большей выборкой пациентов. В литературе нет данных о существенных преимуществах Тимоглобулина перед Атга-мом, однако, в 10-летнем исследовании Университета Миссури, опубликованном в 2008 году при одинаковой выживаемости трансплантатов отмечены более низкая частота реакций отторжения (11%) и заболеваемость всеми видами злокачественных новообразований (8%) при назначении Тимоглобу-лина, по сравнению с аналогичными реципиентами получавших Атгам – 42% и 21% соответственно [7].
В нашем исследовании Тимо-глобулин продемонстрировал достоверно меньшую склонность вызывать тромбоцитопению по сравнению с Атгамом и комбинацией Aтгама и Симулекта. Однако умеренная частота неспецифических инфекционно-воспалительных осложнений и ЦМВ-виремии позволяет сделать заключение об адекватности режимов дозирования изучаемых лекарственных средств и отсутствии «гиперсупрессии».
Создается впечатление о соизмеримой эффективности Атгама и Тимоглобулина в профилактике острого отторжения после пересадки органов и некотором преимуществе Тимоглобулина по безопасности, в частности, по риску развития тромбоцитопении.
Не столь однозначными оказались результаты комбинированного применения Aтгама и Симу-лекта. Данная схема не продемонстрировала преимуществ ни по эффективности, ни по безопасности. Мало того при монотерапии Тимог-лобулином частота развития тромбоцитопении была достоверно меньше, чем в других группах. Вероятно, при родственной трансплантации такую комбинацию следует считать избыточной. В других клинических ситуациях, например, при сочетанной трансплантации почки и поджелудочной железы, где есть риск острого отторжения априори выше, комбинированное применение Aтгама и Симулекта возможно продемонстрирует преимущества.
ЗАКЛЮЧЕНИЕ
Резюме:
Введение. В статье проанализированы результаты использования трех схем индукционной иммуносупрессивной терапии с применением различных препаратов поли- и
Список литературы Применение антител к лимфоцитам человека для профилактики острого отторжения после трансплантации органов при хронической почечной недостаточности
- Юшков В.В., Миронов А.Н., Меркулов В.А. Иммунофармакология. М., Феникс. 2012. 590 с.
- Яровой С.К. Применение поли-и моноклональных антител к лимфоцитам человека в лечении и профилактике острого отторжения после пересадки почки: Автореф дисс. к.м.н. М., 2006. 16 с.
- Готье С.В. Очерки клинической трансплантологии. М., 2009. С.88-93.
- Goggins WC, Pascual MA, Powelson JA, Magee C, Tolkoff-Rubin N, Farrell ML, et al. A prospective, randomized, clinical trial of intraoperative versus postoperative Thymoglobulin in adult cadaveric renal transplant recipients. Transplantation 2003;76(5):798-802.
- Cravedi P, Codreanu I, Satta A, Turturro M, Sghirlanzoni M, Remuzzi G, et al. Cy closporine prolongs delayed graft function in kidney transplantation: are rabbit anti-human thymocyte globulins the answer? Nephron Clin Pract 2005; 101(2):65-71 DOI: 10.1159/000086224
- Beiras-Fernandez A, Chappell D, Hammer C, Beiras A, Reichart B, Thein E. Impact of polyclonal anti-thymocyte globulins on the expression of adhesion and inflammation molecules after ischemia-reperfusion injury. Transpl Immunol 2009;20(4):224-228. doi.org/10.1016/j.trim.2008.11.004
- Hardinger KL, Rhee S, Buchanan P, Koch M, Miller B, Enkvetchakul D, et al. A prospective, randomized, double-blinded comparison of thymoglobulin versus Atgam forinduction immunosuppressive therapy: 10-year results. Transplantation. 2008;86(7):947-952 DOI: 10.1097/TP.0b013e318187bc67


