Применение аппарата компрессионных толстокишечных анастомозов в хирургии рака прямой кишки
Автор: Власов А.А., Важенин А.В., Плотников В.В., Власов А.В., Спирев В.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 3 (39), 2010 года.
Бесплатный доступ
Разработан аппарат нового поколения для формирования циркулярных компрессионных толстокишечных анастомозов. Экспериментально разработана технологическая цепочка применения аппарата. В клинике аппарат использован при 97 передних резекциях по поводу рака прямой кишки. Осложнений и летальности не отмечено, получены хорошие функцио- нальные результаты при использовании данной хирургической методики.
Аппарат компрессионных толстокишечных анастомозов, никелид титана, колоректальный компрес- сионный анастомоз, кта device
Короткий адрес: https://sciup.org/14055623
IDR: 14055623 | УДК: 616.351-006.6:615.47:616-089.86
Текст научной статьи Применение аппарата компрессионных толстокишечных анастомозов в хирургии рака прямой кишки
За последние десятилетия в мире наблюдается рост заболеваемости колоректальным раком. Ежегодно регистрируется около 800 тысяч больных колоректальным раком и около 440 тысяч смертей от этого заболевания [12]. Увеличение заболеваемости раком прямой кишки обусловило особую актуальность сфинктеросберегающих операций по поводу этого заболевания. Наилучшие функциональные результаты получены после выполнения передней резекции прямой кишки [22, 25]. Основной проблемой данной операции является несостоятельность колоректального анастомоза, которая при ручном шве колеблется в пределах 5,4–69,2 % [9, 16, 17, 20, 21], с летальностью, достигающей 23,8 % [1, 24]. Ручной «низкий» колоректальный анастомоз технически сложно формировать в условиях малого таза, что зачастую приводит к отказу от выполнения соустья и выведению противоестественного ануса на брюшной стенке [11, 15].
При всех разновидностях ручного лигатурного кишечного шва в области анастомоза на тот или иной срок в виде инородных тел остается шовный материал. По ходу нитей происходит просачивание в толщу тканей области соустья инфицированного кишечного содержимого и пищеварительных ферментов с развитием воспаления, с образованием микроабсцессов. Даже при благоприятном исходе операции отторжение, инкапсуляция или длительное рассасывание нитей способствуют рубцеванию, сужению и деформации анастомоза. Одновременно, в связи с «биологической негерметичностью» кишечного шва, вокруг анастомоза развивается выраженный спаечный процесс [8].
Все это присуще и механическому шву, так как скрепка, хотя и в меньшей степени, обладает теми же свойствами, что и нить [18]. Аппаратный шов становится все более сложным и дорогостоящим, но проблемы остаются прежние: кровотечение из зоны анастомоза, трудности соединения атрофированных и гипертрофированных кишечных стенок, заживление линии шва вторичным натяжением [14]. По средним статистическим данным, несостоятельность анастомоза при механическом соединении равна 9 % [19]. Неудовлетворенность результатами заставляет хирургов искать альтернативные способы соединения кишечной трубки.
Альтернативой представленных методик явилась разработка бесшовных способов соединения кишечных соустий. В 1826 г. F. Denans в эксперименте на собаках сформировал илео-трансверзоанастомоз с помощью компрессионного устройства. В 1892 г. J. Murphy предложил более совершенное устройство, названное «пуговкой». В начале ХХ века это устройство нашло широкое применение в странах Европы и России, поскольку оно позволяло сократить время операции и упрощало технику формирования анастомоза [5, 6].
Дальнейшее развитие компрессионного анастомоза связано с именем выдающегося хирурга Н.Н. Каншина, который в 1968 г. в эксперименте на собаках продемонстрировал идеальное срастание отрезков желудочно-кишечного тракта после наложения компрессионных анастомозов, что стимулировало создание различных устройств, аппаратов АКА, ЛПК, АСК и др. Эти сшивающие аппараты создавали физическую герметичность анастомоза и надежный гемостаз. Отторжение силиконовых прокладок, создающих компрессию шва, в просвет кишки происходило в раннем послеоперационном периоде, освобождая анастомоз от шовного материала, и обусловливало заживление соустья первичным натяжением. Морфологические исследования экспериментальных анастомозов, выполненные под руководством Н.К. Пермякова, показали, что независимо от разновидности сдавливающих устройств заживление соустья происходит к периферии от зоны сдавливания по типу первичного натяжения, с минимальной воспалительной реакцией, без образования грубого рубца и выраженного перифокального спаечного процесса [7].
За рубежом компрессионный шов получил свое развитие благодаря работам T. Hardy, который в 1985 г. применил для толстокишечных анастомозов компрессионное устройство BAR – биофрагментирующееся кольцо, состоящее на 87,5 % из полигликоевой кислоты (Dexon) и на 12,5 % из сульфата бария. Кольца представляют собой полую втулку, на которой при помощи фестончатых колпачков фиксируются анастомозируемые петли кишечника и формируется инвертированное толстокишечное соустье. В просвете толстой кишки полигликоевая кислота подвергается резорбции, что приводит к элиминации колец BAR на 15-е сут после операции. Сквозного прокалывания кишечной стенки кольцами не происходит. Соустья заживают по типу первичного натяжения [23]. Недостатками колец BAR являются недостаточное расстояние между кольцами устройства в открытом положении, отсутствие дозированной компрессии тканей, кольца достаточно хрупкие и легко разрушаются при чрезмерном давлении, кольца не следует использовать для анастомозирования кишки разных диаметров [7, 13, 20].
Попытки разработать методику бесшовного компрессионного анастомоза продолжаются до сих пор. Открытие в 1949 г. явления термоупругого равновесия фаз в твердых телах послужило основой для создания металлических сплавов, обладающих эффектом «памяти» формы, привело к созданию принципиально нового научного направления в медицине [2]. Такие сплавы, сохраняя все преимущества металлических материалов, обладают механическим поведением того же типа, что и живые [3]. С начала широкого применения никелида титана в медицине имплантаты из этого сплава все шире используются в абдоминальной хирургии по следующим основным направлениям:
-
1) устройства для создания компрессионных анастомозов;
-
2) стенты для дилатаций;
-
3) имплантаты для пережатия различных структур (паренхиматозных органов, сосудов, протоков);
-
4) сетчатые имплантаты и нити из никелида титана.
Наиболее плодотворно развивалось первое направление, в основном благодаря разработкам тюменских и курганских хирургов под руководством Р.В. Зиганьшина. Созданное ими устройство в виде канцелярской скрепки является в настоящее время «золотым стандартом» для разработчиков новых компрессионных устройств, оно соединило в себе простоту, надежность и эффективность, которые необходимы для широкого распространения любой методики [4]. Изучены особенности регенерации тканей анастомозируемых органов. При формировании анастомозов компрессионными устройствами можно добиться практически полного восстановления анатомо-функционального состояния резецированных органов [10, 11].
Материал и методы
Разработан новый аппарат компрессионных толстокишечных анастомозов – КТА (Патент РФ № 58330). При создании аппарата руководствовались следующими требованиями: аппарат должен быть изготовлен из химически и биологически инертного материала, быть простым в эксплуатации, легко разбираться, подвергаться предстерилизационной обработке и стерилизации, быть легко управляемым при формировании анастомоза, не быть травматичным при манипуляциях в кишке, быть достаточно холодоемким, чтобы иметь резерв времени при формировании анастомоза. Аппарат собственной конструкции содержит корпус с рукояткой, направляющую изогнутую трубку и закрепленную на ее конце посредством муфты с цангой рабочую головку. Установленный внутри корпуса и направляющей трубки толкатель контактирует резьбовой частью с ходовой гайкой и снабжен стопорным винтом (рис. 1).
Основной частью аппарата является рабочая головка, которая состоит из двух компрессионных колец, соединенных через телескопические втулки никелид-титановой пружиной. Марка сплава ТН-10. Сила сжатия рабочей головки аппарата была изучена при помощи тензометрической установки УТР в ООО НПП МИЦ (г. Томск). При деформации и восстановлении формы никелид-титановой пружины, находящейся внутри рабочей головки, развивается постоянное усилие на кишечные стенки при расстоянии между кольцами от 10 до 0 мм. Из этого следует, что при любой толщине соединяемых тканей кольца рабочей головки аппарата оказывают на них равномерную постоянную компрессию. Диаметры колец рабочих головок 27, 30, 33 мм, что позволяет выбрать необходимый для конкретного анастомоза размер рабочей головки.
Выработана технологическая цепочка применения аппарата. В нее вошли: предоперационная сборка, проверка функции, предоперационная стерилизация и охлаждение в морозильной камере бытового холодильника в антисептике, применение в ходе оперативного пособия, стадия элиминации устройства, послеоперацион-

Рис. 1. Аппарат компрессионных толстокишечных анастомозов СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2010. №3 (39)
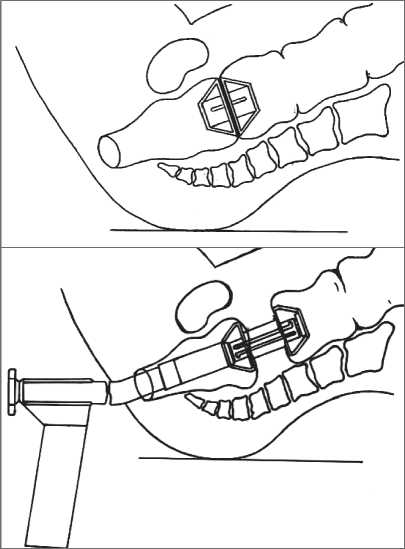
Рис. 2. Методика формирования колоректального анастомоза ное ведение больных и повторная подготовка аппарата к работе. Клиническому использованию аппарата собственной конструкции предшествовало экспериментальное исследование, проведенное на беспородных половозрелых собаках и органокомплексах трупов людей. Эксперимент позволил оценить надежность компрессионных анастомозов, оптимизировать и отработать методики формирования кишечных компрессионных анастомозов.
Результаты и обсуждение
В клинике аппарат КТА использован при формировании 97 колоректальных анастомозов по поводу рака прямой кишки. Мужчин было 42 (43,3 %), женщин – 55 (56,7 %). Средний возраст пациентов – 61,5 ± 12,87 года. С I стадией заболевания прооперировано 17 (17,5 %) больных, со II – 34 (35,1 %), с III – 39 (40,2 %), с IV – 7 (7,2 %).
Все оперативные вмешательства выполнены в плановом порядке и были проведены в соответствии с современными онкологическими принципами: опухоли удалены единым блоком, включая брыжейку прямой кишки и регионар- ные лимфоузлы трех уровней, с пересечением нижних брыжеечных артерии и вены у основания, что соответствует объему тотальной мезо-ректумэктомии (ТМЭ). Следует отметить, что процесс формирования колоректального анастомоза стал простым, асептичным и атравматичным. Среднее время формирования соустья – 6 ± 0,25 мин. В раннем послеоперационном периоде осложнений и случаев летальных исходов не было. Компрессионные устройства отторгались на 8–14-е сут, в среднем на 9 ± 1,25 сут.
Результаты рентгенологических и эндоскопических исследований позволяют утверждать, что сформированные сверхэластичными компрессионными устройствами колоректальные анастомозы в разные сроки после операции обладают хорошей функцией. В отдаленном периоде соустья имеют поперечное расположение, округлую форму, строго определенные размеры, соответственно диаметру примененных устройств. Анастомозы лишены лигатурных свищей, эластичны, способны смыкаться при перистальтических сокращениях, обеспечивают порционно-ритмичную эвакуацию каловых масс.
Заключение. Разработан новый, оригинальный аппарат для формирования циркулярных компрессионных толстокишечных анастомозов, основанный на эффекте «памяти» формы и сверхэластичности у сплавов никелида титана. Использование аппарата в клинической онко-колопроктологии показало его высокую эффективность за счет упрощения работы хирурга, снижения частоты осложнений со стороны анастомоза в раннем и отдаленном послеоперационном периоде.


