Применение добавок с множественными микроэлементами для минимизации риска ухудшения показателей гемоглобина, ферритина и цинка у детей в возрасте 6–11 месяцев (рандомизированное контролируемое исследование)
Автор: Фам Ван Зоань, Чан Тхи Минь Нгуэт, Чан Тхуи Нга, Ле Тхи Тхуи Зунг
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Оценка риска в организации здравоохранения
Статья в выпуске: 3 (50), 2025 года.
Бесплатный доступ
Дефицит микроэлементов остается значимой проблемой общественного здравоохранения среди детей грудного возраста в сельских районах Вьетнама. Питание в возрасте 6–11 месяцев, характеризующееся введением адекватного и разнообразного прикорма, играет ключевую роль в развитии ребенка. Целью данного исследования была оценка эффективности добавки Bibomix, содержащей множественные микроэлементы, для снижения риска ухудшения показателей гемоглобина, ферритина и цинка у детей грудного возраста. Двойное слепое рандомизированное контролируемое исследование проводилось в 10 коммунах округа Куанг Сыонг, провинция Тханьхоа (Вьетнам). В исследование были включены 360 детей, которые случайным образом распределялись в интервенционную или контрольную группу с учетом возраста и пола. Группа вмешательства получала ежедневную дозу Bibomix, в то время как контрольная группа – плацебо в течение 12 месяцев. Через 12 месяцев в интервенционной группе, по сравнению с контрольной, были зафиксированы достоверно более высокие показатели: уровень гемоглобина (среднее ± СК: 7,9 ± 7,2 против 3,9 ± 1,3 г/л; разность разностей (DID) = 4,41; p < 0,001), концентрация ферритина (медиана [IQR]: 8,5 [1,0–16,6] против 5,52 [-7,4–13,4]; DID = 2,97; p = 0,001) и уровень цинка в сыворотке (среднее ± СК: 1,67 ± 1,33 против 1,26 ± 1,47 мкмоль/л; DID = 0,41; p = 0,008). Также наблюдалось снижение распространенности анемии на 18,4 % (ОР = 25,0; 95 % ДИ: 1,8–333,3) и дефицита цинка на 31,0 % (ОР = 7,1; 95 % ДИ: 3,3–14,3). Программа вмешательства с применением добавок, содержащих множественные микроэлементы, показала высокую эффективность в улучшении обеспеченности основными микроэлементами у детей грудного возраста в сельской местности. Рекомендуется расширение данной нутриционной модели в регионах с высоким уровнем анемии и дефицита микроэлементов.
Вьетнам, сельская местность, дети 6–11 месяцев, рандомизированное контролируемое исследование (РКИ), двойное слепое исследование, множественные микроэлементы
Короткий адрес: https://sciup.org/142245782
IDR: 142245782 | УДК: 613.2; 612.1 | DOI: 10.21668/health.risk/2025.3.14
Текст научной статьи Применение добавок с множественными микроэлементами для минимизации риска ухудшения показателей гемоглобина, ферритина и цинка у детей в возрасте 6–11 месяцев (рандомизированное контролируемое исследование)
Адекватное питание в течение первых 1000 дней жизни имеет решающее значение для закладывания прочной основы оптимального физического роста, развития мозга и благоприятных долгосрочных последствий для здоровья на протяжении всей жизни [1]. Научные данные убедительно подтверждают эффек- тивность и устойчивость ранних нутритивных вмешательств в содействии физическому и когнитивному развитию детей. Оптимальные меры нутритивной поддержки в этот критический «золотой период» первых 1000 дней способны сыграть ключевую роль в комплексном подходе к борьбе с недоеданием и дефицитом микронутриентов, а также в значительном снижении их распространенности [1–4].
Дефицит железа и цинка является одним из наиболее распространенных видов микронутриентной недостаточности в мире, особенно среди беременных женщин, младенцев и детей раннего возраста, что обусловлено повышенными потребностями в питательных веществах в периоды интенсивного роста [5]. По данным Всемирной организации здравоохранения (ВОЗ), глобальная распространенность анемии среди детей в возрасте до пяти лет составляет около 40 %, при этом наибольшие показатели наблюдаются в Африке, за которой следует Азия [6, 7]. В рамках обследования, проведенного в 2021 г. в 32 странах Африки, было зафиксировано, что распространенность анемии среди детей младше пяти лет достигает 64,1 % [8]. В 19 европейских странах распространенность дефицита железа среди детей в возрасте от 6 до 12 месяцев варьируется от 2 до 25 %. В России железодефицитная анемия является распространенным состоянием среди детей, при этом уровень распространенности колеблется от 6 до 40 % в зависимости от региона [10]. Другое исследование, проведенное в России, показало, что от 10 до 40 % детей имеют дефицит цинка, а прием добавок цинка способствует улучшению физического развития и снижению частоты респираторных и желудочно-кишечных заболеваний [11]. Во Вьетнаме, по данным Национального опроса по питанию среди детей младше пяти лет за 2019–2020 гг., проведенного Национальным институтом питания, уровень дефицита цинка составил 58 %, а распространенность анемии – 19,6 %. Особенно примечательно, что среди детей в возрасте от 6 до 11 месяцев уровень анемии достигал 25,6 % [12]. Высокая распространенность анемии и дефицита цинка среди детей в возрасте до двух лет в основном обусловлена повышенными физиологическими потребностями в период быстрого роста, недостаточным потреблением железа и цинка вследствие несбалансированного прикорма, низкой усвояемостью питательных веществ, а в некоторых случаях – инфекциями или потерей крови1.
Дети в возрасте от 6 до 11 месяцев особенно уязвимы к дефициту микронутриентов и часто страдают от инфекционных заболеваний [12]. Это во многом связано с практиками введения прикорма, которые не соответствуют физиологическим потребностям детей раннего возраста. Подобные недостатки в питании чаще всего наблюдаются в бедных сельских районах, где экономические и социокультурные условия ограничены. В таких условиях лица, осуществляющие уход за детьми, нередко сталкиваются с барьерами в доступе к санитарно-гигиеническому просвещению и информационной поддержке, что приводит к низкому уровню знаний и неадекватной практике в области охраны здоровья и питания детей [1]. Многочисленные международные исследования подтвердили эффективность применения мультивитаминно-минеральных добавок в повышении уровня гемоглобина (Hb), ферритина и цинка у детей младшего возраста [2, 13, 14]. Тем не менее во Вьетнаме аналогичные исследования остаются ограниченными, особенно среди детей в возрасте от 6 до 11 месяцев, проживающих в сельских районах. В то же время вмешательство с использованием Bibomix – обогащенной пищевой добавки, содержащей 15 основных витаминов и минералов, разработанной в соответствии с рекомендациями Национального института питания Вьетнама2 и ВОЗ3 – в сочетании с образовательными и информационными мероприятиями по вопросам питания до настоящего времени не получило широкой оценки в условиях реальной практики на уровне сообществ. В связи с этим нами было проведено данное исследование.
Материалы и методы. Данное исследование представляло собой рандомизированное, двойное слепое, плацебоконтролируемое испытание, основанное на сообществе. Его целью было проверить гипотезу, что применение пищевой добавки Bibomix в сочетании с прямым просвещением по вопросам питания и здоровья (NHE) для лиц, ухаживающих за детьми, способствует снижению частоты анемии, дефицита железа и дефицита цинка среди детей в возрасте от 6 до 11 месяцев по истечении 12-месячного периода вмешательства.
Период проведения вмешательства составил 12 месяцев: с февраля 2019 г. по апрель 2020 г. Место проведения исследования: район Куангсюонг, провинция Тханьхоа, Вьетнам.
Протокол исследования был одобрен Институциональным этическим комитетом по биомедицинским исследованиям Национального института питания Вьетнама (решение № 259/VDD-QLKH от 15 июня 2018 г.).
Рандомизация. Выбор коммун. Для участия в исследовании было отобрано десять сельских коммун, обладающих схожими социально-экономическими условиями, не участвовавших ранее в программах нутритивного вмешательства и имеющих плотность населения более 5000 человек на коммуну.
Отбор участников. Был составлен полный список всех младенцев, проживающих в выбранных коммунах, с указанием даты рождения и пола. Данные о дате рождения были получены из свидетельств о рождении детей.
Распределение по группам. После базовой оценки 436 детей из 10 коммун участники были случайным образом распределены на две группы – интервенционную группу и группу контроля – с равным числом детей в каждой. Сначала отбор в интервенционную группу осуществлялся на основе заранее определенных критериев включения. Затем участники контрольной группы подбирались с учетом обеспечения сопоставимости между группами по полу и возрасту. Схема исследования представлена на рис. 1.
Интервенция по обучению питанию и уходу за детьми в обеих группах. Образовательные и информационные материалы для коммуникационной составляющей вмешательства были разработаны на основе ресурсов Национального института питания Вьетнама, включая материалы Программы профилактики детского недоедания (PEM), а также передового международного опыта в области кормления грудных и маленьких детей (IYCF), рекомендованного Всемирной организацией здравоохранения [15, 16]. Коммуникационная программа также включала рекомендации по надлежащей практике в области доступа к чистой воде, личной гигиены и санитарии окружающей среды (WASH).
Все обучающие мероприятия проводились сотрудниками Национального института питания, представителями районных органов здравоохранения и местными медицинскими работниками.
Критерии включения и исключения. Был составлен список всех детей в возрасте от 6 до 11 месяцев, проживающих в 10 отобранных коммунах района Куангсюонг, провинция Тханьхоа, с указанием даты рождения и пола. Участники прошли отбор по следующим критериям:
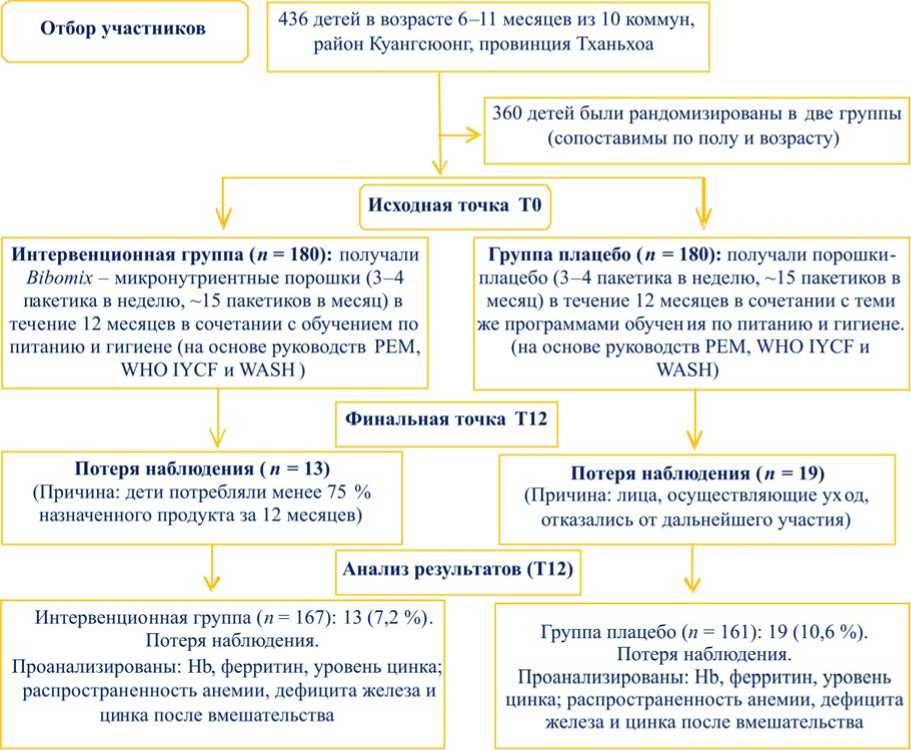
Рис. 1. Схема исследования
Критерии включения: дети в возрасте от 6 до 11 месяцев, постоянно проживающие в районе проведения исследования, родители или законные представители которых добровольно согласились на участие, подписав форму информированного согласия, и дали согласие соблюдать все процедуры исследования.
Критерии исключения: дети с тяжелой формой недоедания ( Z -оценка массы тела к росту < -3), тяжелой анемией (уровень гемоглобина < 70 г/л), серьезными инфекционными заболеваниями, а также дети, которые в момент набора либо ранее участвовали в других программах нутритивного вмешательства. Кроме того, из окончательного анализа были исключены дети, употребившие менее 75 % назначенного продукта к концу периода вмешательства.
Нутритивное вмешательство. Участники интервенционной группы получали порошкообразную многокомпонентную микронутриентную добавку Bibomix (MNPs), тогда как участники контрольной группы получали пакетики плацебо. Оба продукта были идентичны по внешнему виду с целью минимизации предвзятости при внедрении вмешательства в условиях сообщества. Упаковка содержала маркировку с указанием месяца и года производства: март 2021 г. для Bibomix и сентябрь 2021 г. для плацебо. Медицинские работники на уровне общины еженедельно посещали семьи участников, отслеживали приверженность режиму приема и распространяли продукт в соответствии с групповой принадлежностью. Обеим группам было рекомендовано использовать по одному пакетику на прием, 3–4 раза в неделю (в среднем 15 пакетиков в месяц) в течение 12 месяцев, смешивая порошок с кашей. Ни участники, ни лица, осуществляющие уход, ни сотрудники, собирающие данные, не могли отличить Bibomix от плацебо, что обеспечивало ус- ловия двойного ослепления на протяжении всего исследования – в соответствии с протоколом4и рекомендациями ВОЗ по микронутриентной поддержке от 2016 г.5
Плацебо-продукт содержал 1 г рисового порошка. Как саше с микронутриентной добавкой Bibomix, так и саше плацебо были изготовлены Центром по оказанию услуг в области питания, пищевой науки и технологий, действующим при Национальном институте питания Вьетнама. Оба продукта соответствовали микробиологическим стандартам безопасности в соответствии с Решением № 46/2007/QD-BYT, а также требованиям по предельно допустимому содержанию тяжелых металлов, установленным техническим регламентом QCVN 8-2: 2011/BYT, утвержденным Министерством здравоохранения Вьетнама.
Оценка нутритивного статуса. Образцы венозной крови (2,5 мл) были взяты у каждого участника в утренние часы – с 8:00 до 11 00 – с использованием стерильных шприцев. Полная кровь помещалась в пробирки без антикоагулянтов; 20 мкл использовались немедленно для измерения концентрации гемоглобина (Hb). Оставшаяся кровь сохранялась в охлаждаемых контейнерах и центрифугировалась в течение 10 мин при 3000 об./мин не позднее чем через 4 ч после взятия. Сыворотка переносилась в пробирки типа Эппендорф и хранилась при температуре -20 °C в Провинциальном центре профилактической медицины. По завершении полевых работ сывороточные образцы были отправлены экспресс-доставкой в лабораторию Национального института питания, где хранились при температуре -80 °C до момента анализа. Все процедуры по забору крови, центрифугированию и хранению биообразцов строго соответствовали стандартным протоколам для предотвращения загрязнения цинком.
Таблица 1
Состав многокомпонентной микронутриентной добавки Bibomix (на 1 г саше)
|
Микронутриент |
Количество |
Микронутриент |
Количество |
|
Витамин A, мкг |
400,0 |
Витамин B12, мкг |
0,9 |
|
Витамин D, мкг |
5,0 |
Фолиевая кислота, мкг |
150,0 |
|
Витамин E, мг |
5,0 |
Железо, мг |
10,0 |
|
Витамин C, мг |
20,0 |
Цинк, мг |
4,1 |
|
Витамин B1, мг |
0,5 |
Медь, мг |
0,56 |
|
Витамин B2, мг |
0,5 |
Селен, мкг |
17,0 |
|
Витамин B3 (Ниацин), мг |
6,0 |
Йод, мкг |
90,0 |
|
Витамин B6, мг |
0,5 |
||
|
Вспомогательные вещества: модифицированный крахмал, стеарат магния |
|||
Уровень гемоглобина (Hb). Уровень гемоглобина измеряли методом цианметгемоглобина в лаборатории Национального института питания. Дети с уровнем Hb ниже 110 г/л классифицировались как страдающие анемией, а при уровне ниже 70 г/л – как имеющие тяжелую анемию6.
Сывороточный ферритин. Уровень ферритина в сыворотке измеряли методом ИФА (ELISA) с использованием коммерческого набора (Ramco Laboratories, Inc., Стаффорд, Техас, США) в Национальном институте питания. Точность измерений была подтверждена в соответствии с международными стандартами ВОЗ. Истощение запасов железа определялось как концентрация ферритина < 12 мкг/л при уровне С-реактивного белка (CRP) < 5 мг/л или как ферритин > 30 мкг/л при CRP > 5 мг/л. Железодефицитная анемия определялась как уровень Hb < 110 г/л в сочетании с ферритином <12 мкг/л7.
Сывороточный цинк. Анализ концентрации цинка в сыворотке проводился методом атомноабсорбционной спектрометрии с пламенем (Австралия) в отделе микронутриентов Национального института питания. Все процедуры были организованы с учетом предотвращения перекрестного загрязнения металлами. Точность измерений подтверждалась контрольными образцами и стандартами на основе соляной кислоты. Дефицит цинка у детей определялся как концентрация цинка в сыворотке < 9,9 мкмоль/л в утренних, не натощак взятых пробах8.
С-реактивный белок (CRP). CRP измеряли методом ИФА с использованием коммерческого набора (Diagnostic Systems Laboratories Inc., Вебстер, Техас, США) в отделе микронутриентов Национального института питания. Уровень CRP > 5 мг/л расценивался как признак острой фазы воспалительного ответа [17].
Сбор общей информации. Данные собирались с использованием структурированных анкет, которые заполнялись обученными полевыми специалистами из исследовательской группы. Анкета включала следующую информацию. Факторы, относящиеся к ребенку: возраст (количественная переменная), пол (дихотомическая переменная: девочка / мальчик), масса тела при рождении (дихотомическая переменная: > 2500 г / < 2500 г), эксклюзивное грудное вскармливание в течение первых шести месяцев (дихотомическая переменная: < 6 месяцев / > 6 месяцев). Также фиксировалась заболеваемость за последние две недели, включая симптомы острых респираторных инфекций, диареи и лихорадки (дихотомическая переменная: да / нет)9. Показатели, относящиеся к матери: возраст (дихотомическая переменная: < 30 лет / > 30 лет), уровень образования (дихотомическая переменная: < среднее (окончено <12 классов) / > среднего (более 12 классов)) и род занятий (дихотомическая переменная: официально трудоустроенные, включая госслужащих и владельцев малого бизнеса / другие, включая фермеров, рабочих, домохозяек и фрилансеров). Также регистрировалось использование поливитаминноминеральных добавок во время беременности (дихотомическая переменная: да / нет). Показатели, относящиеся к домохозяйству: общий ежемесячный доход семьи (дихотомическая переменная: > 5 миллионов донгов /< 5 миллионов донгов) и количество детей в семье (дихотомическая переменная: > 2 детей / < 2 детей).
Расчет объема выборки и статистический анализ. Объем выборки был рассчитан с использованием стандартной формулы для интервенционных исследований10:
2 δ 2 ( Z 1 -α /2 + Z 1 -β /2 ) 2 n = 2 ,
( µ 0 -µ a )
где n – необходимый размер выборки на одну группу; α – вероятность ошибки первого рода, уста новлена на уровне 5 % (Z1-α/2 = 1,96);
β – вероятность ошибки второго рода, установлена на уровне 10 %, что соответствует мощности исследования 90 % ( Z 1-β/2 = 1,28);
δ – стандартное отклонение;
µ₀ – µ ₐ – ожидаемая разница средних значений между группами.
Объем выборки был рассчитан для оценки различий в концентрации гемоглобина (Hb) между группами. При ожидаемой разнице средних значений µ₀ – µₐ = 3,07 и стандартном отклонении δ = 6,5 [18] полученный минимальный объем выборки составил n = 59 участников на группу. Для концентрации цинка в сыворотке ожидаемая разница составила µ₀ – µₐ = 0,83 при стандартном отклонении δ = 2,28 [18], что дало необходимый объем выборки n = 101 на группу. Таким образом, минимально необходимый объем выборки составлял 101 ребенка в каждую группу. В рамках настоящего исследования было включено по 180 детей в каждую группу, что дало общий объем выборки 360 участников для интервенционного исследования.
Статистический анализ . Данные были введены, проверены и проанализированы с использованием программ EpiData 3.1 и SPSS версии 26.0. До проведения статистических тестов все переменные были проверены на нормальность распределения. Категориальные переменные представлены в виде частот и процентов. Количественные переменные с нормальным распределением описаны как среднее значение ( X ) ± стандартное отклонение ( SD ), а переменные с ненормальным распределением – как медиана и межквартильный размах ( IQR ).
Для оценки эффективности вмешательства использовался показатель абсолютного снижения риска (ARR). ARR отражает разницу в риске между двумя группами, выраженную в процентах, с 95%-ным доверительным интервалом (95 % CI )11. Положительное значение ARR (> 0) по завершении вмешательства указывает на более низкую частоту неблагоприятного исхода в интервенционной группе по сравнению с группой плацебо.
Обобщенные линейные модели (GLM) применялись для анализа эффекта вмешательства с поправкой на потенциальные искажающие факторы. В качестве количественных ковариат рассматривались: возраст ребенка в месяцах на момент включения (T₀), концентрации гемоглобина, ферритина, С-реактивного белка (CRP) и цинка на момент завершения вмешательства (T₁₂). Категориальные ковариаты включали: пол ребенка, массу тела при рождении, факт исключительно грудного вскармливания в течение первых шести месяцев, наличие заболеваний (ОРЗ, диарея, лихорадка) за две недели до оценки (T₁₂), а также возраст матери, уровень ее образования, род занятий, использование микронутриентных добавок во время беременности, общий ежемесячный доход семьи и количество детей в семье – всё на момент включения в исследование (T₀). Мультиколлинеарность между независимыми переменными оценивалась с использованием коэффициента инфляции дисперсии (VIF); все значения VIF были ниже 2,0, что свидетельствует об отсутствии значимой мультиколлинеарности.
Результаты и их обсуждение. Для обеспечения сопоставимости групп перед анализом результатов вмешательства была проведена оценка исходных характеристик участников. В табл. 2 приведены обобщенные данные об их характеристиках на момент включения в исследование ( T ₀).
В табл. 2 приводится сравнительный анализ исходных данных между двумя группами с высоким уровнем гомогенности, при этом все значения p > 0,05. Это подтверждает сопоставимость и надежность последующих анализов, оценивающих эффективность вмешательства.
Данные табл. 3 указывают, что не было статистически значимых различий между интервенционной и контрольной группами.
Эти результаты (табл. 2 и 3) предполагают эпидемиологически сбалансированное распределение между двумя группами на исходном уровне, что гарантирует объективность и надежность в последующей оценке эффектов вмешательства.
В табл. 4 представлены данные сравнения статуса микроэлементов в плазме, включая концентрации гемоглобина (Hb), ферритина, цинка и CRP.
Таблица 2
Характеристики участников
|
Исходные характеристики |
Интервенционная группа, n = 167 |
Контрольная группа, n = 161 |
p |
|
Пол ребенка, n (%) |
|||
|
Девочки |
83 (49,7) |
89 (55,3) |
0,312 |
|
Мальчики |
84 (50,3) |
72 (44,7) |
|
|
Средний возраст (в месяцах) |
|||
|
Среднее ± SD (мин. – макс.) |
7,7 ± 1,4 (6,0–11,8) |
7,9 ± 1,6 (6,0–11,9) |
0,360 |
|
Масса тела при рождении, n (%) |
|||
|
≥ 2500 г |
155 (92,8) |
147 (91,3) |
0,613 |
|
< 2500 г |
12 (7,2) |
14 (8,7) |
|
|
Исключительное грудное вскармливание до 6 месяцев |
|||
|
< 6 месяцев |
105 (62,9) |
100 (62,1) |
0,887 |
|
≥ 6 месяцев |
62 (37,1) |
61 (37,9) |
|
|
Возраст матери, n (%) |
|||
|
≤ 30 лет |
46 (27,5) |
39 (24,2) |
0,493 |
|
> 30 лет |
121 (72,5) |
122 (75,8) |
|
|
Образование матери, n (%) |
|||
|
Среднее и ниже |
122 (73,1) |
112 (69,6) |
0,485 |
|
Выше среднего |
45 (26,9) |
49 (30,4) |
|
|
Занятость матери, n (%) |
|||
11 Nguyen Van Tuan. Data Analysis with R. – Ho Chi Minh City: General Publishing House, 2014 (in Vietnamese).
Окончание табл. 2
|
Исходные характеристики |
Интервенционная группа, n = 167 |
Контрольная группа, n = 161 |
p |
|
Государственная служба |
42 (25,1) |
33 (20,5) |
0,316 |
|
Другое* |
125 (74,9) |
128 (79,5) |
|
|
Общий месячный доход домохозяйства, n (%) |
|||
|
> 5 млн/мес. |
140 (83,8) |
141 (87,6) |
0,333 |
|
≤ 5 млн/мес. |
27 (16,2) |
20 (12,4) |
|
|
Общее количество детей в семье, n (%) |
|||
|
> 2 детей |
32 (19,2) |
29 (18,0) |
0,789 |
|
≤ 2 детей |
135 (80,8) |
132 (82,0) |
|
Примечание: p были получены с помощью t -тестов для сравнения средних значений или χ²-тестов для сравнения пропорций между двумя группами на одном и том же временном интервале; * – фермеры, рабочие на фабриках, домохозяйки и фрилансеры.
Таблица 3
Исходный уровень микроэлементов, концентрация гемоглобина, сывороточный ферритин и цинк
|
Исходные характеристики |
Интервенционная группа, n = 167 |
Контрольная группа, n = 161 |
p |
|
Распространенность анемии, n (%) |
49 (29,3) |
42 (26,1) |
0,510 |
|
Распространенность железодефицита, n (%) |
22 (13,2) |
30 (18,6) |
0,176 |
|
Распространенность железодефицита – CRP**, n (%) |
23 (13,8) |
32 (19,9) |
0,139 |
|
Распространенность железодефицитной анемии, n (%) |
15 (9,0) |
22 (13,7) |
0,180 |
|
Распространенность дефицита цинка, n (%) |
124 (74,3) |
113 (70,2) |
0,411 |
|
Концентрация гемоглобина, г/л |
|||
|
Среднее ± SD (мин. – макс.) |
113,8 ± 8,3 (88,9–137,2) |
115,2 ± 8,9 (89,5–137,4) |
0,145 |
|
Концентрация сывороточного ферритина, мкг/л |
|||
|
Среднее ± SD (мин. – макс.) |
27,7 ± 17,5 (1,9–101,6) |
26,5 ± 18,4 (1,0–85,1) |
0,564 |
|
CRP, мг/л |
|||
|
Среднее ± SD (мин. – макс.) |
1,33 ± 1,21 (0,15–8,69) |
1,17 ± 0,99 (0,04–8,43) |
0,221 |
|
Концентрация сывороточного цинка, мкмоль/л |
|||
|
Среднее ± SD (мин. – макс.) |
8,95 ± 1,62 (4,28–13,64) |
9,00 ± 1,51 (4,32–13,38) |
0,752 |
Примечание: значения p были получены с помощью t -тестов для сравнения средних значений и χ² - тестов для сравнения пропорций между двумя группами на одном и том же временном интервале. Железодефицит был определен как уровень ферритина < 12 мкг/л при CRP ≤ 5 мг/л или ферритин > 30 мкг/л при CRP > 5 мг/л. SD – стандартное отклонение.
Таблица 4
Сравнение статуса микроэлементов в плазме, гемоглобина, ферритина, цинка
|
Характеристики |
Интервенная группа |
Среднее различие |
p |
Контрольная группа |
Среднее различие |
p |
DID |
p |
||
|
исходные данные, n = 167 |
конечные данные, n = 167 |
исходные данные, n = 161 |
конечные данные, n = 161 |
|||||||
|
Уровень гемоглобина, г/L |
||||||||||
|
Среднее ± SD |
113,8 ± 8,3 |
121,8 ± 8,4 |
7,9 ± 7,2 |
< 0,001b |
115,2 ± 8,9 |
119,4 ± 8,7 3,9 ± 1,3 < 0,001 |
4,41 |
< 0,001a |
||
|
CRP, мг/L |
||||||||||
|
Медиана (p25; p75) |
1,12 (0,7; 1,5) |
0,74 (0,16; 1,51) |
0,00 (-0,4; 0,4) |
0,022d |
1,05 (0,7; 1,4) |
1,1 (0,8; 1,5) |
0,11 (-0,2; 0,5) |
0,885d |
-0,11 |
0,114c |
|
Уровень сывороточного ферритина, μг/L |
||||||||||
|
Медиана (p25; p75) |
24,2 (17,3; 32,9) |
34,0 (23,6; 50,6) |
8,5 (1,0; 16,6) |
< 0,001d |
21,9 (14,8; 33,5) |
26,4 (19,4; 35,5) |
5,52 (-7,4; 13,4) |
0,002d |
2,97 |
0,001c |
|
Уровень сывороточного цинка, μmol/L |
||||||||||
|
Среднее ± SD |
8,95 ± 1,62 |
10,62 ± 0,97 1,67 ± 1,33 |
< 0,001b 9,01 ± 1,51 10,26 ± 1,31 1,26 ± 1,47 < 0,001 |
0,41 |
0,008 a |
|||||
Примечание: DID – разница в разницах; SD – стандартное отклонение; pа – независимый t -тест для сравнения средних значений между интервенционной и контрольной группами на одном и том же временном интервале (для нормально распределенных переменных); pb – парный t -тест для сравнения средних значений внутри одной группы до и после вмешательства (для нормально распределенных переменных); pc – U -тест Манна – Уитни для сравнения интервенционной и плацебо-групп на одном и том же временном интервале (для ненормально распределенных переменных); pd – тест знаков Вилкоксона для сравнения медиан внутри одной группы до и после вмешательства (для ненормально распределенных переменных).
Анализ разницы в разницах (DID) показал увеличение концентрации гемоглобина после вмешательства на DID = 4,41 г/л ( p < 0,001), а также увеличение концентрации сывороточного ферритина на DID = 2,97 мкг/л ( p = 0,001). Изменение концентрации CRP в сыворотке составило DID = -0,11 мг/л ( p = 0,114). Концентрация сывороточного цинка увеличилась на DID = 0,41 мкмоль/л ( p = 0,008). Эти результаты свидетельствуют о значительном положительном эффекте вмешательства на уровень гемоглобина, ферритина и цинка у детей, в то время как его влияние на воспаление (по данным CRP) не было статистически значимым.
На рис. 2 продемонстрирована значительная эффективность вмешательства в улучшении состояния с анемией, железодефицитом и дефицитом цинка среди детей.
Распространенность анемии в интервенционной группе составила всего 3,0 %, что значительно ниже 12,4 % в группе плацебо ( p = 0,039). Распространенность железодефицита была 1,2 % в интервенционной группе, что значительно ниже 10,6 % в группе плацебо ( p = 0,004). Дефицит цинка также показал существенное снижение: 13,8 % в интервенционной группе по сравнению с 40,4 % в группе плацебо ( p < 0,001). Эти результаты указывают на сильное и статистически значимое влияние вмешательства.
Данные табл. 5 показывают, что вмешательство привело к абсолютному снижению распространенности анемии на 18,4 % (95 % ДИ: 2,3–34,5), с корректированным относительным риском ( RR ) 25,0 (95 % ДИ: 1,8–333,3; p = 0,025). Снижение распространенности железодефицита составило 13,2 %
(95 % ДИ: -5,2–31,6), с корректированным RR 12,5 (95 % ДИ: 0,7–250,0; p = 0,092). Вмешательство привело к снижению дефицита цинка на 31,0 % (95 % ДИ: 19,5–42,3), с корректированным RR 7,1 (95 % ДИ: 3,3–14,3; p < 0,001). После корректировки на искажающие факторы вмешательство оказало явно значительный эффект на снижение анемии и дефицита цинка среди детей, у которых эти дефициты были на исходном уровне ( p < 0,001). Однако эффект на железодефицит не был статистически значимым ( p > 0,05).
Результаты исследования показали, что через 12 месяцев вмешательства средняя концентрация гемоглобина (Hb) в интервенционной группе увеличилась на 4,41 г/л по сравнению с данными контрольной группы (DID = 4,41; p < 0,001). Вмешательство также значительно снизило распространенность анемии, с корректированным относительным риском ( RR ) 4,1 (95 % ДИ: 1,6–10,8; p < 0,001)
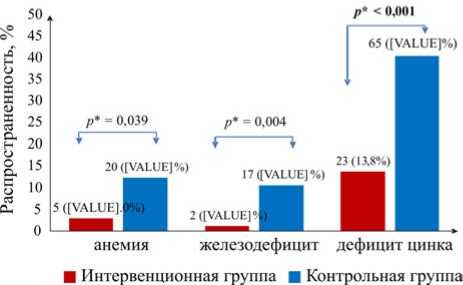
Рис. 2. Изменения распространенности анемии, железодефицита и дефицита цинка среди детей после вмешательства
Таблица 5
Эффективность вмешательства в снижении анемии, железодефицита и дефицита цинка среди детей после вмешательства
|
Характеристика |
Интервенционная группа n (%) |
Контрольная группа n (%) |
ARR % (95 % ДИ) |
RR (95 % ДИ) |
p |
RR * (95 % ДИ) |
p * |
|
Влияние на статус анемии |
|||||||
|
Анемия |
5 (10,2) |
12 (28,6) |
18,4 (2,3–34,5) |
2,8 (1,1–7,1) |
0,025 |
25,0 (1,8–333,3) |
0,015 |
|
Без анемии |
44 (89,8) |
30 (71,4) |
|||||
|
Влияние на статус железодефицита |
|||||||
|
Железодефицит |
2 (8,7) |
7 (21,9) |
13,2 (-5,2–31,6) |
2,5 (0,6–11,1) |
0,193 |
12,5 (0,7–250,0) |
0,092 |
|
Без железодефи-цита |
21 (91,3) |
25 (78,1) |
|||||
|
Влияние на статус дефицита цинка |
|||||||
|
Дефицит цинка |
22 (17,7) |
55 (48,7) |
31,0 (19,5 – 42,3) |
2,8 (1,8 – 4,2) |
< 0,001 |
7,1 (3,3–14,3) |
< 0,001 |
|
Без дефицита цинка |
102 (82,3) |
58 (51,3) |
|||||
Примечание: p* – сравнение скорректированного риска между двумя исследуемыми группами, полученное на основе обобщенного многовариантного регрессионного анализа. Анемия была определена как уровень гемоглобина < 110 г/л; железодефицит был определен как ферритин < 12 мкг/л; дефицит цинка был определен как концентрация цинка в плазме < 9,9 мкмоль/л; ARR – абсолютное снижение риска после 12 месяцев вмешательства; RR (95 % ДИ) – грубый относительный риск, не скорректированный для искажений; RR * (95 % ДИ) – скорректированный относительный риск после контроля искажений; p -значение (по χ²-тесту) – сравнение изменений пропорций между группами.
и абсолютным снижением риска (ARR) на 18,4 % (95 % ДИ: 2,3–34,5). Уровни сывороточного ферритина и общая распространенность железодефицита также улучшились значительно ( p < 0,001). Эти результаты указывают, что вмешательство улучшило концентрации гемоглобина и ферритина и снизило распространенность анемии и железодефицита более эффективно, чем в предыдущем исследовании S.J. Jack et al. (2012), проведенном в Камбодже среди детей в возрасте 6–11 месяцев [14]. В то же время исследование A. Albelbeisi et al. (2020), проведенное в Газе, Палестина, среди детей в возрасте 6–24 месяцев, показало, что после 12 месяцев применения порошка с несколькими микроэлементами (MNP) концентрации гемоглобина снизились как в интервенционной, так и в контрольной группе [2]. Оба автора предложили, что отсутствие улучшения состояния с анемией и железодефицитом после вмешательства могло быть связано с тем, что содержание железа в добавках было ниже физиологических потребностей детей или с недостаточностью общего питания.
По сравнению с аналогичными исследованиями вмешательства, проведенными во Вьетнаме, эффективность, наблюдаемая в нашем исследовании, значительно выше. Например, в исследовании Huynh Van Dung, в котором образовательные вмешательства по питанию с продвижением использования доступных локальных продуктов, богатых микроэлементами, для детей в возрасте 6–23 месяцев, привели к увеличению концентрации гемоглобина на 6,23 ± 2,61 г/л в интервенционной группе через шесть месяцев, по сравнению с 2,94 ± 2,51 г/л в контрольной группе. Распространенность анемии в интервенционной группе снизилась на 21,05 %, в то время как контрольная группа показала снижение всего на 11,27 % [13]. В исследовании, проведенном Nguyen Van Dung на детях в возрасте 6–23 месяцев, получавших лечение от острых респираторных инфекций, добавление многокомпонентного микроэле-ментного порошка Bibomix в течение шести месяцев привело к снижению концентрации гемоглобина на 0,3 ± 13,7 г/л в интервенционной группе, с уменьшением распространенности анемии с 38,3 до 33,3 %. В то время как группа плацебо показала большее снижение концентрации гемоглобина (2,4 ± 15,3 г/л), а распространенность анемии увеличилась с 40,7 до 55,9 %12.
Наши результаты показали статистически значимое снижение уровней CRP в интервенционной группе (p < 0,05); однако между группами не было обнаружено значимой разницы после вмешательства (p > 0,05). Поскольку CRP быстро реагирует на незначительные или даже бессимп- томные инфекции [19], он может быть подвержен влиянию экологических факторов, которые выходят за рамки контроля исследования. Следовательно, внутренние колебания уровня CRP могли снизить эффект между группами, несмотря на тенденцию к улучшению в интервенционной группе, что в итоге привело к отсутствию статистически значимой разницы.
Оценка эффективности вмешательства показала, что уровни сывороточного цинка продемонстрировали наибольшее улучшение, как в плане концентрации, так и в снижении общей распространенности дефицита цинка как в интервенционной, так и в контрольной группе. Через 12 месяцев средняя концентрация цинка улучшилась в обеих группах с эффективностью лечения дефицита цинка, достигшей 31,0 % ( p < 0,05). Этот результат превосходит тот, что был получен в исследовании Huynh Van Dung, где после шести месяцев средняя концентрация сывороточного цинка в интервенционной группе увеличилась на 1,38 ± 2,3 мкмоль/л, по сравнению с увеличением на 0,66 ± 2,86 мкмоль/л в контрольной группе, что дало эффективность вмешательства 25,7 % [13]. В исследовании Nguyen Van Dung после шести месяцев вмешательства средняя концентрация сывороточного цинка в интервенционной группе увеличилась на 1,90 ± 3,17 мкмоль/л, с уменьшением дефицита цинка на 28,3 %. В то же время группа плацебо показала лишь незначительное увеличение на 0,03 ± 3,26 мкмоль/л и снижение дефицита цинка на 10,1 %12. В другом исследовании S.J. Jack, проведенном среди детей в возрасте 6–11 месяцев в Камбодже, после 12 месяцев вмешательства было зафиксировано различие в концентрации сывороточного цинка между группами на уровне 2,88 мкмоль/л ( p < 0,05) при эффективности вмешательства по снижению дефицита цинка на 5,2 % [14].
Наблюдается растущий тренд в сторону использования многокомпонентных микроэлементных добавок (MMS) для групп высокого риска, заменяя предыдущий подход, при котором добавлялись отдельные микроэлементы. MMS, когда она предоставляется в соответствии с рекомендуемыми диетическими требованиями через различные методы доставки, была выделена как практическая стратегия для решения широко распространенной проблемы дефицита микроэлементов. Это особенно актуально для маленьких детей, которые часто страдают от дефицита нескольких микроэлементов одновременно, а не только от дефицита отдельных веществ. Более того, MMS показала большую эффективность в профилактике и лечении таких состояний, как за- держка роста, анемия, железодефицит и дефицит цинка, благодаря синергетическим взаимодействиям между комбинированными микроэлементами. Эти вещества работают вместе, улучшая терапевтические результаты. Например, витамины A, B12, фолиевая кислота, витамин C и витамины группы B (B1, B2, B3) играют ключевую роль в улучшении всасывания железа, метаболизма железа и образовании красных кровяных клеток, тем самым улучшая концентрацию гемоглобина, сывороточный ферритин и сывороточные уровни цинка. Эти механизмы существенно способствуют профилактике анемии, желе-зодефицита, дефицита цинка и других заболеваний, связанных с дефицитом микроэлементов. Основываясь на методологии и результатах нашего исследования, мы представляем дополнительные доказательства в поддержку внедрения раннего вмешательства с использованием MMS, желательно начиная с 6–11 месяцев и поддерживаемого в течение 12 месяцев для достижения оптимальных пищевых и клинических результатов.
Сильные и слабые стороны исследования. Вмешательство, включающее порошок с несколькими микроэлементами (MNPs) Bibomix, содержащий 15 основных витаминов и минералов, рекомендованных ВОЗ и Национальным институтом питания, является одним из немногих исследований во Вьетнаме, которые объединяют коммуникацию по вопросам здравоохранения (GDSK) с добавками микроэлементов. Эта модель вмешательства представляет собой оптимальное решение для регионов с умеренной и высокой распространенностью дефицита микроэлементов, выполняя как профилактическую, так и поддерживающую роль в лечении анемии, железоде-фицита и дефицита цинка у маленьких детей. Порошки Bibomix имеют несколько преимуществ, включая легкость в использовании, удобство транспортировки, приятный вкус для детей, доступную стоимость и доказанную эффективность в улучшении антропометрических показателей и статуса микроэлементов. Поэтому этот подход к вмешательству имеет высокий потенциал для широкомасштабного внедрения, чтобы помочь сократить недоедание и дефицит микроэлементов в этой уязвимой возрастной группе в ближайшем будущем.
Однако остаются некоторые ограничения. В частности, в исследовании не наблюдался значительный эффект лечения железодефицита после 12 месяцев вмешательства. Также не была оценена устойчивость вмешательства после прекращения добавок, что необходимо для оценки долгосрочного воздействия сочетания порошка Bibomix с прямой коммуникацией GDSK. Кроме того, в анализе обобщенной линейной регрессии было трудно контролировать все искажающие переменные, особенно поведенческие изменения у матерей, вызванные воздействием различных методов коммуникации по вопросам здравоохранения.
Выводы. После вмешательства средние различия между двумя группами составили 4,41 г/л для концентрации гемоглобина, 2,97 мкг/л для сывороточного ферритина и 0,41 мкмоль/л для сывороточного цинка, все с p < 0,05. Эффективность вмешательства по состоянию с анемией составила 3,4 (95 % ДИ: 1,1–10,7; p = 0,039), по железо-дефициту – 12,2 (95 % ДИ: 2,2–67,8; p = 0,004), по дефициту цинка – 4,2 (95 % ДИ: 2,3–7,4; p < 0,001). Что касается эффективности терапевтической поддержки, воздействие на анемию составило 25,0 (95 % ДИ: 1,8–333,3; p = 0,015), на железодефицит – 12,5 (95 % ДИ: 0,7–250,0; p = 0,092), на дефицит цинка – 7,1 (95 % ДИ: 3,3–14,3; p < 0,001). Эти результаты демонстрируют значительное улучшение по многим показателям питания. Bibomix MNPs в дозировке 3–4 пакетика в неделю (15 пакетиков в месяц) в течение 12 месяцев и более, особенно для детей в возрасте 6–11 месяцев, проживающих в районах с аналогичными социально-экономическими и географическими условиями, как в месте проведения исследования, способствует минимизации риска нарушения ряда показателей крови и рекомендуется к применению.
Финансирование. Авторы искренне благодарят Университет технологий и образования Хошимина (HCMUTE) и Национальный институт питания Вьетнама (NIN), чьи объекты и ресурсы были необходимы для успешного завершения исследования.


