Применение ионообменного волокна на стадии доочистки сточных вод гальванического производства
Автор: Перегудов Ю.С., Тимкова А.В., Горбунова Е.М., Плотникова С.Е.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Химическая технология
Статья в выпуске: 4 (78), 2018 года.
Бесплатный доступ
В гальваническом производстве используются большие объемы воды, которая на стадиях технологического процесса загрязняется различными соединениями. Сточная вода, содержащая ионы переходных металлов представляет собой не только опасный источник загрязнения окружающей среды, но и ценные отходы. Учитывая проблемы, связанные с экологией и рациональным использованием природных ресурсов необходимо создавать мало- и безотходные производства, в частности, разрабатывать новые технологические процессы и соответствующее оборудование, внедрять водооборотные циклы. В настоящей работе приведены результаты исследования сорбции катионов меди (II) и никеля (II) ионообменным волокном ФИБАН Х-1. Проведены калориметрические исследования тепловых эффектов взаимодействия волокна ФИБАН Х-1 с растворами нитратов меди (II) и никеля (II). Показано, что мощность, тепловой эффект и время процесса зависят от природы и концентрации ионов металлов в растворе. На основе экспериментальных данных рассчитана энтальпия процесса...
Энтальпия, хемосорбционное волокно, калориметрический метод, сорбция, сточные воды, ионы меди (ii) и никеля (ii)
Короткий адрес: https://sciup.org/140244285
IDR: 140244285 | DOI: 10.20914/2310-1202-2018-4-330-336
Текст научной статьи Применение ионообменного волокна на стадии доочистки сточных вод гальванического производства
Гальваническое производство является опасным источником загрязнения окружающей среды. В процессе нанесения гальванических покрытий огромное количество воды расходуется на приготовление электролитов, технологических растворов, а также на меж- и послеоперационную промывку деталей. При этом образуются сточные воды, загрязненные ионами тяжелых металлов – меди, никеля, хрома, железа и т. д.
В настоящее время для очистки сточных вод гальванического производства используются: ─ механические методы очистки (отстаивание, фильтрование);
─ химические методы очистки (нейтрализация, химическое осаждение, окисление);
─ физико-химические методы очистки (коагуляция, флокуляция, мембранные методы очистки, ионный обмен, сорбция).
Суть очистки сточных вод гальванического производства от тяжелых металлов заключается в переводе растворенных ионов металлов в нерастворенные химические соединения с последующим отделением и обезвоживанием твердой фазы. Как правило, все имеющиеся виды растворов поступают в усреднитель, нейтрализуются и сбрасываются в канализацию [1].
Часто для очистки сточных вод гальванического производства используют процесс, состоящий из следующих ступеней: нейтрализация – выравнивание определенного значения уровня рН с помощью NаОН, Ca(OH) 2 для химического осаждения металлов; флокуляция – добавление органических флокулянтов для образования макрофлокул; осаждение – для отделения твердой фазы с последующим обезвоживанием шлама; заключительная доочистка – фильтрация, сорбция или ионный обмен. Для этих целей могут использоваться зернистые и волокнистые ионообменные материалы.
В связи с этим представляет интерес изучение сорбции ионов переходных металлов на хемосорбционных волокнах. Безотходная технология – это идеальная модель производства, которая в большинстве случаев в настоящее время реализуется не в полной мере, а лишь частично. В области гальванического производства необходимо разрабатывать и применять современные и эффективные методы водоочистки, позволяющие переходить к замкнутым процессам рециркуляции воды и извлечению металлов из сточных вод. Внедрение бессточных систем водоснабжения и реконструкция действующего производства способствует резкому сокращению расходов воды и уменьшению объема сточных вод.
Материалы и методы
Объектом исследования являлось хемо-сорбционное волокно ФИБАН Х-1 в Na-форме. Волокно данной марки разработано Институтом физико-органической химии Академии Наук Беларуси на основе полиакрилонитрильного волокна (таблица 1) [2]. Подготовку волокнистого ионообменника проводили по стандартным методикам [3].
Таблица 1.
Характеристика волокна ФИБАН Х-1
Table 1.
Characteristics of fiber FIBAN X–I
|
Функциональные группы Functional group |
СОЕ, ммоль/г |
Набухание в Н+–форме, г Н 2 О/г ионита Swelling in H+ form, g H 2 O/g of the ion exchanger |
|
|
–N(СН 2 COOH) 2 – COOH |
3,76 |
0,60 |
0,60 |
|
Рабочий интервал рН | pH range |
Рабочий интервал температур | Operating temperature range |
||
|
5–12 |
0–80 °C |
||
Ионообменный материал ФИБАН Х-1 устойчив к воздействию концентрированных кислот и органических растворителей, характеризуется умеренным набуханием в воде и водных растворах. При переходе из водородной формы в натриевую набухание и емкость волокна увеличиваются. В определенных случаях возможна регенерация и повторное использование материала [4].
Сорбционную емкость волокна ФИБАН Х-1 по ионам меди и никеля определяли в статических условиях с применением магнитной мешалки для перемешивания раствора. Для этого навеску волокна 0,2 г заливали 50 см3 раствора нитрата соответствующего металла с начальными концентрациями 2, 4, 6, 8, 10 ммоль/дм3 и выдерживали до установления равновесия. Затем раствор отфильтровывали и определяли равновесную концентрацию катионов металлов.
Способность меди к комплексообразованию позволяет количественно определять содержание ионов меди в растворе различными фотометрическими методами [5]. Сущность используемой методики [6] заключается в измерении оптической плотности окрашенного раствора аммиаката меди, полученного в ходе реакции:
Cu2+ + 4NH 4 OH ⇄ [Cu(NH 3 ) 4 ]2+ + 4H 2 O
Измерение оптической плотности растворов проводили на колориметре фотоэлектрическом концентрационном КФК-2МП при длине волны 590 нм в 10 мм кювете.
Содержание ионов Ni2+ в растворе определяли методом комплексонометрического титрования. Для этого в колбу для титрования вносили 5 см3 пробы, 1 см3 раствора аммиака с массовой долей 25% и столько мурексида, чтобы раствор окрасился в интенсивно желтый цвет. Титровали раствором ЭДТА до перехода желтого окрашивания в фиолетовое [7].
Сорбционную емкость ( А , ммоль/г) в условиях установившегося в системе равновесия определяли по формуле
А= ( C - C p ) V
m где C, Ср – исходная и равновесная концентрация ионов исследуемых металлов в растворе соответственно, ммоль/ дм3; V – объем раствора, дм3; m – масса сорбента, г.
Полученные данные по сорбции ионов меди и никеля из растворов с разными концентрациями использовали для построения изотерм сорбции.
Калориметрические исследования процессов взаимодействия волокна с растворами солей исследуемых металлов проводились на микрокалориметре МИД-200 при 298 K. Для эксперимента использовали растворы нитратов меди (II) и никеля (II) с концентрацией от 0,001 до 0,01 моль/дм3.
Методика эксперимента заключалась в следующем. В калориметрический стакан помещали 50 см3 раствора соли, а в лодочку, плавающую на поверхности, 0,2 г волокна. После термостатирования в течение 24 ч волокно и раствор соли смешивали и регистрировали тепловые эффекты их взаимодействия. Погрешность калориметрических измерений не превышала 2% [8].
Результаты и обсуждение
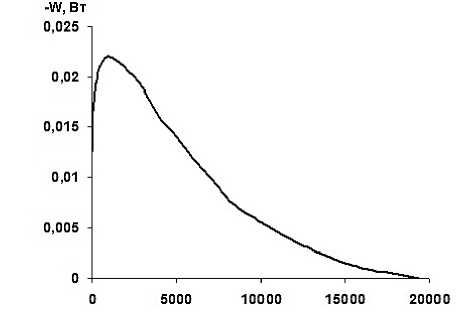
По результатам калориметрических измерений получены термокинетические кривые. Данные кривые представляют собой энергию процесса как функцию от времени W = f ( τ ). На термокинетических кривых имеется один ярко выраженный максимум.
На рисунке 1 представлена термокинетическая кривая на примере взаимодействия волокна ФИБАН Х-1 с раствором нитрата никеля (II). Все термокинетические кривые близки по форме, но различаются по высоте пика и длительности.
При всех исследуемых концентрациях растворов Cu(NO 3 ) 2 и Ni(NO 3 ) 2 процесс сопровождается поглощением тепла. С повышением концентрации возрастает термоэффект и время установления равновесия. В момент достижения наибольшего значения эндоэффекта, в реакцию с ионами вступает максимальное число функциональных групп. Из термокинетических кривых были рассчитаны энтальпии взаимодействия (∆Н) волокна с катионами металлов (рисунок 2) . Для солевых растворов с концентрацией
0,01 - 0,03 моль/дм3 величины ∆ Н для ионов Cu2+ и Ni2+ близки по значениям. С концентрацией 0,04 моль/дм3 наблюдается превышение энтальпии взаимодействия Ni2+ с волокном по сравнению с Cu2+.
Время, с
Рисунок 1. Термокинетическая кривая на примере взаимодействия волокна ФИБАН Х-1 с раствором нитрата никеля (II)
Figure1. Thermokinetic curve on the example of the interaction of fiber FIBAN X–I with a solution Nickel (II) nitrate
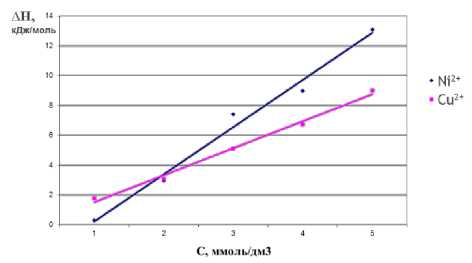
Рисунок 2. Энтальпия взаимодействия волокна ФИБАН Х-1 с растворами нитратов меди (II) и никеля (II)
Figure2. Enthalpies of the interaction fiber FIBAN X–I with solutions of copper nitrate (II) and nickel (II)
Процесс сорбции ионов металлов волокном ФИБАН Х-1 во многом зависит от природы насыщающих волокно ионов. Некоторые характеристики исследованных ионов представлены в таблице 2 [9].
Таблица 2.
Ионный радиус r (по Гольдшмидту), электронное строение иона, энтальпия и энтропия гидратации, изменение энтропии воды при гидратации ионов
Table 2.
Ionic radius r (according to Goldschmidt), electronic structure of the ion, enthalpy and entropy of hydration, change in the entropy of water during the hydration of ions
|
Ион Ion |
Строение Structure |
г, нм |
-ΔН гидр , кДж/моль |
-ΔS гидр , Дж/(моль К) |
-ΔS II , Дж/(моль К) |
|
Сu2+ |
…3d9 |
0,079 |
2975,7 |
433,5 |
205,0 |
|
Ni2+ |
…3d8 |
0,078 |
2964,8 |
443,5 |
225,1 |
Процесс взаимодействия волокна с ионами металлов складывается из параллельно идущих стадий, каждая из которых вносит определенный вклад в энтальпию процесса в целом. Необходимо учитывать следующие основные вклады [10]:
AH = AHсорб + AHди +
+AHдф+AHн2о + AHдеф, где ∆Нсорб – сорбция ионов волокном; ∆Нд.и. – дегидратация ионов; ∆Нд ф. – дегидратация функциональных групп волокна; ∆НH2O – изменение структуры воды, связанное с природой иона; ∆Ндеф – деформация полимерных цепей волокна для образования сорбционных центров
Исходя из полученных данных, можно предположить, что экзотермический эффект образования связей между волокном и указанными ионами перекрывается энергетическими затратами, связанными с дегидратационными эффектами и изменением конформаций полимерных цепей
На рисунке 3 представлены изотермы сорбции ионов меди и никеля Nа-формой ионообменного волокна ФИБАН Х-1.
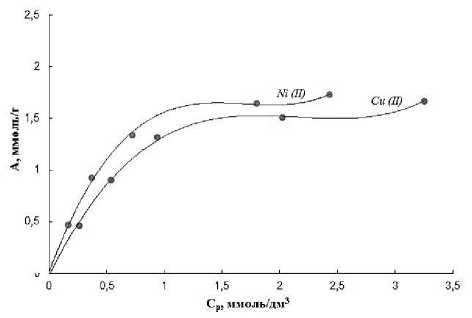
Рисунок 3 Изотермы сорбции ионов Ni2+ и Cu2+ хемосорбционным волокном ФИБАН Х-1
Figure 3. Sorption isotherms of Ni2+ and Cu2+ ions with chemisorption fiber FIBAN X–I
Как видно из рисунка 3, повышение концентрации металлов в растворе приводит к увеличению сорбционной емкости волокна Также стоит отметить, что при всех исследуемых концентрациях ионы Ni2+ в данных условиях поглощаются ионообменным волокном лучше, чем катионы Cu2+.
Для обработки полученных изотерм были применены модели Ленгмюра и Фрейндлиха. Изотермы сорбции в линейной форме показаны на рисунках 4 и 5.
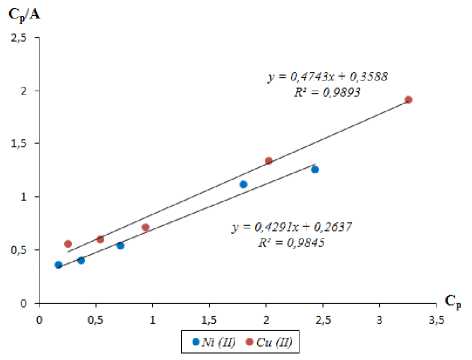
Рисунок 4 Изотермы сорбции ионов меди (II) и никеля (II) в линейной форме по Ленгмюру
Figure 4. Sorption isotherms of copper (II) and nickel (II) ions in linear form according to Langmuir
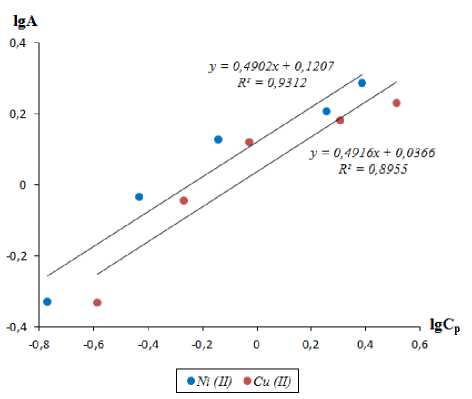
Рисунок 5 Изотермы сорбции ионов меди (II) и никеля (II) в линейной форме по Фрейндлиху Figure5. Sorption isotherms of copper (II) and nickel (II) ions in Freundlich linear form
Параметры обработки изотермы сорбции по модели Ленгмюра и Фрейндлиха приведены в таблице 3.
Таблица 3.
Характеристики сорбции ионов меди и никеля
Table 3.
Sorption characteristics copper and nickel ions
|
Катион металла Metal cation |
Параметры модели Ленгмюра Langmuir model parameters |
Параметры модели Фрейндлиха Freundlich model Parameters |
||||
|
А ∞ , ммоль/г |
К, дм3/ммоль |
R2 |
k |
1/n |
R2 |
|
|
Cu2+ |
2,108 |
1,322 |
0,9893 |
1,0879 |
0,4916 |
0,8955 |
|
Ni2+ |
2,330 |
1,627 |
0,9845 |
1,3204 |
0,4902 |
0,9312 |
Как видно из таблицы 3, уравнение Ленгмюра описывает сорбционную изотерму лучше, чем уравнение Фрейндлиха. Из этого следует, что все сорбированные частицы взаимодействуют только с центрами сорбции и не взаимодействуют друг с другом, при этом на поверхности сорбента образуется мономолеку-лярный сорбционный слой. Константы сорбции ионов меди (II) и никеля (II) больше 1, следовательно, величина энергии Гиббса будет больше нуля. Это свидетельствует о самопроизвольности протекания процесса. Величина предельной сорбции А ∞ катионов меди (II) и никеля (II) составила 2,108 и 2,330 ммоль/г соответственно. Результаты проведенных исследований и расчетов показывают, что ионообменное волокно может быть использовано для стадии доочистки сточных вод гальванического производства с концентрацией ионов Cu2+ и Ni2+ от 0,001 до 0,01 моль/дм3. Нами предложена следующая технологическая схема очистки гальванических сточных вод с применением ионообменного волокна ФИБАН Х-1 (рисунок 6) .
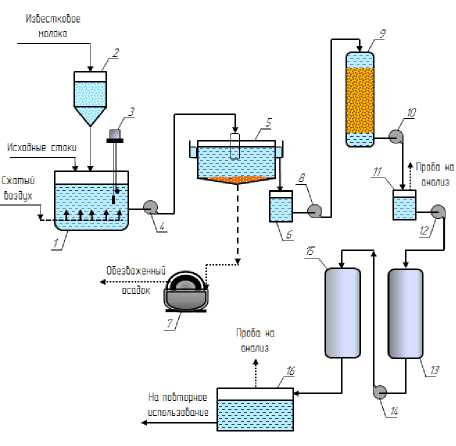
Рисунок 6. Технологическая схема очистки медь-и никельсодержащих сточных вод: 1 – реактор; 2 – дозатор щелочного агента; 3 – датчик pH-метра; 4, 8, 10, 12, 14 – насосы; 5 – отстойник; 6 – приемная емкость; 7 – узел обезвоживания осадка; 9 – механический фильтр; 11 – сборник осветленных стоков; 13, 15 – ионообменные фильтры; 16 – сборник очищенной воды
Figure 6. Technological scheme of cleaning copper and nickel-containing wastewater: 1 – reactor; 2 – dispenser alkali agent; 3 – pH meter; 4, 8, 10, 12, 14 – pumps; 5 – sump; 6 – receiving capacity; 7 – sludge dewatering unit; 9 – mechanical filter; 11 – collection of clarified effluents; 13, 15 – ion exchange filters; 16 – collection of purified water
В состав предлагаемой технологической схемы очистки стоков входят узлы:
─ реагентной обработки;
─ тонкослойного отстаивания стоков;
─ обезвоживания осадка;
─ глубокого осветления на механических фильтрах:
─ доочистки сточных вод (ионообменные фильтры).
В соответствии со схемой (рисунок 6) сточные воды из промывных ванн поступают в реактор 1, туда же дозирующим устройством 2 подается щелочной реагент. Наиболее дешевым и доступным реагентом является гидроксид кальция, который применяют в виде 5%-ого раствора известкового молока. При достижении pH = 9–10 происходит осаждение ионов Cu2+ и Ni2+ в виде малорастворимых осадков основных карбонатов по реакциям [2]:
2Ni2+ + CO2- + 2OH- ^ (NiOH)2 CO Ф 2Cu2+ + CO32— + 2OH- ^ (CuOH)2 CO3 Ф
Значение рН контролируют с помощью погружного датчика 3. Время контакта сточных вод с реагентом в камере реакции не менее 30 мин.
Для выделения из сточных вод нерастворимых соединений водную суспензию направляют в отстойник 5, в котором она выдерживается в течение 2 ч. Осветленная вода из отстойника накапливается в приемной емкости 6, а образовавшийся осадок поступает на узел обезвоживания 7 и затем на утилизацию.
Для более глубокого осветления сточные воды насосом подаются на механический фильтр 9, где происходит их доочистка от остаточного количества взвесей. Образовавшийся фильтрат поступает в сборник осветленных стоков 11.
Для обеспечения глубокой очистки воды и обессоливания до требований ГОСТ 9.317–90 предложено использовать фильтры тонкой очистки (13, 15), заполненные хелатным сорбентом ФИБАН Х-1.
Предлагаемый ионообменный материал работает в области малых концентраций ионов токсичных металлов и позволяет обеспечить замкнутый водооборот с использованием воды повторно в производственном цикле.
Для достижения наиболее высокой степени очистки стоки пропускают последовательно через два ионообменных фильтра с загрузкой из волокнистого хемосорбента. Остаточная концентрация Cu2+ и Ni2+ составляет около 0,1 мг/л, что соответствует требованиям ГОСТ 9.317–90. Очищенная вода может использоваться повторно для приготовления электролитов, обезжиривающих и травильных растворов и промывку деталей, а также на охлаждение ванн и выпрямителей тока.
По сравнению с зернистыми ионитами волокнистые ионообменные материалы обладают высокой скоростью ионообменных и сорбционных процессов. Фильтрующие слои волокна ФИБАН Х-1 обеспечивают в процессах очистки сточных вод высокие скорости потоков, на порядок превышающие аналогичные зернистые иониты, одновременно обладая более высокой сорбционной активностью по ионам переходных металлов. Сопротивление фильтрующего слоя ФИБАН Х-1 зависит от плотности его упаковки, которая задается текстильной формой или дополнительным принудительным уплотнением. Для процессов очистки воды оптимальной является плотность слоя 0,16–0,20 кг/дм3, а толщина слоя 3–6 см [2].
Наиболее совершенные конструкции фильтров с загрузкой из волокнистых материалов
Список литературы Применение ионообменного волокна на стадии доочистки сточных вод гальванического производства
- Жданова А.В., Илларионов С.А. Очистка сточных вод гальванического производства от загрязнений тяжелыми металлами//Вестник Пермского университета. Серия: Химия. 2012. № 1. С. 54-60.
- Институт физико-органической химии Национальной академии наук Беларуси. ФИБАН-1. URL: http://ifoch.by/research/fiban/X1_1.html
- Полянский Н.Г., Горбунов Г.В., Полянская Н.Я. Методы исследования ионитов. М.: Химия, 1976. 280 с.
- Солдатов В.С., Зеленковский В.М., Сосинович З.И., Мосунова Н.В. и др. Селективное выделение меди и цинка из модельных растворов шахтных вод волокнистыми ионитами//Известия Национальной академии наук Беларуси. Серия химических наук. 2011. № 2. С. 41-45.
- Кулиев К.А., Плотникова С.Е., Горбунова Е.М., Таранова А.Н. Смешаннолигандные комплексы мeди (II) с дитиолфенолами и гетероциклическими диаминами//Вестник ВГУИТ. 2017. № 1. С. 248-256.
- Дехтярь Т.Ф., Бочарова Е.С. Определение меди фотометрическим методом//Молодежный научный вестник. 2017. № 1 (13). С. 81-86.
- Булатов А.В., Зеймаль А.Е., Николаева Д.Н., Никоноров В.В. и др. Методические указания к практикуму «Химические методы анализа»: учебное пособие. СПб.: ВВМ, 2010. 54 с.
- Астапов А.В., Перегудов Ю.С., Копылова В.Д. Попова К.А. Энтальпии взаимодействия сильноосновных анионитов с ионами аминокислот//Журнал физической химии. 2009. Т. 83. № 6. С. 1016-1020.
- Крестов Г.А. Термодинамика ионных процессов в растворах. Л.: Химия, 1984. 272 с.
- Астапов А.В., Перегудов Ю.С., Нифталиев С.И. Сорбция катионов никеля (II) хелатным волокнистым сорбентом ФИБАН Х1//Журнал физической химии. 2017. № 8. С. 1397-1402.
- Петров Ю.П., Котюков А.Б. Совершенствование конструкции фильтров с загрузкой из углеродных волокнистых сорбентов (УВС), активированной углеродной ткани (АУТ) и волокнистого ионообменного материала ВИОН//Вестник Пермского университета. Геология. 2013. № 2 (19). С. 94-101.


