Применение криосохраненных гомографтов в клапанной хирургии - опыт одной клиники
Автор: Комаров Р.Н., Царегородцев А.В., Ткачв М.И., Васалатий И.М., Олейник И.В., Панченко М.О., Клюзина А.Г., Нуриджанян А.В., Калинина Ю.А., Лайпанов М.А., Тебиева Д.К.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.39, 2024 года.
Бесплатный доступ
Введение. Хирургическое лечение инфекционного (ИЭ) и протезного эндокардита с использованием гомографтов дает хорошие результаты. Имплантация аортальных гомографтов (АГ) является распространенной методикой, в то время как замена трехстворчатого и митрального (МК) клапанов на митральный гомографт (МГ) встречается крайне редко. Множественные клапанные пороки при ИЭ представляют собой хирургическую проблему, поскольку такие пациенты обычно находятся в тяжелом состоянии, а результаты хирургического лечения часто неудовлетворительны. В данной статье мы описываем опыт успешного хирургического лечения пациентов, которым выполнялась имплантация криосохраненных гомографтов (КГ).Цель: изучить среднеотдаленные результаты имплантации КГ, свободу от реоперации, отдаленную выживаемость, а также продемонстрировать новые технические аспекты имплантации гомографтов.Материал и методы. Представлен ретроспективный анализ 24 пациентов, оперированных в нашей клинике (УКБ № 1 Сеченовского Университета) в период с 2015 по 2021 гг. АГ в ортотопическую позицию имплантировался 6 пациентам с активным ИЭ. Легочный гомографт (ЛГ) имплантировался 13 пациентам: в ортотопическую позицию (n = 10) и в гетеротопическую (в корень аорты (КА)) (n = 3). МГ имплантировался 4 пациентам, причем лишь одному из них в ортотопическую позицию, тогда как 3 пациентам - в позицию трикуспидального клапана (ТК). У 1 пациента с ИЭ аортального клапана (АК) и МК, распространенным на митрально-аортальный контакт, протребовалось использование аорто-митрального моноблока.Результаты. В среднеотдаленном периоде нам были доступны данные всех выживших пациентов. Средний градиент на АК после имплантации АГ и ЛГ в позицию корня аорты (КА) составил 4,6 ± 1,96 мм рт. ст., значимая регургитация отсутствовала у всех пациентов, случаев реопераций не отмечено. После ортотопической имплантации ЛГ средний градиент составил 3,2 ± 1,4 мм рт. ст., значимая регургитация отсутствовала во всех случаях. После имплантации МГ в позицию ТК, по данным эхокардиографии (ЭхоКГ), у всех пациентов имелась 0-1 ст. регургитации на протезе, средний градиент давления составил 2,5 ± 0,6 мм рт. ст. МГ в ортопическую позицию имплантировался в одном случае - женщине 52 лет с болезнью Бехтерева, средний градиент на МК составил 4 мм рт ст., регургитация 0-1 ст.Заключение. Клапанные гомографты могут иметь более расширенные показания, чем ИЭ. Такие методы, как имплантация МГ в трикуспидальную или ортотопическую позицию, а также использование комбинированных гомографтов, демонстрируют многообещающие результаты, однако требуют дальнейшего набора клинического материала и оценки отдаленного периода
Криосохраненные гомографты, митральный гомографт, аортальный гомографт, легочный гомографт
Короткий адрес: https://sciup.org/149145659
IDR: 149145659 | УДК: 616.126.3-089.844:57.086.13 | DOI: 10.29001/2073-8552-2024-39-2-78-85
Текст научной статьи Применение криосохраненных гомографтов в клапанной хирургии - опыт одной клиники
Современные литературные данные указывают на криосохраненные гомографты (КГ) как на имплантаты, демонстрирующие естественную биосовместимость, хороший гемодинамический профиль, низкий риск тромбоэмболических осложнений и устойчивость к инфекциям [1, 2]. Однако со временем выявились некоторые недостатки использования КГ, такие как ограниченная доступность и склонность к структурной деградации [3–5]. Тем не менее, КГ по-прежнему являются бесценным вариантом лечения для некоторых когорт пациентов. У лиц со сложными врожденными пороками сердца КГ считаются кондуитами первого выбора для реконструкции выводного отдела правого желудочка (ВОПЖ). Они также представляют собой важную часть хирургической стратегии лечения инфекционного эндокардита (ИЭ), особенно в случае протезного эндокардита. Следует отметить, что данные, касающиеся использования гомографтов в различных анатомических зонах, представлены в литературе в разной степени. Так, если результаты имплантации аортальных (АГ) и легочных гомографтов (ЛГ) в ортотопической позиции отражены во многих публикациях, то опыт использования митральных и аорто-митральных КГ представлен в единичных работах.
В данной статье мы демонстрируем 6-летний опыт одного центра по имплантации КГ в различных анатомических зонах сердца.
Материал и методы
Представлен ретроспективный анализ 24 пациентов, оперированных в нашей клинике в период с 2015 по 2021 гг. (табл. 1).
Таблица 1. Общая характеристика исследуемой популяции
Table 1 . General characteristics of the study population
|
Вид гомографта |
n |
Зона имплантации |
Показания |
Средний возраст пациентов, M ± SD, лет |
Гендерное распределение м/ж, n |
III–IV ФК по NYHA, n |
Повторная операция, n |
|
Аортальный |
6 |
Ортотопическая |
ИЭ нативного клапана, n = 4 ИЭ протезный, n = 2 |
46,8 ± 20,1 |
6/0 |
4 |
2 |
|
Легочный |
13 |
Ортотопическая, n = 10 Гетеротопическая (КА), n = 3 |
ИЭ АК, n = 1 Дисфункция биопротеза АК, n = 1 Аневризма КА, n = 1 Операция Росса – ВОПЖ, n = 6 Стеноз ЛА после операции Росса, n = 2 Опухоль ЛА, n = 1 ИЭ ЛК, n = 1 |
48 ± 11,2 |
9/2 |
6 |
4 |
|
Аортомитральный комплекс |
1 |
Ортотопическая |
ИЭ МК и АК |
23 |
– |
1 |
– |
|
Митральный |
4 |
Ортотопическая, n = 1 Гетеротопическая (ТК), n = 3 |
МН 3-й ст., n = 1 Тромбоз механического протеза ТК, n = 1 НТК 3-й ст. на фоне опухолевого тромбоза, n = 1 НТК 3-й ст. после РКТФ |
41,75 ± 16,8 |
1/3 |
4 |
2 |
Примечание: АК – аортальный клапан, ВОПЖ – выводной отдел правого желудочка, ИЭ –инфекционный эндокардит, КА – корень аорты, ЛА – легочная артерия, ЛК – легочный клапан, ТК – трикуспидальный клапан, МК – митральный клапан, МН – митральная недостаточность, НТК- недостаточность трикуспидального клапана, РКТФ – радикальная коррекция тетрады Фалло.
АГ в ортотопическую позицию имплантировался 6 пациентам с активным ИЭ. У всех этих пациентов имелся абсцесс корня аорты (КА), у 1 пациента также диагностирована фистула между выводным отделом левого желудочка (ВОЛЖ) и правым предсердием, у 2 пациентов – поражение центрального фиброзного тела. По данным трансторакальной эхокардиографии (ЭхоКГ), у всех 6 пациентов выявлялась значимая аортальная регургитация от 2-й до 4-й ст.
ЛГ имплантировался 13 пациентам: в ортотопическую позицию ( n = 10) и в гетеротопическую (в КА) ( n = 3). Показания для использования ЛГ были многогранны (см. табл. 1). Следует отметить, что у больных, перенесших имплантацию ЛГ в КА ( n = 3), применялся комбинированный легочно-аортальный гомографт (легочный аллокла-пан с синусами и участок аллогенной аорты, фиксированный к синотубулярному соединению). У 8 пациентов ЛГ использовался в качестве протеза ВОПЖ для операции Росса, причем в 6 случаях первично, а в 2 – повторно (стенозирование ВОПЖ после ранее выполненной операции Росса).
Митральный гомографт (МГ) имплантировался 4 пациентам, причем лишь 1 из них в ортотопическую позицию, тогда как 3 пациентам – в позицию трикуспидального клапана (ТК) (см. табл. 1).
У 1 пациента с ИЭ аортального (АК) и митрального (МК) клапанов, распространенным на митрально-аортальный контакт, протребовалось использование аорто-митрального моноблока.
Хирургическая техника
При имплантации АГ использовалась ортотопическая техника по типу «свободного корня». После пересечения аорты и глубокой мобилизации КА выполнялось иссечение пораженного АК (протеза клапана), синусов Вальсальвы, устья коронарных артерий высекались на площадках. При наличии абсцесса проводилась его ревизия, санация раствором антисептиков. Далее в аортальную позицию имплантировался гомографт. Размер гомографта подбирался на 1–2 номера меньше диаметра фиброзного кольца АК. Использовалось 3 комиссуральных направляющих швов-держалок. Гомографт вворачивался в полость левого желудочка, после чего сопоставление тканей гомографта и фиброзного кольца реципиента не составляло труда (рис. 1A–B).
Аорто-митральный комплекс имплантирован путем удаления части крыши левого предсердия, митрально-аортального контакта, МК и всего КА. Сначала выполнена имплантация митральной части гомографта с применением двух направляющих швов-держалок на 3-м и 9-м условных часах циферблата. Папиллярные мышцы имплантированы бок-в-бок к собственным папиллярным мышцам 4 швами на прокладках. Выполнена аннуло-пластика МК мягким опорным полукольцом. Аортальная часть гомографта имплантировалась описанным выше способом, но для того, чтобы замкнуть фиброзное кольцо АК, рассеченное со стороны некоронарного синуса, накладывался 1 шов (рис. 1С).
Еще 1 пациенту имплантирован АГ с передней створкой МК для реконструкции верхней и средней трети нативной створки, а также митрально-аортального контакта (рис. 1D).
Имплантация МГ в позицию ТК подробно описана в нашей предыдущей публикации [6].
ЛГ в ортотопическую позицию имплантируются доступом через срединную стернотомию. Важно выпол- нить полноценную мобилизацию ствола легочной артерии (ЛА) с дистальным отсечением до бифуркации. Ствол ЛА деликатно отсекают от правого желудочка с частичным захватом мышечной ткани ВОПЖ под визуальным контролем ствола левой коронарной артерии и первой септальной ветви передней межжелудочковой артерии. ЛГ мы фиксируем непрерывными обвивными швами нитью пролен 5–17, причем следует избегать излишней тракции нити ввиду высокого риска разрыва тканей. У пациентов с ИЭ и саркомами ЛА резекция ЛА должна затрагивать максимально возможную часть инфундибулярного отдела правого желудочка, однако эта манипуляция требует осторожности ввиду близкого расположения ствола левой коронарной артерии и первой септальной ветви. Кроме того, для обеспечения комфортной и полноценной резекции бифуркации и ветвей ЛА мы предлагаем использовать прием по рассечению восходящей аорты и верхней полой вены.
МГ имплантируется с использованием двух направляющих швов-держалок. Головки папиллярных мышц гомографта фиксируют бок-в-бок к папиллярным мышцам реципиента четырьмя п-образными швами на прокладках. Обязательна аннулопластика МК.
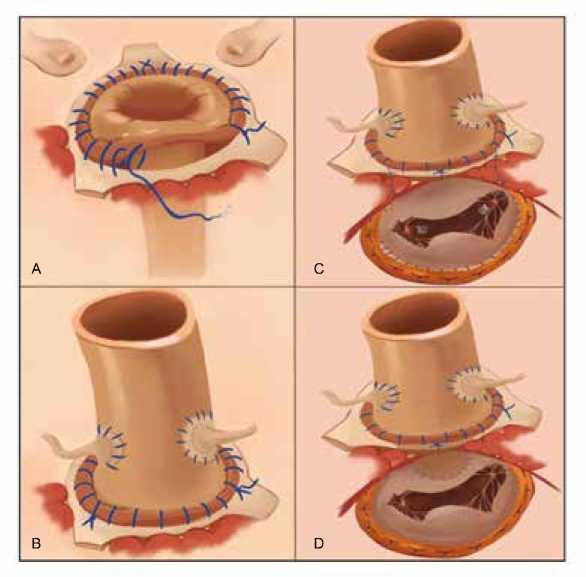
Рис. 1. Различные техники протезирования аортального клапана криосохраненными гомографтами
Fig. 1. Different techniques for aortic valve replacement with cryopreserved homografts
Результаты
Результаты имплантации АГ ( n = 6) и ЛГ в аортальную позицию ( n = 3) представлены в таблице 2.
В когорте АГ в стационаре умер 1 пациент, причиной смерти послужил сепсис на фоне тяжелого доопераци-онного ИЭ. У 3 пациентов имелось умеренное скопление жидкости в полости перикарда, потребовавшее консервативной терапии, а у 1 пациента была транзи-торная умеренная сердечная недостаточность. В среднеотдаленном периоде нам были доступны данные всех выживших пациентов. Средний градиент на АК составил 4,6 ± 1,96 мм рт. ст., значимая регургитация отсутствовала у всех пациентов, случаев реопераций не отмечено.
Результаты имплантации ЛГ в ортотопическую позицию ( n = 10) представлены в таблице 3.
Таблица 2. Результаты имплантации аортальных и легочных гомографтов в позицию корня аорты ( n = 9)
Table 2. Results of implantation of aortic and pulmonary homografts in the position of aortic root ( n = 9)
|
Параметры |
Результаты |
|
Длительность ИК, M ± SD , мин |
160 ± 38 |
|
Длительность пережатия аорты, M ± SD , мин |
129 ± 36 |
|
Пребывание в отделении реанимации и интенсивной терапии, сут, Me ( Q 25%; Q 75%) |
1,2 (0,8; 5) |
|
Пребывание в стационаре, сут, Me ( Q 25%; Q 75%) |
8,3 (6; 14) |
|
Острая сердечная недостаточность, n |
2 |
|
Другие осложнения, n |
3 |
|
I-II ФК по NYHA при выписке, n |
4 |
|
Смерть в стационаре, n |
1 |
|
Срок наблюдения, мес., Me ( Q 25%; Q 75%) |
23 (5; 63) |
Таблица 3. Результаты имплантации легочного гомографта в ортотопическую позицию ( n = 10)
Table 3. Results of pulmonary homograft implantation in the orthotopic position ( n = 10)
|
Параметры |
Результаты |
|
Длительность ИК, M ± SD , мин |
120 ± 44 |
|
Длительность пережатия аорты, M ± SD , мин |
90 ± 31 |
|
Пребывание в отделении реанимации и интенсивной терапии, сут, Me ( Q 25%; Q 75%) |
0,7 (0,5; 7) |
|
Пребывание в стационаре, сут, Me ( Q 25%; Q 75%) |
10,1 (8; 19) |
|
О страя сердечная недостаточность, n |
1 |
|
Другие осложнения, n |
1 |
|
I-II ФК по NYHA при выписке, n |
10 |
|
С мерть в стационаре, n |
0 |
|
Срок наблюдения, мес., Me ( Q 25%; Q 75%) |
28 (12; 55) |
В раннем послеоперационном периоде летальных исходов не отмечено. У пациентки с интимальной саркомой наблюдалась манифестация острой сердечной недостаточности, потребовавшая пролонгированного введения инотропных препаратов и нахождения в отделении реанимации и интенсивной терапии. У 1 пациента, перенесшего повторную (после операции Росса) реконструкцию ВОПЖ, отмечена атриовентрикулярная блокада 3-й ст., в связи с чем имплантирован постоянный электрокардиостимуля- тор. Нам были доступны данные всех оперированных в среднеотдаленном периоде, который составил в среднем 28 мес. Средний градиент на АК был равен 3,2 ± 1,4 мм рт. ст., значимая регургитация отсутствовала во всех случаях. У пациенток с ИЭ и интимальной саркомой в сроки наблюдения 24 и 32 мес. соответственно рецидивов не отмечено. На рисунке 2 продемонстрированы результаты магнитно-резонансной томографии пациентки через 32 мес. после имплантации ЛГ по поводу интимальной саркомы.
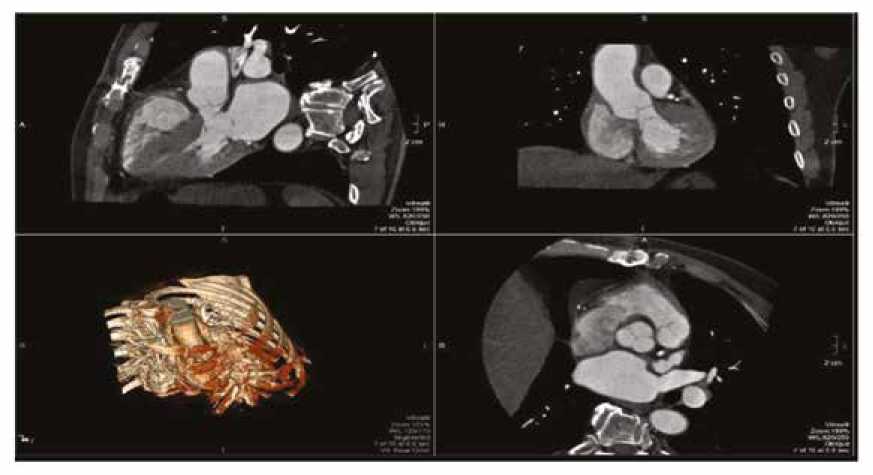
Рис. 2. Данные магнитно-резонансной томографии сердца через 32 мес. после имплантации легочного гомографта по поводу интимальной саркомы Fig. 2. Cardiac MRI data in 32 months after pulmonary homograft implantation for intimal sarcoma
У пациентов, перенесших имплантацию МГ в позицию ТК ( n = 3), длительность ИК составила 115 ± 42 мин, пережатия аорты – 82 ± 21 мин. Все пациенты выжили, причем у 2 из них через 13 и 25 мес. соответственно определен I ФК по NYHA. Мужчина 26 лет, перенесший имплантацию МГ в ТК позицию, на фоне реканализации дефекта межжелудочковой перегородки после ранее выполненной радикальной коррекции тетрады Фалло через 7 мес. после операции находится во II ФК по NYHA в связи с выраженной легочной артериальной гипертензией и атриовентрикулярной блокадой 3-й ст., имевшейся до операции (пациент подписал информированный отказ от имплантации электрокардиостимулятора). По данным ЭхоКГ, у всех пациентов имеется 0–1 ст. регургитации на протезе, средний градиент давления – 2,5 ± 0,6 мм рт. ст.
МГ в ортопическую позицию имплантировался в одном случае – женщине 52 лет с болезнью Бехтерева с выраженной деструкцией и регургитацией АК и МК. АК протезирован путем аутоперикардиальной неокуспиди-зации. Длительность ИК составила 182 мин, пережатия аорты – 155 мин, кровопотеря – 450 мл. Послеоперационный период характеризовался минимальным болевым синдромом в области раны и отсутствием существенных побочных явлений. Пациентка была выписана на 14-й день после операции в состоянии, соответствующем I ФК по NYHA. Средний градиент на АК составил 9 мм рт. ст., на МК – 4 мм рт. ст, регургитация 0–1 ст. При контрольном осмотре через 12 мес. у пациентки установлен I ФК по NYHA, гемодинамические параметры на клапанах – без отрицательной динамики.
Обсуждение
Представленная работа демонстрирует многогранность патологических состояний, которые являются абсолютными и относительными показаниями к имплантации КГ. Условно такие показания можно разделить на три группы: ИЭ, сложные врожденные пороки сердца и иные [1].
Современные клинические рекомендации не отдают предпочтение какому-либо виду имплантата при лечении ИЭ, однако рекомендуют индивидуальный подход для каждого отдельного пациента и клинической ситуации [7]. Тем не менее некоторые базовые исследования продемонстрировали, что КГ обладают лучшей биосовместимостью, устойчивостью к инфекциям и обеспечивают более легкую реконструкцию, особенно при наличии абсцесса КА, по сравнению с традиционными механическими и биологическими протезами [8, 9]. Следует отметить, что 2 недавних метаанализа продемонстрировали сопоставимые показатели выживаемости и отсутствия рецидивов ИЭ между КГ и механическими протезами, указав, однако, на высокий риск дисфункции в когорте гомографтов [10, 11]. В более ранних работах показано всестороннее преимущество ранней агрессивной замены АК гомографтом при активном ИЭ с перианнулярными абсцессами. Отмечено, что КГ меньшего размера является дополнительным фактором риска ранней и поздней повторной операции [12]. В нашей практике при ИЭ АК и МК мы все же отдаем предпочтение широкому иссечению не только нативного клапана, но и стенок аорты и ствола ЛА (а также подклапанных структур), так как отдельные авторы сообщают о наличии микроскопических очагов инфекции вокруг скомпрометированной зоны, защищенных фибриновой пленкой и резистентных к местным антисептикам и системным антибиотикам [13].
Следует отметить, что при имплантации ЛГ в КА ( n = 3) впервые в мире применялся комбинированный легочноаортальный гомографт (легочный аллоклапан с синусами и участок аллогенной аорты, фиксированный к синотубулярному соединению). Выбор такой комбинации гомографтов (одобрен локальным этическим комитетом клиники) основывался на прогнозируемо лучших гемодинамических исходах в сравнении с АГ, а также снижении риска дилатации ствола ЛА в аортальной позиции за счет гомографта восходящей аорты. В литературе нами не найдено сообщений, касающихся использования подобных гомографтов.
В вопросах протезирования ВОПЖ ЛГ мы придерживаемся принципов радикализации резекции в когорте больных, имеющих высокий риск рецидива. Мы считаем, что резекция ЛА в таких случаях должна затрагивать максимально возможную часть инфундибулярного отдела правого желудочка. Однако эта манипуляция требует осторожности ввиду близкого расположения ствола левой коронарной артерии и первой септальной ветви. Кроме того, для обеспечения комфортной и полноценной резекции бифуркации и ветвей ЛА мы предлагаем использовать прием по рассечению восходящей аорты и верхней полой вены. Ранее о подобном приеме сообщалось лишь в публикациях, посвященных хирургическому лечению врожденных пороков сердца в педиатрической когорте пациентов [14]. Описываемый нами подход к радикальной хирургии ЛА представляется более перспективным в отношении снижении риска рецидивов, что подтверждается современными работами [15]. В случае с пациентами с ИЭ и интимальной саркомы подобный радикальный подход обеспечил свободу от реопераций и рецидивов в течение 24 и 32 мес. соответственно.
Различными авторами предложено множество хирургических методов замены трехстворчатого клапана с использованием митральных, трехстворчатых или даже легочных гомотрансплантатов с многообещающими первоначальными результатами [16–19]. Мы продемонстрировали опыт имплантации МГ в трикуспидальную позицию у 3 пациентов с совершенно разными показаниями. Мы использовали МГ в виде блока с сохранением аннулохордальной непрерывности. Все опубликованные ранее статьи ограничены небольшими сериями случаев со спорными хирургическими техниками, которые препятствуют широкому внедрению этой методики в клиническую практику. Некоторые авторы пропагандируют сначала фиксацию сосочковых мышц, а затем кольца, в то время как другие настаивают на фиксации кольца в начале процедуры, а затем на регулировке сосочков [19, 20]. Последний метод имеет такие недостатки, как риск эрозии и разрыва хрупких папиллярных мышц во время наложения швов при фиксации кольца, что делает имплантацию рискованной.
Другой сложной проблемой является правильная ориентация гомотрансплантата в кольцевом пространстве и введение сосочков в правый желудочек, что может быть достигнуто путем имплантации в перегородку, нативные сосочковые мышцы или свободную стенку [19]. Мы предлагаем ортотопическую ориентацию МГ в трикуспидальной позиции, когда передняя створка ориентируется к передней части фиброзного кольца, а задняя – к септальной части соответственно, а далее подшить сосочковые мышцы к перегородке (входная часть) до точки, рассчитанной на столе. Принимая во внимание тот факт, что задняя часть фиброзного кольца является наиболее уязвимой в отношении расширения правого желудочка, в то время как септальная часть вряд ли дилатируется, наша методика реимплантации сосочков в перегородку кажется более разумной. Описанная методика имплантации МГ в трикуспидальную позицию позволила нам добиться хороших гемодинамических показателей на клапане в сроки до 25 мес.
В настоящее время не существует полностью удовлетворительного имплантата для замены МК. Протезирование МК приводит к изменениям геометрии левого желудочка и ухудшению его функции. Таким образом, замена МК гомотрансплантатом является привлекательной альтернативой в тех случаях, когда выполнение пластики не представлется возможным. Имплантация МГ – сложная процедура, требующая правильного воспроизведения подклапанного аппарата. Иногда такие анатомические особенности, как выраженная гипертрофия левого же- лудочка или недилатированное и нерасширенное левое предсердие, которые ухудшают видимость МК, невозможно обойти, что делает процедуру технически невозможной. Опыт имплантации митрального гомотрансплантата показал, что поражения клапанов ревматической этиологии, к которым относится болезнь Бехтерева, могут быть основным показанием к применению этого метода.
Заключение
Клапанные гомографты могут иметь более расширенные показания, чем ИЭ. Такие методы, как имплантация МГ в трикуспидальную или ортотопическую позицию, а также использование комбинированных гомографтов, демонстрируют многообещающие результаты, однако требуют дальнейшего набора клинического материала и оценки отдаленного периода.
Список литературы Применение криосохраненных гомографтов в клапанной хирургии - опыт одной клиники
- Skific M., Golemovic M., Safradin I., Duric Z., Biocina B., Golubic Cepulic B. Cryopreserved human heart valve allografts: a ten-year single centre experience. Cell Tissue Bank. 2023:24(2): 401-416. https://doi.org/10.1007/s10561-022-10043-3.
- Lisy M., Kalender G., Schenke-Layland K., Brockbank K.G., Biermann A., Stock U.A. Allograft heart valves: Current aspects and future applications. Biopreserv. Biobank. 2017; 15(2):148-157. https://doi.org/10.1089/bio.2016.0070.
- Arabkhani B., Bekkers J.A., Andrinopoulou E.-R., Roos-Hesselink J.W., Takkenberg J.J.M., Bogers A.J.J.C. Allografts in aortic position: insights from a 27-year, single-center prospective study. J. Thorac. Cardiovasc. Surg. 2016;152(6):1572-1579.e3. https://doi.org/10.1016/j.jtcvs.2016.08.013.
- Poinot N., Fils J.F., Demanet H., Dessy H., Biarent D., Wauthy P. Pulmonary valve replacement after right ventricular outflow tract reconstruction with homograft vs Contegra®: A case control comparison of mortality and morbidity. J. Cardiothorac. Surg. 2018;13(1):8. https://doi.org/10.1186/s13019-018-0698-5.
- Nappi F., Avtaar Singh S.S., Timofeeva I. Learning from controversy: Contemporary surgical management of aortic valve endocarditis. Clin. Med. Insights Cardio. 2020;14:1179546820960729. https://doi.org/10.1177/1179546820960729.
- Nuzhdin M.D., Komarov R.N., Matsuganov D.A., Nadtochiy N.B. Original technique for tricuspid valve replacement by mitral homograft: Step-bystep approach and initial results. J. Card. Surg. 2022;37(12):5195-5201. https://doi.org/10.1111/jocs.17228.
- Habib G., Lancellotti P., Antunes M.J., Bongiorni M.G., Casalta J.P., Del Zotti F. et al.; ESC Scientific Document Group. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur. Heart J. 2015;36(44):3075-3128. https://doi.org/10.1093/eurheartj/ehv319.
- Musci M., Hübler M., Amiri A., Stein J., Kosky S., Meyer R. et al. Surgical treatment for active infective prosthetic valve endocarditis: 22-year single-centre experience. Eur. J. Cardiothorac. Surg. 2010;38(5):528-538. https://doi.org/10.1016/j.ejcts.2010.03.019.
- Yankah A.C., Klose H., Petzina R., Musci M., Siniawski H., Hetzer R. Surgical management of acute aortic root endocarditis with viable homograft: 13-year experience. Eur. J. Cardiothorac. Surg. 2002;21(2):260- 267. https://doi.org/10.1016/s1010-7940(01)01084-3.
- Yanagawa B., Mazine A., Tam D.Y., Jüni P., Bhatt D.L., Spindel S. et al. Homograft versus conventional prosthesis for surgical management of aortic valve infective endocarditis: A systematic review and meta-analysis. Innovations (Phila). 2018;13(3):163-170. https://doi.org/10.1097/IMI.0000000000000510.
- Williams M.L., Brookes J.D.L., Jaya J.S., Tan E. Homograft versus valves and valved conduits for extensive aortic valve endocarditis with aortic root involvement/destruction: A systematic review and meta-analysis. Aorta (Stamford). 2022;10(2):43-51. https://doi.org/10.1055/s-0042-1743110.
- Yankah A.C., Klose H., Petzina R., Musci M., Siniawski H., Hetzer R. Surgical management of acute aortic root endocarditis with viable homograft: 13-year experience. Eur. J. Cardiothorac. Surg. 2002; 21(2):260- 267. https://doi.org/10.1016/s1010-7940(01)01084-3.
- Morris A.J., Drinković D., Pottumarthy S., MacCulloch D., Kerr A., West T. Bacteriological outcome after valve surgery for active infective endocarditis: Implications for duration of treatment after surgery. Clin. Infect. Dis. 2005;41(2): 187-194. https://doi.org/10.1086/430908.
- Ghez O., Saeed I., Serrato M., Quintero D., Kreitmann B., Fraisse A. et al. Surgical repair of pulmonary artery branches. Multimed. Man Cardiothorac. Surg. 2013;2013:mmt014. https://doi.org/10.1093/mmcts/mmt014.
- Wyler von Ballmoos M., Chan E., Reardon M. Imaging and surgical treatment of primary pulmonary artery sarcoma. Int. J. Cardiovasc. Imaging. 2019;35(8):1429-1433. https://doi.org/10.1007/s10554-018-1489-8.
- Pomar J.L., Mestres C.A. Tricuspid valve replacement using a mitral homograft: surgical technique and initial results. J. Heart Valve Dis. 1993;2:125-128. URL: https://pubmed.ncbi.nlm.nih.gov/8261148 (14.05.2024).
- Luciani G.B., de Manna N.D., Segreto A., Lanzoni L., Faggian G. Scalloped freehand pulmonary homograft for prosthetic tricuspid valve replacement. Ann. Thorac. Surg. 2021;112(1):e61-e64. https://doi.org/10.1016/j.athoracsur.2020.12.089.
- Acar C., Tolan M., Berrebi A., Gaer J., Gouezo R., Marchix T. et al. Carpentier Homograft replacement of the mitral valve. Graft selection, technique of implantation, and results in forty-three patients J. Thorac. Cardiovasc. Surgery. 1996;111(2):367-378. https://doi.org/10.1016/s0022-5223(96)70446-4.
- Shrestha B.M., Fukushima S., Vrtik M., Chong I.H., Sparks L., Jalali H. et al. Partial replacement of tricuspid valve using cryopreserved homograft. Ann. Thorac. Surg. 2010;89(4):1187-1194. https://doi.org/10.1016/j.athoracsur.2009.12.047.
- Couetil J.P., Argyriadis P.G., Shafy A., Cohen A., Berrebi A.J., Loulmet D.F. et al. Partial replacement of the tricuspid valve by mitral homografts in acute endocarditis. Ann. Thorac. Surg. 2002;73:1808-1812. https://doi.org/10.1016/s0003-4975(02)03574-9.


