Применение ксеногенного фракционированного протеомного секретома стволовых и прогениторных клеток при остром ишемическом повреждении почек в эксперименте
Автор: Кирпатовский В.И., Сивков А.В., Ефремов Г.Д., Самойлова С.И., Фролова Е.В., Аполихин О.И.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 1 т.15, 2022 года.
Бесплатный доступ
Введение. В настоящее время широко исследуются возможности клеточной терапии с использованием стволовых клеток для коррекции функциональных нарушений органов, в том числе почек. Основными механизмом действия стволовых клеток считают активацию клеточной регенерации и ингибирование апоптоза продуктами их секреции (секретомом), что заставляет изучать механизмы действия секретома стволовых клеток. Цель исследования. Изучить связь нефропротективного действия препарата, представляющего собой белково-пептидный секретом эмбриональных клеток головного мозга (СЭСК), с его влиянием на регенерацию поврежденных ишемией клеток почки и активность их апоптоза. Материал и методы. Опыты проведены на 40 беспородных крысах-самцах массой 280-320 г. Острое повреждение почки различной степени выраженности вызывали удалением правой почки и ишемией оставшейся левой почки в течение 60 минут или 90 минут (по 20 крыс в группе). В каждой из этих групп 10 крысам ежедневно подкожно вводили СЭСК в дозе 0,1 мл/кг (10 инъекций), а другим 10 крысам терапии не проводили. Через 3, 7 и 14 дней удаляли ишемизированную почку и подвергали ее гистологическому исследованию и гистохимическому определению экспрессии маркера пролиферации Ki-67 и антиапоптотического белка Bcl-2 в структурах почки. Результаты. При терапии СЭСК уже на 3-и сутки выявляли до 20% гипертрофированных почечных клубочков при отсутствии клубочков с явлением гломерулосклероза, тогда как в контрольных опытах на этом сроке гипертрофированные клубочки не выявлялись, а доля клубочков с признаками гломерулосклероза составляла 5-10%. На 7-е и 14-е сутки в обеих группах доля гипертрофированных клубочков возрастала, сравниваясь в группе с 60-минутной ишемией, но сохраняя более высокие значения в опытах с 90-минутной ишемией и терапией СЭСК по сравнению с контролем. Клубочки в состоянии гломерулосклероза достоверно реже выявлялись при терапии СЭСК, в независимости от выраженности ишемического повреждения. При этом экспрессия Bcl-2 в клетках почечных клубочков при терапии СЭСК снижалась существенно в меньшей степени, чем в контрольных опытах, подтверждая взаимосвязь ингибирования апоптоза при терапии СЭСК с торможением развития склеротических процессов. В почечных канальцах при терапии СЭСК уже на 3-и сутки выявили значительное увеличение количества эпителиальных клеток, экспрессирующих маркер пролиферации Ki-67, с последующим постепенным уменьшением их количества, тогда как в контроле увеличение количества меченых клеток происходило лишь на 7-е и 14-е сутки. При увеличении выраженности ишемического повреждения стимулирующий пролиферацию эффект СЭСК пролонгировался до 14 суток. Пролиферативный эффект терапии СЭСК сопровождался уменьшением повреждения почечных канальцев, причем процент канальцев с некротизированным эпителием с увеличением срока после начала терапии (7 и 14 дней) прогрессивно уменьшался с 3-5% до 0-1%, свидетельствуя о регенерации эпителия, тогда как в контроле их доля сохранялась на более высоком уровне. Заключение. В нефропротективном эффекте СЭСК (препарата Целлекс), как и у стволовых клеток, существенную роль играет стимуляция клеточной пролиферации и ингибирование апоптоза поврежденных клеток.
Острое повреждение почек, клеточная терапия, секретом стволовых клеток, пролиферация клеток, апоптоз
Короткий адрес: https://sciup.org/142234550
IDR: 142234550
Текст научной статьи Применение ксеногенного фракционированного протеомного секретома стволовых и прогениторных клеток при остром ишемическом повреждении почек в эксперименте
Острое повреждение почек (ОПП) с развитием острой почечной недостаточности (ОПН) является серьезным и часто жизнеугрожающим осложнением хирургических операций, тяжелых инфекционных осложнений или интоксикаций [1-3]. Повреждение почек может быть необратимым или функция органа может полностью или частично восстановиться в зависимости от интенсивности повреждающего фактораи возможности регенерации по-врежденныхклеточных структур. Основными факторами влияющими на полноту восстановления функции поврежденных почек, считается стойкое ухудшение микроциркуляции с развитием тканевой гипоксии и дисфункцией митохондрий, ведущиекак кповреждению клубочков, так и канальцевого аппарата почки, а также остановка клеточного цикла и старение эпителиальных клеток почечных канальцев с изменением фенотипов и функций резидентных клеток почек, что приводит к уменьшению регенераторного потенциала клеток и усилению их апоптоза приводящих развитию фиброза почек [3-6].
Восстановление функции почек при ОПН приобретает все большеезначение, поскольку мероприятия по профилактике или лечению ОПП ограничены [7]. По мнению S. Kumar и соавт. ключевым фактором терапии ОПП является разработка стратегии усиления эндогенных процессов восстановления поврежденных почечных структур и замедления профибротических реакций, развивающихся в результате неэффективной регенераци клеток [8]. В этом плане перспективным направлением является использование клеточных технологий с трансплантацией низкодифференцированных стволовых/прогениторных клеток (СК)
выделенных из различных источников (костногомозга, жировой ткани, пульпы зуба, пупочного канатика, амниотической жидкости), или введением продуктов их секреции. (так называемая бесклеточная терапия), основой которой является применение комплекса биоактивных продуктов секреции СК (секретомаСК – СЭСК), изготовленныхна основе кондиционированной среды культивирования СК или экстракта из эмбриональных или плодных тканей [3, 9-13]. Показано, что содержащиеся в СЭСК белки, пептиды, РНК в том числе микроРНК и липидные медиаторы возможно выделять, концентрировать, замораживать и лиофилизировать без потери их биологической активности [12, 14].
Данные литературы свидетельствуют, что такая терапия способствует уменьшению выраженности функциональных расстройств и ускорению восстановления функциональной полноценности почек после их ишемического илитоксического повреждения [3, 15-18].При этом многие авторы отмечают, что нефропротективное действие такой терапии связано как с активацией сигнальных путей, способствующих регенерации клеток, так и с ингибированием апоптоза поврежденных клеток [9, 16, 19-23].
К такому типу препаратов относится препарат Цел-лекс® (AO «Фарм-Синтез», Россия), являющийся хроматографически выделенным белково-пептидным комплексом эмбриональной ткани головногомозга свиней. В ранее проведенных исследованиях нами было показано, что терапия крыс с острой постишемической ОПНпрепаратом Целлекс уменьшает выраженность функциональных расстройств и морфологических нарушений после ишемического повреждения почки разной степени выраженности [24]. Как при умеренно выраженной, так и прирезко выраженной ОПН которая вызывалась ишемией единственной почки в течение 60 или 90 минут соответственно, терапия СЭСК способствовала сохранению величины клубочковой фильтрации и канальцевой реабсорбции натрия и кальция на нормальном или субнормальном уровне, что было особенно выражено на раннихсроках после развития ишемического повреждения (3 суток) и при более тяжелой ОПН.
Данное исследование посвящено изучению вопроса, связано ли терапевтическое действие СЭСК с его влиянием на активность регенерации поврежденных в результате ишемии клеток и их апоптоза, как основных потенциальных механизмов репаративной регенерации.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на 40 самцах белых беспородных крыс массой 280-320 г. Наркоз осуществляли внутрибрюшинным введении смеси препаратов Золетил и Ксилавет в соотношении 1:1 при расчетной дозе Золе-тила 15 мг/кг. Постишемическую ОПН разной степени выраженности вызывали удалением правой почки и пережатием сосудистой ножки левой почки на 60 минут (умеренная ОПН) или90 минут (тяжелая ОПН), как описано ранее [24]. В контрольных опытах (1-я и 2-я серии соответственно, по 10 крыс в серии) терапии не проводили, а в опытныхсериях (3-я и4-я серии соответственно по 10 крыс в серии) ежедневно вводили препарат СЭСК подкожно вдозе 0,1 мл/кг массы тела (0,1 мг/кг активного вещества) 5 дней в неделю, всего 10 инъекций.
Через 3, 7 и 14 дней удаляли ишемизированную почку и исследовали гистологически и путем проведения гистохимического анализа. Для оценки выраженности морфологических изменений изготовленные по стандартной методике срезы почки окрашивали гематоксилином и эозином. Для количественной оценки морфометрических показателей использовали программу His-toScan. Оцифрованные изображения загружали в программу с последующим количественным определением диаметра клубочков. К гипертрофированным клубочкам относили те клубочки диаметр которых превышал максимальные значения, характерные для интактной почки. В качестве маркера активности клеточной регенерации использовали выраженность экспрессии фактора Ki-67 а маркером активности процессов апоптоза служилаэкс-прессия антиапоптотического фактора Bcl-2, определяемых иммуно-гистохимически на автоматическом иммуногистостейнере Ventana Ultra. Использовали моноклональные антитела, готовые к употреблению (RTU) к Ki-67 (клон SP66, фирмы Roche) и к Bcl-2 (клон 30-9 фирмы Roche).
Статистическую обработку цифровых данных проводили с помощьюпрограмм MS Exel и Statistica 6.0. Определяли средние значения показателей в группах и ошибку средней (М±m), для определения достоверностиразличий между группами использовали критерий Стьюдента. Различия считали статистически значимыми при p <0,05.
РЕЗУЛЬТАТЫ
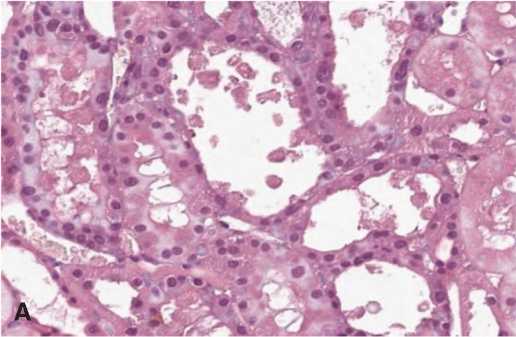
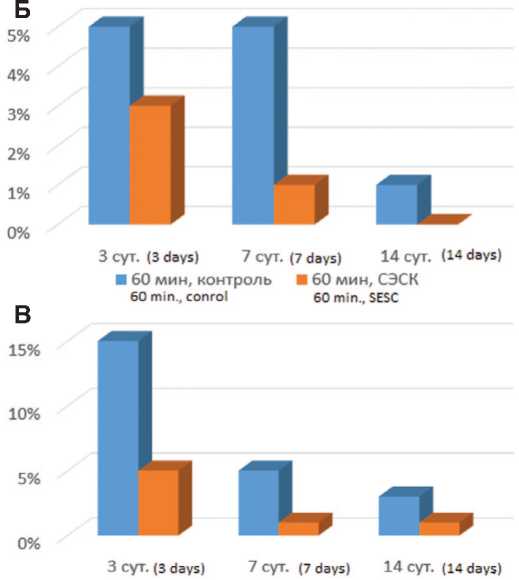
Морфометрический анализ гистологических срезов показал, что в опытах с терапией СЭСК уже на 3-и сутки после ишемического воздействия разной степени выраженности (60 или 90 минут) выявляли до 20% гипертрофированных клубочков от общего количества клубочков в препарате) (рис. 1А), тогда как в контрольных сериях при этом сроке исследования их не выявляли (рис. 1Б, В). Приувеличении срока наблюдения до 7 и 14 суток в опытах с 60-минутной ишемией различия между опытной и контрольной сериями исчезали, тогда как в опытах с тяжелой ОПН (90 минутная ишемия) доля гипертрофиро-
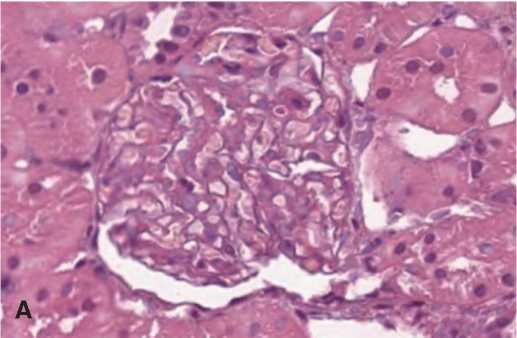
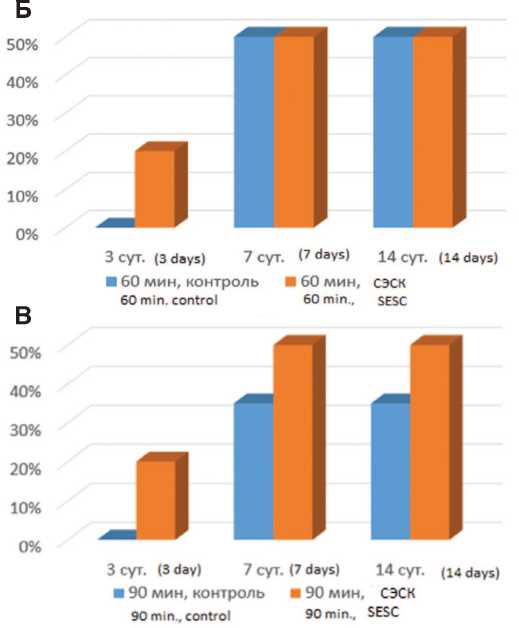
Рис. 1. А – гипертрофированный клубочек. 3 суток после 60-минутной ишемии, терапия СЭСК. Окраска гематоксилином и эозином. х 200. Б – влияние терапии СЭСК на долю гипертрофированных клубочков (% в препарате) в опытах с 60минутной ишемией. В – влияние терапии СЭСК на долю гипертрофированных клубочков (% в прпарате) в опытах с 90-минутной ишемией

ванных клубочков в опытной серии постоянно превышала значения контрольной группы опытов.
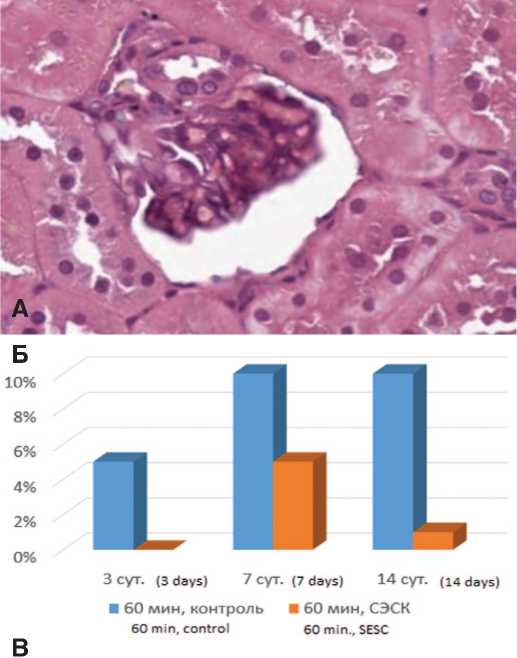
В то же время резко измененные клубочки с явлениями гломерулосклероза (рис. 2А) в опытах с терапией СЭСК в ранние сроки (3 суток) после 60-минутной ишемии не выявлялись, а после 90 минутой ишемии составляли всего 5%, тогда как в контрольных сериях их доля составляла 5% и 10% соответственно (рис. 2Б, В). В более отдаленные сроки различия между опытными и контрольными сериямисохранялись спреобладанием развития гломерулосклероза в обеих контрольных сериях. Более того,в опытах с 60-минутной ишемией и терапией СЭСК через 14 суток отмечали уменьшение доли клубочков с явле- ниями гломерулосклероза до минимальных значений, а при более тяжелой ОПН (90 минутная ишемия) их доля с увеличением сроканаблюдения оставалась стабильной, составляя 5%, тогда как в контрольных опытах через 7 суток доля поврежденных клубочков возрастала до 10-15% и сохранялась на этом уровне до 14 суток.
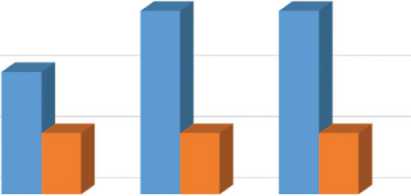
Терапия СЭСК способствовала также уменьшению степени повреждения почечных канальцев. В обеих контрольных сериях наблюдалась массивная гиалиново-капельная дистрофия эпителия почечных канальцев (в 40-45% канальцев) с полным некрозом эпителиальной выстилки в 5% канальцев при 60-минутой ишемии и 15% канальцев при 90-минутой ишемии (рис. 3А). В обеих опытных
3 сут. (з days) 7 сут. (7 days) 14 сут. (14 days) ■ 90 мин, контроль ■ 90 мин, СЭСК
90 min., control 90 min., SESC
Рис. 2. А – Коллабированный клубочек с явлениями гломерулосклероза.
3 суток после 60-минутной ишемии, контрольная серия. Окраска гематоксилином и эозином. Ув. 200х. Б – влияние терапии СЭСК на долю клубочков с гломерулосклерозом (% в препарате) в опытах с 60-минутной ишемией. В – влияние терапии СЭСК на долю клубочков с гломерулосклерозом (% в препарате) в опытах с 90-минутной ишемией
■ 90 мин, контроль ■ 90 мин, СЭСК 90 min., control 90 min., SESC
Рис. 3. А – почечные канальцы в состоянии резко выраженной дистрофии и некроза эпителия. 3 суток после 90-минутной ишемии, контроль. Окраска гематоксилином и эозином. Ув. 200х. Б – влияние терапии СЭСК на долю некротизированных почечных канальцев в опытах с 60-минутной ишемией. В – влияние терапии СЭСК на долю некротизированных почечных канальцев при 90-минутной ишемии
сериях доля канальцев с некротизированным эпителием была меньше при всех сроках наблюдения, хотя различия через 14 суток после ишемического воздействия сглаживались (рис. 3Б, В).
Из этих данных можно заключить, что терапевтическое действие СЭСК в отношении уменьшения повреждения почечных клубочков и почечных канальцев реализуется преимущественно на ранних стадиях репаративного процесса, способствуя регенерации почечных структур и уменьшению склеротических процессов.
Для подтверждения способности СЭСК активировать регенерацию клеток почки мы изучили влияние препарата на экспрессию маркера клеточной пролиферации Ki-67 в структурах почки при разной выраженности ишемического повреждения. Исследование показало, что если в норме экспрессия этого маркера выявляется лишь в ядрах единичных эпителиальных клеток почечных канальцев, то после ишемического воздействия 60-минутной длительности в условиях терапии СЭСК количество клеток, экспрессирующих Ki-67, через 3 суток возрастает (рис.4А), но через 7 и 14 дней экспрессия Ki-67 в ядрах клеток практически исчезает (рис. 4В). В контрольной серии выявляется обратная динамика – через 3 суток экспрессия Ki-67 выявляется в ядрах единичных клеток, (рис. 4Б), а через 7 и 14 дней количество клеток, экспрессирующих этот маркер, возрастает (рис. 4Г). В почечных клубочках в обеих сериях меченые клетки практически не выявлялись.
В опытах с более тяжелой ОПН (90 минут ишемии) и терапий СЭСК высокая пропорция клеток, экспрессирующих Ki-67 в эпителии почечных канальцев сохраняется до 14 суток послеишемического воздействия, тогда как в контрольной серии доля этих клеток была существенно ниже. В клеткахпочечных клубочков притерапии СЭСК выявлялись единичные клетки, экспрессирующие Ki-67, тогда как в контрольных опытах экспрессия этого маркера в клетках клубочков не выявлялась (рис. 5).
Таким образом, более быстрое восстановление функционального состояния ишемизированной почки на фоне терапия СЭСК может быть обусловлено стимуляцией регенерации эпителиальных клеток поврежденных почечных канальцев, особенно на ранних сроках после ишемического воздействия. При этом мы отметили, что продолжительность активации клеточной регенерации при терапии СЭСК была пропорциональна выраженности действия повреждающего фактора: в опытах с 60-минутной ишемией она была максимальна в первые 3 суток после развития повреждения, уменьшалась к 7-м суткам и практически исчезала через 14 суток тогда как после 90-минутной ишемии, стимулирующий эффект сохранялся до конца периода наблюдения.
Поскольку мы не выявили существенной активации регенерации клеток почечных клубочков под влиянием терапии СЭСК (в отличии от почечных канальцев) мы изучили влияние этого препарата на апоптоз клеток
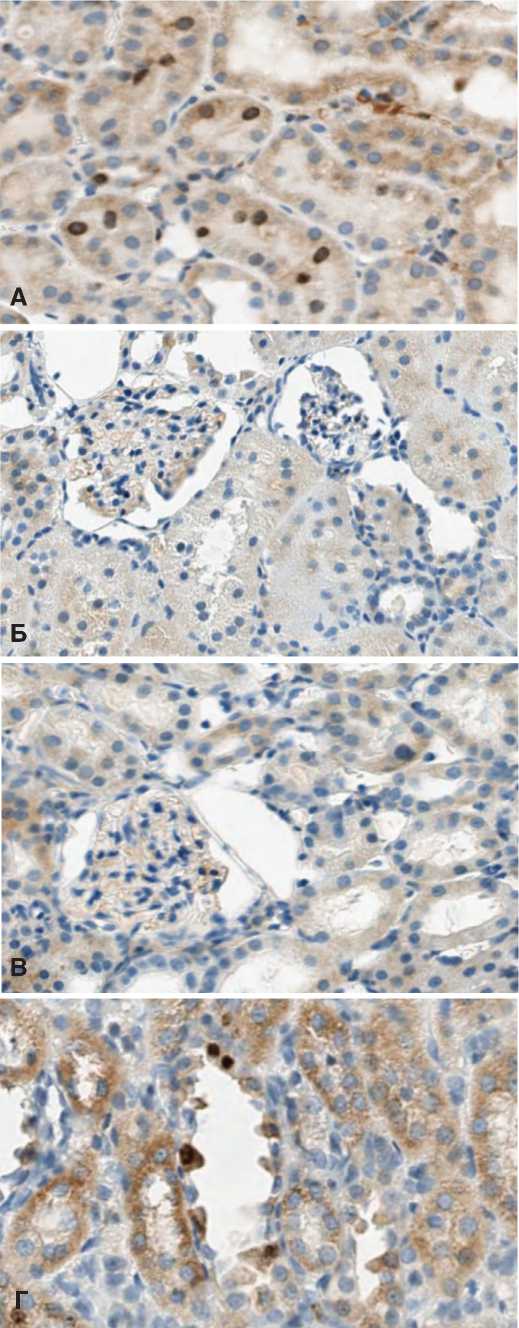
Рис. 4. Влияние терапии СЭСК на экспрессию Ki-67 в клетках почки при умеренно выраженной ОПН. А – 60 минут ишемии, 3 сутки, терапия СЭСК. Б – 60 минут ишемии, 3 сутки, контроль. В – 60 минут ишемии, 14 суток, терапия СЭСК, Г – 60 минут ишемии, 14 суток, контроль. х 200
Fig. 4. The effect of SESC therapy on the expression of Ki-67 in kidney cells with moderate acute renal failure. A – 60 minutes of ischemia, 3 days, SESC therapy. Uv.200x. B – 60 minutes of ischemia, 3 days, control. Uv.100x. C – 60 minutes of ischemia, 14 days, SESC therapy, D – 60 minutes of ischemia, 14 days, control. x 200
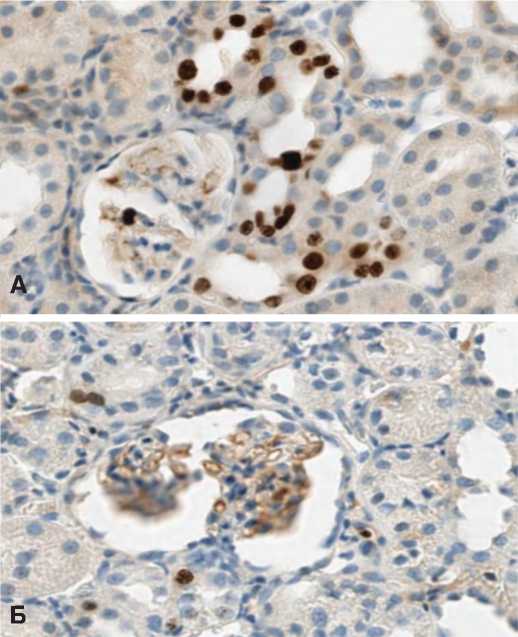
Рис. 5. Влияние терапии СЭСК на экспрессию Ki-67 в клетках почки при тяжелой ОПН. А – 90 минут ишемии, 14 суток, терапия СЭСК. Окраска гематоксилином и эозином и на Ki-67. Ув. 200х. Б – 90 минут ишемии, 14 суток, контроль. Окраска гематоксилином и эозином и на Ki-67. х 100
Fig. 5. The effect of SESC therapy on Ki-67 expression in kidney cells in severe acute renal failure. A – 90 minutes of ischemia, 14 days, SESC therapy. Staining with hematoxylin and eosin and on Ki-67. Uv. 200x. Б – 90 minutes of ischemia, 14 days, control. Staining with hematoxylin and eosin and on Ki-67. х 100
активность которого играет существенную роль в функциональных последствиях острого повреждения органов. С этой целью мы изучили влияние СЭСК на экспрессиюмар-кера антиапоптоза Bcl-2 в структурах почки, подвергнутой ишемии различной длительности, на фоне терапии СЭСК и без терапии.
В интактной почке клетки большинства почечных клубочков (до 80%) экспрессировали Bcl-2. После ишеми-ческоговоздействия количество Bcl-2-позитивных клубочков в обеих группах значительно снижалось, но более выраженно (через 3и 7 суток после ишемии) в контрольной серии опытов (рис. 6). Через 14 суток процент Bcl-2-пози-
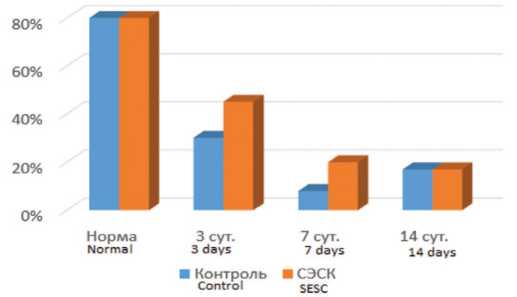
Рис. 6. Влияние терапии СЭСК на долю почечных клубочков, экспрессирующих Bcl-2
Fig. 6. The effect of SESC therapy on the proportion of glomeruli that extract Bcl-2
тивных клубочков в опытной и контрольной группах сравнивался.
При этом на фоне терапии СЭСК через 3 и 7 суток после 60-минутной ишемии отмечали не только большее количество Bcl-2-позитивных клубочков, но и более выраженную экспрессию этого маркера (рис. 7А, Б). К 14 суткам различия между сериями сглаживались
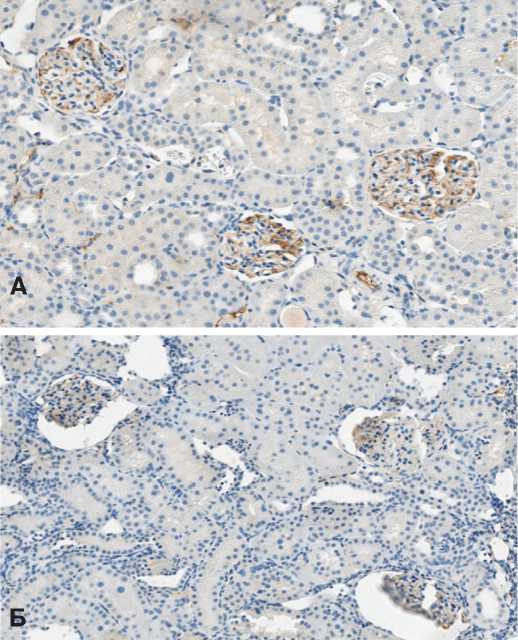
Рис. 7. Экспрессия Bcl-2 в клубочках после 60-минутной ишемии при тера пии СЭСК (А) и без терапии (Б) на 3-и сутки после ишемии. х 100
Fig. 7. Bcl-2 expression in glomeruli after 60-minute ischemia with SESC therapy (A) and without therapy (Б) on the 3rd day after ischemia. х 100
В опытах с 90-минутной ишемией более высокая экспрессия Bcl-2 сохранялась до 14 суток после ишемического воздействия (рис. 8).
Эти данные свидетельствуют, что под действием терапии СЭСК степень активации апоптоза поврежденных клеток уменьшается как при средней степени выраженности ОПН, так и при тяжелом повреждении почек, что способствует сохранению функционально активной паренхимы органа и препятствует развитию нефросклероза.
Важно отметить, что преобладающее количество меченых Bcl-2 клеток выявляли в почечных клубочках, что позволяет предполагать, что уменьшение гломерулосклероза при терапии СЭСК обусловлено именноза счет сохранения активности антиапоптотических сигнальных путей препятствующих гибели клеток и их замещению соединительной тканью.
Обобщая полученные данные, можно предположить что предотвращение выраженных функциональных расстройств при терапии СЭСК в отношении сохранения функции клубочков и канальцевреализуются разными путями. Если в отношении канальцевого эпителия,
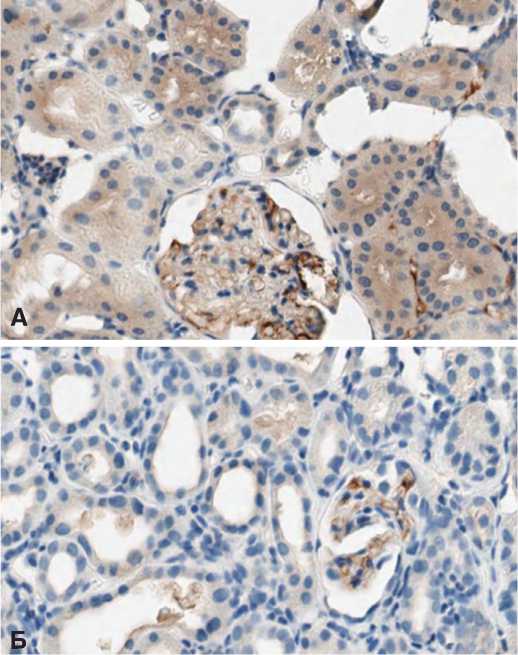
Рис. 8. Экспрессия Bcl-2 в структурах почки через 14 суток после 90-минутной ишемии. А – терапия СЭСК, Б – контроль
Fig. 8. Bcl-2 expression in kidney structures 14 days after 90-minute ischemia. A – SESC therapy, B – control потенциально обладающего регенераторнымпотенциалом основным механизмомявляется его стимуляция путем активации генома, маркером чего является повышение экспрессии Ki-67, то в отношении клубочковых клеток их защита реализуется путем подавленияпроцессов апоптоза на что указывает более высокая экспрессия Bcl-2.
ОБСУЖДЕНИЕ
Исход патологического процесса после развития ОПП определяется балансом между гибелью функционально активных клеток и активностью процессов регенерации поврежденных клеточных структур [1, 2, 8]. В случае преобладания деструктивных процессов возникает риск перехода острого повреждения в хроническую болезнь почек, что доказано, как в экспериментальных исследованиях, так и в клинических наблюдениях, причем хроническая форма может развиваться через некоторое время после восстановления функции почки после острого повреждения [2, 5, 6, 25, 26].
Для восстановления функции почек после ОПП по мнению H. Fattah и соавт. жизненно важно восстановление канальцев, что также обеспечивает улучшение скорости клубочковой фильтрации, и, вероятно, определяет, какие пациенты полностью выздоравливают от ОПП или прогрессируют до хронического заболевания почек [27]. Согласно данным других авторов не менее важное значение имеет восстановление поврежденныхпочечных клубочков с предотвращением развития гломерулосклероза, в процессе которого важную роль играет возможность сохранения жизнеспособности и регенерации подоцитов [28].
Полученные нами результаты показали, что уменьшение выраженностиморфологических нарушений, опре-деляющихболеебыстрое восстановление функциональной активности ишемизированной почки, при терапии СЭСК связано как со стимуляцией регенерации поврежденных клеток, так и с подавлением процесса их апоптоза. При этом фактор стимуляции регенерации играет более важную роль в отношении почечных канальцев, а фактор ингибирования апоптоза поврежденных клеток – в отношении клубочкового аппарата почки.
Для регенерации канальцевого эпителия по данным H. Fattah и соавт. необходима дедифференцировка клеток во время фазы повреждения канальцев, что способствует последующейклеточнойпролиферацииизамещениюутра-ченныхэпителиальных клеток [27]. Терапия СЭСК, по всей видимости, способствует стимуляцииэтого процесса сраз-блокировкой определенных генов и вступлением клеток в пролиферативный процесс, очем свидетельствуетувеличе-ние эпителиальных клеток, экспрессирующих Ki-67.
Известно,что маркер клеточной пролиферации Ki-67 выявляет лишь начальныйэтап подготовки клеток кделе-нию и не дает точной информации о последствиях активации клеточного генома – приводит ли это к гипертрофии клеток,делению клеток или гибели клеток в результатеми-тоза из-за выраженного повреждения клеточной ДНК (митотической катастрофе) – тем не менееэтот маркерисполь-зуется многими исследователями для характеристики активности пролиферативного процесса, поскольку его экспрессия коррелирует с другими часто используемыми маркерами пролиферации, в частности, бром-деоксиури-дином, инефропротективным действием терапевтических средств, в том числе СК и их производными [29, 30-33].
Имеются данные, что при ишемическом воздействии максимум регенерации канальцевых клеток наступает на 3-8-й дни после ишемического повреждения [34, 35]. В наших исследованияхмытакже выявили,что притерапии СЭСК наибольшее количество канальцев с клетками, мечеными Ki-67, определялось через 3суток в опытах как с умеренно выраженной, так и при тяжелой ОПН. При этом в опытах с умеренно выраженным ОПП через 7 и 14 суток различия между опытной и контрольной сериями постепенно нивелировались за счет снижения числе меченых клеток в опытной серии и увеличения в контроле. При нарастании степени повреждения почки (тяжелая ОПН) повышенное количество меченых Ki-67 клеток в опытной группе по сравнению с контролем сохранялосьдо 14 суток.
Таким образом, при умеренно выраженном ОПП терапия СЭСК ускоряет процесс регенерации почечных ка-нальцев,уменьшая функциональные последствия повреж-денияв наиболее критический период (первые 3 суток). Без терапии регенеративные процессы развиваются медленнее но сохранившиесярезервыпозволяют постепенно восста-
новить функционирование канальцевого аппарата почки. При тяжелой ОПН только терапия СЭСК позволяет адекватно стимулировать регенерацию канальцев и тем самым улучшить функцию поврежденной почки, тогда как без стимуляции резервные возможности клеток становятся недостаточными.
Помимо того, что клетки, экспрессирующие Ki-67 можно отнести к клеткам, вступившим в пролиферативный цикл, имеются данные, что эти клетки не экспрессируют α-актингладкомышечных клеток (α-АГМК),тогда какво многих клетках, не экспрессирующих Ki-67, выявляется экспрессия α-АГМК [36]. Поскольку α-АГМК обычно выявляется в миофибробластах, его экспрессия может служить индикатором развития эпителиально-мезенхимной трансформации клеток, то есть начального этапа нефро-склероза. Индукция терапией СЭСК повышения экспрессии Ki-67 может свидетельствовать, что эта терапия обладает антисклеротическим действием, что подтвердилось гистологическим исследованием.
Ряд авторов предполагает, что после повреждения почки различной этиологии способность к регенерации имеется только у особой популяции клеток, называемой «клетки, длительно удерживающие метки», в частности бром-деоксиуридин, часто используемый как маркер клеточной регенерации, и именно эти клетки после повреждения активноэкспрессируют Ki-67, хотя в нормеэтотмаркер в них не выявляют [31, 37]. При этом в условиях культивирования in vitro эти клетки могут дифференцироваться не только в клетки канальцевого эпителия, но и в подоциты что важно для регенерации клубочков [37].
Выявленное в предыдущих исследованиях быстрое восстановление клубочковой фильтрации при терапии СЭСК может быть связано с уменьшением повреждения почечных клубочков и ускорением их регенерациии гипертрофии, чтомы подтвердили в данном исследовании. Хотя при определении экспрессии Ki-67 при терапии СЭСК в структурах почечных клубочков выявлялись лишь немногие меченые париетальныеподоцитыи клеткимезангиума тем не менееужена3 сутки до20% клубочков не только сохраняли нормальную морфологию, но и гипертрофировались, тогда как в контрольных опытах гипертрофированные клубочки наэтом сроке наблюдения отсутствовали. Обратная зависимость выявлена в отношении доли клубочков с явлениями гломерулосклероза. Если при терапии СЭСК в опытах с 60-минутной ишемии через 3 суток их не выявляли, а после 90-минутной ишемии их доля составляла 5%,то в контрольных опытах эти цифры составили 5 и 10% соответственно. На более отдаленных сроках выраженность гломерулосклероза при терапии СЭСК была в 2-3 раза ниже, чем без терапии.
Таким образом, терапия СЭСК предотвращает развитие склероза клубочков при ОПН и способствует ускорению регенерации и развитию гипертрофии малоповреж-денных клубочков. То, что мы не выявили значимой экспрессии Ki-67 в почечных клубочках, возможно, связано с тем, что его экспрессия индуцируется в почечных структурах в разной степени в зависимости от вида нефропатии: в клубочках – в большей степени при гломерулопатиях, а в эпителии канальцев – при тубулопатиях [38]. При ишемическом повреждении в большей степени страдают извитые канальцы, что и определяет большую стимуляцию пролиферации их эпителия [37]. Кроме того, регенерационный потенциал эпителиальных клеток почечных канальцев существенно выше, чем клеток почечных клубочков, в которых основным источником пролиферирующих клеток являются преимущественно подоциты и в меньшей степени париетальные эпителиальные клетки наружного слоя капсулы Боумена [39, 40]. Именно в этих зонах мы выявляли отдельные меченые Ki-67 клетки
Сохранение клубочкового аппарата при ишемическом повреждении может происходить не только через стимуляцию регенерации клубочковых клеток, но и за счет уменьшения их повреждения, в том числе за счет подавления активности апоптоза. В качестве маркера активности апоптоза часто используют Bcl-2, относящийся к семейству белков В-клеточной лимфомы 2, локализованных на внешней митохондриальной мембране. Регулирующий эффект этого соединения, относящегося к ингибиторам апоптоза, осуществляется во взаимодействии с активаторами этого процесса,в частности Bax. Конечный итог определяется балансом этих регуляторов, причем, проапоптотическая активность Bax ограничивается антиапоптотической активностью Bcl-2. Белки Bcl-2 также регулируют важнейшие функции почечных клеток, включая клеточный метаболизм аутофагию, морфологию митохондрий (деление и слияние органелл), а также митохондриальный биогенез, что позволяет считать белки BCL-2 определяющими жизнеспособность клеток [41].
Многие авторы выявляли связь между сохранением жизнеспособностиклеток почки под влияниемразличных воздействий, в том числе при ишемическом повреждении с сохранением или повышением экспрессии Bcl-2 [42-45]. Более того, искусственно вызванное увеличение экспрессии Bcl-2 у трансгенных мышей приводило к повышению резистентностипочекживотныхк ишемическому повреждению, что сопровождалось снижением активности белка каспазы и уменьшению количества апоптотических клеток [46, 47].
В почечных клубочках в норме мРНК Bcl-2 и ее продукт – белок Bcl-2 были обнаружены в подоцитах, но не выявлялись в мезангиальныых клетках [48]. То есть, именно подоциты являются «объектом защиты» от апоптоза. При этом показано,чтоименно апоптозподоцитовлежитв основе развития гломерулосклероза, а выраженное снижение экспрессии Bcl-2 вподоцитахсопровождалосьувеличениемсте-пени повреждения почечных клубочков [42]. Именно такая картина была выявлена в нашем исследовании. Если в норме 80% клубочков экспрессировали Bcl-2, то после ишемического воздействия доля таких клубочков в контрольных опытахуменьшалась в 4-5 раз,что сопровождалось развитием гломерулосклероза в 10-15% почечных клубочков. В опытах с терапией СЭСК утрата экспрессии Bcl-2 вклубочках былав 1,5-2раза менее выражена, что сопровождалось значительно меньшим количеством выявляемых клубочков в состоянии гломерулосклероза (не более 5%).
Важным моментом является то, что в клетках млекопитающих Bcl-2 имеет двойную субклеточную локализацию – в митохондриях и эндоплазматическом ретикулуме и цитопротективный эффект этих белков в зависимости от локализации различен. Экспрессия митохондриального Bcl-2 проявляла значительное ингибирующее действие на апоптоз клеток, индуцируемый цисплатином или истоще-ниемАТФ,тогда какэндоплазматический Bcl-2 былгораздо менее эффективен. Во время истощения АТФ цитохром С высвобождался из митохондрий в цитозоль, активируя апоптоз через каспазный путь. Это высвобождение подавлялось митохондриальным Bcl-2, но не подавлялось эндоплазматическим Bcl-2. Митохондриальный Bcl-2, но не эндоплазматический Bcl-2, блокировал активацию Bax во время истощенияАТФ, критическогособытияв отношении проницаемости внешней мембраны митохондрий и высвобождения цитохрома С [49].
Ингибирование апоптоза, что проявляется сохранением более высокой экспрессии Bcl-2, может быть следствием активации аутофагии, стимулированной СЭСК которая тормозит этот процесс на эффекторном уровне способствуяудалению продуктов острой фазы повреждения клеточных органелл [50].
Эти данные могут свидетельствовать, что на субклеточном уровне цитопротективный эффект Bcl-2 реализуется путем защиты митохондрий от повреждения сохранения барьерных свойств их наружной мембраны что предотвращает выход в цитоплазму цитохроома С и последующую активацию каспазного пути развития апоптоза. Терапия СЭСК способствует сохранению этого адаптивного пути защиты от клеточного повреждения.
ВЫВОДЫ
Терапевтический эффект СЭСК (препарат Целлекс) опосредован активацией регенерации и подавлением апоптоза поврежденных клеток почки при ишемиче-ском/реперфузионном повреждении, как умеренной, так и значительной выраженности, что способствует более быстрому восстановлению функционального состояния почки после перенесенного ОПП.
Список литературы Применение ксеногенного фракционированного протеомного секретома стволовых и прогениторных клеток при остром ишемическом повреждении почек в эксперименте
- Basile DP, Anderson MD, Sutton TA. Pathophysiology of acute kidney injury. Compr Physiol 2012;2(2):1303-53. https://doi.org/10.1002/cphy.c110041.
- Zuk A, Bonventre JV. Acute Kidney Injury. Annu Rev Med 2016(67):293-307. https://doi.org/10.1146/ annurev-med-050214-013407.
- Missoum A. Recent Updates on mesenchymal stem cell based therapy for acute renal failure. Curr Urol 2020;13(4):189-199. https://doi.org/10.1159/000499272.
- Zhao L, Hu C, Zhang P, Jiang H, Chen J. Mesenchymal stem cell therapy targeting mitochondrial dysfunction in acute kidney injury. J Transl Med 2019;17(1):142. https://doi.oig/10.1186/s12967-019-1893-4.
- Yu SM, Bonventre JV. Acute kidney injury and maladaptive tubular repair leading to renal fibrosis. Curr Opin Nephrol Hypertens 2020;29(3):310-318. https://doi.org/10.1097/MNH.0000000000000605.
- Fiorentino M, Grandaliano G, Gesualdo L, Castellano G. Acute kidney injury to chronic kidney disease transition. Contrib Nephrol 2018(193):45-54. https://doi.org/10.1159/000484962.
- Palant CE, Patel SS, Chawla LS. Acute kidney injury recovery. Contrib Nephrol 2018(193):35-44. https://doi.org/10.1159/000484961.
- Kumar S. Cellular and molecular pathways of renal repair after acute kidney injury. Kidney Int 2018;93(1):27-40. https://doi.org/10.1016/j.kint.2017.07.030.
- Minocha E, Sinha RA, Jain M, Chaturvedi CP, Nityanand S. Amniotic fluid stem cells ameliorate cisplatin-induced acute renal failure through induction of autophagy and inhibition of apoptosis. Stem Cell Res Ther 2019;10(1):370. https://doi.org/10.1186/s13287-019-1476-6.
- Hafazeh L, Changizi-Ashtiyani S(1), Ghasemi F, Najafi H, Babaei S, Haghverdi F. Stem cell therapy ameliorates ischemia-reperfusion induced kidney injury after 24 hours reperfusion. Iran J Kidney Dis 2019;13(6):380-388.
- Yokoo T. Stem cell sheet therapy: another option for acute kidney injury? Kidney Int 2021;99(1):22-24. https://doi.org/10.1016/j.kint.2020.08.034.
- Bogatcheva NV, Coleman ME. Conditioned medium of mesenchymal stromal cells: a new class of therapeutics. Biochemistry (Mosc) 2019;84(11):1375-1389. https://doi.org/10.1134/S0006297919110129.
- Pan B, Fan G. Stem cell-based treatment of kidney diseases. Exp Biol Med (Maywood) 2020;245(10):902-910. https://doi.org/10.1177/1535370220915901.
- Wang SY, Hong Q, Zhang CY, Yang YJ, Cai GY, Chen XM. miRNAs in stem cell-derived extracellular vesicles for acute kidney injury treatment: comprehensive review of preclinical studies. Stem Cell Res Ther 2019;10(1):281. https://doi.org/10.1186/s13287-019-1371-1.
- Selim RE, Ahmed HH, Abd-Allah SH, Sabry GM, Hassan RE, Khalil WKB, Abouhashem NS. Mesenchymal stem cells: a promising therapeutic tool for acute kidney injury. Appl Biochem Biotechnol 2019 Sep;189(1):284-304. https://doi.org/10.1007/s12010-019-02995-2.
- Vizoso FJ, Eiro N, Cid S, Schneider, Perez-Fernandez R. Mesenchymal stem cell secretome: toward cell-free therapeutic strategies in regenerative medicine. Int J Mol Sci 2017(18):1852; https://doi.org/10.3390/ijms18091852.
- Li JS, Li B. Renal injury repair: how about the role of stem cells. Adv Exp Med Biol 2019(1165):661-670. https://doi.org/10.1007/978-981-13-8871-2_32.
- Hafazeh L, Changizi-Ashtiyani S, Ghasemi F, Najafi H, Babaei S, Haghverdi F. Stem cell therapy ameliorates ischemia-reperfusion induced kidney injury after 24 hours reperfusion. Iran J Kidney Dis 2019 Nov;13(6):380-388.
- Beer L, Mildner M, Ankersmit HJ. Cell secretome based drug substances in regenerative medicine: when regulatory affairs meet basic science. Ann Transl Med 2017(5):170.
- GolleL, Gerth HU, Beul K, Heitplatz B, Barth P, Fobker M, et al. Bone marrow-derived cells and their conditioned medium induce microvascular repair in uremic rats by stimulation of endogenous repair mechanisms. Sci. Rep 2017(7):9444.
- Lee KH, Tseng WC, Yang CY, Tarng DC. The Anti-inflammatory, anti-oxidative, and anti-apop-totic benefits of stem cells in acute ischemic kidney injury. Int J Mol Sci 2019;20(14). pii: E3529. https://doi.org/10.3390/ijms20143529.
- Rota C, Morigi M, Imberti B. Stem cell therapies in kidney diseases: progress and challenges. Int J Mol Sci 2019(20):2790; https://doi.org/10.3390/ijms20112790.
- Yun CW, Lee SH. Potential and therapeutic efficacy of cell-based therapy using mesenchymal stem cells for acute/chronic kidney disease. Int J Mol Sci 2019;20(7):1619. https://doi.org/10.3390/ ijms20071619.
- Кирпатовский В.И., Сивков А.В., Голованов С.А., Дрожжева В.В., Ефремов Г.Д., Самойлова С.И. Стимуляция структурно-функционального восстановления почки у крыс с постишеми-ческой острой почечной недостаточностью разной степени выраженности терапией эмбриональным белково-пептидным комплексом. Бюллетень экспериментальной биологии и медицины 2020;169(5):551-558. [Kirpatovskiy V.I., Sivkov A.V., Golovanov S.A., Drozhzheva V.V., Efremov G.D., Samjlova S.I. Stimulation of the structural and functional recovery of the kidney in rats with post-ischemic acute renal insufficiency of varying severity by therapy with an embryonic protein-peptide complex. ByuHeten1 eksperimentalnoy biologii i meditsiny = Bulletin of Experimental Biology and Medicine 2020;169(5):551-558. (in Russian)].
- Ferenbach DA, Bonventre JV Acute kidney injury and chronic kidney disease: From the laboratory to the clinic. Nephrol Ther 2016;12(Suppl 1):S41-8. https://doi.org/10.1016/j.nephro.2016.02.005.
- Ogbadu J, Singh G, Aggarwal D. Factors affecting the transition of acute kidney injury to chronic kidney disease: Potential mechanisms and future perspectives. Eur J Pharmacol 2019(865):172711. https://doi.org/10.1016/j.ejphar.2019.172711.
- Fattah H, Vallon V. Tubular recovery after acute kidney injury. Nephron 2018;140(2):140-143. https://doi.org/10.1159/000490007.
- Кирпатовский В.И., Соколов М.А., Рабинович Э.З., Сивков А.В. Клеточные и гуморальные механизмы регенерации почки. Экспериментальная и клиническая урология 2017(2):42-51. [Kirpatovskiy V.I., Sokolov M.A., Rabinovich E.Z., Sivkov A.V. Cellular and humoral mechanisms of kidney regeneration. Eksperimentalnaya i Klinicheskaya urob-giya = Experimental and Clinical Urology 2017(2):42-51. (in Russian)].
- Thomasova D, Anders HJ. Cell cycle control in the kidney. Nephrol Dial Transplant 2015;30(10):1622-30. https://doi.org/10.1093/ndt/gfu395.
- Liu X, Liu H, Sun L, Chen Z, Nie H, Sun A, et al. The role of long-term label-retaining cells in the regeneration of adult mouse kidney after ischemia/reperfusion injury. Stem CM Res Ther 2016;7(1):68. https://doi.org/10.1186/s13287-016-0324-1.
- Sakakima M, Fujigaki Y, Yamamoto T, Hishida A. A distinct population of tubular cells in the distal S3 segment contributes to S3 segment regeneration in rats following acute renal failure induced by uranyl acetate. Nephron Exp Nephrol 2008;109(2):e57-70. https://doi.org/10.1159/000142100.
- Goodlad RA. Quantification of epithelial cell proliferation, cell dynamics, and cell kinetics in vivo. Wiley Interdiscip Rev Dev Biol 2017;6(4). https://doi.org/10.1002/wdev.274.
- Hussein AM, Barakat N, Awadalla A, Gabr MM, Khater S, Harraz AM, et al. Modulation of renal ischemia/reperfusion in rats by a combination of ischemic preconditioning and adipose-derived mesenchymal stem cells (ADMSCs). Can J Physiol Pharmacol 2016;94(9):936-46. https://doi.org/10.1139/ cjpp-2016-0018.
- Regner KR, Nozu K, Lanier SM, Blumer JB, Avner ED, Sweeney WE Jr, Park F. Loss of activator of G-protein signaling 3 impairs renal tubular regeneration following acute kidney injury in rodents. FASEB J. 2011;25(6):1844-55. https://doi.org/10.1096/fj.10-169797.
- Sari FT, Arfian N, Sari DCR. Effect of kidney ischemia/reperfusion injury on proliferation, apop-tosis, and cellular senescence in acute kidney injury in mice. Med J Malaysia 2020;75(Suppl 1):20-23.
- Terada N, Karim MR, Izawa T, Kuwamura M, Yamate J. Expression of OI-catenin in regenerating renal tubules of cisplatin-induced kidney failure in rats. Clin Exp Nephrol 2018;22(6):1240-1250. https://doi.org/10.1007/s10157-018-1583-1.
- Kim K, Lee KM, Han DJ, Yu E, Cho YM. Adult stem cell-like tubular cells reside in the corti-comedullary junction of the kidney. Int J Clin Exp Pathol 2008;1(3):232-41.
- Hall PA, Greenwood RA, d'Ardenne AJ, Levison DA. In situ demonstration of renal tubular regeneration using the monoclonal antibody Ki67. Nephron 1988;49(2):122-5. https://doi.org/10.1159/000185037.
- Shankland SJ, Pippin JW, Duffield JS. Progenitor cells and podocyte regeneration. Semin Nephrol 2014;34(4):418-428. https://doi.org/10.1016/j.semnephrol.2014.06.008.
- Wanner N, Hartleben B, Herbach N, Goedel M, Stickel N, Zeiser R, et al. Un raveling the role of podocyte turnover in glomerular aging and injury. J Am Soc Nephrol 2014;25(4):707-716. https://doi.org/10.1681/ASN.2013050452.
- Borkan SC. The role of BCL-2 family members in acute kidney injury. Semin Nephrol. 2016 May;36(3):237-50. https://doi.org/10.1016/j.semnephrol.2016.04.001.
- Qiu LQ, Sinniah R, I-Hong Hsu S. Downregulation of Bcl-2 by podocytes is associated with progressive glomerular injury and clinical indices of poor renal prognosis in human IgA nephropathy. J Am Soc Nephrol 2004;15(1):79-90. https://doi.org/10.1097/01.asn.0000104573.54132.2e.
- Isaka Y, Suzuki C, Abe T, Okumi M, Ichimaru N, Imamura R, et al. Bcl-2 protects tubular epithelial cells from ischemia/reperfusion injury by dual mechanisms. Transplant Proc 2009;41(1):52-4. https://doi.org/10.1016/j.transproceed.2008.10.026.
- Kim JH, Lee SS, Jung MH, Yeo HD, Kim HJ, Yang JI, et al. N-acetylcysteine attenuates glycerol-induced acute kidney injury by regulating MAPKs and Bcl-2 family proteins. Nephrol Dial Transplant 2010;25(5):1435-43. https://doi.org/10.1093/ndt/gfp659.
- Hashemi M. The Study of pentoxifylline drug effects on renal apoptosis and bcl-2 gene expression changes following ischemic reperfusion injury in rat. Iran J Pharm Res 2014 Winter;13(1):181-9.
- Suzuki C, Isaka Y, Shimizu S, Tsujimoto Y, Takabatake Y, Ito T, et al. Bcl-2 protects tubular epithelial cells from ischemia reperfusion injury by inhibiting apoptosis. CeU Transplant 2008;17(1-2):223-9. https://doi.org/10.3727/000000008783907053.
- Chien CT, Chang TC, Tsai CY, Shyue SK, Lai MK. Adenovirus-mediated bcl-2 gene transfer inhibits renal ischemia/reperfusion induced tubular oxidative stress and apoptosis. Am J Transplant 2005;5(6):1194-203. https://doi.org/10.1111/j.1600-6143.2005.00826.x.
- Haishima A, Murakami M, Ikeda T, Inoue K, Kamiie J, Shirota K. Detection of Bcl-2 mRNA and its product in the glomerular podocytes of the normal rat kidney. Exp Toxicol Pathol. 2012;64(6):633-7. https://doi.org/10.1016/j.etp.2010.12.006.
- Bhatt K, Feng L, Pabla N, Liu K, Smith S, Dong Z. Effects of targeted Bcl-2 expression in mitochondria or endoplasmic reticulum on renal tubular cell apoptosis. Am J Physiol Renal Physiol 2008;294(3):F499-507. https://doi.org/10.1152/ajprenal.00415.2007.
- Cui J, Bai X, Chen X. Autophagy and acute kidney injury. Adv Exp Med Biol 2020;1207:469-480. dhttps://doi.org/10.1007/978-981-15-4272-5_34.


