Применение липосомальных технологий в доставке силибина в печень у пациентов с неалкогольной жировой болезнью печени
Автор: Павлов Чавдар Савов, Туранкова Таисия Алексеевна, Варганова Дарья Леонидовна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 1, 2023 года.
Бесплатный доступ
Цель работы оценить эффективность и безопасность липосомальных технологий в терапии неалкогольной жировой болезни печени (НАЖБП) на примере активного действующего вещества силибина («Липолив»). Материалы и методы. Проведено рандомизированное плацебо-контролируемое исследование, одобренное этическим комитетом. В исследование были включены 111 участников в возрасте 18-65 лет с диагнозом НАЖБП. Длительность терапии препаратом «Липолив» (группа терапии) или идентичным плацебо (контрольная группа) составляла 12 нед, дозировка препарата 1 капсула в сутки. У пациентов оценивались показатели эффективности: активность стеатогепатита (АСТ, АЛТ), выраженность стеатоза печени (транзиентная эластография с контролируемым параметром затухания ультразвуковой волны), качество жизни (шкала SF-36) и безопасности: нежелательные явления. Статистический анализ проводился с использованием программы StatTech v. 1.2.0. Результаты. В группе терапии в конце лечения отмечено достоверное снижение показателей АЛТ (p
Липосомальные технологии, нажбп, силибин, контролируемый параметр затухания
Короткий адрес: https://sciup.org/14127223
IDR: 14127223 | УДК: 615.036.8 | DOI: 10.34014/2227-1848-2023-1-50-62
Текст научной статьи Применение липосомальных технологий в доставке силибина в печень у пациентов с неалкогольной жировой болезнью печени
Введение. В настоящее время неалкогольная жировая болезнь печени (НАЖБП) является одним из наиболее часто встречающихся хронических заболеваний печени. Распространенность НАЖБП в мире составляет от 11,2 % до 37,2 %, а среди пациентов с метаболическим синдромом и ожирением – от 12,6 % до 30,4 % [1]. По оценочным данным, практически четверть населения планеты страдает НАЖБП [2], а высокая частота этого заболевания делает его ведущим фактором развития гепатоцеллюлярной карциномы в США и Европе [3]. В связи с вышесказанным вопрос поиска эффективного способа терапии и своевременной профилактики прогрессиро- вания данного заболевания является крайне актуальным.
В настоящее время во всем мире проводится огромное количество клинических исследований препаратов для терапии НАЖБП [4]. Важным аспектом всех современных исследований является поиск эффективного препарата с высокой биодоступностью, минимальным количеством побочных эффектов и таргетным воздействием, что стало возможным благодаря появлению новых технологий, в частности связанных с доставкой препаратов. Одной из таковых является липосомальная технология в доставке препаратов с гепа-тотропным эффектом.
Липосомальная технология стала активно использоваться в медицине с конца XX в. [5]. Липосомы представляют собой современную систему нанодоставки биологически активных соединений. При изменении состава двухслойной фосфолипидной оболочки липосом происходит изменение не только их подвижности и формы, но и физико-химических свойств. Химический состав обеспечивает инкапсулированную доставку гидрофильных молекул в водном ядре, увеличивая возможность проникновения молекул через липофильные мембраны, липидный бислой захватывает липофильные препараты, увеличивает их растворимость в биологических жидкостях [6]. Кроме того, липосомы позволяют улучшить доставку к тканям-мишеням и гидрофобных молекул, повышая биораспределение в тканях, снижая возможную токсичность биологически активных веществ. Использование липосомальной технологии способствует усилению терапевтического эффекта лекарственного препарата.
В одной из современных работ, посвященных изучению гепатотропных препаратов, отмечено положительное действие препаратов на основе силимарина на показатели функции печени [7]. Силимарин – собирательное название флаволигнанов (1,5–3,0 %) плодов расторопши пятнистой. Основным компонентом этого комплекса является силибин, или силибинин (на его долю приходится 60–70 %) [8]. Силимарин обладает антиоксидантной активностью, ингибируя свободные радикалы, повреждающие клеточные мембраны и вызывающие липопероксидацию [9]. Кроме того, силимарин усиливает активность глутатиона печени, увеличивает синтез белка в гепатоцитах, стимулируя активность РНК-полимеразы I [10], поддерживает целостность мембраны гепатоцитов и препятствует проникновению токсичных веществ или ксенобиотиков. Были получены данные, что сили-марин уменьшает инсулинорезистентность у пациентов с циррозом печени и сахарным диабетом 2-го типа [11].
На отечественном рынке единственным гепатотропным препаратом, синтезированным с использованием липосомальной техно- логии и содержащим активные вещества плодов расторопши, является «Липолив».
Цель исследования. Оценить эффективность и безопасность липосомальных технологий в терапии неалкогольной жировой болезни печени на примере активного действующего вещества силибина («Липолив»).
Материалы и методы. Проведено рандомизированное плацебо-контролируемое исследование на базе ГБУЗ ГКБ им. С.П. Боткина ДЗМ сотрудниками кафедры терапии Института профессионального образования ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России (Сеченовский Университет). Протокол исследования согласован с правилами ICH GCP, Хельсинкской декларацией Международной медицинской ассоциации и действующими нормативными требованиями, одобрен этическими комитетами всех участвующих клинических центров. В период с 07.09.2020 по 21.09.2020 в исследование последовательно было включено 111 участников (61 мужчина и 50 женщин), подписавших добровольное информированное согласие.
Критериями включения были следующие: возраст от 18 до 65 лет; диагноз НАЖБП, верифицированный с использованием клинических данных, данных анамнеза, УЗИ печени, транзиентной эластографии с контролируемым параметром затухания ультразвуковой волны (САР), биохимического анализа крови (повышенная активность АСТ и АЛТ; сахарный диабет 2-го типа, ИМТ>25 кг/м2).
Критериями исключения являлись наличие вирусного гепатита В и/или С, ВИЧ-инфекции, избыточное потребление алкоголя (более 40 г чистого этанола в сутки для мужчин и более 20 г – для женщин), наличие вторичного стеатоза печени, наследственных заболеваний, беременности.
Всем участникам были даны стандартные рекомендации по питанию и образу жизни. Участники не принимали дополнительных препаратов, снижающих активность стеатоге-патита.
До включения в исследование участники амбулаторно проходили скрининговое исследование, в частности УЗИ брюшной полости, транзиентную эластографию с CAP, биохимический анализ крови. После завершения скрининга участники были рандомизированы с помощью компьютерной программы в одну из двух групп: группу терапии, пациенты которой получали липосомальный силибин («Ли-полив») – 1 капсулу в сутки, и контрольную группу, где применялось идентичное плацебо – 1 капсула в сутки в течение 12 нед.
Эффективность терапии оценивалась по изменению следующих параметров: уровня активности стеатогепатита по данным лабораторных исследований; выраженности стеатоза печени по данным транзиентной эластогра-фии с CAP; качества жизни.
Метод транзиентной эластографии с функцией контролируемого параметра затухания ультразвуковой волны – неинвазивный метод диагностики, предназначенный для измерения жесткости печени в килопаскалях, имеющий высокую чувствительность и специфичность, сопоставимую с биопсией печени [12], – был выбран с целью определения наличия и степени выраженности стеатоза печени. Для количественной оценки стеатоза с помощью контролируемого параметра затухания анализируется мера ослабления ультразвука, которая соответствует уменьшению амплитуды ультразвуковых волн по мере их распространения через печень. Технология основана на оценке ультразвуковых сигналов, полученных с помощью устройства FibroScan (ультразвуковая виброуправляемая переходная эла-стография) [13]. Контролируемый параметр затухания измерялся с помощью зонда M на частоте 3,5 МГц и глубине от 25 до 65 мм или с помощью зонда XL, предназначенного для людей с избыточным весом, на глубине от 35 до 75 мм. Достоверность измерений обеспечивалась: 1) проведением 10 и более измерений; 2) интерквартильным диапазоном/медианой (IQR/med) менее 30 % при эластографии; 3) произведением более 60 % удачных измерений. В исследовании использовались следующие значения отсечения для оценки стеатоза печени: стеатоз 1 степени – до 259,4 дБ/м, стеатоз 2 степени – до 268 дБ/м, стеатоз 3 степени – 280 дБ/м [14–16].
Качество жизни оценивалось с использованием валидированной анкеты SF-36 для оценки качества жизни. Опросник SF-36 состоит из 36 пунктов, сгруппированных в восемь шкал: физическое функционирование, ролевая деятельность, телесная боль, общее здоровье, жизнеспособность, социальное функционирование, эмоциональное состояние и психическое здоровье. Показатели каждой шкалы варьируют между 0 и 100, где 100 представляет полное здоровье. Все шкалы формируют два показателя: общее душевное и общее физическое благополучие. Компьютерная интерпретация результатов тестирования основана на показателях, выраженных в процентах: 0–20 % – низкий показатель качества жизни; 21–40 % – пониженный показатель качества жизни; 41–60 % – средний показатель качества жизни; 61–80 % – повышенный показатель качества жизни; 81–100 % – высокий показатель качества жизни.
Безопасность терапии оценивалась по наличию, характеру и интенсивности (степени тяжести) нежелательных явлений в период приема «Липолива», по динамике жизненно важных показателей.
Статистический анализ проводился с использованием программы StatTech v. 1.2.0 (ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро – Уилка (при числе исследуемых менее 50) или критерия Колмогорова – Смирнова (при числе исследуемых более 50). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна – Уитни. Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью критерия χ2 Пирсона (при значениях ожидаемого явления более 10). В качестве количе- ственной меры эффекта при сравнении относительных показателей использовался показатель отношения шансов с 95 % доверительным интервалом (ОШ; 95 % ДИ). При сравнении нормально распределенных количественных показателей, рассчитанных для двух связанных выборок, использовался парный t-критерий Стьюдента. При сравнении количественных показателей, распределение которых отличалось от нормального, в двух связанных группах использовался критерий Уилкоксона.
Результаты. Общая сравнительная характеристика групп исследования представлена в табл. 1. Группы были сопоставимы по возрасту, полу и ИМТ.
Таблица 1
Table 1
Descriptive statistics of study participants
|
Показатель Parameter |
Группа терапии Experimental group |
Группа контроля Control group |
|
Число участников, абс. (%) Number of study participants, abs. (%) |
81 (73) |
30 (27) |
|
Половой состав, муж./жен., абс. (%) Gender (M/F), abs (%) |
44 (72,13)/37 (74) |
17 (27,87)/37 (74) |
|
p=0,825 (критерий χ2 Пирсона) p=0,825 (Pearson's chi-square test) |
||
|
Возраст, Me (Q1–Q3), лет Age, Me (Q1–Q3), y.o. |
53 (49–60) |
54 (52–58) |
|
р=0,543 (U-критерий Манна – Уитни) р=0,543 (Mann–Whitney U test) |
||
|
ИМТ перед терапией, M±SD, кг/м2 BMI at baseline, M±SD |
31±1 |
31±1 |
|
р=0,507 (t-критерий Стьюдента) р=0,507 (Student's t-test) |
||
Таблица 2
Table 2
Therapy-specific ALT dynamics
|
Группа исследования Study group |
Этапы наблюдения Stages of observation |
p |
|||
|
До терапии Before treatment |
В конце терапии After treatment |
||||
|
Me |
Q1–Q3 |
Me |
Q1–Q3 |
||
|
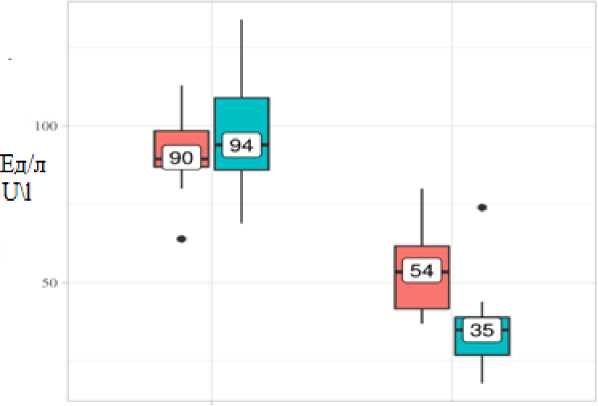
Группа контроля Control group |
90 |
87–98 |
54 |
42–62 |
<0,001* |
|
Группа терапии Experimental group |
94 |
86–109 |
35 |
27–39 |
<0,001* |
|
p |
0,194 |
<0,001* |
|||
Динамика показателя АЛТ в зависимости от терапии
Примечание. Здесь и далее: * – статистически значимые различия (p<0,05).
Note. Hereinafter: * – the differences are significant (p<0.05).
h^ группа контроля control group
НН групп?» терапии ^xp^ilт.^.tal srotp
До терапии
Before treatment
После терапии After treatment
Описательная статистика участников
Показатели АЛТ и АСТ определялись перед терапией и после ее окончания. На этапе рандомизации, т.е. перед началом терапии, показатели АЛТ (рис. 1, табл. 2) и АСТ (рис. 2, табл. 3) в группах исследования не имели статистически значимых различий (p=0,194 и
p=0,104 соответственно). По окончании терапии статистически значимое снижение показателей, свидетельствующее об улучшении функции печени, наблюдалось в обеих группах, при этом различия между группами отмечались по обоим показателям (p<0,001).
Рис. 1. Анализ динамики АЛТ
Fig. 1. ALT dynamics
Таблица 3
Table 3
Therapy-specific AST dynamics
|
Группа исследования Study group |
Этапы наблюдения Stages of observation |
p |
|||
|
До терапии Before treatment |
В конце терапии After treatment |
||||
|
Me |
Q1–Q3 |
Me |
Q1–Q3 |
||
|
Группа контроля Control group |
57 |
44–70 |
38 |
36–41 |
<0,001* |
|
Группа терапии Experimental group |
64 |
53–72 |
28 |
24–34 |
<0,001* |
|
p |
0,104 |
<0,001* |
|||
Таблица 4
Table 4
|
Группа исследования Study group |
Этапы наблюдения Stages of observation |
p |
|||
|
До терапии Before treatment |
В конце терапии After treatment |
||||
|
Me |
Q1–Q3 |
Me |
Q1–Q3 |
||
|
Группа контроля Control group |
272 |
266–274 |
272 |
266–273 |
0,149 |
|
Группа терапии Experimental group |
273 |
268–276 |
270 |
267–273 |
<0,001* |
|
p |
0,474 |
0,209 |
|||
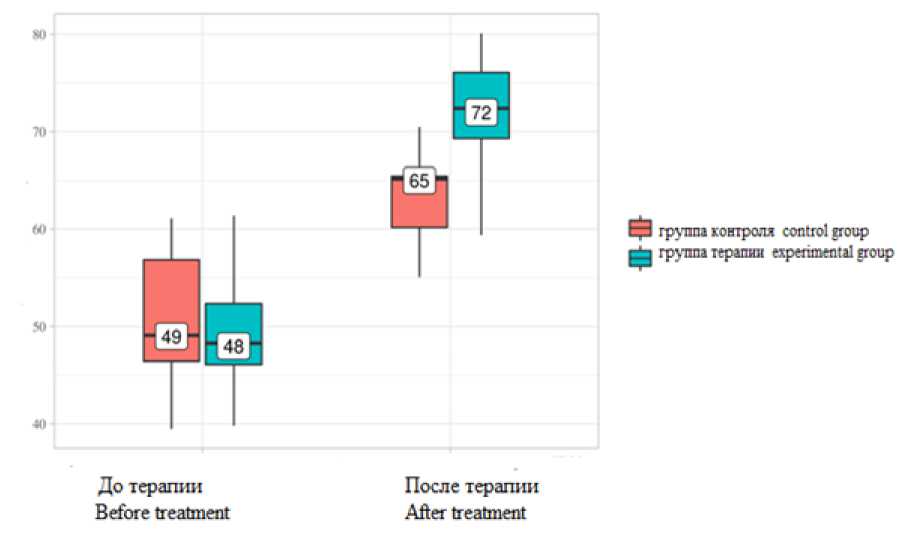
Рис. 4. Анализ динамики показателя качества жизни с помощью опросника SF-36 в экспериментальной и контрольной группах по шкале общего физического благополучия
Fig. 4. Changes in the quality of life index according to SF-36 questionnaire in the experimental and control groups (physical well-being scale)
Таблица 5
Table 5
Динамика показателя качества жизни по шкале общего физического благополучия (опросник SF-36) в группах сравнения
Changes in the quality of life index according to SF-36 questionnaire in the experimental groups (physical well-being scale)
|
Группа исследования Study group |
Этапы наблюдения Stages of observation |
p |
|||
|
До терапии Before therapy |
В конце терапии After therapy |
||||
|
Me |
Q1–Q3 |
Me |
Q1–Q3 |
||
|
Группа контроля Control group |
49 |
46–57 |
65 |
60–65 |
<0,001* |
|
Группа терапии Experimental group |
48 |
46–52 |
72 |
69–76 |
<0,001* |
|
p |
0,39 |
<0,001* |
- |
||
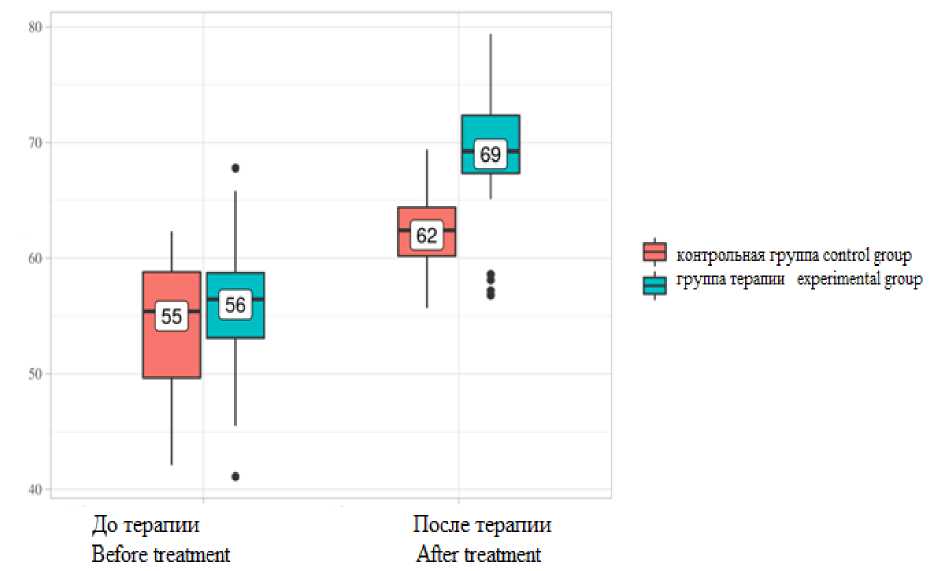
Рис. 5. Анализ динамики показателя качества жизни с помощью опросника SF-36 в экспериментальной и контрольной группах по шкале общего душевного благополучия
Fig. 5. Changes in the quality of life index according to SF-36 questionnaire in the experimental and control groups (mental well-being scale)
Таблица 6
Table 6
Динамика показателя качества жизни по шкале общего душевного благополучия (опросник SF-36) в группах сравнения
Changes in the quality of life index according to SF-36 questionnaire in the experimental groups (mental well-being scale)
|
Группа исследования Study group |
Этапы наблюдения Stages of observation |
p |
|||
|
До терапии Before therapy |
В конце терапии After therapy |
||||
|
Me |
Q1–Q3 |
ME |
Q1–Q3 |
||
|
Группа контроля Control group |
55 |
50–59 |
62 |
60–64 |
<0,001* |
|
Группа терапии Experimental group |
56 |
53–59 |
69 |
67–72 |
<0,001* |
|
p |
0,426 |
<0,001* |
|||
В ходе исследования ни у одного участника не было отмечено нежелательных реакций. Ни один пациент не отказался от участия в исследовании. Все участники принимали препараты в соответствии с данными инструкциями и не пропускали прием дозы.
Обсуждение. В ходе проведенного исследования были получены убедительные данные о нормализации и снижении показателей активности стеатогепатита и улучшении качества жизни на фоне приема препарата сили-бина, синтезированного с применением липосомальных технологий. Несмотря на то что по результатам исследования не было отмечено связи приема препарата со снижением массы тела, получено достоверное уменьшение выраженности стеатоза по результатам транзи-ентной эластографии с функцией САР в группе терапии, что является крайне важным параметром, требующим дальнейшего исследования возможности применения препарата. В опубликованных ранее работах отмечалось уменьшение фиброза печени на фоне приема силимарина при НАЖБП у 22 % пациентов по сравнению с 6 % в контрольной группе [17]. Использование липосомальной технологии при увеличении длительности курса терапии открывает новые перспективы для дальнейшего изучения влияния силимарина на фиброз
печени. Препарат имеет высокий профиль безопасности, что подтверждено отсутствием нежелательных явлений.
При плановом обследовании перед вакцинацией, проведенном по завершении исследования, у 14 пациентов из группы терапии и 5 пациентов контрольной группы были выявлены антитела к новой коронавирусной инфекции. При ретроспективном анализе удалось установить, что пациенты с ранее верифицированной НАЖБП переболели COVID-19 за 1–3 мес. до включения в исследование (медиана – 51 день); заболевание протекало по типу ОРЗ. У данной группы пациентов было отмечено снижение показателей активности цитолиза, что при отсутствии группы сравнения в настоящее время не может считаться достоверным и требует дальнейшего изучения.
Заключение. Применение препарата «Липолив» в терапии НАЖБП позволяет добиться нормализации показателей функции печени, уменьшить выраженность стеатоза печени, улучшить качество жизни пациентов. Применение препарата у пациентов в комплексной терапии после перенесенной новой коронавирусной инфекции и его влияние на фиброз печени требуют дальнейшего изучения.
Список литературы Применение липосомальных технологий в доставке силибина в печень у пациентов с неалкогольной жировой болезнью печени
- Dufour J.F., Scherer R., BalpM., McKenna S.J., Janssens N., Lopez P., Pedrosa M. The global epidemiology of nonalcoholic steatohepatitis (NASH) and associated risk factors - A targeted literature review. Endocrine and Metabolic Science. 2021; 3. DOI: https://doi.org/10.1016/j.endmts.2021.100089.
- Huang D.Q., El-Serag H.B., Loomba R. Global epidemiology of NAFLD-related HCC: trends, predictions, risk factors and prevention. Nat Rev Gastroenterol Hepatol. 2021; 18: 223-238. DOI: https://doi.org/10.1038/s41575-020-00381-6.
- White D.L., Kanwal F., El-Serag H.B. Association between nonalcoholic fatty liver disease and risk for hepatocellular cancer, based on systematic review. Clin. Gastroenterol. Hepatol. 2012; 10: 1342-1359.
- ClinicalTrials.gov. URL: https://clinicaltrials.gov/ct2/results?cond=nafld&term=&cntry=&state=&city= &dist (дата обращения: 18.10.2022).
- Bulbake U., Doppalapudi S., Kommineni N., Khan W. Liposomal Formulations in Clinical Use: An Updated Review. Pharmaceutics. 2017; 9 (2): 12. DOI: 10.3390/pharmaceutics9020012.
- Lee Y., Choi S.Q. Quantitative analysis for lipophilic drug transport through a model lipid membrane with membrane retention. Eur J Pharm Sci. 2019; 134: 176-184. DOI: 10.1016/j.ejps.2019.04.020.
- Zhong S., Fan Y., Yan Q., Fan X., Wu B., Han Y., Zhang Y., Chen Y., Zhang H., Niu J. The therapeutic effect of silymarin in the treatment of nonalcoholic fatty disease: A meta-analysis (PRISMA) of randomized control trials. Medicine (Baltimore). 2017; 96 (49): e9061. DOI: 10.1097.
- BijakM. Silybin, a Major Bioactive Component of Milk Thistle (Silybum marianum L. Gaernt.) - Chemistry, Bioavailability, and Metabolism. Molecules. 2017; 22 (11): 1942. DOI: 10.3390/mole-cules22111942.
- Taleb A., Ahmad K.A., Ihsan A., Qu J., Lin N., Hezam K., Koju N., Hui L., Qilong D. Antioxidant effects and mechanism of silymarin in oxidative stress induced cardiovascular diseases. Biomedicine & Pharmacotherapy. 2018; 102: 689-698.
- Vargas-Mendoza N., Madrigal-Santillán E., Morales-González A. Hepatoprotective effect of silymarin. World J Hepatol. 2014; 6 (3): 144-149. DOI: 10.4254/wjh.v6.i3.144.
- Voroneanu L., Nistor I., Dumea R., Apetrii M., Covic A. Silymarin in Type 2 Diabetes Mellitus: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. J Diabetes Res. 2016; 2016: 5147468. DOI: 10.1155/2016/5147468.
- Широкова Е.Н., Павлов Ч.С., Карасева А.Д., Алиева А.М., Седова А.В., Ивашкин В.Т. Эластография в диагностике неалкогольной жировой болезни печени. Вестник РАМН. 2019; 74 (1): 5-13. DOI: 10.15690/vramn1071.
- Sandrin L., Oudry J., Bastard C. Non-Invasive Assessment of Liver Fibrosis by Vibration-Controlled Transient Elastography (Fibroscan®). In: Takahashi H. (Ed.). Liver Biopsy, InTech, Chapter 19. 2011. DOI: http://dx.doi.org/10.5772/20729.
- Mikolasevic I., Orlic L., Franjic N. Transient elastography (FibroScan) with controlled attenuation parameter in the assess-ment of liver steatosis and fibrosis in patients with nonalcoholic fatty liver disease - where do we stand? World J Gastroenterol. 2016; 22 (32): 7236-7251. DOI: 10.3748/wjg.v22.i32. 7236.21.
- Castera L., Forns X., Alberti A. Non-invasive evaluation of liver fibrosis using transient elastography. J Hepatol. 2008; 48 (5): 835-847. DOI: 10.1016/j.jhep.2008.02.008.
- Kleiner D., Brunt E., Van Natta M. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology. 2005; 41 (6): 1313-1321. DOI: 10.1002/hep.20701.
- Zaman A. Silymarin Associated with Improved Fibrosis in Nonalcoholic Steatohepatitis. NEJM. J Watch. Gastroenterology. 2017. URL: https://www.jwatch.org/na44042/2017/05/09/silymarin-associated-with-improved-fbrosis-nonalcoholic (дата обращения: 18.10.2022).


