Применение методов неинвазивной кардиовизуализации при катетерной аблации желудочковых тахикардий
Автор: Романов А.Б., Минин С.М., Шаяхметова С.В., Никитин Н.А., Филиппенко А.Г., Михеенко Игорь Леонидович, Моржанаев Е.А., Перегудов И.С., Лосик Д.В., Шабанов В.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 3 т.24, 2020 года.
Бесплатный доступ
Несмотря на развитие технологий диагностики и интраоперационной навигации катетерная аблация желудочковых тахикардий у пациентов с ишемической болезнью сердца является нерешенной проблемой, что связано с электрической разнородностью миокарда, поврежденного вследствие ишемии, и, как результат, возникновением циклов реентри. Представленный клинический случай является частью исследования, направленного на поиск персонифицированного подхода к аблации желудочковых тахикардий различных нозологий. 53-летний мужчина с ишемической болезнью сердца, постинфарктным кардиосклерозом, стентированием правой коронарной артерии и пароксизмальной желудочковой тахикардией поступил в кардиохирургическое отделение нарушений ритма сердца. За последнее время пароксизмы аритмии участились до нескольких раз в месяц, несмотря на антиаритмическую терапию. При поступлении пациент предъявлял жалобы на учащенное сердцебиение, слабость, дискомфорт в области грудной клетки. Медикаментозная терапия включала беталок, кардиомагнил, розувастатин. Пациенту предложили участвовать в исследовании по персонифицированному подходу к аблации желудочковых нарушений ритма сердца. После включения в исследование пациенту выполнили однофотонную эмиссионную компьютерную томографию миокарда с перфузионным и нейротропным радиофармацевтическими препаратами, а также магнитно-резонансную томографию сердца с контрастированием. В процессе оперативного вмешательства осуществили таргетную аблацию с купированием тахикардии и невозможностью последующей индукции, а затем гомогенизацию субстрата до исчезновения патологических потенциалов. Представленный клинический случай демонстрирует возможность применения методов неинвазивной визуализации для разработки персонифицированного подхода к аблации желудочковой тахикардии у пациентов с ишемической болезнью сердца. Однако диагностическая точность, прогностическая возможность и целесообразность использования методов требуют дальнейшего изучения.
Автономная нервная система, желудочковая тахикардия, катетерная аблация, клинический случай, магнитно-резонансная томография сердца, метайодбензилгуанидин, однофотонная эмиссионная компьютерная томография
Короткий адрес: https://sciup.org/142230744
IDR: 142230744 | DOI: 10.21688/1681-3472-2020-3-138-144
Текст научной статьи Применение методов неинвазивной кардиовизуализации при катетерной аблации желудочковых тахикардий
Романов А.Б., Минин С.М., Шаяхметова С.В., Никитин Н.А., Филиппенко А.Г., Михеенко И.Л., Моржанаев Е.А., Перегудов И.С., Лосик Д.В., Шабанов В.В. Применение методов неинвазивной кардиовизуализации при катетерной аблации желудочковых тахикардий. Патология кровообращения и кардиохирургия. 2020;24(3):138-144.
А.Б. Романов,
С.Н. Минин,
Н.А. Никитин,
А.Г. Филиппенко, И.Л. Михеенко, Е.А. Моржанаев, И.С. Перегудов, Д.В. Лосик,
В.В. Шабанов,
Несмотря на развитие технологий нефлюороскопических навигационных систем катетерная аблация желудочковых тахикардий (ЖТ) является одним из наиболее сложных интервенционных вмешательств. В свою очередь, у пациентов с ишемической болезнью сердца после инфаркта миокарда возможно наличие нескольких типов ЖТ вследствие неоднородности рубцового повреждения миокарда левого желудочка (ЛЖ). Это приводит к многочисленным аблационным воздействиям в соответствующих областях, однако далеко не всегда удается эффективно устранить все типы желудочковых тахикардий. Персонифицированный подход при катетерной аблации ЖТ у пациентов с ишемической болезнью сердца отсутствует. Для решения данной проблемы рассматривается ряд методик неинвазивной кардиовизуализации, однако их преимущества и недостатки, как и целесообразность применения, остаются предметом дискуссий. Данный клинический случай демонстрирует возможность применения современных методов неинвазивной кардиовизуализации как для планирования оперативного вмешательства при аблации ЖТ, так и для оценки полноты проведенного воздействия.
Клинический случай
53-летний мужчина поступил в кардиохирургическое отделение нарушений ритма сердца ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России. Ишемическая болезнь сердца. Постинфарктный кардиосклероз. Пароксизмальная желудочковая тахикардия. Артериальная гипертензия III стадии, степень 3, риск 4. Хроническая сердечная недостаточность 2А, II функциональный класс по классификации Нью-Йоркской ассоциации кардиологов (англ. New York Heart Association, NYHA). В 2015 г. пациент перенес острый инфаркт миокарда, выполнена чрескожная транслюминальная ангиопластика со стентированием правой коронарной артерии. После реваскуляризации сохранялись признаки снижения систолической функции левого желудочка (ЛЖ). С 2016 г. пациент стал отмечать приступы учащенного сердцебиения, возникающие спонтанно. По серии записей электрокардиографии регистрировалась ЖТ с частотой сердечных сокращений от 140 до 180 в минуту и морфологией блокады правой ножки пучка Гиса.
Приступы тахикардии сопровождались умеренным ухудшением гемодинамики. Пациент неоднократно был госпитализирован в стационар по месту жительства для восстановления ритма. За последнее время пароксизмы ЖТ участились до нескольких раз в месяц, несмотря на антиаритмическую терапию. При поступлении пациент предъявлял жалобы на учащенное сердцебиение, слабость, дискомфорт в области грудной клетки. Медикаментозная терапия включала беталок, кардиомагнил, розувастатин.
Обследование при поступлении
По данным электрокардиографии, ритм синусовый, ширина QRS — 110 мс, интервал QT — 410 мс. Признаки крупноочаговых рубцовых изменений миокарда нижней стенки левого желудочка. По данным эхокардиографии, полости обоих предсердий не увеличены, толщина межжелудочковой перегородки — 1,3 см, задняя стенка ЛЖ — 1,2 см, конечный диастолический объем ЛЖ — 163 мл, конечный систолический объем ЛЖ — 100 мл, фракция выброса ЛЖ — 39 %. Выявлен склероз и акинез нижнесептального, нижнего сегментов базального и перегородочного отделов левого желудочка.
Пациенту предложено участие в исследовании по планированию оперативного вмешательства на основе неинвазивной кардиовизуализации при аблации ЖТ с комплексной интра- и послеоперационной оценкой эффективности проведенного воздействия. Исследование одобрено экспертным советом и локальным этическим комитетом ФГБУ «НМИЦ им. ак. Е.Н. Мешал-кина» Минздрава России в соответствии c принципами надлежащей клинической практики (англ. Good clinical practice) и Хельсинкской декларации. Пациент подписал информированное согласие на участие в исследовании.
Для разработки персонифицированной стратегии оперативного лечения пациенту выполнили дополнительные исследования — однофотонную эмиссионную компьютерную томографию (ОФЭКТ) миокарда с перфузионным (99mТехнеция-метоксибутилизонтрил (99mТс-МИБИ)) и нейротропным (123Йод-метайодбензил-гуанидин (123I-МИБГ)) радиофармацевтическими препаратами, а также магнитно-резонансную томографию (МРТ) сердца с контрастированием.
Однофотонная эмиссионная компьютерная томография миокарда
Выполняли ОФЭКТ миокарда на двухдетекторной гамма-камере (Infinia Hewkeye, GE Healthcare, Израиль)
Рис. 1. Двухизотопная однофотонная эмиссионная компьютерная томография миокарда с 123I-МИБГ/99mТс-МИБИ демонстрирует зону несоответствия нарушений симпатической иннервации (А) и перфузии (Б) миокарда, локализованную преимущественно в средних и базальных сегментах нижней стенки, нижне-боковой и нижнеперегородочной области левого желудочка — сегменты 3–5, 9–11 (стрелка на рис. А, треугольник на рис. B).
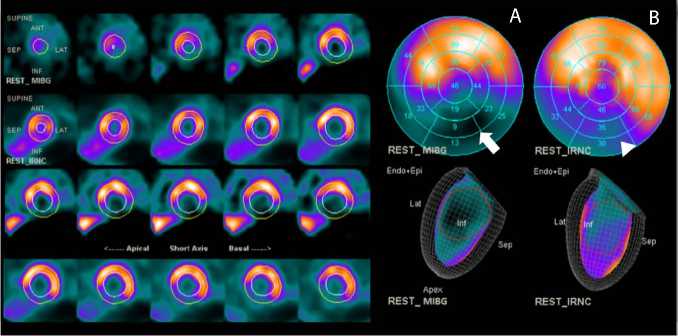
за 1–2 дня перед оперативным вмешательством. Протокол исследования включал оценку миокардиальной перфузии и симпатической иннервации миокарда левого желудочка. Для оценки перфузии использовали 99mТс-МИБИ в дозе 570 МБк, для оценки симпатической иннервации — 123I-МИБГ в дозе 350 МБк. Подготовку пациента к исследованиям и сбор данных выполняли в соответствии с актуальными рекомендациями отраслевых профессиональных сообществ [1; 2]. При анализе полученных изображений использовали 17-сег-ментарную модель миокарда ЛЖ и 5-балльную шкалу выраженности нарушений перфузии и иннервации в каждом сегменте, где 0 баллов — накопление радиофармацевтического препарата в сегменте ≥ 70 % от максимума, 1 балл — 50–69 %, 2 балла — 30–49 %, 3 балла — 10–29 %, 4 балла — <10 %. Таким образом, подсчитывали суммарный индекс нарушения иннервации миокарда и перфузии миокарда. По результатам исследования выявили зону несоответствия выраженности нарушений иннервации и перфузии в виде более выраженного снижения симпатической активности миокарда в сегментах нижней стенки, нижнеперегородочной и нижне-боковой областей ЛЖ, индекс нарушения иннервации миокарда — 27 баллов, перфузии миокарда — 11 баллов, количество сегментов с несоответствием перфузии и иннервации — 8 (рис. 1).
Магнитно-резонансная томография сердца с контрастированием
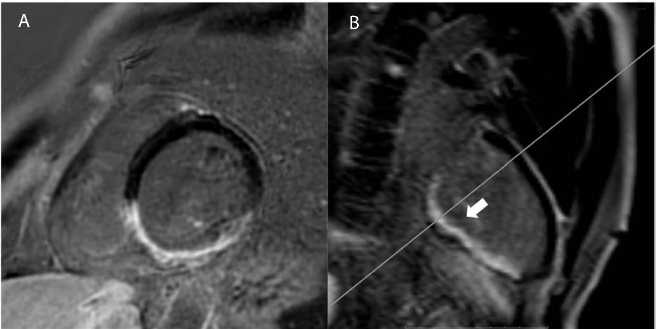
Выполняли исследования на аппарате c напряженностью магнитного поля 1,5 Тл (Intera Achieva, Philips, Нидерланды) за 1 день перед оперативным вмешательством и через 7 дней после него. Для сбора данных использовали специализированную сердечную катушку, синхронизацию с электрокардиографией и дыханием пациента, а также внутривенное введение контрастного препарата (КП) на основе гадолиния в дозе из расчета 0,1 ммоль на 1 кг веса пациента. Протокол МРТ включал получение изображений сердца для морфологической и функциональной оценки, в том числе в режиме кино-МРТ, а также для оценки отсроченного накопления КП в миокарде ЛЖ через 10–15 мин после введения. Проводили изображения, ориентированные по короткой оси, с разметкой на всем протяжении ЛЖ (от уровня митрального клапана до верхушки). По данным предоперационного исследования выявили зоны трансмурального накопления КП миокардом в сегментах нижней стенки и частично нижнеперегородочной области ЛЖ с признаками негомогенности МР-сигнала в виде небольших участков, в которых накопление КП отсутствовало (рис. 2).
Согласно клиническим рекомендациям, результатам анамнеза и обследования, неэффективности антиарит-мической терапии приняли решение о катетерной аблации желудочковой тахикардии [3].
Катетерная аблация
Оперативное вмешательство выполняли под интубационным наркозом. В полость правого желудочка и коронарного синуса установили диагностические катетеры. При электрофизиологическом исследовании программной стимуляцией правого желудочка с 4 экстрастимулами индуцировали пароксизмы ЖТ с разными циклами от 400 до 320 мс по типу блокады правой ножки пучка Гиса. После пункции межпредсердной перегородки, согласно протоколу исследования, проводили построение вольтаж-ной 3D-реконструкции ЛЖ (с помощью навигационной системы CARTO 3, Biosense Webster, US, модуль Confidence, Continuous mapping) на фоне стимуляции
Рис. 2. Магнитно-резонансная томография сердца с контрастированием перед оперативным вмешательством. Изображения с отсроченным контрастированием миокарда в плоскости по короткой оси (А) и двухкамерной плоскости по длинной оси левого желудочка (B) демонстрируют трансмуральное (>50%) накопление контрастного препарата миокардом нижней стенки в базальном, среднем и верхушечном отделах. Стрелкой указан участок негомогенности МР-сигнала в среднем и базальном отделах нижней стенки левого желудочка
правого желудочка и коронарного синуса для поиска патологических сигналов. Выявили низкоамплитудную зону, соответствующую рубцовой ткани с многочисленными патологическими сигналами (фрагментированными, поздними диастолическими, низкоамплитудными потенциалами) в области базальных отделов нижней стенки ЛЖ, что соотносилось с данными предоперационной неинвазивной визуализации (рис. 3, А). Основываясь на интраоперационных данных, результатах ОФЭКТ миокарда и МРТ сердца, определили таргетную область воздействия. После картирования возник стойкий пароксизм ЖТ с частотой сердечных сокращений 180 в минуту, выполнили построение активационной карты ЛЖ во время тахикардии с удовлетворительными показателями гемодинамики. Провели таргетную аблацию в данной области с купированием тахикардии и невозможностью последующей индукции. Далее, согласно протоколу исследования, выполнили гомогенизацию субстрата до исчезновения патологических потенциалов (рис. 3, B).
Перед выпиской по данным 24-часового холтеровского мониторирования электрокардиографии:
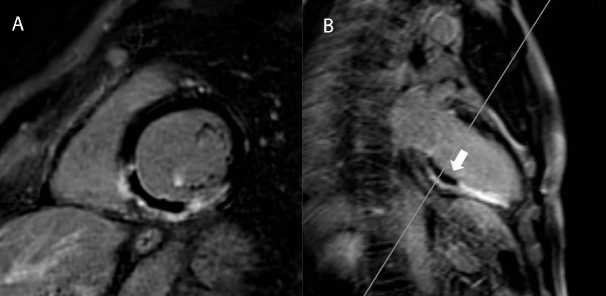
синусовый ритм с частотой сердечных сокращений 55–112 в минуту, пароксизмов ЖТ не зарегистрировано. При контрольной МРТ сердца с контрастированием, по сравнению с предоперационным исследованием, выявлены признаки гомогенизации рубцовых изменений миокарда в базальных отделах нижней стенки и межжелудочковой перегородки в местах воздействий (рис. 4). За период наблюдения 2 мес. пароксизмы ЖТ у пациента не регистрировались.
Обсуждение
Катетерная аблация желудочковых тахикардий у пациентов с ишемической болезнью сердца является нерешенной проблемой несмотря на развитие технологий диагностики и интраоперационной навигации. Одна из причин — электрическая разнородность поврежденного ишемией миокарда, что создает условия для возникновения нескольких циклов реентри. В свою очередь, воздействие на патологические сигналы в данных областях сопряжено с многочисленным повреждением ткани миокарда ЛЖ для создания однородности (гомогенизации) субстрата аритмии.
Рис. 3. ЗD-реконструкция левого желудочка при стимуляционном картировании с последующей тар-гетной аблацией. Стимуляционное картирование с 3D-реконструкцией левого желудочка (А): розовые точки — патологические сигналы (фрагментированные, поздние диастолические, низкоамплитудные потенциалы); белыми линиями воспроизведена 17-сегментраная модель левого желудочка; красная линия — область таргетного воздействия, соответствующая данным однофотонной эмиссионной компьютерной томографии миокарда и магнитно-резонансной томографии сердца. 3D-реконструкция левого желудочка с аблационными воздействиями в таргетной области с последующей аблацией в областях с патологическими сигналами (красные точки, B)
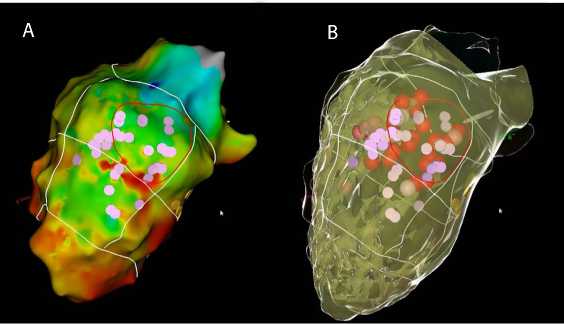
Рис.4. Магнитно-резонансная томография сердца с контрастированием через 7 дней после оперативного вмешательства. Изображения с отсроченным контрастированием миокарда в плоскости по короткой оси (А) и в двухкамерной плоскости по длинной оси левого желудочка (B) демонстрируют отсутствие визуализированного ранее контрастирования на 75% толщины миокарда в базальных отделах межжелудочковой перегородки и нижней стенки левого желудочка (стрелки)
Поиск методов персонифицированного таргетного воздействия на область аритмии является актуальным.
По результатам небольших ретроспективных исследований методы неинвазивной кардиовизуализации использовались как для планирования оперативного вмешательства [4; 10], так и для прогнозирования клинического эффекта после операции [5; 11]. В работе A. Gimelli с соавт. показано, что сегменты миокарда ЛЖ, демонстрирующие при двухизотопной ОФЭКТ с 99mTc-тетрафосмином и 123I-МИБГ несоответствие перфузии и симпатической иннервации, наиболее часто содержат источники патологической электрофизиологической активности, являющиеся целью аблации при желудочковой тахикардии [4]. Кроме этого, данная группа исследователей установила, что уменьшение количества сегментов миокарда ЛЖ, демонстрирующих несоответствие перфузии и симпатической иннервации через 1 мес. после аблации, может являться предиктором позитивного клинического эффекта оперативного вмешательства [5]. Абсолютные противопоказания к радиоизоптному исследованию отсутствуют, однако ограничением может служить индивидуальная непереносимость радиофармацевтического препарата у пациента.
МРТ сердца с оценкой отсроченного накопления контрастного препарата является широко распространенной методикой для визуализации рубцовых изменений в миокарде левого желудочка. Наличие рубца, визуализированного с помощью МРТ с отсроченным контрастированием, является независимым предиктором внезапной сердечной смерти и рецидивирующей желудочковой тахикардии [6].
Однако некоторые виды рубцов могут быть более аритмогенными, чем другие. Наличие гетерогенной ткани в участках между рубцом и неповрежденным миокардом чаще наблюдается у пациентов с ЖТ, по сравнению с больными без нее, сопоставимыми по возрасту, полу, локализации инфаркта и фракции выброса левого желудочка [7]. Задача МР-ди-агностики заключается в том, чтобы обеспечить наиболее точное разграничение аритмогенного и неаритмогенного участка рубцовой ткани с целью проведения субстрат-направленной аблации. Недавно обнаружено, что такой показатель, как энтропия — распределение интенсивности сигнала в рубцовой ткани, — может быть ключевым для верификации аритмогенных и неаритмогенных рубцов в миокарде [8]. Тем не менее вопрос о том, насколько точно может МРТ идентифицировать конкретные участки ткани, участвующие в цепи ЖТ, открыт. В отдельных клинических исследованиях МРТ сердца с контрастированием продемонстрировала возможность выявлять в структуре рубцовых изменений миокарда ЛЖ участки неоднородности МР-сигнала, которые соответствуют субстрату, инициирующему желудочковую тахикардию [9]. В работе D. Andreu с соавт. показано, что паттерны распределения рубцовых изменений в миокарде ЛЖ при МРТ могут применяться для дифференцировки эпи- и эндокардиальной локализации субстрата ЖТ и таким образом быть полезными для планирования аблации [10]. Кроме этого, в исследовании на животных H.L. Estner с соавт. показали возможность использования МРТ сердца с контрастированием для оценки полноты гомогенизации рубцовой ткани после радиочастотной аблации желудочковой тахикардии. Так, сохранение индуцибельности ЖТ спустя 1 нед. после аблации наблюдалось лишь в тех случаях, где МРТ демонстрировала неполную гомогенизацию рубцовой ткани, и отсутствовало в тех случаях, где рубцовая ткань выглядела однородной [11]. Способность четко визуализировать участки аблационного воздействия с помощью МРТ может быть использована в качестве потенциально новой процедурной конечной точки, чтобы судить, проведена ли аблация в достаточном объеме.
Однако весомым ограничением для выполнения МРТ сердца с контрастированием пациентам с ЖТ является имплантированный кардиовертер-дефибриллятор. Существуют сообщения как о выходе из строя МР-несовместимых устройств, так и об ограничении визуализации > 50 % сегментов из-за артефактов от электродов на сериях изображений с отсроченным накоплением контрастного препарата [12 ;13].
Клинический случай является частью исследования, направленного на поиск персонифицированного подхода к аблации ЖТ различных нозологий. Представленные методы кардиовизуализации продемонстрировали первые позитивные результаты в данном направлении. Требуются исследования на большей когорте пациентов с отдаленным периодом наблюдения для подтверждения полученных результатов.
Заключение
Представленный клинический случай демонстрирует возможность применения методов неинвазивной кардиовизуализации для планирования оперативного вмешательства при аблации ЖТ с комплексной интра- и послеоперационной оценкой эффективности воздействия у пациента с ишемической болезнью сердца. Однако диагностическая точность, прогностическая возможность и целесообразность использования методов требуют дальнейшего изучения.
Список литературы Применение методов неинвазивной кардиовизуализации при катетерной аблации желудочковых тахикардий
- Verberne H.J., Acampa W., Anagnostopoulos C., Ballinger J., Bengel F., De Bondt P., Buechel R.R., Cuocolo A., van Eck-Smit B.L., Flotats A., Hacker M., Hindorf C., Kaufmann P.A., Lindner O., Ljungberg M., Lonsdale M., Manrique A., Minarik D., Scholte A.J., Slart R.H., Tragárdh E., de Wit T.C., Hesse B., European Association of Nuclear Medicine (EANM). EANM procedural guidelines for radionuclide myocardial perfusion imaging with SPECT and SPECT/CT: 2015 revision. Eur J Nucl Med Mol Imaging. 2015;42(12):1929-1940. https://doi.org/10.1007/s00259-015-3139-x
- Bombardieri E., Giammarile F., Aktolun C., Baum R.P., Bischof Delaloye A., Maffioli L., Moncayo R., Mortelmans L., Pepe G., Reske S.N., Castellani M.R., Chiti A. 131I/123I-metaiodobenzylguanidine (mlBG) scintigraphy: procedure guidelines for tumour imaging. Eur J Nucl Med Mol Imaging. 2010;37(12):2436-2446. https://doi.org/10.1007/ s00259-010-1545-7
- Al-Khatib S.M., Stevenson W.G., Ackerman M.J., Bryant WJ., Callans D.J., Curtis A.B., Deal B.J., Dickfeld T., Field M.E., Fonarow G.C., Gillis A.M., Granger C.B., Hammill S.C., Hlatky M.A., Joglar J.A., Kay G.N., Matlock D.D., Myerburg R.J., Page R.L. 2017 AHA/ACC/HRS Guideline for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the HeartRhythm Society. Circulation. 2018;138(13):e210-271. https://doi.org/10.1161/ CIR.0000000000000548
- Gimelli A., Menichetti F., Soldati E., Liga R., Vannozzi A., Marzullo P., Bongiorni M.G. Relationships between cardiac innervation/perfusion imbalance and ventricular arrhythmias: impact on invasive electrophysiological parameters and ablation procedures. Eur J Nucl Med Mol Imaging. 2016;43(13):2383-2391. https://doi.org/10.1007/s00259-016-3461-y
- Gimelli A., Menichetti F., Soldati E., Liga R., Scelza N., Zucchelli G., Cori A.D., Segreti L., Vannozzi A., Bongiorni M.G., Marzullo P. Predictors of ventricular ablation's success: Viability, innervation, or mismatch? J Nucl Cardiol. 2019. https://doi. org/10.1007/s12350-018-01575-x
- John R.M., Tedrow U.B., Koplan B.A., Albert C.M., Epstein L.M., Sweeney M.O., Miller A.L., Michaud G.F., Stevenson W.G. Ventricular arrhythmias and sudden cardiac death. Lancet. 2012;380(9852):1520-1529. https://doi. org/10.1016/S0140-6736(12)61413-5
- Perez-David E., Arenal A., Rubio-Guivernau J.L., del Castillo R., Atea L., Arbelo E., Caballero E., Celorrio V., Datino T., Gonzalez-Torrecilla E., Atienza F., Ledesma-Carbayo MJ., Bermejo J., Medina A., Fernández-Avilés F. Noninvasive identification of ventricular tachycardia related conducting channels using contrast-enhanced magnetic resonance imaging in patients with chronic myocardial infarction: comparison of signal intensity scar mapping and endocardial voltage mapping. J Am Coll Cardiol. 2011;57(2):184-194. https://doi.org/10.1016Xi. jacc.2010.07.043
- Androulakis A.F.A., Zeppenfeld K., Paiman E.H.M., Venlet J., Glashan C.A., Schalij MJ., Van Der Geest R.J., Tao Q. Scar transmurality and composition derived from LGE MRI predicts VT in post-infarct patients. EP Europace. 2017;19(Suppl 3):iii145. https://doi.org/10.1093/ehici/eux149.003
- Mukherjee R.K., Whitaker J., Williams S.E., Razavi R., O'Neill M.D. Magnetic resonance imaging guidance for the optimization of ventricular tachycardia ablation. Europace. 2018;20(11):1721-1732.
- Andreu D., Ortiz-Pérez J.T., Boussy T., Fernández-Armenta J., de Caralt T.M., Perea RJ., Prat-González S., Mont L., Brugada J., Berruezo A. Usefulness of contrast-enhanced cardiac magnetic resonance in identifying the ventricular arrhythmia substrate and the approach needed for ablation. Eur Heart J. 2014;35(20):1316-1326. https://doi.org/10.1093/eurheartj/eht510
- Estner H.L., Zviman M.M., Herzka D., Miller F., Castro V., Nazarian S., Ashikaga H., Dori Y., Berger R.D., Calkins H., Lardo A.C., Halperin H.R. The critical isthmus sites of ischaemic ventricular tachycardia are in zones of tissue heterogeneity, visualised by magnetic resonance imaging. Heart Rhythm. 2011 ;8(12):1942-1949. https://doi.org/10.1016/j.hrthm.2011.07.027
- Roguin A., Schwitter J., Vahlhaus C., Lombardi M., Brugada J., Vardas P., Auricchio A., Priori S., Sommer T. Magnetic resonance imaging in individuals with cardiovascular implantable electronic devices. Europace. 2008;10:336-346. https://doi. org/10.1093/europace/eun021
- Mesubi O., Ahmad G., Jeudy J., Jimenez A., Kuk R., Saliaris A., See V., Shorofsky S., Dickfeld T. Impact of ICD artifact burden on late gadolinium enhancement cardiac MR imaging in patients undergoing ventricular tachycardia ablation. Pacing Clin Electrophysiol. 2014;37:1274-1283. https://doi.org/10.1111/ pace.12405


