Применение ниволумаба при раке толстой кишки с синдромом Линча. Клиническое наблюдение
Автор: Хакимова Г.Г., Трякин А. А., Хакимов Г. А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинический случай
Статья в выпуске: 1 т.10, 2020 года.
Бесплатный доступ
Синдром Линча (СЛ), возникающий в результате нарушений репарации неспаренных оснований ДНК, характеризуется повышенным риском развития рака толстой кишки, эндометрия и мочевыводящих путей. Независимо от типа опухоли, иммунотерапия ингибиторами контрольных точек (ИКТ) была одобрена для лечения пациентов с неоперабельными или метастатическими опухолями с нарушением системы репарации ДНК (dMMR), что может быть опцией для лечения пациентов с СЛ. В статье описывается клиническое наблюдение пациентки с герминальной мутацией MLH1 и с первично-множественными злокачественными образованиями ободочной кишки, получавшей лечение ниволумабом в течение 26 месяцев. Это наблюдение демонстрирует успех иммунотерапии после 6 линий химиотерапии, подразумевая потенциальный контроль опухолевого роста у пациентов с СЛ.
Иммунотерапия, рак толстой кишки, микросателлитная нестабильность, анти- pd-1-моноклональные антитела, ниволумаб, пембролизумаб
Короткий адрес: https://sciup.org/140251215
IDR: 140251215 | DOI: 10.18027/2224-5057-2020-10-41-48
Текст научной статьи Применение ниволумаба при раке толстой кишки с синдромом Линча. Клиническое наблюдение
Синдром Линча — высокопенетрантный аутосомно-доминантный наследственный онкологический синдром, ассоциированный с повышенным риском развития злокачественных новообразований (ЗНО) желудочно-кишечного тракта, в первую очередь рака толстой кишки (РТК), а также рака эндометрия у женщин [1]. Ежегодно в мире диагностируется около 36–60 тыс. случаев РТК, ассоциированных с СЛ [2]. По данным популяционных исследований, СЛ диагностируют в 1 из 35 вновь зарегистрированных случаев РТК [3]. Окончательный диагноз СЛ основан на выявлении герминальных мутаций в генах системы репарации неспаренных оснований ДНК (dMMR), главным образом, генов MLH1, PMS2, MSH2 и MSH6. Дефекты белков системы MMR обычно приводят к накоплению генетических ошибок во время репликации ДНК, что отражается в виде высокого уровня микросател-литной нестабильности (MSI-H) генома [4].
Ниволумаб — антитело против рецептора запрограммированной клеточной гибели- 1 (PD-1) — демонстрирует эффективность при опухолях с MSI-H или с дефицитом системы MMR (dMMR). В настоящее время иммунотерапия является вариантом выбора у пациентов с метастатическим КРР с MSI, начиная со второй линии терапии, а также, по последним данным, может применяться у пациентов и в первой линии [5,6]. Так как высокий уровень микроса-теллитной нестабильности выявляется у 20–15% пациентов с локализованным раком толстой кишки, а при с метастатическом — только у 2–4% [7], возможно, в будущем, иммунотерапия будет назначаться и при ранних стадиях рака толстой кишки.
Представляем клиническое наблюдение больной первично-множественным злокачественным образованием ободочной кишки с синдромом Линча.
Пациентка 1940 г. р., в апреле 2013 г. поступила в Ташкентский городской филиал Республиканского специализированного научно-практического центра онкологии и радиологии с рецидивом рака ободочной кишки в брюшной полости. Из анамнеза: первично-множественный метахронный рак ободочной кишки. Состояние после правосторонней гемиколэктомии в 1980 г. Рак сигмовидной кишки, состояние после резекции сигмовидной кишки с формированием анастомоза в 2008 г. Осложнение: перфорация дивертикула дистальнее анастомоза, перитонит, по поводу чего была выполнена операция Гартмана. Рак нисходящей ободочной кишки. Состояние после резекции ободочной кишки в 2010 г. Рецидив в ложе удаленной опухоли от ноября 2012 г. Гистологическое заключение: аденокарцинома, G2. Иммуногистохимическое заключение: мутаций KRAS, NRAS, BRAF не выявлено. Молекуляр-
|
Первично-множественный метахронный рак ободочной кишки 09.04.2013 г |
|
|
II-линия FOLFIRI (9 курсов) Бевацизумаб (с 5 курсом) J Капецитабин (8 мес.) |
РЭА — 11нг/мл (10.04.2013 г.) 1 РЭА — 2,04нг/мл, СА19.9 — 8,29 Е/мл (15.08.2013 г.) |
|
Прогрессирование |
|
|
III-линия FOLFIRI (14 курсов) + Цетуксимаб (+ 13 мес.) |
КТ ОБП — рост очагов по брюшине. Рост рецидивной опухоли. РЭА — 11,55 нг/мл, СА19.9 — 18,82 Е/мл (08.04.2014г.) РЭА — 0,64нг/мл, СА19.9 — 5,2 Е/мл (04.10.2014г.) |
|
Прогрессирование |
|
|
IV-линия FOLFIRI (11 курсов) + Цетуксимаб (+ 13 мес.) J |
КТ ОБП — рост очагов по брюшине. Рост рецидивной опухоли. РЭА — 5,02 нг/мл, СА19.9 — 12,73 Е/мл (03.11.2015г.) |
|
Прогрессирование |
|
|
V-линия FOLFOX ( 12 курсов) + Бевацизумаб (+9 мес.) |
КТ ОБП — рост рецидивной опухоли. Частичная кишечная непроходимость. РЭА — 18,48 нг/мл (12.08.2016г.) РЭА — 2,7 нг/мл (22.01.2017г.) |
|
Прогрессирование |
|
|
VI- линия FOLFIRI (10курсов) + Цетуксимаб 1 |
КТ ОБП — частичная кишечная непроходимость. V РЭА — 18,4 нг/мл (28.10.2017г.) |
|
Прогрессирование |
|
|
VI-линия (Ниволумаб) |
КТ ОБП — рост рецидивной опухоли. Болевой синдром. к РЭА — 8,98 нг/мл, СА19.9 — 13,26 Е/мл (17.04.2018г.) |
Медиана наблюдения 26 мес.
Рисунок 1. Схема лечения пациентки раком толстой кишки с СЛ.
09.04.2013 г. пациентка обратилась в Ташкентский городской филиал Республиканского специализированного научно-практического центра онкологии и радиологии, где с учетом объема хирургического лечения начата химиотерапия 2 линии по схеме FOLFIRI. С 21.05.2013 г. по 01.08.2013 г. были проведены 4–9 курсы химиотерапии с добавлением Бевацизумаба с 5 курса (06.2013 г.). С 08.2013 г. по 03.2014 г. проводилось лечение тутабином и Бевацизумабом по месту жительства. Прогрессирование от 04.2014 г. С 08.04.2014 г. по 01.10.2014 г. проведено 14 курсов ХТ 3 линии по схеме FOLFIRI + Цетуксимаб. Продолжение лечения Цетуксимабом до 11.2015 г. (13 мес.). Прогрессирование от 11.2015 г. Учитывая эффективность и длительность ремиссии на ХТ по схеме FOLFIRI, решено провести 4 линию лечения в прежнем объеме: FOLFIRI + Цетуксимаб. С 03.12.2015 г. по 25.04.2016 г. проведено 11 курсов ХТ и лечение Цетуксимабом до 08.2016 г. в монорежиме. Прогрессирование от 08.2016 г. С 18.08.2016 г. по 18.01.2017 г. проведено 12 курсов ХТ 5 линии по схеме FOLFOX + Бевацизумаб. Прогрессирование от 10.2017 г. С 02.11.2017 г. по 29.03.2018 г. проведено 10 курсов ХТ 6 линии по схеме FOLFIRI + Цетуксимаб. Прогрессирование от 03.2018 г. По решению консилиума, учитывая число раннее проведенных линий терапии, наличия синдрома Линча, предрасполагающих высокую эффективность иммунотерапии, рекомендовано применение анти-PD1-терапии (Ниволумаб 3 мг/кг в/в каждые 2 недели либо Пембролизумаб 200 мг в/в каждые 3 недели). С марта 2018 г. по настоящее время пациентка находится на иммунотерапии Ниволумабом 180 мг в/в каждые 2 недели. Данных за рецидив и наличие метастазов от 15.05.2020 г. не получено (период наблюдения — 26 месяцев). Состояние пациентки удовлетворительное, ECOG- 2 (рис. 1).
ОБСУЖДЕНИЕ
РТК остается одним из самых распространенных онкологических процессов, где постановка диагноза генетической предрасположенности к нему предоставляет возможности для прицельного лечения, раннего выявления, а также предотвращения последующих онкологических заболеваний у пациентов и их родственников из группы риска. Показано, что осуществление рутинного скрининга опухолей РТК на дефицит MMRулучшает выявление синдрома Линча за пределами, ограниченными критериями наследственности [8].
В целом, наследственный неполипозный рак толстой кишки можно условно разделить на 2 группы: вариант с микросателлитной нестабильностью и герминальными мутациями в генах системы репарации неспаренных оснований ДНК (MMR) и наследственный рак с интактной системой репарации, т. е. с отсутствием MSI [9]. В 1-ю группу входят СЛ и синдром конститутивного дефицита в системе репарации (биаллельная герминальная инактивация генов системы MMR). Вторая группа включает синдром, ассоциированный с мутациями в генах POLE, POLD1, и семейный колоректальный рак типа X (СКРТX). Подтверждение генетического диагноза позволяет определить стратегию клинического наблюдения и профилактики, лечения и прогнозирования течения заболевания у больных наследственным неполипозным раком толстой кишки и их родственников.
У носителей мутаций MLH1 и MSH2, MSI-H выявляется в более 90% случаев РТК. Кроме того, более 90% мутаций, обнаруженных у членов семьи больных с СЛ, были в генах MLH1 или MSH2 [23–26]. У данной пациентки, ИГХ-ис-следование выявило потерю экспрессии белка MLH1, что подразумевает наличие dMMR.
Другие ЗНО, встречающиеся в составе СЛ, а также риски их развития представлены в табл. 1.
Рак толстой кишки как компонент СЛ характеризуется рядом клинико-морфологических особенностей [1,9,27,28]: — средний возраст манифестации РТК составляет 45– 50 лет;
-
— тенденция к правосторонней локализации опухолевого очага (в более молодом возрасте — поражение дистальных отделов ободочной и прямой кишки);
-
— повышенный риск развития синхронных и метахронных ЗНО толстой кишки (16 % и 41 % соответственно к 10 и 20 годам наблюдения после диагностирования первичной опухоли);
-
— наличие единичных полипов толстой кишки (для СЛ нехарактерно множественное полипозное поражение, однако единичные полипы могут встречаться и появляться на протяжении жизни);
-
— морфологически Линч-ассоциированный РТК характеризуется вариабельной гистологической картиной: наряду с классическими аденокарциномами кишечного типа наблюдается высокая частота муцинозных адено-
- карцином, медуллярного и перстневидноклеточного рака;
-
— высокий процент образований с низкой степенью дифференцировки;
-
— наличие муцинозного компонента и перстневидных клеток в опухоли;
-
— лимфоцитарная инфильтрация опухоли.
Совокупность анамнестических, клинических и морфологических данных позволяет на первичном этапе идентифицировать пациентов с формально-генетическим диагнозом СЛ.
Учитывая, что дефицит MMR является подтвержденным биомаркером для назначения иммунотерапии [19,36], после использования всего арсенала химиопрепаратов (оксалиплатин, иринотекан, фторурацил) и таргетных лекарств (бевацизумаб, цетуксимаб) пациентке назначена иммунотерапия ИКТ (Ниволумабом), отсутствие изменений рецидивной опухоли и имплантационных метастазов рассматривается как стабилизация заболевания. Можно привести результаты исследования с анти-PD-1 антителом пембролизумабом у двух групп больных химиорефрактер-ным раком различныхлокализаций —с MSI-H и MSS. Всего в исследование был включен 41 пациент с MSI-H опухолями, 10 из которых имели рак толстой кишки, и 21 больной — с MSS. Среди больных раком толстой кишки и MSI-H у 40% был отмечен объективный эффект на терапии пембро-лизумабом, еще у 50% — стабилизация. У 11 пациентов с синдромом Линча частота объективных ответов (ЧОО) составила 27%, в то время каку 6 больных с MSI-H опухолями не ассоциированных с СЛ, ЧОО составила 100%. В случае неизмененной функции системы репарации неспаренных оснований ни у одного из пациентов не был зарегистрирован объективный эффект и только у 2 (11 %) отмечена стабилизация. Интересно отметить, что частота объективных эффектов в опухолях с MSI-H, но локализацией не в толстой
Таблица 1. Риск развития различных ЗНО в составе синдрома Линча (адаптировано из [27])
кишке, также была высокой и составила 71 % (5/7) [35]. Такие результаты послужили предпосылкой инициации исследования II и III фаз с пембролизумабом (NCT02460198 [37] и NCT02563002 [38]) у больных метастатическим раком толстой кишки и дефицитом в системе репарации не спаренных оснований. Результаты данных исследований послужили основой для беспрецедентного в истории онкологии регистрации FDA препарата (пембролизумаба) в мае 2017 г. не по нозологическому принципу, а по типу молекулярного нарушения, а в дальнейшем и ниволумаба при опухолях толстой кишки и MSI-H (в РФ одобрен с 2018 г.) [39]. Оба препарата блокируют связывание рецептора PD-1 лимфоцитов и моноцитов с лигандами PD-L1 и PD-L2, связывание которых приводит к ингибированию рецептора Т-лимфоцитов (TCR) и супрессии Т-клеточной эффекторной функции. Соответственно, активность PD-1 проявляется главным образом в опухолевом микроокружении, где стимуляция данных рецепторов ограничивает Т-клеточный лизис опухолевых клеток (рис. 2). Гиперэкспрессия PD-L1 на опухолевых клетках указывает на то, что сигнальный путь PD-1 является одним из механизмов уклонения опухоли от иммунного ответа [40].
Неактивный Т-лимфоцит / Клетка опухоли / Inactive T-lymphocyte Tumor Cell
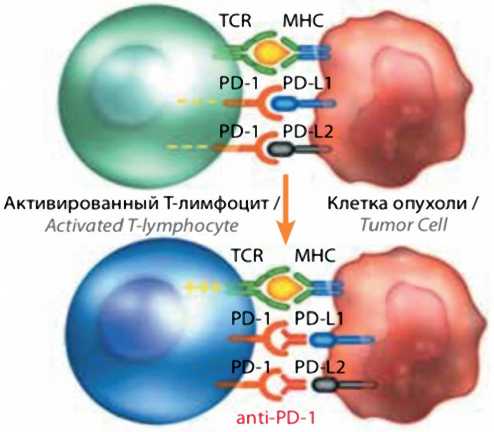
Рисунок 2. Механизм действия ниволумаба.
TCR — рецептор Т-лимфоцитов; MCH — главный комплекс гистосовместимости.
проведения пилотного исследования, где пациенты с I–III стадиями резектабельного рака ободочной кишки получили 6 недель терапии комбинацией ниволумаб + ипилимумаб, после чего были радикально прооперированы. У 4 из 7 пациентов с MSI-H был достигнут полный лечебный патоморфоз, у остальных 3 пациентов доля жизнеспособных опухолевых клеток не превышала 2%. При этом эффект реализовывался независимо от наличия синдрома Линча и мутации в гене BRAF [45]. В то же время у всех 8 больных с MSS опухолями отсутствовали признаки лечебного патоморфоза.
Известным фактором, предсказывающим чувствительность к ингибиторам контрольных точек иммунного ответа, является мутационная нагрузка в опухоли (tumor mutational burden — TMB). Один из первых мета-анализов выявил четкую корреляцию между большей TMB и ЧОО при использовании монотерапии анти-PD1 или анти-PD-L1 антителами [46], частично подтверждённую и в более поздней работе: TMB ассоциировалась с лучшей выживаемостью на иммунотерапии при большинстве опухолей, за исключением рака молочной железы, глиом и рака почки [47]. К сожалению, в данных работах не был отдельно проанализирован статус MSI.
Таким образом, опухоли с MSI-H, имея достоверно большую TMB, могли и обусловливать часть большего успеха иммунотерапии в группе TMB-high. Значение TMB у пациентов с MSI-H было впервые проанализировано в небольшой рестропективной работе, включившей 22 пациентов с MSI-H РТК, получавших пембролизумаб. За границу был взят уровень TMB 37–41 мутаций на мегабазу, разделивший пациентов в группы с TMB-high (13 больных имели более 41 мутаций) и TMB-low (9 больных в диапазоне от
37 до 41 мутаций на мегабазу). TMB четко предсказывал эффективность иммунотерапии: 12-месячная ВБП составила 90% и 0% соответственно, а медиана ВБП не достигла и 2 месяцев [48]. Следовательно, полученные результаты о предиктивном значении TMB требуют подтверждения на больших когортах больных до того как это войдет в рутинную практику селекции больных [39].
Таким образом, у пациентов метастатическим РТК, MSI-H с синдромом Линча иммунотерапия является вариантом выбора, начиная со второй линии терапии, а также может применяться у пациентов, не подлежащих химиотерапии и в первой линии [5,6]. Возможными опциями являются комбинация ниволумаба и ипилимумаба (предпочтительнее), монотерапия ниволумабом или пембролизумабом.
ЗАКЛЮЧЕНИЕ
При выявлении злокачественных опухолей толстой кишки в рамках наследственных синдромов, особенности болезни помогают не только определиться с объемом хирургического вмешательства при ранних стадиях, но и определить прогноз болезни и потенциальную чувствительность к ингибиторам иммунных контрольных точек при метастатическом заболевании. По частоте ответов приближаясь к эффективности таргетных препаратов, ингибиторы PD-1 (ниволумаб и пембролизумаб) обладают неоспоримым преимуществом, как возможностью длительного удержания достигнутых ответов, а также благоприятным профилем безопасности.
Список литературы Применение ниволумаба при раке толстой кишки с синдромом Линча. Клиническое наблюдение
- Burt R. Inheritance of colorectal cancer. Drug Discov Today Dis Mech 2007;4 (4): 293 - 300. 10.1016 / j. ddmec. 2008.05.004. DOI: 10.1016/j.ddmec.2008.05.004
- Recommendations from the EGAPP Working Group: genetic testing strategies in newly diagnosed individuals with colorectal cancer aimed at reducing morbidity and mortality from Lynch syndrome in relatives. Evaluation of Genomic Applications in Practice and Prevention (EGAPP) Working Group. GenetMed2009;11 (1):35 - 41.
- Yurgelun M. B., Kulke M. H., Fuchs C. S. et al. Cancer susceptibility gene mutations in individuals with colorectal cancer J Clin Oncol 2017;35 (10):1086 - 95. 10.1200 / JCO. 2016.71.0012. DOI: 10.1200/JCO.2016.71.0012
- Lynch HT, Snyder CL, Shaw TG, Heinen CD and Hitchins MP: Milestones of Lynch syndrome: 1895 - 2015. Nat Rev Cancer. 15:181 - 194. 2015.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Colon Cancer. Version 2.2019. https:// www.nccn.org / professionals / physician_gls / pdf/ colon. pdf.
- www.accessdata.fda.gov
- Sinicrope FA, Sargent DJ. Clin Cancer Res. 2012
- Valle L, Vilar E, Tavtigian SV, Stoffel EM. Genetic predisposition to colorectal cancer: syndromes, genes, classification of genetic variants and implications for precision medicine. J Pathol. 2019;247 (5):574-588. 10.1002 / path. 5229
- DOI: 10.1002/path.5229
- Carethers J. M., Stoffel E. M. Lynch syndrome and Lynch syndrome mimics: the growing complex landscape of hereditary colon cancer. World J Gastroenterol 2015;21 (31):9253 - 61. 10.3748 / wjg. v21. i31.9253.
- DOI: 10.3748/wjg.v21.i31.9253
- Warthin AS. Hereditary with reference to carcinoma. Arch Intern Med (chic). 1913. 10.1001 / archinte. 1913.00070050063006.
- DOI: 10.1001/archinte.1913.00070050063006
- Lynch HT, de la Chapelle A. Hereditary colorectal cancer. N Engl J Med. 2013. 10.1056 / NEJMra012242.
- DOI: 10.1056/NEJMra012242
- Lynch HT. Natural history of colorectal cancer in hereditary nonpolyposis colorectal cancer (Lynch syndromes I and II) Dis Colon Rectum. 1988;31:439 - 444. 10.1007 / BF02552613.
- DOI: 10.1007/BF02552613
- Vasen HF. Screening for hereditary non-polyposis colorectal cancer: a study of 22 kindreds in the Netherlands. Am J Med. 1989;86:278 - 281. 10.1016 / 0002 - 9343 (89) 90296 - 9.
- DOI: 10.1016/0002-9343(89)90296-9
- Vasen HF. The international collaborative group on hereditary non polyposis colorectal Cancer (ICG-HNPCC) Dis Colon Rectum. 1991;34:424 - 425. 10.1007 / BF02053699.
- DOI: 10.1007/BF02053699
- Lynch HT. Hereditary nonpolyposis colorectal Cancer (Lynch syndromes I and II). II Biomarker studies. Cancer. 1985;56:939 - 951. 10.1002 / 1097 - 0142 (19850815) 56:43.0. CO;2-T.
- DOI: 10.1002/1097-0142(19850815)56
- Vasen HF. Guidelines for the clinical management of Lynch syndrome (hereditary non-polyposis cancer) J Med Genet. 2007;44:353 - 362. 10.1136 / jmg. 2007.048991.
- DOI: 10.1136/jmg.2007.048991
- Kastrinos F. Phenotype comparison of MLH1 and MSH2 mutation carriers in a cohort of 1,914 individuals undergoing clinical genetic testing in the United States. Cancer Epidemiol Biomark Prev. 2008. 10.1158 / 1055 - 9965.
- DOI: 10.1158/1055-9965
- Watson P. Extracolonic Cancer in hereditary nonpolyposis colorectal Cancer. Cancer. 1993;71:677 - 685. 10.1002 / 1097 - 0142 (19930201) 71:33.0. CO;2-#.
- DOI: 10.1002/1097-0142(19930201)71
- Le DT, Durham JN, Smith KN, et al. Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade. Science 2017; 357: 409 - 413.
- Venderbosch S, Nagtegaal ID, Maughan TS et al. Mismatch repair statusand BRAF mutation status in metastatic colorectal cancer patients: apooled analysis of the CAIRO, CAIRO2, COIN, and FOCUS studies. Clin Cancer Res 2014; 20 (20): 5322 - 5330.
- Taieb J, Shi Q, Pederson L, et al. Prognosis of microsatellite instability and/ or mismatch repair deficiency stage III colon cancer patients after disease recurrence following adjuvant treatment: results of an accent pooled analysis of 7 studies. Ann Oncol. 2019 Jul 3. pii: mdz208. 10.1093 / annonc/ mdz208. [Epub ahead of print].
- DOI: 10.1093/annonc/mdz208
- Innocenti F, Ou FS, Qu X, et al. Mutational Analysis of Patients With Colorectal Cancer in CALGB/ SWOG 80405 Identifies New Roles of Microsatellite Instability and Tumor Mutational Burden for Patient Outcome. J Clin Oncol. 2019 May 10;37 (14):1217 - 1227.
- Yin J, Kong D. Mutation of hMSH3 and hMSH6 mismatch repair genes in genetically unstable human colorectal and gastric carcinomas. Hum Mutat. 1997. 10.1002 / (SICI) 1098 - 1004 (1997) 10:63.0. CO;2-D.
- Liu B. hMSH2 mutations in hereditary nonpolyposis colorectal cancer kindreds. Cancer Res. 1994;54:4590 - 4594.
- Han HJ. Genomic structure of human mismatch repair gene, hMLH1, and its mutation analysis in patients with hereditary non- polyposis colorectal cancer (HNPCC) Hum Mol Genet. 1995;4:237 - 242. 10.1093 / hmg/ 4.2.237.
- DOI: 10.1093/hmg/4.2.237
- Wijnen J, Khan PM. Hereditary nonpolyposis colorectal cancer families not complying with the Amsterdam criteria show extremely low frequency of mismatch-repair-gene mutations. Am J Hum Genet. 1997. 10.1086 / 514847. [PMC free article] [PubMed]
- DOI: 10.1086/514847
- https://www.nccn.org / professionals / physician_gls / pdf/ genetics_colon. pdf.
- Tiwari A. K., Roy H. K., Lynch H. T. Lynch syndrome in the 21st century: clinical perspectives. QJM 2016;109 (3):151 - 8. 10.1093 / qjmed / hcv137.
- DOI: 10.1093/qjmed/hcv137
- Lichtenstein P., Holm N. V., Verkasalo P. K. et al. Environmental and heritable factors in the causation of cancer. Analyses of cohorts of twins from Sweden, Denmark, and Finland. Engl J Med 2000;343 (2):78 - 85. 10.1016 / S0039-6257 (00) 00165-X.
- DOI: 10.1016/S0039-6257(00)00165-X
- Yurgelun M. B., Kastrinos F. Tumor testing for microsatellite instability to identify Lynch syndrome: new insights into an old diagnostic strategy. J Clin Oncol 2019;37 (4):263 - 5. 10.1200 / JCO. 18.01664.
- DOI: 10.1200/JCO.18.01664
- Bonadona V., Bonaïti B., Olschwang S. et al. Cancer risks associated with germline mutations in MLH1, MSH2, and MSH6 genes in Lynch syndrome. JAMA 2011;305 (22): 2304 - 10. 10.1001 / JAMA. 2011.743
- DOI: 10.1001/jama.2011.743
- Møller P., Seppälä T., Bernstein I. et al. Cancer incidence and survival in Lynch syndrome patients receiving colonoscopic and gynaecological surveillance: first report from the prospective Lynch syndrome database. Gut 2017;66 (3):464 - 72. 10.1136 / Gutjnl-2015 - 309675.
- DOI: 10.1136/gutjnl-2015-309675
- Joost P., Therkildsen C., Dominguez- Valentin M. et al. Urinary tract cancer in Lynch syndrome; increased risk in carriers of MSH2 mutations. Urology 2015;86 (6):1212 - 7. 10.1016 / j. Urology. 2015.08.018.
- DOI: 10.1016/j.urology.2015.08.018
- Kastrinos F., Mukherjee B., Tayob N. et al. Risk of pancreatic cancer in families with Lynch syndrome. JAMA 2009;302 (16): 1790 - 5. 10.1001 / JAMA. 2009.1529.
- DOI: 10.1001/jama.2009.1529
- Senter L., Clendenning M., Sotamaa K. et al. The clinical phenotype of Lynch syndrome due to germ-line PMS2 mutations. Gastroenterology 2008;135 (2):419 - 28.
- Le DT, Uram JN, Wang H, Bartlett BR, Kemberling H, Eyring AD, Skora AD, Luber BS, Azad NS, Laheru D, et al: PD-1 blockade in tumors with mismatch-repair deficiency. N Engl J Med. 372:2509 - 2520. 2015.
- Study of Pembrolizumab (MK-3475) as Monotherapy in Participants With Previously-Treated Locally Advanced Unresectable or Metastatic Colorectal Cancer (MK-3475 - 164 / KEYNOTE-164). Электронный ресурс: http://clinicaltrials.gov / show / NCT02460198, дата обращения 22.09.2018, 2018.
- Study of Pembrolizumab (MK-3475) vs Standard Therapy in Participants With Microsatellite Instability-High (MSI-H) or Mismatch Repair Deficient (dMMR) Stage IV Colorectal Carcinoma (MK-3475 - 177 / KEYNOTE-177). Электронный ресурс: http://clinicaltrials. gov / show / NCT02563002, дата обращения 22.09.2018, 2018.
- Трякин А. А., Федянин М. Ю., Цуканов А. С., Шелыгин Ю. А., Покатаев И. А. и др. Микросателлитная нестабильность как уникальная характеристика опухолей и предиктор эффективности иммунотерапии. 2019; 9 (4)
- Thompson R. H., Kuntz S. M., Leibovich B. C. et al. Tumor B7-H1 is associated with poor prognosis in renal cell carcinoma patients with long-termfollow-up. Cancer Res 2006;66 (7):3381 - 5. 10.1158 / 0008 - 5472. CAN-05 - 4303. PMID: 16585157.
- DOI: 10.1158/0008-5472.CAN-05-4303.PMID
- Le DT, Uram JN, Wang H, et al. PD-1 blockade in tumors with mismatch-repair deficiency. N Engl J Med. 2015;372:2509 - 2520.
- Eng C, Kim TW, Bendell J, et al. Atezolizumab with or without cobimetinib versus regorafenib in previously treated metastatic colorectal cancer (IMblaze370): a multicentre, open-label, phase 3, randomised, controlled trial. Lancet Oncol. 2019 Jun;20 (6):849 - 861.
- Overman MJ, Lonardi S, KYM W, et al. Durable clinical benefit with nivolumab plus ipilimumab in DNA mismatch repair- deficient/ microsatellite instability-high metastatic colorectal cancer. J Clin Oncol. 2018;36 (8):773 - 9.
- H-J J Lenz, E Van Cutsem, M L Limon, et al. Durable clinical benefit with nivolumab (NIVO) plus low-dose ipilimumab (IPI) as first-line therapy in microsatellite instability-high / mismatch repair deficient (MSI-H/ dMMR) metastatic colorectal cancer (mCRC). Ann Oncol, 2018, 29 (8), mdy424.019, https://doi.org / 10.1093 / annonc/ mdy424.019.
- DOI: 10.1093/annonc/mdy424.019
- Chalabi M, Fanchi LF, Van den Berg JG, et al. Neoadjuvant ipilimumab plus nivolumab in early stage colon cancer. Ann Oncol. 2018;29 (suppl 8):abstr LBA37.
- Yarchoan M, Hopkins A, Jaffee EM. Tumor Mutational Burden and Response Rate to PD-1 Inhibition. N Engl J Med. 2017 Dec 21;377 (25):2500 - 2501.
- Samstein R, Lee CH, Shoushtari A, et al. Tumor mutational load predicts survival after immunotherapy across multiple cancer types. Nature Genetics, 2019,51:202 - 206.
- Schrock AB, Ouyang C, Sandhu J, et al. Tumor mutational burden is predictive of response to immune checkpoint inhibitors in MSI-high metastatic colorectal cancer. Ann Oncol. 2019 Apr 30. pii: mdz134. 10.1093 / annonc/ mdz134.
- DOI: 10.1093/annonc/mdz134


