Применение обогатительно-селективной среды для культивирования сальмонелл
Автор: Чугунова Елена Олеговна
Журнал: Вестник Омского государственного аграрного университета @vestnik-omgau
Рубрика: Ветеринарные науки
Статья в выпуске: 2 (22), 2016 года.
Бесплатный доступ
Рассмотрены преимущества разработанного состава питательной среды для обогащения сальмо- нелл по сравнению с аналогом. Основой для создания питательной среды послужила забуференная пеп- тонная вода, в которую перед бактериальным посевом добавляли пропиленгликоль. Работа выполнена на базе Пермского ветеринарного диагностического центра в период с 2014 по 2015 г. В процессе исследо- ваний использовали референтные культуры Salmonella spp., Sh. flexneri, E. coli, Pr. vulgaris, S. aureus иL. monocytogenes. В результате выявлена существенная разница в скорости размножения бактерий рода Salmonella при культивировании. Предложенная среда способствовала увеличению чистой культуры сальмонелл в среднем на 38,57 %. При культивировании Salmonella spp. в ассоциации с сопутствующей микрофлорой был также получен прирост бактериальной массы сальмонелл в опыте на 15,04-61,54 %. Исключение составило культивирование со штаммами S. choleraesuis. Чистые культуры данных штаммов показали прирост бактериальных клеток в опытных образцах на 8,97 % больше, чем в контрольных.В ассоциации с другими микроорганизмами как контрольные, так и опытные пробы были примерно оди- наковой мутности. Однако количество бактериальных клеток было большим и составило 1,3 х 108. Таким образом, предложенный состав обогатительной питательной среды может быть с успехом применим в ветеринарных лабораториях, так как позволяет выделять в короткие сроки Salmonella spp.
Сальмонеллы, сопутствующие микроорганизмы, питательные среды, обогащение, бактериальная биомасса
Короткий адрес: https://sciup.org/142199178
IDR: 142199178 | УДК: 579.672
Текст научной статьи Применение обогатительно-селективной среды для культивирования сальмонелл
Пищевые сальмонеллезы – широко распространенные болезни людей, их регистрируют во всех странах, на всех континентах. Возбудители поражают человека и длительное время сохраняются в окружающей среде [1]. Вместе с тем, растущий темп жизни общества отражается на его питании. Быстрые способы приготовления еды, полуфабрикаты из супермаркетов требуют все большего внимания к мерам профилактики и гигиены [2].
Бактерии рода Salmonella могут присутствовать в пищевых продуктах в незначительном количестве вместе с большим числом других бактерий [3]. Для изоляции сальмонелл из продуктов питания используют несколько групп сред: обогатительные, селективные и идентифи-
кационные. Обогатительные среды содержат минимальное количество селективных агентов и отличаются высокой питательностью [4], что способствует развитию как Salmonella spp., так и сопутствующей микрофлоры. Известно, что выделение чистых культур микроорганизмов значительно осложняется, если в микробной ассоциации присутствует протей, способный к роению (Покровский В.И., 1985). Для подавления роения протеев обычно используют различные химические вещества (Cowan S.T., Steel K.J., 1974). Они в ряде случаев ингибируют и рост искомых микроорганизмов [5]. В связи с этим актуальна разработка обогатительноселективной среды, способствующей увеличению биомассы сальмонелл при подавлении сопутствующей микрофлоры.
Объекты и методы
Объектом исследования служили референтные штаммы S. typhimutium, S. enteritidis, S. gallinarum-pullorum, S. dublin, S. choleraesuis, S. infantis, S. hamburg, S. virchow, Sh. flexneri , E. coli , Pr. vulgaris , S. aureus , L. Monocytogenes , полученные из ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России и выделенные из мясной и яичной продукции. Исследования проводили, используя суточные агаровые культуры изучаемых микроорганизмов. Исходную бактериальную суспензию, содержащую 1 х 108 МТ/см3 или 0,5 ед. мутности по МакФарланду (McF), готовили с помощью оптического прибора Densi-La-Meter (Erba Lachema, Чехия). Далее делали ряд последовательных разведений до получения рабочей суспензии, содержащей 1 х 101 МТ/см3, которую использовали для культивирования в забуфе-ренной пептонной воде (ЗПВ), приготовленной по ГОСТ 31659‒2012 (контроль) и в питательной среде, предложенной автором (опыт).
При разработке обогатительно-селективной среды в стандартную ЗПВ добавляли пропи-ленгликоль (1,2 пропиленгликоль, пропандиол-1,2) «чистый» [6]. В испытуемую и контрольную питательную среду инокулировали взятые в опыт микроорганизмы и инкубировали при 37 °С в течение 24 ч. На следующий день устанавливали прирост бактериальной массы по степени мутности на приборе Densi-La-Meter. Мутность бактериальной суспензии выражали в единицах МакФарланда (McF).
Опыты проводили в 10-кратной повторности. Статистический анализ результатов исследования проведен в программе Statistica 6.0 с использованием методов вариационной статистики [7]. Вычисляли средние величины (М), их стандартную ошибку (m) и среднеквадратическое отклонение ( σ ). Достоверность различий между показателями оценивали с использованием непарного t-критерия Стъюдента. Различия считали статистически значимыми при p < 0,05. Результаты статистической обработки в таблицах представлены в виде средней арифметической и ее стандартной ошибки (M ± m).
Результаты исследований
Установлена способность разработанной питательной среды влиять на скорость размножения сальмонелл. Визуально испытуемая среда после инкубации с бактериями рода Salmonella была более мутной, чем ЗПВ контрольных образцов. Измерив степень мутности контрольных и опытных образцов ЗПВ на оптическом анализаторе DensiLaMeter, подтвердили свойство разработанной среды катализировать процесс увеличения биомассы сальмонелл (табл. 1).
Таблица 1
Прирост бактериальной массы Salmonella spp. при культивировании в питательных средах
|
Серотип сальмонелл |
Степень мутности, ед. McF |
Прирост бактериальной массы |
||
|
Опыт |
Контроль |
Абсолютное значение, ед. McF |
% |
|
|
S. typhimurium |
1,838 ± 0,091 |
1,013 ± 0,035 |
0,825 |
44,89 |
|
S. Dublin |
1,1 ± 0,0531 |
0,913 ± 0,099 |
0,187 |
17,00 |
|
S. choleraesuis |
0,725 ± 0,0893 |
0,66 ± 0,05 |
0,065 |
8,97 |
|
S. enteritidis |
1,11 ± 0,0641 |
0,675 ± 0,046 |
0,435 |
39,19 |
|
S. gallinarum-pullorum |
1,538 ± 0,0521 |
1,05 ± 0,053 |
0,488 |
31,73 |
|
S. infantis |
2,163 ± 0,0521 |
0,963 ± 0,052 |
1,2 |
55,48 |
|
S. hamburg |
2,388 ± 0,0351 |
0,8 ± 0,0 |
1,588 |
66,50 |
|
S. virchow |
1,738 ± 0,091 |
0,96 ± 0,052 |
0,778 |
44,76 |
|
Среднее значение |
1,568 ± 0,562 |
0,879 ± 0,15 |
0,70 |
38,57 |
1Р < 0,001; 2Р < 0,01; 3Р < 0,05.
При анализе полученных результатов установлено, что разработанный состав питательной среды для этапа предобогащения сальмонелл сопровождается приростом бактериальной массы. Прирост бактериальной массы в опытных образцах среды для серотипов S. typhimurium, S. infantis, S. virchow составил более 40 % по сравнению с контролем. Наибольшая степень размножения отмечена при культивировании штаммов серотипа S. hamburg – 66,50 %. Однако штаммы S. choleraesuis показали слабую способность ферментировать пропиленгликоль, что отразилось на результате: прирост бактериальной массы бактерий в опытной среде оказался выше всего на 8,97 %, чем в контрольной.
Определенный интерес вызывает способность исследуемой питательной среды влиять на размножение кишечной палочки, протея, шигелл, золотистого стафилококка и листерий. После 24-часовой инкубации контрольных и опытных образцов ЗПВ со штаммами вышеперечисленных микроорганизмов оказалось, что разработанная среда в разной степени ингибирует размножение данных бактерий (табл. 2).
Таблица 2
Прирост бактериальной массы при культивировании ассоциации микроорганизмов в питательных средах
|
Вид микроорганизмов |
Степень мутности, ед. McF |
Прирост бактериальной массы |
||
|
Опыт |
Контроль |
Абсолютное значение, ед. McF |
% |
|
|
Р. vulgaris |
0,488 ± 0,0641 |
0,613 ± 0,064 |
–0,125 |
–20,39 |
|
E. coli |
0,775 ± 0,0461 |
0,975 ± 0,046 |
–0,2 |
–20,51 |
|
S. aureus |
0,588 ± 0,0351 |
0,713 ± 0,035 |
–0,125 |
–17,53 |
|
L. monocytogenes |
0,025 ± 0,046 |
0,038 ± 0,052 |
–0,013 |
–34,21 |
|
Sh. flexneri |
0,3 ± 0,01 |
0,663 ± 0,052 |
–0,363 |
–54,75 |
1Р < 0,001.
Опытная ЗПВ тормозит размножение золотистого стафилококка на 17,53 %, литерий на 34,21 %, шигелл – более чем на 50 %. По результатам исследований выявлено свойство испытуемой среды сдерживать прирост бактериальной массы протея и кишечной палочки на 20 %. Данный факт имеет огромное значение в повседневной лабораторной практике, так как часто именно БГКП и рода Proteus подавляют развитие сальмонелл, что приводит к ложноотрицательным результатам исследований.
Для объективности оценки полученных данных провели посев ассоциации микроорганизмов на разработанную неселективную среду. Для этого сальмонеллы и взятые в опыт штаммы прочих микроорганизмов в равных количествах (по 1 х 101 МТ/см3) инокулировали в опытные и контрольные флаконы с ЗПВ (табл. 3) .
Очевидна позитивная роль испытуемой среды для неселективного размножения сальмонелл. Прирост бактериальной массы сальмонелл в опытных образцах был на 13,64–64,89 % больше, чем в контроле. Наглядно результаты данного опыта отражены на рисунке.
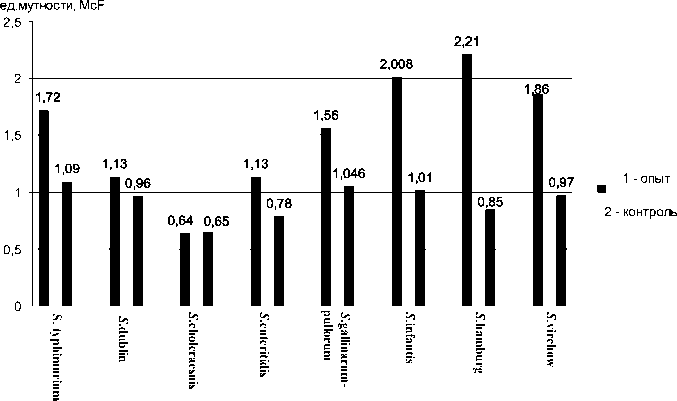
Влияние испытуемой питательной среды на размножение сальмонелл в ассоциации с другими видами микроорганизмов, ед. мутности McF
Таблица 3
Прирост бактериальной массы сальмонелл в ассоциации с сопутствующими микроорганизмами
|
Вид микроорганизмов |
Степень мутности, ед. McF |
Прирост бактериальной массы |
||
|
Опыт |
Контроль |
Абсолютное значение, ед. McF |
% |
|
|
S. typhimurium |
+ |
|||
|
Р. vulgaris |
1,73 ± 0,0951 |
1,08 ± 0,079 |
0,65 |
37,80 |
|
E. coli |
1,70 ± 0,0821 |
1,07 ± 0,082 |
0,63 |
37,06 |
|
S. aureus |
1,73 ± 0,0821 |
1,12 ± 0,079 |
0,61 |
35,26 |
|
L. monocytogenes |
1,74 ± 0,0521 |
1,10 ± 0,082 |
0,64 |
36,78 |
|
Sh. flexneri |
1,72 ± 0,0791 |
1,08 ± 0,079 |
0,64 |
37,21 |
|
Среднее значение |
1,72 ± 0,0181 |
1,09 ± 0,02 |
0,63 |
36,63 |
|
S. Dublin + |
||||
|
Р. vulgaris |
1,11 ± 0,0881 |
0,93 ± 0,048 |
0,18 |
16,22 |
|
E. coli |
1,16 ± 0,0521 |
0,96 ± 0,052 |
0,20 |
17,24 |
|
S. aureus |
1,16 ± 0,0521 |
0,99 ± 0,032 |
0,17 |
14,66 |
|
L. monocytogenes |
1,10 ± 0,01 |
0,95 ± 0,053 |
0,15 |
13,64 |
|
Sh. flexneri |
1,14 ± 0,071 |
0,96 ± 0,07 |
0,18 |
15,79 |
|
Среднее значение |
1,13 ± 0,031 |
0,96 ± 0,02 |
0,17 |
15,04 |
|
S. choleraesuis + |
||||
|
Р. vulgaris |
0,63 ± 0,048 |
0,63 ± 0,048 |
0,0 |
0,0 |
|
E. coli |
0,66 ± 0,052 |
0,69 ± 0,088 |
–0,03 |
–4,55 |
|
S. aureus |
0,63 ± 0,048 |
0,65 ± 0,053 |
–0,02 |
–3,17 |
|
L. monocytogenes |
0,64 ± 0,052 |
0,62 ± 0,042 |
0,02 |
3,13 |
|
Sh. flexneri |
0,62 ± 0,042 |
0,64 ± 0,048 |
–0,02 |
–3,23 |
|
Среднее значение |
0,64 ± 0,015 |
0,65 ± 0,03 |
–0,01 |
–1,54 |
|
S. enteritidis + |
||||
|
Р. vulgaris |
1,13 ± 0,0821 |
0,80 ± 0,082 |
0,33 |
29,20 |
|
E. coli |
1,15 ± 0,071 |
0,86 ± 0,084 |
0,29 |
25,22 |
|
S. aureus |
1,16 ± 0,0521 |
0,72 ± 0,079 |
0,44 |
37,93 |
|
L. monocytogenes |
1,09 ± 0,0571 |
0,83 ± 0,067 |
0,26 |
23,85 |
|
Sh. flexneri |
1,12 ± 0,0791 |
0,69 ± 0,074 |
0,43 |
38,39 |
|
Среднее значение |
1,13 ± 0,031 |
0,78 ± 0,07 |
0,35 |
30,97 |
|
S. gallinarum-pullorum + |
||||
|
Р. vulgaris |
1,70 ± 0,071 |
1,03 ± 0,048 |
0,67 |
39,41 |
|
E. coli |
1,51 ± 0,0741 |
1,05 ± 0,071 |
0,46 |
30,46 |
|
S. aureus |
1,49 ± 0,0741 |
1,07 ± 0,067 |
0,42 |
28,19 |
|
L. monocytogenes |
1,55 ± 0,0531 |
1,04 ± 0,052 |
0,51 |
32,90 |
|
Sh. flexneri |
1,57 ± 0,0671 |
1,04 ± 0,07 |
0,53 |
33,76 |
|
Среднее значение |
1,56 ± 0,081 |
1,046 ± 0,015 |
0,514 |
32,95 |
|
S. infantis + |
||||
|
Р. vulgaris |
1,99 ± 0,0741 |
0,97 ± 0,067 |
1,02 |
51,26 |
|
E. coli |
1,92 ± 0,0421 |
0,94 ± 0,052 |
0,98 |
51,04 |
|
S. aureus |
1,91 ± 0,642 |
1,06 ± 0,052 |
0,85 |
44,50 |
|
L. monocytogenes |
2,11 ± 0,0331 |
1,06 ± 0,053 |
1,05 |
49,76 |
|
Sh. flexneri |
2,11 ± 0,0741 |
1,02 ± 0,079 |
1,09 |
51,66 |
|
Среднее значение |
2,008 ± 0,11 |
1,01 ± 0,05 |
0,998 |
49,70 |
|
S. hamburg + |
||||
|
Р. vulgaris |
2,20 ± 0,1151 |
0,84 ± 0,052 |
1,36 |
61,82 |
|
E. coli |
2,13 ± 0,1421 |
0,89 ± 0,088 |
1,24 |
58,22 |
|
S. aureus |
2,30 ± 0,0821 |
0,89 ± 0,074 |
1,41 |
61,30 |
|
L. monocytogenes |
2,18 ± 0,1321 |
0,82 ± 0,079 |
1,36 |
62,39 |
|
Sh. flexneri |
2,25 ± 0,071 |
0,79 ± 0,057 |
1,46 |
64,89 |
|
Среднее значение |
2,21 ± 0,071 |
0,85 ± 0,04 |
1,36 |
61,54 |
|
S. virchow + |
||||
|
Р. vulgaris |
1,73 ± 0,5762 |
0,96 ± 0,052 |
0,77 |
44,51 |
|
E. coli |
1,83 ± 0,0821 |
0,99 ± 0,057 |
0,84 |
45,90 |
|
S. aureus |
2,02 ± 0,1031 |
0,97 ± 0,048 |
1,05 |
51,98 |
|
L. monocytogenes |
1,87 ± 0,0821 |
0,98 ± 0,079 |
0,89 |
47,59 |
|
Sh. flexneri |
1,86 ± 0,0521 |
0,97 ± 0,082 |
0,89 |
47,85 |
|
Среднее значение |
1,86 ± 0,11 |
0,97 ± 0,01 |
0,89 |
47,85 |
Заключение
Таким образом, выявлена существенная разница между скоростью размножения бактерий рода Salmonella при культивировании в опытных и контрольных образцах питательной среды. Разработанная среда способствовала увеличению чистой культуры сальмонелл в среднем на 38,57 %. При работе с Salmonella spp. в ассоциации с сопутствующей микрофлорой также получили прирост бактериальной массы сальмонелл в опытных образцах. Причем разница биомассы сальмонелл составила от 15,04 до 61,54 % в пользу испытуемой питательной среды. Исключение составили образцы со штаммами S. choleraesuis. Чистые культуры данных штаммов показали прирост бактериальных клеток в опытных образцах на 8,97 % больше, чем в контрольных. При работе с S. choleraesuis в ассоциации с другими микроорганизмами как контрольные, так и опытные пробы были примерно одинаковой мутности, однако количество бактериальных клеток составило 1,3 х 108. Принимая во внимание тот факт, что разрешающая способность бактериологического метода составляет 1 х 105 МТ/см3 [8], а экспесс-методов около 1 х 105–106 МТ/см3 [9], разработка может быть с успехом применима в испытательных лабораториях.
Список литературы Применение обогатительно-селективной среды для культивирования сальмонелл
- Сагабиева, Н.Н. Эпизоотологический мониторинг сальмонеллеза крупного рогатого скота в Курской области: дис. … канд. вет. наук/Н.Н. Сагабиева. -2004. -135 с.
- Слаусгальвис, В. Сальмонеллез: меры борьбы и контроль/В. Слаусгальвис//Животноводство России. -2010. -№ 2. -С. 60-61.
- Микробиологический контроль мяса животных, птицы, яиц и продуктов их переработки: cправочник/С.А. Артемьева, Т.Н. Артемьева, А.И. Дмитриев, В.В. Дорутина. -М.: Колос, 2002. -288 с.
- Шуляк, Б.Ф. Руководство по бактериальным инфекциям собак: в 2 ч./Б.Ф. Шуляк. -М.: ОЛИТА, 2003. -608 с.
- Султанов, З.З. Разработка и усовершенствование технологий получения микробиологических питательных основ и сред: дис. … д-ра биол. наук/З.З. Султанов. -Махачкала, 2008. -271 с.
- Приемопередающее устройство: пат. 2570386 Рос. Федерация. № 2014136524/15; заявл. 08.09.2014; опубл. 10.12.2015. Бюл. № 34. -5 с.
- Мастицкий, С.Э. Методическое пособие по использованию программы Statistica при обработке биологических исследований. -Минск/С.Э. Мастицкий. -Минск: РУП «Институт рыбного хозяйства», 1987. -79 с.
- № 63Fricker, C.R. The isolation of salmonellas andcampylobacters/C.R. Fricker//AppI Bact. -1987. -№ 63 (2). -С. 99-116.
- Пашкова, А.П. Совершенствование элективных питательных сред и биологические свойства свежевыделенных эшерихий и сальмонелл: дис. … канд. биол. наук. -Курск, 2006. -С. 50-54.


