Применение омиксных технологий для идентификации маркеров компетентности индивидуальных овоцитов у крупного рогатого скота
Автор: Узбекова С.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Фундаментальные и практические аспекты: мини-обзоры
Статья в выпуске: 2 т.52, 2017 года.
Бесплатный доступ
Качество овоцита определяется его способностью трансформироваться в полноценную яйцеклетку, которая после оплодотворения разовьется в жизнеспособный эмбрион. Адекватная и быстрая оценка качества ооцита имеет решающее значение для успеха репродуктивных биотехнологий сельскохозяйственных животных. Миниатюризация омиксных технологий сделали возможным применение транскриптомики, протеомики и липидомики для анализа индивидуальных овоцитов и использование этих методов для поиска молекулярных маркеров качества яйцеклеток. Качество ооцита в значительной степени определяется его фолликулярной средой, которая влияет на пул РНК, белков и липидов яйцеклетки. Перед оплодотворением яйцеклетка должна пройти через этап созревания, имеющий решающее значение для приобретения ею компетенции к эмбриональному развитию. В настоящем обзоре даны примеры транскриптомного, протеомного и липидомного анализа, выполненного на индивидуальных яйцеклетках коров и клетках кумулюса, в которых сравнивались овоциты с различной компетенцией к созреванию и эмбриональному развитию до стадии бластоцисты in vitro. Особое внимание уделяется оригинальным технологиям протеомики и липидомики на основе масс-спектрометрии, в частности фенотипированию клеток и идентификации молекулярных биомаркеров.
Омиксные технологии, индивидуальные овоциты, крупный рогатый скот
Короткий адрес: https://sciup.org/142214019
IDR: 142214019 | УДК: 636.2:576.08:577.29 | DOI: 10.15389/agrobiology.2017.2.223rus
Текст научной статьи Применение омиксных технологий для идентификации маркеров компетентности индивидуальных овоцитов у крупного рогатого скота
Оценка качества гамет играет важную роль в репродуктивных биотехнологиях, так как именно состояние половых клеток имеет существенное значение для успешного оплодотворения и образования эмбриона, полностью способного к развитию. В целом, 20-50 % высокопродуктивных лакти-рующих коров молочных пород переносят самопроизвольную потерю беременности в течение ее первой недели (1). На эффективность репродукции могут влиять многие факторы — генотип (порода, локусы количественных признаков и т.д.), физиологическое состояние (возраст, способность к деторождению, лактация и пр.) или внешние воздействия (условия кормления, температурный стресс и т.д.). В то же время 10-20 % искусственных осеменений, не завершившихся зачатием или рождением плода, объясняются неспособностью к оплодотворению или ранней эмбриональной смертностью. Однако у коров голштинской породы, например, опло-дотворяемость обычно выше 80 %, следовательно, ранние эмбриональные потери могут быть связаны с некондиционностью овоцитов вследствие неблагоприятных микроусловий в фолликуле, состоянием репродуктивного тракта, в котором не обеспечивается оптимальная для развития эмбриона среда, и (или) неадкватными взаимосвязями между материнским организмом и эмбрионом (2).
Материнские факторы овоцита обеспечивают развитие зародыша до тех пор, пока не будет активирован его собственный геном, что у крупного рогатого скота происходит у зародыша на стадии 8-16 клеток. Для выявления факторов, определяющих готовность овоцита быть оплодотворенным и обеспечить жизнеспособность эмбриона на первых стадиях дробления, ведутся широкомасштабные молекулярные исследования. В последнее десятилетие значительный прогресс в понимании биологии овоцита связан с развитием различных омиксных технологий, охватывающих геномику, транскриптомику, протеомику, метаболомику (включая липидомику) и эпигенетику (3).
Женские половые клетки приобретают потенциал развития внутри фолликула, и самый важный этап подготовки овоцита к оплодотворению — это созревание. Современные методы позволяют инициировать эмбриональное развитие при инкубации овоцита с предварительно обработанными сперматозоидами в соответствии с протоколом, известным как экстракорпоральное оплодотворение (in vitro fertilization, IVF), который повсеместно применяется в биотехнологиях репродукции у крупного рогатого скота. Оригинальная процедура включает обработку высокими дозами гонадотропина для стимуляции созревания овоцитов и овуляции in vivo; in vitro овоцит может возобновить мейоз в отсутствие гонадотропинов. Созревание овоцита представляет собой переход от незрелого овоцита, тран-скрипционно неактивной стадии зародышевого пузырька, к зрелой яйцеклетке в стадии метафазы II, что сопровождается образованием первого полярного тельца, реорганизацией ооплазмы и молекулярными изменениями, которые касаются содержания белков и их посттрансляционных модификаций (4). Созревание — крайне важный этап приобретения овоци-том компетенции к развитию (ее определяют как качество овоцита), которая имеет решающее значение и для состояния эмбриона. Овоциты после извлечения из мелких антральных фолликулов на стадии до отбора и доминирования дозревают in vitro в специальной среде культивирования согласно протоколу (in vitro maturation, IVM). IVM — перспективная техника в репродуктивных биотехнологиях, особенно для высокопородных молочных коров, у которых частота успешных оплодотворений при искусственном осеменении бывает низкой. У крупного рогатого скота незрелые ово-циты можно получить либо при заборе яйцеклетки, либо после убоя животного, затем их подвергают процедуре IVM, оплодотворяют и культивируют эмбрион до стадии, пригодной для трансплантации. Сравнение зрелых и незрелых овоцитов, проявляющих контрастный потенциал развития, с помощью омиксных технологий позволяет выявить молекулярные факторы, вовлеченные в обеспечение качества овоцита.
Основная проблема при применении омиксных технологий (транскриптомика, протеомика и метаболомика) для анализа женских гамет (в отличие от сперматозоидов) заключается в малом количестве биоматериала, содержащегося в индивидуальном овоците. В достигшей максимального размера яйцеклетке крупного рогатого скота общее количество РНК, белка или липидов составляет соответственно около 2-3 нг, 80-130 нг и 200-250 нг на овоцит. Тем не менее, в последние годы достигнут существенный прогресс в адаптации омиксных инструментов к решению подобных задач на уровне индивидуального овоцита.
Транскриптомика овоцита. Глобальный анализ транскрип-тома овоцитов, начатый в 2003 году (5), превратился в рутинную процедуру благодаря методам амплификации РНК, NGS (new generation sequencing) РНК и глобальной аннотации генома крупного рогатого скота. Нескольких или даже одного овоцита достаточно, чтобы амплифицировать РНК и провести транскриптомный анализ, таким образом, можно сравнивать 224
генную экспрессию у овоцитов с разной компетентностью. Например, показано, что гены SLC25A16, PPP1R14C, ROBO1, AMDHD1 и MEAF6 неодинаково экспрессируются у коров породы Монбельярд в овоцитах с разной способностью к образованию жизнеспособных эмбрионов после IVM (6). Сравнение яйцеклеток с более высокой компетентностью из крупных фолликулов (> 8 мм) и сниженной компетентностью из мелких фолликулов (< 3 мм) позволило идентифицировать несколько генов, вовлеченных в ключевые функции, такие как регуляция транскрипции ( TAF2 ), ремоделирование хроматина ( PPP1CB ), энергообразование ( SLC25A31 ), транспорт ключевых молекул внутри клетки ( NAGPA, CYHR1 и SLC3A12 ) (7). Овоци-ты, лишенные кумулюсных клеток перед IVM, оказались менее компетентными, чем созревающие в составе кумулюсного комплекса, и при гибридизации на микрочипах обнаружено разное содержание некоторых транскриптов, хотя основные различия касались липидного состава (8).
Применимость технологий транскриптомного анализа ограничена тем, что полноразмерные овоциты находятся в состоянии транскрипционного покоя, вследствие чего основные различия в содержании разных транскриптов между зрелыми и незрелыми яйцеклетками обусловлены в основном либо процессами деградации PHК, либо степенью полиаденилирования 3´-нетранслируемой области (3´UTR) (9, 10). Вследствие этого для овоцитов, как правило, характерно отсутствие корреляций между содержанием транскриптов и соответствующих белков: мы подтвердили это для таких основных участников мейотического созревания овоцитов коров при IVM, как Aurora киназы, циклин B1, CDK1, c-MOS и CPEB1 (11).
Пр оте о мика о в оцито в. У овоцитов крупного рогатого скота созревание сопровождается синтезом белков de novo и посттрансляционными модификациями (post-translational modifications, PTM) — фосфорилированием или ацетилированием. Об изменениях протеома в яйцеклетке при созревании, как и тех, что определяют качество овоцита при IVM, известно недостаточно. Интерес представляет оценка влияния разных протоколов IVM на эти процессы в индивидуальных овоцитах, в связи с чем разрабатываются подходы на основе методов протеомики. При классическом анализе, основанном на разделении в геле с тандемной масс-спектрометрией (MS) после жидкостной хроматографии (liquid chromatography, LC-MS/MS), требуется от нескольких сотен до нескольких тысяч овоцитов на одно определение: хотя овоцит — самая крупная клетка в организме (у коров ее диаметр составляет около 120 мкм), содержание в ней внутриклеточных белков относительно низкое. В среднем у крупного рогатого скота это примерно 100 нг общего белка, из которых около 15 % приходится на zona pellucida — плотную оболочку вокруг цитоплазматической мембраны, состоящую в основном из гликопротеинов. В нескольких исследованиях сообщается о применении подхода функциональной протеомики для исследования пула незрелых и зрелых овоцитов у крупного рогатого скота (12). Были идентифицированы многочисленные протеины, включая предполагаемые маркеры компетентности при развитии овоцита, в том числе белки, необходимы для оплодотворения, репрограммирования, активации генома эмбриона, и первых дроблений в процессе раннего эмбрионального развития. Предложенный недавно метод эффективной пробоподготовки с использованием магнитных шариков позволил идентифицировать более 400 белков в овоците человека (14). Однако эта процедура очень сложна и не подходит для широкомасштабного количественного анализа индивидуальных овоцитов.
В нашей лаборатории для этих целей адаптировали оригинальный метод — матричную лазерную десорбцию интактных клеток/времяпролет-ную масс-спектрометрию с газоразрядной ионизацией (Intact Cells Matrix-Assisted Laser Desorption/Ionization time-of-flight Mass Spectrometry, ICM-MS) (рис.). Будучи исходно разработанным для фенотипирования бактерий (15), ICM-MS может выявлять наиболее представленные молекулярные ионы, присутствующие непосредственно в биологическом образце, в достаточно широком диапазоне масс (обычно 100-25 000 Да) с высокой чувствительностью (от пикомолярных до фемтомолярных концентраций) и устойчивостью к присутствию примесей, например солей. Кроме того, ICM-MS позволяет обнаруживать низкомолекулярные протеины, которые часто не детектируются при использовании классических методов LC-MS/MS.
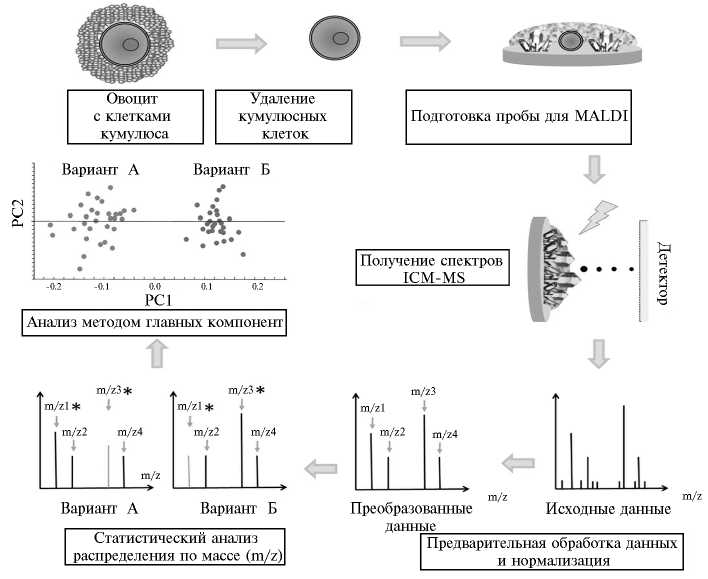
Типичная схема анализа липидных и белково-пептидных профилей индивидуального овоцита методом ICM-MS (Intact Cells Matrix-Assisted Laser Desorption/Ionization time-of-flight Mass Spectrometry) с использованием MALDI-TOF (матрично-активированная лазерная десорб-ция/ионизация) времяпролетного масс-спектрометра. Потенциальные биомаркеры (отмечены звездочками) выявляются с помощью статистического анализа. Метод главных компонент позволяет дискриминировать овоциты в разных состояниях и (или) условиях.
Разработанная нами процедура включает несколько простых подготовительных этапов (освобождение овоцитов от клеток кумулюса и отмывание для удаления соматических клеток и избытка солей). Овоцит помещают на плату для MALDI (Matrix-Assisted Laser Desorption/Ionization), покрывают соответствующим матриксом и оставляют для кристаллизации. Анализ выполняют на приборе UltrafleXtreme MALDI-TOF/TOF («Bruker Co.», США), однако MALDI-TOF спектрометры других марок тоже могут быть использованы. Соответствующий процессинг и методы биоинформа-тического анализа позволяет получить профили ICM-MS, характеризующие спектральные особенности овоцитов в связи с их реальным качеством и стадией созревания, то есть дифференцировать состояние. Таким образом, ICM-MS — мощный инструмент прямой идентификации пептидов и белков в сложных смесях, присутствующих в биологических образцах (грубые 226
экстракты и интактные клетки), как это было сделано для сперматозоидов хряка с разной степенью созревания (из четырех зон эпидидимиса) (16). Поскольку при ICM-MS в большей степени сравниваются профили пептидов и низкомолекулярных протеинов, но не индивидуальные биомаркеры, его применение предпочтительно при идентификации фенотипических различий, связанных с физиологическими состояниями, патологиями, влиянием условий эксперимента, в частности при субфертильности и высокой фертильности, как показано на сперме петухов (17). ICM-MS позволяет использовать многочисленные образцы необработанных клеток (без экстракции и предварительного фракционирования), но при простоте исполнения и пробоподготовки нуждается в наличии платформ для статистической обработки данных и программного обеспечения для анализа и квантификации спектральных пиков. Все это делает такой подход особенно перспективным в репродуктивных биотехнологиях при исследовании различных клеток в тканях репродуктивных органов.
Для обнаружения факторов, определяющих качество овоцитов, мы сравнили индивидуальные яйцеклетки, использовав ICM-MS. Спектральный профиль (фингерпринт) белков/пептидов, полученный для единичных овоцитов (незрелых и после IVM), включал более двух сотен пиков (18). Анализ методом главных компонент (Principle Component Analysis) позволил легко дискриминировать незрелые и зрелые овоциты на основании ряда пиков, которые значительно различались между группами. Более того, такой фингерпринт позволил дискриминировать даже овоци-ты одной и той же степени зрелости, но с разным потенциалом после IVF, например овоциты, дозревавшие in vivo против таковых in vitro, либо овоциты после IVM, дозревавшие в присутствии или в отсутствие клеток кумулюса, либо овоциты от неполовозрелых особей против таковых от взрослых коров.
ICM-MS анализ завершается идентификацией пиков спектра по массе и заряду (m/z). Массы пиков соотносятся с нативными эндогенными молекулами, присутствующими в образце. Среди доступных в настоящее время приемов лучший подход, позволяющий идентифицировать эндогенные пептидо- и протеоформы, предоставляет top-down (TD) протеомика с применением нано-LC-MS/MS высокого разрешения, так как при этом проводятся измерения интактных молекулярных форм и прямая фрагментация, что позволяет описать первичную структуру белка и его модификации (19). Комплексы овоцитов с кумулюсом и фолликулярными клетками были использованы для экстракции общего белка и последующей TD идентификации пиков в ICM-MS спектрах овоцитов. TD метод позволил выявить более 350 уникальных компонентов, которые были представлены либо интактными протеинами малого размера (15 %), либо N-концевыми, C-концевыми или внутренними фрагментами белков с большей молекулярной массой. Эти фрагменты представляют собой продукты протеолиза различными эндопептидазами с сайт-специфической или суб-страт-специфической активностью. PTMs тоже свидетельствовали о наличии этих протеоформ. Среди идентифицированных маркеров созревания овоцитов мы обнаружили протеины, связанные с формированием цитоскелета ( α - и β -тимозин), структурной организацией хромосом (гистоны) и деградацией протеинов (убиквитин) (20).
Л ипидо мика о во цито в. Внутриклеточные липиды выполняют различные функции, в том числе структурные (компоненты клеточных мембран), энергообеспечения и молекулярного сигналинга. Важность липидного метаболизма овоцита в процессе созревания для формирования компетентности к развитию в настоящее время окончательно признана (21). Активный липолиз, синтез жирных кислот и их окисление постоянно происходят в овоцитах крупного рогатого скота и окружающих их клетках кумулюса, усиливаясь при IVM (22). У коров овоциты богаты липидными капельными включениями, и при IVM общее количество липидов снижается (8). Различные приемы анализа липидов в овоцитах животных разных видов позволили охарактеризовать классы липидов в содержимом овоцита. Так, при исследовании комплекса липидов в индивидуальном овоците коровы методом MALDI-MS были обнаружены некоторые формы сфингомиелинов, фосфатилиохолинов и триацилглицеролов (23).
Мы адаптировали ICM-MS для получения фингерпринта липидов индивидуального овоцита. Эта процедура аналогична описанной для бел-ков/протеинов (изменяется матрикс и параметры спектров). Липиды легко детектировались, давая профили с множеством пиков разной интенсивности. Оценивая нормализованную высоту пиков для всех обнаруженных ионов, мы сопоставили липидные фингерпринты у незрелых овоцитов и овоцитов после IVM и обнаружили значительное увеличение по нескольким пикам, соответствующим фосфатидилхолину и сфингомиелину, тогда как представленность двух форм с меньшей молекулярной массой (предположительно свободные жирные кислоты) существенно снизилась (24).
Ограничения применимости омиксных технологий при изучении индивидуальных овоцитов. Технические препятствия для омиксного анализа индивидуального овоцита, связанные с минимальным количеством биоматериала, очевидны и требуют миниатюризации приемов экстракции и измерения показателей. Вероятно, в меньшей мере это касается транскриптомики (из-за амплификации РНК), однако и здесь возможны деформации в отношении представленности специфических РНК при неодинаковой скорости обогащения ими пула (из-за различий по уровню экспрессии или длине транскрипта). Также остается в силе вопрос о нормализации данных при исследовании овоцитов на разных стадиях созревания.
Условия хранение образцов до проведения анализа тоже критичны для получения корректных результатов. РНК овоцитов достаточно защищена от рибонуклеаз благодаря zona pellucida (кроме того, доступны протекторы РНК), но для защиты липидов (даже в замороженных образцах) необходимы дополнительные меры. Из-за массированной оксидации и деградации липидов под действием атмосферного кислорода, что значительно изменяет их профили в процессе хранения при - 80 ° С, липидомный анализ должен проводиться как можно быстрее после сбора образов. Белки, судя по всему, более стабильны, однако при выполнении ICM-MS на свежих овоцитах полученные спектры значительно информативнее и воспроизводимее тех, что дают замороженные яйцеклетки.
У овоцита, использованного для молекулярного анализа, способность к развитию уже нельзя оценить непосредственно, и о ней судят по компетентности овоцитов того же животного, дозревавших в тех же условиях. Однако здесь важно учитывать изменчивость овоцитов, полученных от одного животного и (или) из фолликулов разного размера. Качество овоцитов, отобранных для дозревания, рассматривается как ключевой фактор, определяющий долю овоцитов, развившихся до бластоцисты после IVM (25). Принимая во внимание все эти вариации, необходимо проводить анализ с достаточным числом биологических повторностей.
Использование клеток кумулюса при поиске неинвазивных биомаркеров качества овоцитов. Физически и метаболи-228
чески кумулюсные клетки связаны с овоцитами и могут отражать их физиологический статус благодаря непрерывному обмену малыми молекулами (ионы, метаболиты, аминокислоты, жирные кислоты, циклический АМФ и т.д.). Исходя из этого, для анализа можно взять часть кумулюсных клеток, а сам овоцит использовать в IVM и IVF. Так, сообщалось о системе для IVM, IVF и развития до стадии бластоцисты для незрелого овоцита с индивидуализацией процедуры идентификации (26). Между транскриптомом кумулюсных клеток овоцита и развитием из него зародыша обнаружили связь, что позволило идентифицировать маркеры, ассоциированные с качеством яйцеклетки (27). В результате был выявлен ген AGPAT9 вовлеченного в липидный метаболизм фермента 1-ацилглицерол-3-фосфат-O-ацилтранс-феразы, сверхэксперессия которого в клетках кумулюса коррелировала с остановкой развития зародыша на стадии 2-8 бластомеров.
В нашей лаборатории метод ICM-MS был адаптирован для изучения липидов и белков кумулюсных клеток индивидуального овоцита. Использовали весь кумулюс либо биопсийный материал. Липидные профили кумулюсных клеток четко дискриминировались по стадии созревания или метаболическому статусу соответствующих ооцитов (22). То же отмечали по белково-пептидным профилям, которые были специфичны и группировались в соответствии с состоянием овоцитов. Идентифицированные с помощью TD метода пики этих профилей кумулюсных клеток составили базу данных, которая будет использована в дальнейших исследованиях.
Таким образом, различные омиксные технологии становятся надежным инструментом при изучении индивидуальных овоцитов и соматических клеток фолликула. Методы транскриптомики, протеомики и липидо-мики овоцитов и кумулюсных клеток позволяют получать данные, на основании которых возможна разработка точного, быстрого и доступного теста для оценки качественных характеристик овоцитов, что необходимо в современных репродуктивных технологиях сельскохозяйственных животных и при маркер-опосредованной селекции (MAS). Очевидно, что сочетание оригинальных методов масс-спектрометрии (ICM-MS и TD) представляет собой правильную стратегию для идентификации маркеров качества овоци-тов у крупного рогатого скота при ограниченном количестве биоматериала.
Список литературы Применение омиксных технологий для идентификации маркеров компетентности индивидуальных овоцитов у крупного рогатого скота
- Wiltbank M.C., Baez G.M., Garcia-Guerra A., Toledo M.Z., Monteiro P.L., Melo L.F., Ochoa J.C., Santos J.E., Sartori R. Pivotal periods for pregnancy loss during the first trimester of gestation in lactating dairy cows. Theriogenology, 2016, 86(1): 239-53 ( ) DOI: 10.1016/j.theriogenology.2016.04.037
- Lonergan P., Fair T., Forde N., Rizos D. Embryo development in dairy cattle. Theriogenology, 2016, 86(1): 270-277 ( ) DOI: 10.1016/j.theriogenology.2016.04.040
- Sirard M.A., Gilbert I. Omics as tools for oocyte selection, in Biology and pathology of the oocyte/A. Trounson, R. Gosden, E.-R. Ursula (eds.). Cambridge University Press, 2013: 297-304.
- Sirard M.A., Richard F., Blondin P., Robert C. Contribution of the oocyte to embryo quality. Theriogenology, 2006, 65(1): 126-136 ( ) DOI: 10.1016/j.theriogenology.2005.09.020
- Dalbies-Tran R., Mermillod P. Use of heterologous complementary DNA array screening to analyze bovine oocyte transcriptome and its evolution during in vitro maturation. Biol. Reprod., 2003, 68(1): 252-261.
- Angulo L., Guyader-Joly C., Auclair S., Hennequet-Antier C., Papillier P., Boussaha M., Fritz S., Hugot K., Moreews F., Ponsart C., Humblot P., Dalbies-Tran R. An integrated approach to bovine oocyte quality: from phenotype to genes. Reprod. Fertil. Dev., 2015, 28(9): 1276-1287 ( ) DOI: 10.1071/RD14353
- Labrecque R., Fournier E., Sirard M.A. Transcriptome analysis of bovine oocytes from distinct follicle sizes: Insights from correlation network analysis. Mol. Reprod. Dev., 2016. 83(6): 558-69 ( ) DOI: 10.1002/mrd.22651
- Auclair S., Uzbekov R., Elis S., Sanchez L., Kireev I., Lardic L., Dalbies-Tran R., Uzbekova S. Absence of cumulus cells during in vitro maturation affects lipid metabolism in bovine oocytes. American Journal of Physiology: Endocrinology and Metabolism, 2013, 304(6): E599-E613 ( ) DOI: 10.1152/ajpendo.00469.2012
- Misirlioglu M., Page G.P., Sagirkaya H., Kaya A., Parrish J.J., First N.L., Memili E. Dynamics of global transcriptome in bovine matured oocytes and preimplantation embryos. PNAS USA, 2006, 103(50): 18905-18910 ( ) DOI: 10.1073/pnas.0608247103
- Thelie A., Papillier P., Pennetier S., Perreau C., Traverso J.M., Uzbekova S., Mermillod P., Joly C., Humblot P., Dalbies-Tran R. Differential regulation of abundance and deadenylation of maternal transcripts during bovine oocyte maturation in vitro and in vivo. BMC Developmental Biology, 2007, 7: 125 ( ) DOI: 10.1186/1471-213X-7-125
- Uzbekova S., Arlot-Bonnemains Y., Dupont J., Dalbies-Tran R., Papillier P., Pennetier S., Thelie A., Perreau C., Mermillod P., Prigent C., Uzbekov R. Spatio-temporal expression patterns of aurora kinases a, B, and C and cytoplasmic polyadenylation-element-binding protein in bovine oocytes during meiotic maturation. Biol. Reprod., 2008, 78(2): 218-233 ( ) DOI: 10.1095/biolreprod.107.061036
- Bhojwani M., Rudolph E., Kanitz W., Zuehlke H., Schneider F., Tomek W. Molecular analysis of maturation processes by protein and phosphoprotein profiling during in vitro maturation of bovine oocytes: a proteomic approach. Cloning Stem Cells, 2006, 8(4): 259-274 ( ) DOI: 10.1089/clo.2006.8.259
- Arnold G.J., Frohlich T. Dynamic proteome signatures in gametes, embryos and their maternal environment. Reprod. Fertil. Dev., 2011, 23(1): 81-93 ( ) DOI: 10.1071/RD10223
- Virant-Klun I., Leicht S., Hughes C., Krijgsveld J. Identification of maturation-specific proteins by single-cell proteomics of human oocytes. Mol. Cell. Proteomics, 2016, 15(8): 2616-2627 ( ) DOI: 10.1074/mcp.M115.056887
- Holland R.D., Wilkes J.G., Rafii F., Sutherland J.B., Persons C.C., Voorhees K.J., Lay J.O., Jr. Rapid identification of intact whole bacteria based on spectral patterns using matrix-assisted laser desorption/ionization with time-of-flight mass spectrometry. Rapid Commun. Mass Spectrom., 1996, 10(10): 1227-1232 (doi: 10.1002/(SICI)1097-0231(19960731)10:103.0.CO;2-6).
- Labas V., Spina L., Belleannee C., Teixeira-Gomes A.P., Gargaros A., Dacheux F., Dacheux J.L. Analysis of epididymal sperm maturation by MALDI profiling and top-down mass spectrometry. J. Proteomics, 2015, 113: 226-243 ( ) DOI: 10.1016/j.jprot.2014.09.031
- Labas V., Grasseau I., Cahier K., Gargaros A., Harichaux G., Teixeira-Gomes A.-P., Alves S., Bourin M., Gérard N., Blesbois E. Qualitative and quantitative peptidomic and proteomic approaches to phenotyping chicken semen. J. Proteomics, 2015, 112: 313-335 ( ) DOI: 10.1016/j.jprot.2014.07.024
- Labas V., Spina L., Uzbekova S. Single cell MALDI-TOF mass spectrometry analysis: mammalian oocyte profiling could reflect its quality. Proc. 10th World Congress HUPO 2011. Genève, 2011: 1.
- Kellie J.F., Tran J.C., Lee J.E., Ahlf D.R., Thomas H.M., Ntai I., Catherman A.D., Durbin K.R., Zamdborg L., Vellaichamy A., Thomas P.M., Kelleher N.L. The emerging process of Top Down mass spectrometry for protein analysis: biomarkers, protein-therapeutics, and achieving high throughput. Mol. Biosyst., 2010, 6(9): 1532-1539 ( ) DOI: 10.1039/c000896f
- Uzbekova S. Mass spectrometry approaches for characterization of fertility biomarkers: from tissue to single cell. Proc. 2nd Int. Symp. on Microgenomics 2016. Paris, 2016: 1.
- Dunning K., Russell D.L., Robker R. Lipids and oocyte developmental competence: the role of fatty acids and B-oxidation. Reproduction, 2014, 148: R15-R27 ( ) DOI: 10.1530/REP-13-0251
- Sanchez-Lazo L., Brisard D., Elis S., Maillard V., Uzbekov R., Labas V., Desmarchais A., Papillier P., Monget P., Uzbekova S. Fatty acid synthesis and oxidation in cumulus cells support oocyte maturation in bovine. Mol. Endocrinol., 2014, 28(9): 1502-1521 ( ) DOI: 10.1210/me.2014-1049
- Ferreira C.R., Saraiva S.A., Catharino R.R., Garcia J.S., Gozzo F.C., Sanvido G.B., Santos L.F., Lo Turco E.G., Pontes J.H., Basso A.C., Bertolla R.P., Sartori R., Guardieiro M.M., Perecin F., Meirelles F.V., Sangalli J.R., Eberlin M.N. Single embryo and oocyte lipid fingerprinting by mass spectrometry. J. Lipid Res., 2010, 51(5): 1218-1227 ( ) DOI: 10.1194/jlr.D001768
- Bertevello P., Ghazouani O., Elis S., Banliat C., Teixeira Gomes A.-P., Maillard V., Labas V., Uzbekova S. MALDI-TOF mass spectrometry analysis of lipids in single bovine oocytes during IVM. Proc. 32nd Scientific meeting of the Association of Embryo Technology in Europe (AETE). Barcelona, Spain, 2016: 213.
- Lonergan P., Fair T. Maturation of oocytes in vitro. Annu. Rev. Anim. Biosci., 2016, 4: 255-268 ( ) DOI: 10.1146/annurev-animal-022114-110822
- Matoba S., Fair T., Lonergan P. Maturation, fertilisation and culture of bovine oocytes and embryos in an individually identifiable manner: a tool for studying oocyte developmental competence. Reprod. Fertil. Dev., 2010, 22(5): 839-851 ( ) DOI: 10.1071/RD09277
- Bunel A., Jorssen E.P., Merckx E., Leroy J.L., Bols P.E., Sirard M.A. Individual bovine in vitro embryo production and cumulus cell transcriptomic analysis to distinguish cumulus-oocyte complexes with high or low developmental potential. Theriogenology, 2015, 83(2): 228-237 ( ) DOI: 10.1016/j.theriogenology.2014.09.019


