Применение пептидов мочевого пузыря крупного рогатого скота при лучевом поражении мочевого пузыря в хроническом эксперименте
Автор: Цуканов А.Ю., Байпакова М.И., Дорофеева В.П., Леонов О.В., Глатко С.Б., Новоселов А.В., Городилов Р.В., Снитко И.О.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 1 т.18, 2025 года.
Бесплатный доступ
Введение. Лучевое поражение мочевого пузыря является осложнением после терапевтического облучения органов малого таза. Стратегия фармакотерапии таких осложнений в настоящий момент неоднозначна из-за малого количества исследований и неясности патогенеза. Цель исследования. Изучить эффективность применения полипептидов мочевого пузыря крупного рогатого скота при моделировании лучевого поражения мочевого пузыря у крыс.
Регуляторные пептиды, лучевой цистит, везустен, морфология мочевого пузыря
Короткий адрес: https://sciup.org/142245466
IDR: 142245466 | DOI: 10.29188/2222-8543-2025-18-1-18-26
Текст научной статьи Применение пептидов мочевого пузыря крупного рогатого скота при лучевом поражении мочевого пузыря в хроническом эксперименте
экспериментальная урология экспериментальная и клиническая урология № 1 2025
Лучевое поражение мочевого пузыря является потенциальным осложнением после терапевтического облучения злокачественных новообразований органов малого таза (предстательной железы, шейки матки прямой кишки, мочевого пузыря). До сих пор данная патология является недостаточно изученной, не в полной мере определены этиопатогенетические механизмы и тактика ведения пациентов [1].
Мочевой пузырь является критически уязвимым органом, в том числе чувствительным к низким дозам радиации. Несмотря на возможность применения усовершенствованных методов лучевой терапии (модуляция интенсивности, стереотаксическая лучевая терапия и брахитерапия под визуальным контролем) которые позволяют доставлять более эффективные дозы в меньших объемах с улучшением переносимости лечения, облучение органов малого таза по-прежнему является причиной ранних и/или поздних нежелательных явлений, в значительной степени нарушающих функцию мочевого пузыря [2, 3].
Заболеваемость лучевым циститом по различным литературным данным колеблется от 9,1% до 80%. Столь высокий разброс связан с различиями в диагностических критериях и методах мониторинга. Острые проявления лучевого цистита могут быть недооценены (и, следовательно, о них не сообщается), хотя в это время развиваются необратимые радиационно-индуцированные поражения мочевого пузыря. Поздний лучевой цистит является результатом продолжающегося процесса разрушения ткани мочевого пузыря и гистологических изменений [4].
Тяжесть лучевого цистита зависит от объема радиационного воздействия, общей полученной дозы, а также от схемы лучевой терапии и фракционирования. Это заболевание может существенно влиять на качество жизни пациентов.
Особую по сложности курации группу составляют пациенты, длительное время находящиеся на лучевой терапии, когда качество жизни максимально снижено. Заболеваемость поздним симптоматическим лучевым циститом стабильна с течением времени и составляет 5-10%, несмотря на усовершенствование методов лучевой терапии [6-8].
Для облегчения симптомов лучевого цистита традиционно применяют антихолинергические средства, которые являются, по сути, лишь симптоматическими уменьшающими сократимость детрузора [9]. Альфа-адреноблокаторы упоминаются в контексте обсуждаемой проблемы для облегчения симптомов мочеиспускания но действие их весьма ограничено в данной клинической ситуации [4]. Известно применение внутрипузырных инстилляций различными лекарственными «коктейлями», например, комбинации «гидрокортизон+гепарин+ лидокаин» по различным схемам, однако рядом авторов также отмечена их невысокая эффективность [6].
По мере улучшения выживаемости онкологических больных вопросы качества жизни приобретают все большее значение, поэтому улучшение понимания механизмов развития лучевого цистита, а также поиск более эффективных способов терапии имеет важное значение [2].
Известно, что воздействие ионизирующей радиации приводит к изменению экспрессии генов, отвечающих за выживаемость клеток и их пролиферацию, а развитие отсроченных последствий радиации в окружающих тканях зачастую связано с эпигенетическими воздействиями (локальным подавлением экспрессии генов) и последующим нарушением секреции сигнальных молекул, реализующих механизмы защиты и внут-риорганной (паракринной) регуляции, включая факторы пролиферации, репарации и иммунного ответа [10-12].
Таким образом, для предотвращения отдаленных эффектов лучевой терапии особенно перспективным является поиск способов таргетного восстановления экспериментальная и клиническая урология № 1 2025 экспрессии генов и сигнальных молекул в окружающих тканях. Таким способом может стать применение регуляторных полипептидов, эффекты которых, согласно экспериментальным данным, реализованы через модуляцию экспрессии генов и восстановление внутриорганной пептидной регуляции, предотвращение повреждений ДНК и восстановление митохондриальной активности в тропных тканях [13-15].
При радиационно-индуцированных циститах представляется целесообразным применение регуляторных полипептидов мочевого пузыря,способных восстанавливать белоксинтезирующую активность уротелия, внутриорганную регуляцию и, в итоге, нормальную структуру, функциональную активность и репаративный потенциал органа.
Единственный лекарственный препарат на основе регуляторных пептидов мочевого пузыря, зарегистрированный на территории Российской Федерации – Везустен, применяемый в настоящее время для патогенетического лечения гиперактивного мочевого пузыря и вошедший в клинические рекомендации по недержанию мочи. Препарат оказывает тканеспецифическое действие, нормализует сократительную и эва-куаторную функции мочевого пузыря, уменьшает количество эпизодов недержания мочи, частоту и ур-гентность мочеиспусканий [16-18].
Цель: изучить эффективность применения полипептидов мочевого пузыря крупного рогатого скота при моделировании лучевого поражения мочевого пузыря у крыс.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве экспериментальных животных были использованы 55 половозрелых крыс-самок линии Wistar, массой 200±20 г. Все процедуры одобрены локальным этическим комитетом ФГБОУ ВО ОмГМУ Минздрава России, протокол №10 от 19.09.2023. Животных содержали в стандартных лабораторных условиях со своевременным приемом корма и питьевой воды. На 0-е сутки особям делали мультиспиральную компьютерную томографию (МСКТ) для определения положения мочевого пузыря и создания 3D модели мочевого пузыря для формирования зоны облучения. Животную модель лучевого цистита формировали однократным облучением в дозе 20 Гр, аппаратом Varian (США).
Животные были распределены на 5 групп:
-
• группа 1 – интактные животные, без облучения (n=5);
-
• группа 2 – отрицательный контроль, облучение животных без лечения (n=20);
-
• группа 3 – терапия препаратом Везустен, начиная с 10-х суток после облучения, в/м ежедневно в течение 10 дней, в дозе 0,056 мг/кг, в объеме 0,1 мл (n=10);
-
• группа 4 – терапия препаратом Везустен, в/м
ежедневно в течение 10 дней, в дозе 0,056 мг/кг, в объеме 0,1 мл у животных без облучения, для изучения безопасности (n=10);
-
• группа 5 – положительный контроль, проведение «стандартной терапии» – инстилляция комбинации гидрокортизон+гепарин+лидокаин в течение 10 дней, начиная с 10-х суток после облучения (n=10).
В ходе морфологического исследования, кроме описательного, использован иммуногистохимический метод изучения стенки мочевого пузыря, проведенный с целью оценки секреции сигнальных молекул. Серийные поперечные срезы окрашены гематоксилином-эозином.
Для иммуногистохимического исследования использованы антитела к трансформирующему фактору роста бета-1 (TGF-β1) – полифункциональному полипептиду, принадлежащему к семейству димерных полипептидов с молекулярной массой 25 кДа,которые широко распространены в тканях и синтезируются многими клетками. TGF-β1 оказывает разнонаправленные эффекты фактически на все типы клеток,ре-гулирует рост и дифференцировку клеток.
Для исследования использованы максимально измененные участки после создания модели лучевого цистита из области шейки мочевого пузыря. Морфометрию производили в интерфейсе программы ImageJ для оценки долей мышечной и соединительной тканей в препарате (на каждый препарат производили оценку в 5 случайных полях зрения).
РЕЗУЛЬТАТЫ
Оценивали изменения в поведении крыс на протяжении всего эксперимента. Начиная с 5 суток после облучения, у животных отмечалась некоторая заторможенность, крысы были сонные и заметно группировались в домашней клетке. На 14 день после моделирования (4 день терапии)крысы под воздействием Везустена вели себя более активно, у других групп таких изменений не отмечалось.
На 10-14 дни после облучения у крыс начались изменения шерстяного покрова в виде алопеции, язвенных изменений. У животных, получавших терапию пептидным препаратом Везустен,шерстяной покров восстанавливался к 22-26 суткам эксперимента, у крыс из групп положительного и отрицательного контроля язвы и алопеции сохранялись до окончания эксперимента.
При наблюдении крыс из групп негативного контроля и терапии инстилляциями была отмечена острая задержка мочи, в результате чего опорожнение мочевого пузыря происходило с помощью массажных движений в области уретры.
Была изучена гистоструктура мочевого пузыря у интактных и модельных животных (табл. 1, рис. 1). Молодые самки крыс возрастом 2 месяца имели чет-
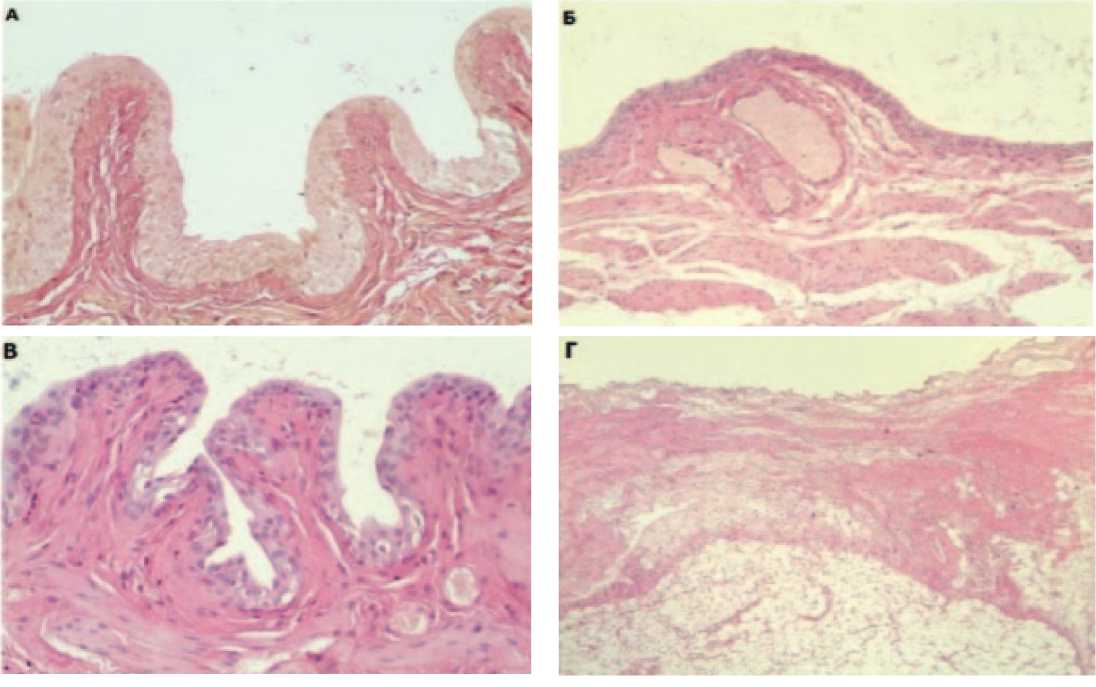
Рис. 1. Микрофотография мочевого пузыря крысы. Окраска гематоксилином и эозином, световая микроскопия, х40. А – Интактная группа. Б – Группа негативного контроля. В – Терапия Везустеном. Г – Терапия инстилляциями. Отмечаются дистрофические изменения на рисунках Б и Г.
Таблица 1. Изменения в морфологии стенки мочевого пузыря крыс
Table 1. Changes in the morphology of the urinary bladder wall in rats
Показатель Indicator Литературные данные [5] Literary data [5] Интактная группа Intact group Отрицательный контроль Negative control Терапия Везустеном Therapy Vesusten Терапия инстилляциями Instillation therapy Толщина стенки мочевого пузыря, мкм Bladder wall thickness, microns 350-420 410 295 385 310 Длина складки, мкм Fold length, microns 385-400 390 - 370 180 Толщина складки, мкм Fold thickness, microns 116 114 - 112 85 Слоистость, мкм Layering, microns 5-7 3-6 1-2 2-4 1-2 Высота микроворсинок, мкм Height of microvilli, microns 2 2 1 2 1 Ядро клетки (d), мкм Cell nucleus (d), microns 4,5-7 5,5 3,5 5,0 4,0 Переходный эпителий слизистой оболочки, мкм Transitional epithelium of the mucous membrane, microns 23-25 24 18 22 18 Собственная пластинка слизистой оболочки, мкм Lamina propria of the mucous membrane, microns 70-75 73 60 69 62 Мышечная оболочка, мкм Muscular membrane, microns 302 299 200 287 224 Серозная оболочка, мкм Serous membrane, microns 7 6 4 6 5 Сосуды, мкм Vessels, microns Капилляры (Capillaries) 7-8 Венулы (Venules) 12-16 Капилляры (Capillaries) 7 Венулы (Venules) 14 Капилляры (Capillaries) 4 Венулы (Venules) 18 Капилляры (Capillaries) 6 Венулы (Venules) 12 Капилляры (Capillaries) 4 Венулы (Venules) 17 экспериментальная и клиническая урология № 1 2025 кую трехслойную структуру и выраженную складчатость слизистой, что коррелируют с данными доступной литературы о нормальной анатомии [5].
Полученные результаты коррелируют с литературными данными, микроскопически модель лучевого цистита была достигнута (рис. 1А). В группе негативного контроля (группа 2) наблюдали резко расширенные просветы мочевых пузырей.Переходный эпителий состоял из 1-2 слоев с выраженной дистрофией. В срезах обнаружена выраженная атрофия, носящая тотальный характер,резкое истончение всех слоев вплоть до очагов атрофии мышечного слоя. В большей части образцов выявлено очаговое/тотальное исчезновение складок. Данные изменения говорят о начинающемся склерозе в мочевом пузыре на фоне облучения (рис. 1Б). В группе животных с введением Везустена (группа 3) морфологическая картина была максимально приближена к интактной группе: небольшое снижение высоты и количества складок, уменьшение слоев эпителия до 1-2 и уменьшение количества сосудов капиллярного типа,по сравнению со здоровыми животными (рис. 1В). При применении инстилляций у крыс (группа 5) морфологическая картина не отличалась от группы негативного контроля: складчатость сглажена, эрозивно-язвенные дефекты слизистой до мышечного слоя, воспалительная инфильтрация распространена на все слои стенки мочевого пузыря, эпителий истончен,с обширными очагами десквамации местами – эрозивные изменения и некроз, гиповаскуляризация, в подслизистой встречаются мелкие капилляры (рис. 1Г). Для оценки безопасности применения препарата Везустен изучали его влияние на мочевой пузырь здоровых животных (группа 4). По результатам контрольного морфологического исследования, в группе 4 строение стенки мочевого пузыря было максимально приближено к нормальному. Лишь в отдельных образцах отмечалась сглаженность слизистой оболочки, количество слоев эпителия достигало 3-5 клеточных слоев (рис. 2).
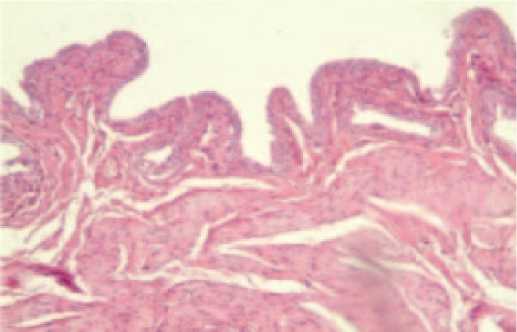
Рис. 2. Микрофотография мочевого пузыря здорового животного после применения препарата Везустен. Окраска гематоксилином и эозином, световая микроскопия, увеличение х40. Нормальное строение слизистой.
При морфометрии полученных микрофотографий в интерфейсе программы ImageJ и оценке долей мышечной и соединительной тканей в препарате получены данные, наглядно демонстрирующие, что фиброз был наиболее выражен в группах негативного контроля и терапии инстилляциями. В группе крыс, получающих терапию Везустеном, изменения были незначительные (табл. 2, рис. 3). Отмечается статистически достоверная разница в распределении мышечной и соединительной тканей между группами интактных животных, негативного контроля и стандартной терапии.
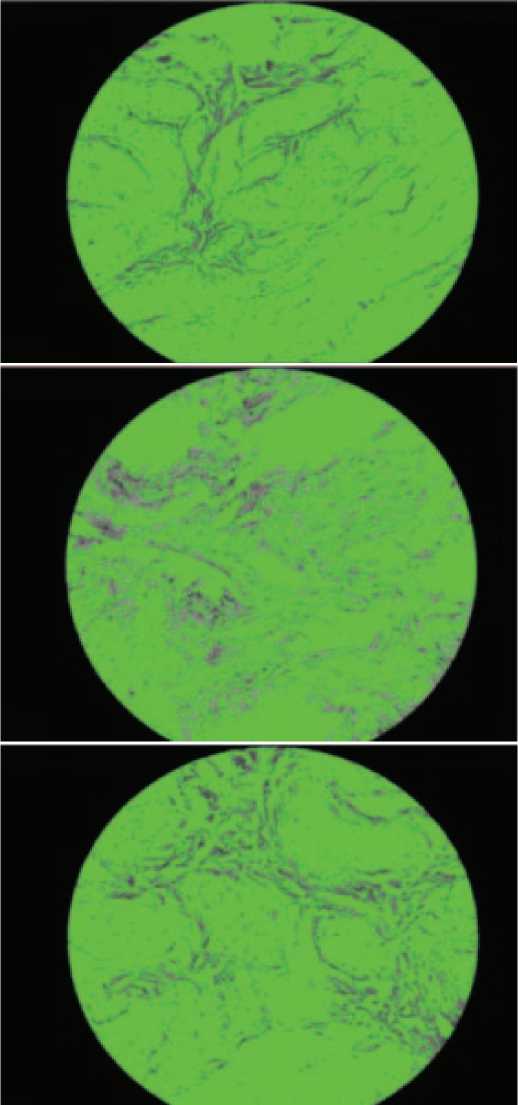
Рис. 3. Вид препарата в интерфейсе программы ImageJ на 40-е сутки.
А – Интактные животные. Б – Негативный контроль. В – Терапия Везустеном Fig. 3. View of the drug in the ImageJ program interface on day 40.
A – Intact animals. Б – Negative control. В – Vesusten therapy
При иммуногистохимическом исследовании оценивали разницу в экспрессии паракринного фактора TGF-β1, которая оказалась наиболее заметной на клетках эндотелия сосудов подслизистой основы. Положительная реакция расценивалась как умеренное мем- бранное и цитоплазматическое окрашивание в более чем 50% клеток сосуда. В микропрепаратах подсчитывалось общее количество капилляров подслизистой основы и количество TGF- β1-положительных капилляров (рис. 4).
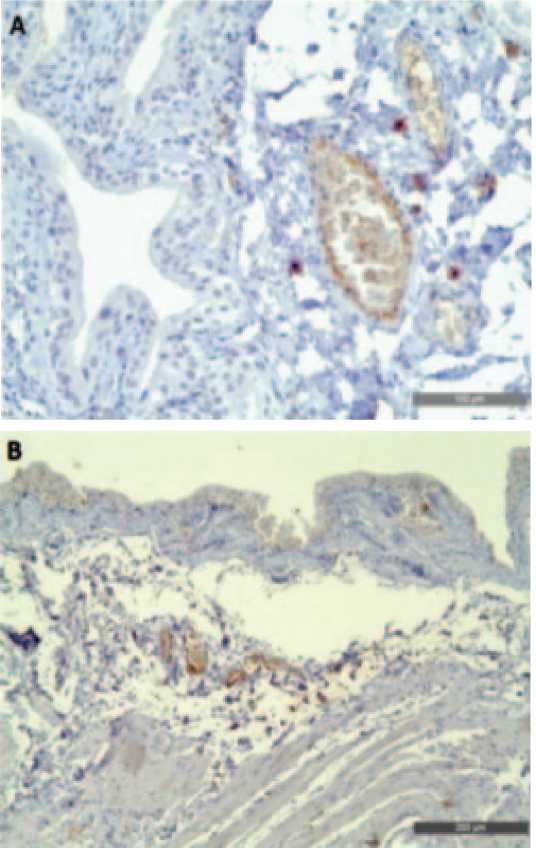
Рис. 4. Иммуногистохимическая картина экспрессии TGF-β1, увеличение х10. А – Интактная группа, экспрессия наблюдалась в 95% случаев. Б – Негативный контроль, отмечалась слабая экспрессия, в некоторых препаратах полностью отсутствовала. В – Терапия Везустеном, экспрессия наблюдалась в 60% случаев. Г – Терапия инстилляциями, экспрессия отмечалась только в сосудах
Fig. 4. Immunohistochemical pattern of TGF-β1 expression, x10. A – Intact group, expression was observed in 95% of cases. Б – Negative control, weak expression was noted, completely absent in some preparations. В – Vesusten therapy, expression was observed in 60% of cases. Г – Instillation therapy, expression was noted only in vessels
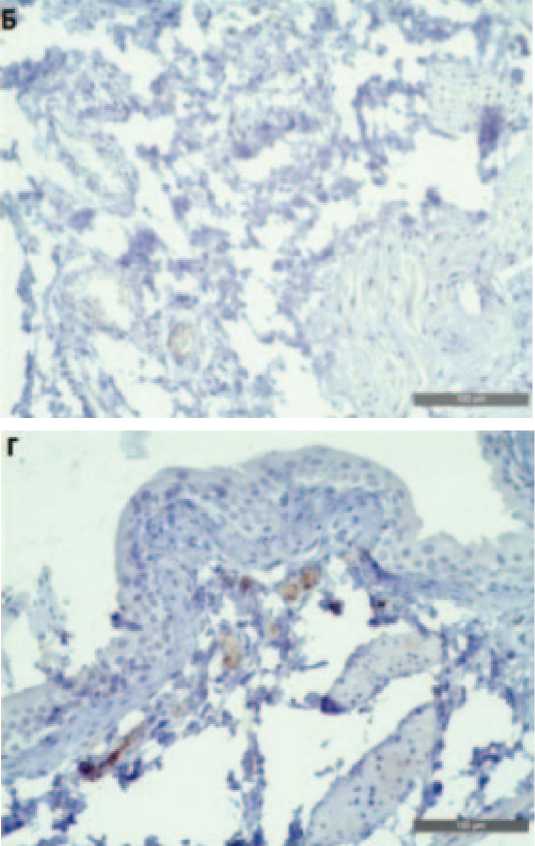
Таблица. 2 Морфометрическое исследование микропрепаратов с использованием программы ImageJ
Table 2. Morphometric study of micropreparations using the ImageJ program
|
Группы Groups |
Среднее значение Average value |
|
|
Мышечная ткань, % Muscle tissue, % |
Соединительная ткань, % Connective tissue, % |
|
|
Интактные животные Intact animals |
62,828 |
37,172 |
|
Негативный контроль Negative control |
47,9814 |
52,0186 |
|
Терапия Везустеном Vesustene therapy |
55,3614 |
44,6386 |
|
Терапия инстилляциями Instillation therapy |
46,5832 |
53,4168 |
При статистической обработке результатов отношения TGF-β1-положительных сосудов к суммарному количеству капилляров с использованием ANOVA с критерием Дьюка установлены следующие различия: уменьшение количества позитивных клеток в группе негативного контроля и терапии инстилляциями по сравнению с интактными животными более чем в 6 раз ((0,62 vs 0,1) p <0,001 и (0,62 vs 0,35) p <0,001); значительное превышение количества позитивных клеток в группе 3 (лечение препаратом Везустен) по сравнению с группой негативного контроля (0,1 против 0,68, p <0,001); тенденция к увеличению TGF-β1-положительных клеток у животных под воздействием Везустена относительно интактных животных (0,68 vs 0,62) p =0,06.
ОБСУЖДЕНИЕ
В доступной литературе данных о применении пептидов мочевого пузыря крупного рогатого скота при лучевом цистите нами не встречено.
Острое лучевое поражение тканей мочевого пузыря обусловлено преимущественно повреждением слизистой оболочки мочевого пузыря. При этом регенерация уротелия останавливается, а клетки слущиваются без регенерации, что делает мочевой пузырь уязвимым к травмам и инфекциям [19]. Эти поражения характеризуются острой воспалительной реакцией проявляющейся отеком и гиперемией уротелия [20]. В большинстве случаев прогноз благоприятный, проявления исчезают спонтанно в течение четырех-шести недель после завершения лучевой терапии [19-21], однако при 3-4 степени тяжести радиационно-индуцированного цистита может потребоваться временное прекращение лучевой терапии, что может привести к снижению контроля над опухолью [21].
В нашем эксперименте были воссозданы клинические и морфологические симптомы лучевого цистита на животных, выявлена низкая эффективность внутрипузырных инстилляций комбинации «гидро-кортизон+гепарин+лидокаин» как в отношении клинических проявлений (состояние шерстяного покрова масса тела, активность), так и на морфологическом уровне (состояние слизистой, развитие фиброза).
Введение регуляторных полипептидов мочевого пузыря (Везустен) оказывало положительный эффект после моделирования лучевого цистита. В сравнении со стандартной терапией инстилляциями,введение Везустена показало лучшую переносимость после-лучевого состояния (поведение животных, состояние шерстяного покрова, масса тела). Эти результаты подтверждаются морфологической картиной: состояние слизистой оболочки мочевого пузыря после облучения на фоне введения Везустена лишь немного отличалось от интактных животных,имелись сущест- венные отличия от групп с инстилляциями и негативного контроля: в группе терапии Везустеном отсутствовали очаги атрофии, некроза, эрозивные изменения, признаки начинающегося склероза и фиброза (табл. 1). При введении Везустена здоровым животным морфологическая картина мочевого пузыря не изменялась,что говорит об отсутствии токсического действия препарата.
Кроме влияния Везустена на общее состояние животных и морфологическую картину при радиационно-индуцированном цистите, в данном эксперименте изучен один из возможных механизмов противовоспалительного, радиопротективного и репаративного действия Везустена – модуляция экспрессии полипептидного фактора TGF-β1, обладающего широким спектром биологической активности.
Известно, что эффекты TGF-β1 включают контроль над клеточным ростом, пролиферацией, процессами воспаления, дифференцировкой клеток и апоптозом [22, 23].
TGF-β1 обладает ингибиторной активностью по отношению к T- и B-клеточнои ̆ пролиферации, а также к созреванию и активации макрофагов и является элементом обратной регуляции иммунного ответа, прежде всего, воспалительной реакции. TGF-β1 ингибирует активность NK-клеток, подавляет цитотоксическую активность CD8+-лимфоцитов, лим-фокин-активированных киллеров и блокирует выработку цитокинов и секрецию некоторых иммуноглобулинов [24].
Активация экспрессии TGF-β1 в норме происходит в ответ на повреждение, что необходимо для активации репарации ДНК и последующего восстановления поврежденных тканей [22]. Показано, что острое радиационное поражение в значительной степени снижает экспрессию TGF-β1, а достоверное сохранение TGF-β1-положительных клеток на физиологическом уровне у животных может быть отражением выраженных протективных эффектов Везустена в отношении тканей мочевого пузыря на фоне лучевой альтерации, в том числе и в части сохранения ангиогенеза подслизистого слоя.
ЗАКЛЮЧЕНИЕ
На достигнутой экспериментальной модели лучевого цистита у крыс введение регуляторных полипептидов мочевого пузыря крупного рогатого скота (препарат Везустен) как значительно уменьшило клинические проявления лучевого поражения, так и нормализовало морфологическую картину. Вероятно репаративный эффект Везустена реализуется, в том числе,за счет нормализации экспрессии паракринного пептидного фактора TGF-β1 по сравнению с животными без терапии.
ИШАТШШШШШ
экспериментальная и клиническая урология № 1 2025
Сведения об авторах:
Цуканов А.Ю. – д.м.н., профессор, заведующий кафедрой хирургических болезней и урологии ДПО ФГБОУ ВО «Омский Государственный Медицинский университет» Минздравa России; Омск, Россия; РИНЦ Author ID 469942,
Байпакова М.И. – врач-уролог, Городской клинический перинатальный центр; Омск Россия;
Дорофеева В.П. – к.вет.н., доцент кафедры диагностики, внутренних незаразных болезней, фармакологии,хирургии и акушерства,ФГБОУ ВО «Омский Государственный Медицинский университет» Минздравa России; Омск, Россия;
РИНЦ AuthorID: 667448,
Леонов О.В. – д.м.н., заместитель главного врача, Клинический онкологический диспансер, Омск, ассистент кафедры онкологии, лучевой терапии, ФГБОУ ВО «Омский Государственный Медицинский университет» Минздравa России; Омск,Россия;
РИНЦ Author ID 367094,
Глатко С.Б. – заведующий патологоанатомическим отделением «Клинический онкологический диспансер»; Омск, Россия; РИНЦ Author ID 570546,
Новоселов А.В. – начальник службы Медико-физического сопровождения радиотерапии, Клинический онкологический диспансер; Омск, Россия;
Городилов Р.В. – к.м.н., врач-патологоанатом патологоанатомического отделения, Клинический онкологический диспансер; Омск, Россия; РИНЦ Author ID 301707,
Снитко И.О. – старший преподаватель кафедры диагностики, внутренних незаразных болезней, фармакологии, хирургии и акушерства, ФГБОУ ВО «Омский Государственный Медицинский университет» Минздравa России; Омск, Россия;
РИНЦ Author ID 1234511,
Вклад авторов:
Цуканов А.Ю. – идея и разработка дизайна исследования, редактирование, проверка и утверждение текста, обработка результатов, написание текста статьи, 25%
Байпакова М.И. – разработка дизайна исследования, проведение экспериментального исследования, обработка результатов, написание текста статьи, 25%
Дорофеева В.П. – проведение экспериментального исследования, 5%
Леонов О.В. – разработка дизайна исследования, проведение экспериментального исследования, 5%
Глатко С.Б. – проведение морфологического исследования, 10%
Новоселов А.В. – помощь в создании модели лучевого цистита, 5%
Городилов Р.В. – проведение морфологического исследования, 10%
Снитко И.О. – проведение экспериментального исследования, 10%
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Финансирование: Статья подготовлена при финансовой поддержке ООО «ПептидПро».
Статья поступила: 19.01.25
Результаты рецензирования: 21.02.25
Исправления получены: 23.02.25
Принята к публикации: 28.02.25
Information about authors:
Tsukanov A.Yu. – Dr. Sci., Professor, Head of the Department of Surgical Diseases and Urology of the Omsk State Medical University of the Ministry of Health of the Russian Federation; Omsk, Russia; RSCI Author ID 469942,
Baypakova M.I. – urologist, City Clinical Perinatal Center; Omsk, Russia;
Dorofeeva V.P. – PhD , Associate Professor of the Department of Diagnostics, Internal Non-Communicable Diseases, Pharmacology, Surgery and Obstetrics, Omsk State Agrarian University; Omsk, Russia; RSCI Author ID 667448,
Leonov O.V. – Dr. Sci., Deputy Chief Physician, Clinical Oncology Dispensary, Omsk, Assistant of the Department of Oncology, Radiation Therapy, Omsk State Medical University Ministry of Health of the Russian Federation; Omsk, Russia;
RSCI Author ID 367094,
Glatko S.B. – Head of the Pathological Anatomical Department of the Clinical
Oncology Dispensary; Omsk, Russia; RSCI AuthorID: 570546,
Novoselov A.V. – Head of the Medical and Physical Support Service for
Radiotherapy, Clinical Oncology Dispensary; Omsk, Russia;
Snitko I.O. – Senior Lecturer, Department of Diagnostics, Internal Non-Communicable Diseases, Pharmacology, Surgery and Obstetrics, Omsk State Medical University of the Ministry of Health of the Russian Federation; Omsk, Russia; RSCI Author ID 1234511
Authors’ contributions:
Tsukanov A.Yu. – idea and development of the study design, editing, checking and approving the text, processing the results, writing the article text, 25%
Baypakova M.I. – development of the study design, conducting the experimental study, processing the results, writing the article text, 25%
Dorofeeva V.P. – conducting the experimental study, 5%
Leonov O.V. – development of the study design, conducting the experimental study, 5%
Glatko S.B. – conducting the morphological study, 10%
Novoselov A.V. – assistance in creating the radiation cystitis model, 5%
Gorodilov R.V. – conducting the morphological study, 10%
Snitko I.O. – conducting the experimental study, 10%
Conflict of interest. The authors declare no conflict of interest.
Financing. The article was prepared with the financial support of
LLC «PeptidPro».
Received: 19.01.25
Peer review: 21.02.25
Corrections received: 23.02.25
Accepted for publication: 28.02.25
™ ТЫ НИКОГДА НЕ ЗНАЕШЬ, ГДЕ ЭТО СЛУЧИТСЯ...
Везустен
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ «НЕДЕРЖАНИЕ МОЧИ» 2024: полипептиды мочевого пузыря [Везустен®]
рекомендуются
* Уровень убедительности рекомендаций А Е£% • Уровень достоверности доказательств 2 Ш?
Р WPT И® ПЕРВЬ|Й*ПРЕПАРАТ Для ПАТОГЕНЕТИЧЕСКОГО D LU J U 11 КУРСОВОГО ЛЕЧЕНИЯ гмп
Снижение частоты мочеиспусканий и ургентных позывов у 67% пациентов более чем на 20% по шкале TUFS
Снижение количества эпизодов недержания мочи в 2,9 раза
Эффект нарастает после завершения курса терапии в течение 3 недель и более
ГМП - гиперактивный мочевой пузырь, TUFS - Total Urgency and Frequency Score - обобщённая шкала ургентности и частоты мочеиспусканий *Первый препарат для патогенетического лечения ГМП в анатомо-терапевтически-химической группе G04BD «Средства для лечения учащенного мочеиспускания и недержания мочи-
Пушкарь Д.Ю., Куприянов Ю.А., Гамидов С.И.. Кривобородов Г.Г., Спивак Л.Г., Аль-Шукри С.Х. и др. Оценка безопасности и А эффективности лекарственного препарата Везустен у пациентов с гиперактивным мочевым пузырем. Урология. 2022;3:42-51
ООО «ПептидПро», 115054, Москва, Космодамианская наб., д. 52, стр. 1В Телефон: +7[495]230-09-09,
’ PeptidPRO*
РЕКЛАМА.
ИНФОРМАЦИЯ ДЛЯ СПЕЦИАЛИСТОВ ЗДРАВООХРАНЕНИЯ. ПОДРОБНАЯ ИНФОРМАЦИЯ СОДЕРЖИТСЯ В ИНСТРУКЦИИ ЛО МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ ПРЕПАРАТА ВЕЗУСТЕН ОТ 26.06.2024


