Применение сандостатина в профилактике острого воспалительного ответа при операциях реваскуляризации миокарда в условиях искусственного кровообращения
Автор: Зыков Илья Сергеевич, Ломиворотов Владимир Владимирович, Князькова Любовь Георгиевна
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Aнестезиология, реаниматология и перфузиология
Статья в выпуске: 4 т.16, 2012 года.
Бесплатный доступ
Изучено влияние сандостатина на протеазно-ингибиторную систему организма при операциях реваскуляризации миокарда в условиях искусственного кровообращения. Сдвиг протеазно-ингибиторного баланса с преобладанием протеолиза может стать причиной послеоперационных осложнений. Установлено отсутствие влияния препарата на динамику изменений нейтрофильной эластазы, альфа-1-антитрипсина, альфа-2-макроглобулина, С-реактивного белка, церулоплазмина.
Протеазно-ингибиторный баланс, сандостатин, антипротеолиз, искусственное кровообращение
Короткий адрес: https://sciup.org/142140505
IDR: 142140505 | УДК: 616.127-005.4-089.166-78
Текст научной статьи Применение сандостатина в профилактике острого воспалительного ответа при операциях реваскуляризации миокарда в условиях искусственного кровообращения
Поступила в редакцию 24 октября 2012 г.
В.В. Ломиворо тов, Л.Г. Князькова , 2012
Изучено влияние сандостатина на протеазно-ингибиторную систему организма при операциях реваскуляризации миокарда в условиях искусственного кровообращения. Сдвиг протеазно-ингибиторного баланса с преобладанием протеолиза может стать причиной послеоперационных осложнений. Установлено отсутствие влияния препарата на динамику изменений нейтрофильной эластазы, альфа-1-антитрипсина, альфа-2-макроглобулина, С-реактивного белка, церулоплазмина. Ключевые слова: протеазно-ингибиторный баланс; сандостатин; антипротеолиз; искусственное кровообращение.
Показано, что операции на сердце с искусственным кровообращением (ИК) могут сопровождаться значительным повышением активности некоторых протеиназ и истощением активности их ингибиторов в операционном периоде [1], что может приводить к сдвигу протеазно-ингибиторного баланса плазмы крови в сторону протеолиза. Поскольку выраженное повышение активности протеолиза может стать причиной развития полиорганной и дыхательной недостаточности, а также тромбогеморрагического синдрома, предпринимаются различные меры по профилактике этих осложнений [2]. Поиск фармакологических средств, позволяющих ингибировать гиперпротеолиз и профилактировать развитие послеоперационных осложнений, остается актуальной проблемой анестезиологического обеспечения кардиохирургических вмешательств в условиях ИК.
Наше внимание привлекли экспериментальные работы и результаты клинической практики применения сандостатина в общей хирургии в качестве ингибитора протеолиза при лечении панкреатита. Влияние соматостатина и его аналога сандостатина на организм было показано на нескольких экспериментальных моделях панкреатита с противоречивыми [3], иногда отрицательными [4], а также положительными результатами [5]. Одновременно в клинической практике использование сандостатина приводит к положительным результатам при лечении больных панкреатитом [3]. Так, опыт применения различных дозировок сандостатина (100, 200 или 500 мг три раза ежедневно) показал его эффективность при лечении этого заболевания, а особенно при использовании дозировки препарата 200 мг [6].
Есть данные об антипротеазной активности синтетического аналога соматостатина и его ингибирующем влиянии на нейтрофильную эластазу in vitrо [7]. Установлено, что сандостатин подавляет синтез цитокинов в моноцитах периферической крови при воспалительных реакциях, что делает перспективным его применение при заболеваниях, сопровождающихся развитием системного воспалительного ответа [8]. Показана роль препарата в иммунных реакциях организма. Работ, связанных с применением сандостатина с целью профилактики системного воспалительного ответа в кардиохирургии, нами не обнаружено.
Исходя из анализа данных литературы, можно заключить, что изучение влияния сандостатина на системный воспалительный ответ организма по-прежнему остается актуальной проблемой, в том числе и в случаях кардиохирургических вмешательств с применением ИК. Цель исследования – оценить антипротеолитическую активность сандостатина при операциях реваскуляризации миокарда в условиях ИК.
МАТЕРИАЛ И МЕТОДЫ
За период с 2007 по 2011 г. были обследованы больные ишемической болезнью сердца (ИБС), в числе которых было 46 мужчин и 2 женщины. Средний возраст пациентов 57 лет. Все приглашенные для участия в исследовании лица были разделены на 2 группы: первая – пациенты, проходящие лечение с использованием препарата сан-достатина, и контрольная группа. Всем пациентам была выполнена операция шунтирования пораженных коронарных артерий в условиях нормотермического ИК и кристаллоидной фармакохолодовой кардиоплегии.
Для вводной анестезии использовали фентанил (4 мкг/кг) и дормикум (0,06 мкг/кг). После введения ардуана в дозе 0,1 мг/кг выполняли интубацию трахеи и переводили больного на искусственную вентиляцию легких (ИВЛ) в режиме умеренной гипервентиляции. Анестезия до и после перфузии поддерживалась подачей галогенсодержащего анестетика в дыхательный контур (севоран 1,5–2,0 об%). Во время перфузии вводили дор-микум (0,05–1,0 мг/(кг·ч). По классификации американской ассоциации анестезиологов (ASA), все пациенты имели третью степень анестезиологического риска.
Больным 1-й группы за 10 ч до операции вводили подкожно сандостатин в дозе 0,2 мг, затем после индукции 0,2 мг внутривенно в 50 мл физиологического раствора в течение 3–5 мин. В контрольной группе использовали плацебо-физиологический раствор, который вводили накануне операции подкожно в объеме 2,0 мл.
Обследованные пациенты имели хорошую сократительную функцию миокарда (фракция выброса не менее 50%, по данным УЗИ сердца), не имели эндокринной патологии и почечной дисфункции.
Группы были сопоставимы по клинической характеристике ИБС, объему и характеру хирургического вмешательства, длительности ИК, времени окклюзии аорты (табл. 1). В периферической крови на различных этапах исследования (перед операцией, через 30 и 120 мин после окончания ИК, в 1-е и 3-и сутки после кардиохирургического вмешательства) определяли уровень нейтрофильной эластазы, ее основного ингибитора – альфа-1-антитрипсина, а также альфа-2-макроглобулина, С-реактивного белка (СРБ), церулоплазмина. Оценивали состав периферической крови на этапах исследования: число лейкоцитов в крови, абсолютное и относительное содержание палочкоядерных нейтрофилов, незрелых форм нейтрофилов. Проводили оценку клинического течения послеоперационного периода.
Статистический анализ полученных результатов проведен с помощью программы Statistica 6,0. Для оценки характера распределения в совокупности по выборочным данным использовали тест Колмогорова – Смирнова. Сравнение групп из совокупностей с нормаль- ным распределением проводили с помощью t-критерия Стьюдента для двух зависимых или независимых выборок. Результаты представлены как средние и стандартные ошибки средних (М±m). Статистически значимыми считали различия данных при р<0,05.
РЕЗУЛЬТАТЫ
У больных ИБС перед операцией уровень нейтрофильной эластазы был несколько выше значений, зарегистрированных в группе здоровых лиц (норма <35 нг/мл). Межгрупповых статистически достоверных различий на всех этапах исследования не установлено (табл. 2). Содержание ингибиторов эластазы альфа-1-антитрипсина и альфа-2-мак-роглобулина на всех этапах исследования не имело статистически достоверных различий между группами (табл. 2).
Определение отношения уровня альфа-1-антитрип-сина в плазме к уровню эластазы было использовано для оценки протеазно-ингибиторного баланса. Его показатель не имел достоверных различий между группами на всех этапах исследования (рисунок).
Исходно уровень СРБ в контрольной группе и у пациентов первой группы достоверно не отличался и был в пределах нормальных значений (норма 0,1–0,6 мг/дл). На всех этапах исследования не было обнаружено статистически достоверных различий между уровнем СРБ у пациентов обследованных групп (табл. 2).
Исходное содержание церулоплазмина в обеих группах соответствовало физиологической норме здорового человека (норма 0,19–0,41 г/л), и не отмечалось статистически достоверных различий между группами как исходно, так и на других этапах исследования (табл. 2).
Исходный уровень лейкоцитов у больных всех обследованных групп был в пределах возрастной нормы (норма 4,5–8,0 × 109). Достоверных отличий исходно между группами по общему содержанию лейкоцитов не отмечено. Количество нейтрофилов также было в пределах нормальных значений (норма 1,8–6,5 × 109; 45–70%), и статистически достоверных различий между группами не установлено. Динамика содержания нейтрофилов на всех этапах операции и в ранние сроки после операции имела однонаправленный характер, и достоверных различий между группами не выявлено.
Исходный уровень билирубина в группах не имел статистически достоверных различий и был в пределах нормальных физиологических значений. Содержание креатинина и мочевины исходно во всех группах было в пределах нормы и на всех этапах исследования также не имело достоверных отличий (табл. 3).
При анализе течения послеоперационного периода не было обнаружено межгрупповых различий в объеме отделяемого по дренажам в первые и вторые сутки после
ОБСУЖДЕНИЕ
В ходе проведенного исследования получены данные, которые свидетельствуют о том, что у обследованных пациентов наблюдались признаки гиперпротеолиза, что выражалось в дисбалансе системы протеолиз-анти-
Влияние сандостатина на динамику протеазноингибиторного коэффициента.
Этапы исследования:
-
1 – перед операцией;
-
2 – перед ИК; 3 – 30 мин после ИК; 4 – 2 ч после ИК;
-
5 – 24 ч после ИК;
-
6 – 3-и сутки после ИК.
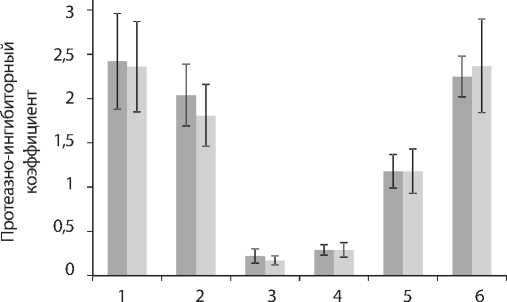
Этапы исследования ■ Сандостатин ■ Контроль
Таблица 3
Содержание в крови билирубина, креатинина, мочевины у обследованных пациентов
|
Группа |
Билирубин, мкмоль/л (норма 3,4–20,5) |
Креатинин, мкмоль/л (норма 44,0–87,0) |
Мочевина, мкмоль/л (норма 2,5–8,3) |
|
|
До операции 1-е сутки п/о |
До операции 1-е сутки п/о |
До операции |
1-е сутки п/о |
|
|
Сандостатин |
15,25±0,96 17,56±2,07 |
95,22±1,92 115,33±3,14 |
5,82±0,27 |
6,91±0,25 |
|
Контроль |
14,79±1,28 13,12±1,58 |
93,05±2,84 105,70±4,82 |
6,75±0,31 |
6,79±0,32 |
Таблица 4
Характеристика послеоперационного периода обследованных пациентов
Полученные результаты указывают на отсутствие влияния сандостатина в терапевтической дозе на уровень нейтрофильной эластазы, альфа-1-антитрипсина, альфа-2-макроглобулина, СРБ, церулоплазмина. Поэтому нецелесообразно применение сандостатина в дозе 0,4 мг с целью антипротеолиза при операциях с ИК.
Единого мнения об эффективности сандостатина и его аналогов при лечении панкреатита также не сформировано. Существует представление о сандостатине как о непосредственном ингибиторе протеолиза и как о пре- парате, который оказывает воздействие на другие звенья патогенеза системного воспаления. В частности, отмечается его влияние на уровень цитокинов, чем объясняются положительные эффекты сандостатина при остром панкреатите [11]. Именно это свойство препарата может предотвратить развитие отдаленных органных повреждений.
Экспериментальные работы показали, что после введения сандостатина наблюдается значимое снижение повышенного уровня воспалительно-ассоциированных цитокинов ИЛ-10 и TGF-beta-1 без изменений вследствие воспаления секреции ферментов поджелудочной железы [12]. Положительное действие сандостатина может быть обусловлено и влиянием его на ИЛ-6 [13], при этом анти-цитокиновые свойства сандостатина изучены недостаточно [14]. Некоторые авторы придерживаются мнения, что антисекреторный эффект сандостатина обусловлен снижением захвата ацинарными клетками поджелудочной железы аминокислот из плазмы [15]. Этот механизм обусловливает уменьшение синтеза панкре- атических ферментов, подавление активности ацинарных клеток и снижение в них аккумуляции ферментов.
Следует предположить, что перспективы дальнейшего изучения клинической роли сандостатина в кардиохирургии – это исследование влияния других доз препарата на развитие воспалительного ответа организма больных, а также дальнейшее выяснение механизмов формирования воспалительной реакции. Авторы не исключают также и ингибирующего влияния использованных в данном исследовании доз сандостатина на весь спектр протеаз и влияния препарата на другие звенья воспалительного ответа, включая цитокины при операциях с ИК.
ВЫВОДЫ
-
1. Применение сандостатина в терапевтических дозах во время операций реваскуляризации миокарда в условиях ИК не оказывает влияния на концентрацию нейтрофильной эластазы, на уровень естественных антипротеолитических ферментов альфа-1-антитрипсина, альфа-2-макроглобулина и на баланс в системе протеолиз-антипротеолиз.
-
2. Применение сандостатина в терапевтических дозах во время операций реваскуляризации миокарда в условиях ИК не оказывает влияния на концентрацию белков острой фазы воспаления.
Список литературы Применение сандостатина в профилактике острого воспалительного ответа при операциях реваскуляризации миокарда в условиях искусственного кровообращения
- Партигулов С.А., Баженова Г.Е., Оглоблина О.Г.//Анестезиология и реаниматология. 1989. № 5. С. 6-9.
- Яворовский А.Г., Трекова Н.А., Зюляева Т.П. и др.//Грудная и серд.-сосудистая хирургия. 2003. № 3. С. 53-57.
- Paran H. et al.//J. Am. Coll. Surg. 1995. V. 181. P. 121-124.
- Degertekin H., Ertan A. et al.//Peptides. 1985. V. 6. P. 1245-1247.
- Paran H. et al.//J. Surg. Res. 1996. V. 62, № 2. P. 201-206.
- Binder M., Uhl W., Friess H. et al.//Digestion. 1994. V. 55. P. 20-23.
- Adeyemi E.O., Savage A.P. et al.//Peptides. 1990. № 11. P. 69-71.
- Гурьянов В.А., Аляутдин Р.Н., Петров В.Е. и др.//Анестезиология и реаниматология. 2002. № 5. С. 68-70.
- Князькова Л.Г., Могутнова Т.А., Зыков И.С. и др.//Патология кровообращения и кардиохирургия. 2009. № 1. С. 43-47.
- Караськов А.М., Ломиворотов В.В.//Биохимическая адаптация организма после кардиохирургических вмешательств. Новосибирск, 2004.
- Uhl W., Buchler M.W. et al.//Gut. 1999. V. 45, №1. P. 97-104.
- Wu H., Chen X., Deng Y. et al.//Sichuan Da Xue Xue Bao Yi Xue Ban. 2003. V. 34, № 2. P. 315-316.
- Jambrik Z., Gyongyosi M., Hegyi P. et al.//Intensive Care Med. 2002. V. 28, № 12. P. 1810-1818.
- Брискин Б.С., Титова Г.П., Рыбаков Г.С. и др.//Анналы хирургической гепатологии. 2001. Т. 6, № 2. С.123-130.
- Гельфанд Б.Р., Бурневич С.З., Гройзик К.Л.//Вестник интенсивной терапии. 1998. № 3. С. 19-24.


