Применение смешанной реальности при лапароскопической резекции почки
Автор: Семенякин И.В., Гаджиев Н.К., Габдуллин А.Ф., Погосян Р.Р., Джалилов И.Б., Кузьмина И.Н., Моршнев А.В.
Журнал: Московский хирургический журнал @mossj
Рубрика: Урология
Статья в выпуске: 4 (78), 2021 года.
Бесплатный доступ
Ведение. Цель: изучить результаты применения смешанной реальности в ходе лапароскопической резекции почки.Материалы и методы. В проспективное исследование были включены 47 пациентов, которым была выполнена лапароскопическая резекция почки с июня 2020 года по февраль 2021 года. Пациенты были разделены на две группы случайным образом: контрольная (24 пациента), в которой использовалась интраоперационная ультразвуковая навигация (УЗИ), и группа исследования (23 пациента), в которой операция выполнялась с использованием дополненной реальности: в смарт-очках была воссоздана индивидуальная объемная модель органа, пораженного опухолью. Модель была создана в программном обеспечении HLOIA©, разработанном нашей командой. По каждому пациенту были собраны анатомические, демографические данные, результаты инструментального обследования в предоперационном периоде, периоперационные данные. Оценка применения дополненной реальности производилась с использованием анкет по 5-ти балльной шкале Лайкерта, заполняемых хирургом после операции.Результаты. Сравнение данных выявило статистически значимые различия по следующим параметрам: время поиска и визуализации почечной ножки, время выявления локализации опухоли (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Опухоль почки, лапароскопическая резекция почки, смешанная реальность
Короткий адрес: https://sciup.org/142231913
IDR: 142231913 | УДК: 616.61-089.84 | DOI: 10.17238/2072-3180-2021-4-47-57
Текст научной статьи Применение смешанной реальности при лапароскопической резекции почки
Лапароскопическая резекция почки (ЛРП), благодаря своей малоинвазивности и высокой эффективности, стала стандартом лечения клинических опухолей почек на стадии T1 [1]. Достижения в области эндоскопических технологий, эволюция лапароскопических инструментов и оборудования позволили достичь признания лапароскопической техники резекции почки в качестве эффективной альтернативы открытым резекциям почек. Если онкологические исходы сопоставимы, то результаты оперативных пособий лапароскопическим доступом превосходят показатели открытых резекций по параметрам срока восстановления и длительности пребывания пациента в стационаре [2]. Однако лапароскопическая резекция технически сложнее и имеет более длительную кривую обучения [3, 4] с более высоким потенциалом осложнений [5]. Основным этапом в ЛРП является визуализация и диссекция почечной ножки [6] и интраоперационное определение локализации опухоли почки. В научной литературе отражена сложность данных этапов [7]. Выход на сосудистый компонент почки – кропотливая работа с высоким риском развития массивного кровотечения при повреждении сосуда с последующей конверсией доступа в открытый. Адекватная навигация и визуализация в операционном поле облегчает определение зоны резекции почки, сводя к минимуму количество положительных краев при оценке патоморфологического материала. Для облегчения вышеупомянутых этапов резекции почки мы разработали пакет программного обеспечения под названием HLOIA© (Healthy life: operations with innovative assistanсe). Программа позволяет создать и использовать 3D модель органа в рамках реализации смешанной реальности (MR) в ходе оперативного пособия с целью максимально персонифицированной навигации во время лапароскопической резекции почки.
Целью нашего исследования было: а) оценить результаты применения MR модели для определения почечной ножки и определения точного местоположения опухоли в ходе (ЛРП), и б) изучить субъективную оценку применения MR модели в качестве интраоперационного справочного инструмента оперирующими хирургами.
Материалы и методы
Дизайн исследования и участники.
В проспективное исследование были включены 47 пациентов, которым выполнили лапароскопическую резекцию почки с целью лечения опухоли почки в стадии T1, в период с июня 2020 года по февраль 2021 года. Пациенты были случайным образом распределены на две группы: контрольную группу (24 пациентов), которым оперативное пособие проводилось с использованием интраоперационного применения датчика эндо-УЗИ с целью навигации, и экспериментальную группу (23 пациентов), которым была проведена операция с использованием MR модели (модели смешанной реальности). Рандомизация проводилась с использованием запечатанных конвертов. Критерии включения: пациенты старше 18 лет с опухолью почки на стадии T1a (по TNM классификации). Все пациенты могли подписать информированное согласие и имели опухоли, поддающиеся ЛРП. Критериями исключения были: возраст пациента моложе 18 лет, нежелание пациента принимать участие в исследовании, несоответствие размеров опухоли стадии T1a по международной классификации опухолей почек. По каждому пациенту проспективно создана база данных, оценивающая возраст, индекс массы тела (ИМТ), клинический размер опухоли, сторону поражения, результаты оценки сложности резекции по нефрометрическим шкалам PADUA, ABC, RENAL. По результатам выполненной операции вносились в базу данных такие параметры как время обнаружения и диссекции почечной ножки, время разметки границ опухоли, время тепловой ишемии почки. Также производилась оценка послеоперационного функционального исхода, осложнений по классификации Clavien - Dindo.
Подготовка модели смешанной реальности.
Всем пациентам в рамках исследования выполнена предоперационная мультиспиральная компьютерная томография (МСКТ) с внутривенным болюсным контрастированием. Важно отметить, что все пациенты лежали в положении «на боку» с целью имитации операционной укладки и нивелирования миграции и смещения органов при повороте на бок во время оперативного пособия. Полученные изображения срезов толщиной 0,5 мм компьютерной томографии (КТ) в формате DICOM были обработаны с целью получения стереолитографических (stl) файлов. Для создания объемной (3D) модели органа изображения были сегментированы по сосудистой сети, с учетом артериального и венозного кровотока почки, по опухоли, по поверхности почки и по собирательной системе почки с использованием метода динамического роста области или метода водораздела. Созданная 3D-модель была экспортирована в виде файла STL – файла (от англ. Stereolithography) – в формате, широко применяемом для хранения трехмерных моделей. Для упрощения использования и исключения необходимости привлечения дополнительных сотрудников технических специальностей, таких как биоинженеры и графические дизайнеры, мы разработали программный пакет под названием HLOIA©. HLOIA© состоит из трех отдельных частей: веб-приложения, облачного сервера и пользовательского приложения для смарт-очков.
Подготовленные путем обработки данных МСКТ STL файлы были загружены хирургом в приложение HLOIA©.
Веб-приложение HLOIA© основано на 3D библиотеке для работы c объектами и расположена по адресу http:// hloia.org. В разделе «редактор» в веб-приложении были скорректированы настройки цвета и прозрачности моделей MR (рис. 1).
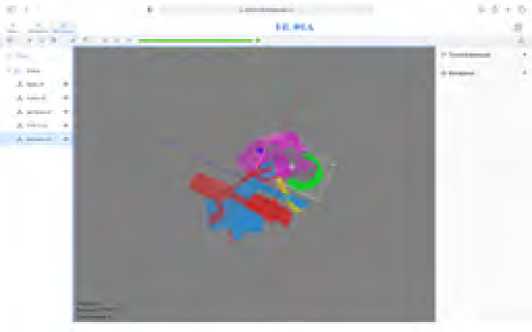
Рис. 1. Интерфейс 3D-редактора веб-приложения HLOIA
Fig. 1. HLOIA’s web application 3D editor desktop
Последние сохранены на облачном сервере HLOIA©. Для адекватной работы с приложением необходимо иметь высокоскоростное подключение к интернету и смарт-очки Hololens (Microsoft, Сиэтл, Вашингтон, США).
Следующим этапом хирург должен со своих смарт-очков получить доступ к веб-сайту HLOIA©, чтобы установить приложение на очки.
После авторизации в приложении загружается ранее сохраненная на облачном сервере объемная модель органа. После чего она становится доступной для автономного использования. Полученная модель MR может быть привязана к любой точке окружающего пространства, и пользователь может просматривать модель с любой позиции (рис. 2).
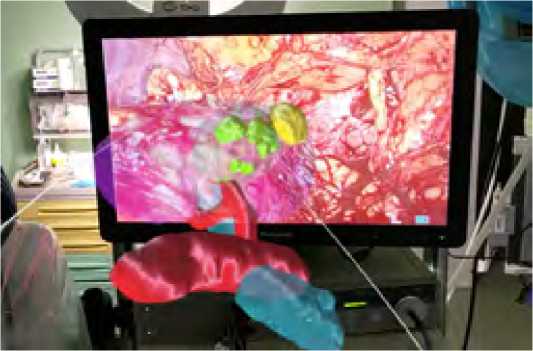
Рис. 2. Прозрачная 3D-модель в среде смешанной реальности, закрепленная перед хирургом и сопоставленная с видеоэндоскопическим изображением в реальном времени во время ЛРП
Fig. 2. Transparent 3D Mixed Reality model anchored in front of the surgeon and matched to the real-time videoendoscopic picture during LPN
Изменение размера и поворот модели MR возможны с помощью команд, опосредованных жестами рук.
Весь процесс создания МR модели от сегментации компьютерной томографии до загрузки ее в смарт-очки с облачного сервера занимает в среднем около 20 минут и выполняется исключительно действующим урологом без предыдущего опыта работы в области биоинженерии или графического дизайна.
Всем пациентам была выполнена лапароскопическая резекция почки через трансабдоминальный доступ. Пациенты находились в положении «на боку», согласно стандартной укладке при выполнении оперативных вмешательств на почках. Операции были выполнены одним хирургом с опытом проведения более 300 лапароскопических операций. В контрольной группе первым этапом производилось выделение почечной ножки. Затем была вскрыта фасция Герота, чтобы визуализировать почку и опухоль. Жир над опухолью, по возможности, сохранялся. После обнаружения опухоли, на усмотрение хирурга, принималось решение о необходимости наложения сосудистых зажимов на почечную ножку. Методом резекции, энуклеации, энуклеорезекции производилось удаление опухоли. После удаления ложе опухоли было герметично ушито с помощью непрерывного шва монофиламентной нитью 3-0.
В экспериментальной группе первым этапом проводилось выделение нижнего полюса почки и/или почечной вены. Затем участок почечной вены и/или нижний полюс почки в модели смешанной реальности был вручную сопоставлен с интраоперационной картиной. Это сопоставление МR модели и органа пациента указало точное расположение всех элементов почечной ножки и расположение опухоли. Расположение опухоли в каждом случае проверялось с помощью эндоскопического ультразвукового датчика. После определения местоположения опухоли почки МR модель была удалена с видеоэндоскопической картины и использовалась в качестве справочного инструмента во время остальных этапов операции.
После каждой лапароскопической резекции почки в экспериментальной группе хирург заполнял 5-балльную анкету по шкале Лайкерта для субъективной оценки полезности МR модели во время операции. Анкета включала три пункта, оцененные по 5-ти балльной шкале Лайкерта: 1 = категорически не согласен, 2 = не согласен, 3 = не ясно, 4 = согласен и 5 = полностью согласен. Ниже представлены утверждения:
-
1. “3D-голографическая модель почки была полезна для экспозиции почечной ножки”.
-
2. “3D-голографическая модель почки была полезна для определения местоположения опухоли почки”.
-
3. “3D-голографическая модель почки была полезна в качестве справочного материала в процессе оперативного вмешательства”.
Статистическая обработка данных.
Характеристики пациентов были проверены с использованием критерия хи-квадрат для категориальных переменных и t-критерия Стьюдента или критерия Манна-Уитни для непрерывных переменных. Все результаты для непрерывных переменных выражены в виде среднего (SD) или медианы (IQR), а частоты и пропорции представлены в процентах. Были оценены интраоперационные и послеоперационные переменные, а различия в количественных и категориальных переменных были проверены с использованием непараметрических критериев Манна-Уитни и хи-квадрат соответственно. Количественные переменные были проиллюстрированы прямоугольными диаграммами и гистограммами частот с плотностями. Категориальные переменные и переменные диапазона представлены в виде гистограмм. Результаты опроса были проиллюстрированы с помощью радиолокационной диаграммы. Для каждого сравнения были показаны точные значения p, и результаты считались статистически значимыми при p ≤ 0,05. Сбор данных осуществлялся с использованием MS Excel 2016, а статистическая обработка осуществлялась с использованием программного пакета Jamovi v.1.8.1.
Результаты
Согласно результатам анализа, предоперационные значения (табл.1), такие как ИМТ, количество гемоглобина в крови, уровень креатинина, скорость клубочковой фильтрации (СКФ) и характеристики опухоли, такие как местоположение, размер и оценка сложности, были статистически незначимыми (р > 0,04).
Сравнение интра- и послеоперационных переменных между группами выявило статистически значимые различия по следующим параметрам: время выделения почечной ножки и время от выделения сосудов до определения местоположения опухоли (р< 0,001) в пользу экспериментальной группы (рис. 3).
Таблица 1
Описательный анализ предоперационных показателей. (СО – стандартное отклонение), МР (IQR - межквартильный размах)
Descriptive analysis of preoperative features
Table 1
|
Контрольная группа Control group |
Группа исследования Experimental group |
p - показатель (значимость) p value |
|||
|
Количество пациентов Number of patients |
24 |
23 |
– |
||
|
Пол, число (%) Gender, (%) |
Мужчины males |
10 (41.7) |
10 (43.5) |
0,90 |
|
|
Женщины females |
14 (58,3) |
13 (56,5) |
|||
|
Возраст (лет), средний возраст (СО) Age (years), mean (SD) |
58,7 (11,4) |
58 (10,4) |
0,83 |
||
|
ИМТ (кг/м2), средний (СО) BMI (kg/m2), mean (SD) |
28,1 (5.51) |
28,3 (3,65) |
0,83 |
||
|
HB предоперационный (г/л), средний (СО) HB preoperative (g/l), mean (SD) |
137 (10,3) |
134 (10,7) |
0,26 |
||
|
СКФ предоперационный (мл/мин), средний (МР) GFR preoperative (ml/min), median (IQR) |
100 (56,6) |
102 (35,9) |
0,62 |
||
|
Креатинин до операции мкмоль/л, средний (МР) Creatinine preoperative mcmol/l, median (IQR) |
68,5 (13) |
76 (27,1) |
0,05 |
||
|
Поверхность почки, количество (%) Kidney face, (%) |
передняя anterior |
14 (58,3) |
16 (69,6) |
0,42 |
|
|
задняя posterior |
10 (41,7) |
7(30,4) |
|||
|
Край почки, количество (%) Kidney rim, (%) |
латеральный lateral |
11 (45,8) |
11 (47,8) |
0,89 |
|
|
медиальный medial |
13 (54,2) |
12 (52,2) |
|||
|
Полюс почки, количество (%) Kidney pole, (%) |
Верхний полюс superior pole |
4 (16,7) |
9 (39,1) |
0,09 |
|
|
Средний сегмет mesorenal location |
12 (50) |
5 (21,7) |
|||
|
Нижний полюс inferior pole |
8 (33) |
9 (39,1) |
|||
|
Сторона, количество (%) Side, (%) |
левая left |
14 (58,3) |
12 (52,2) |
0,67 |
|
|
правая right |
10 (41,7) |
11 (47,8) |
|||
|
Размер опухоли (мм), средний (МР) Tumor size(mm), median (IQR) |
27 (18,5) |
33 (6) |
0,21 |
||
|
PADUA оценка, средняя (МР) PADUA score, median (IQR) |
8 (3,25) |
8 (2,5) |
0,89 |
||
Для указанных переменных также наблюдались большие эффекты: коэффициент Каппа Коэна d = 1,37 и 1,24 соответственно. Ультразвуковой контроль подтвердил наличие опухоли в 100 % случаев в экспериментальной группе. Оценка функционального результата на основе креатинина и расчетных значений рСКФ выявила незначительные различия между группами 101 ± 33,8 и 88 ± 35 (р = 0,34).
Частота послеоперационных осложнений не различалась между группами (р = 0,57). Для остальных переменных, включая патологические данные и частоту положительных хирургических краев, также не было обнаружено статистически значимых различий (табл. 2).
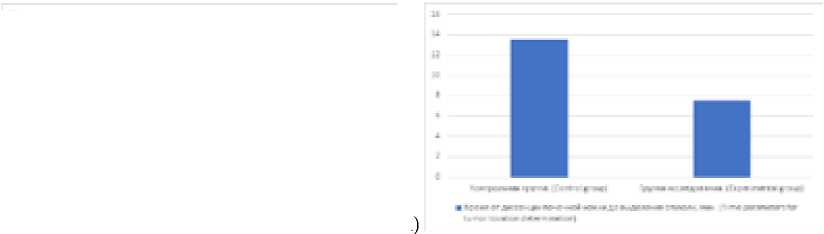
(б)
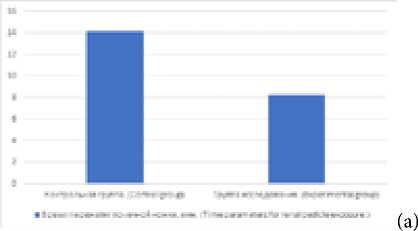
Рис. 3. Время пережатия почечной ножки (а) и определения местоположения опухоли (б)
Fig. 3. Time parameters for renal pedicle exposure (a) and for tumor location determination (b) (Control group, experimental group)
Таблица 2
Интра- и послеоперационные показатели
Intra- and postoperative variables
Table 2
|
Контрольная группа Control group |
Группа исследования Experimental group |
p - показатель (значимость) p value |
||
|
Hb после операции (г/л), средний (СО) Hb after surgery(g/l), mean (SD) |
120 (17,1) |
125 (14,6) |
0,28 |
|
|
Время операции (мин), среднее (СО) Operative time (min), mean (SD) |
106 (28,4) |
95 (24) |
0,15 |
|
|
Время пережатия почечной ножки (мин), среднее (СО) Time for renal pedicle exposure (min), mean (SD) |
14,08 (5,4) |
8,22 (2,76) |
< 0,001 |
|
|
Время от диссекции почечной ножки до выделения опухоли, мин, среднее (СО) Time from renal pedicle to tumor, min, mean (SD) |
13,54 (5,99) |
7,52 (3,36) |
< 0,001 |
|
|
Объем кровопотери (мл), средний (МР) Hemorhage volume(ml), median (IQR) |
150 (200) |
100 (150) |
0,11 |
|
|
Послеоперационный креатинин (мкмоль/л), средний (МР) Сreatinine postoperative (mcmol/l), median (IQR) |
101(33,8) |
88 (35) |
0,35 |
|
|
Пережатие почечной артерии, количество (%) RA clamping, (%) |
Нет No |
2 (8,3) |
6 (26,1) |
0,11 |
|
Да Yes |
22 (91,7) |
17 (73,9) |
||
|
Общее время ишемии (мин), среднее (СО) Global ischemia time (min), mean (SD) |
15,1 (7,73) |
17 (7,33) |
0,38 |
|
Продолжение таблицы 2
|
Конверсии для нефрэктомии, количество (%) Conversion to nephrectomy, (%) |
Нет No |
22 (91,7) |
23 (100) |
0,16 |
|
Да Yes |
2 (8,3) |
0 (0) |
||
|
Осложнения по Клавьен - Диндо < 3 категории, количество (%) Clavien-Dindo score <3, (%) |
Нет No |
22 (91,7) |
22 (95,7) |
0,57 |
|
Да Yes |
2 (8,3) |
1 (4,3) |
||
|
Осложнения по Клавьен - Диндо ≥ 3 категории, количество (%) Clavien-Dindo ≥ 3, (%) |
Нет No |
23 (95,8) |
23 (100) |
0,32 |
|
Да Yes |
1 (4,2) |
0 (0) |
||
|
Патоморфологическое заключение, количество (%) Histopathological findings, (%) |
ОП* RO* |
1 (4,2) |
2 (8,7) |
0,78 |
|
Папиллярный ПКР** PRCC** |
1(4.2) |
2(8.7) |
||
|
ПКР*** ccRCC*** |
20 (83,3) |
18 (78,3) |
||
|
другие оther |
2 (8,3) |
1 (4,3) |
||
|
Хирургический край, количество (%) Surgical margin, (%) |
Положительный Positive |
2 (8,3) |
0 (0) |
0,49 |
|
Отрицательный Negative |
22 (91,7) |
23 (100) |
||
|
СКФ после операции (мл/мин), среднее (МР) GFR postoperative(ml/min), median (IQR) |
65,6 (62,9) |
85,2 (48,4) |
0,47 |
|
|
Использование эндо УЗИ для навигации, количество (%) US tumor control, (%) |
- |
23 (100) |
- |
|
|
Примечание: *- онкоцитома почки; **- папиллярный почечно-клеточный рак; ***- п очечно-клеточный рак. Note: *- Renal Oncocytoma; **- Papillary Renal Cell Carcinoma; ***- clear cell Renal Cell Carcinoma |
||||
Средний балл первого утверждения в анкете “3D голографическая модель почки была полезна при работе на структурах почечной ножки” составил 4,78 ± 0,42. Средние баллы по второму и третьему утверждениям составили 4,13 ± 0,55 и 4,35 ± 0,49 соответственно.
Впечатление хирурга о полезности МR модели, оцененное с помощью предложенной анкеты, продемонстрировало высокие баллы во всех приведенных утверждениях (рис. 4).
Обсуждение
В последние десятилетия был достигнут большой прогресс в лапароскопической хирургии в урологии. Благодаря усовершенствованиям в оптике, электронике, системах эндоскопического видео мониторинга и хирургических инструментах лапароскопическая резекция почки стала эффективным хирургическим методом лечения опухолей почки небольших размеров. Это имеет дополнительное преимущество в сохранении нефронов, чтобы избежать почечной недостаточности [6]. Несмотря на технические и технологические усовершенствования, все еще существуют некоторые критические аспекты лапароскопической резекции почки, такие как выделение почечной ножки, определение местоположения опухоли и ее полное удаление. Предоперационная компьютерная томография обычно дает представление о расположении сосудов в ножке почки и точном расположении опухоли. Однако запоминание каждой детали анатомии, полученной с помощью предоперационной компьютерной томографии во время операции, представляет собой значительную когнитивную проблему. Дополнительный экран с предоперационными КТ-изображениями в операционной может быть решением, хотя и отвлекающим [8]. Для выявления опухолей почек могут использоваться различные методы визуализации, такие как ультразвуковое исследование, флуоресцентная визуализация, оптическая когерентная томография и магнитно-резонансная томография ex vivo, но ни один из них не является универсальным [9]. Была изучена трехмерная (3D) печатная модель органа, которая оказалась надежным инструментом для предоперационного планирования перед резекцией почки и интраоперационной навигацией, поскольку она может выявить реальный размер, глубину и расположение опухоли почки, так и артериовенозных систем и, таким образом, может предотвратить повреждение окружающих структур [10]. Вместо использования печатных 3D-анатомических моделей, которые являются дорогостоящими и трудоемкими, на помощь пришла иммерсивная технология (ИТ), стирающая границу между физическим и виртуальным мирами. Для ясности определение ИТ включает дополненную реальность (AR), виртуальную реальность (VR) и смешанную реальность (MR) (рис. 5) [11].
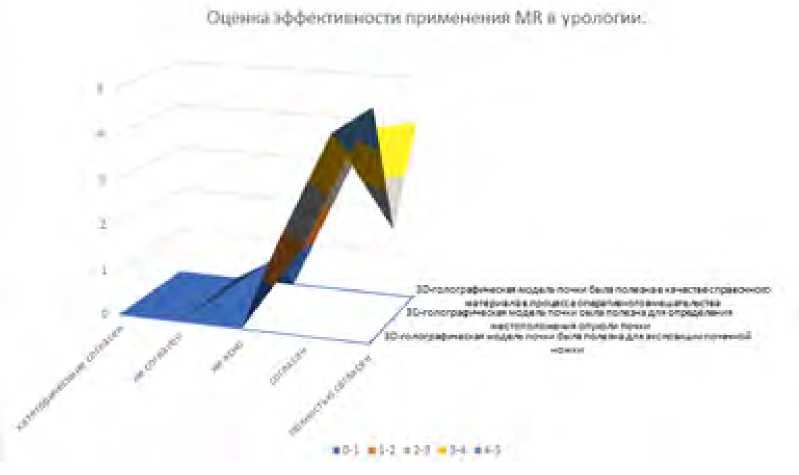
Рис. 4. Диаграмма, отражающая распределение ответов по опроснику
Fig. 4. Diagram showing surgeons’ answers to questions
The statements:
The 3D holographic kidney model was useful for renal pedicle exposure
The 3D holographic kidney model was useful for locating renal tumor
The 3D holographic kidney model was useful as a reference tool during LPN
Answers: 1 = strongly disagree, 2 = disagree, 3 = not clear, 4 = agree, and 5 = strongly agree

Рис. 5. Разница между 3 основными вариантами иммерсивной технологии: VR – это искусственный мир; AR – объект дополненной реальности, видимый на экране; MR – это 3D-объект, видимый как голограмма, которая полностью управляется
Fig. 5. Difference between 3 main domains of Immersive Technology: VR is an artificial world; AR is an object of augmented reality seen on the screen; MR is a 3D object seen as a hologram which is totally controllable
Хотя использование AR во время резекции почки было тщательно изучено и обеспечивает клиническую пользу, для нее требуется дополнительный персонал, такой как инженеры-программисты, для настройки и использования программного обеспечения, дополнительного оборудования, такого как система отслеживания, анализатор видео и мощные компьютеры [12–14]. MR – это новая технология, которая накладывает виртуальные объекты на физическое окружение. Ими можно манипулировать и без потери привязки к физической среде. Она используется со смарт-очками в качестве нового инструмента для визуализации данных предоперационных медицинских изображений, что облегчает анатомическое понимание пациента. Первые результаты применения MR были представлены в России в 2019 году и положили начало для дальнейшего изучения [15]. Чтобы сделать процесс разработки модели MR более простым и менее требовательным, мы создали специальное программное обеспечение под названием HLOIA©. С ее помощью у оперирующего хирурга появилась возможность подготовить MR модель за 20 минут. Наше исследование выявило статистически значимые различия во времени выделения почечной ножки и времени от выделения последней до определения местоположения опухоли (р< 0,001) в пользу экспериментальной группы с большим размером эффектов: d Коэна = 1,37 и 1,24 соответственно. Ультразвуковой контроль подтвердил наличие опухоли в 100 % случаев в экспериментальной группе, что свидетельствует о точности выявления опухоли почки с использованием наложенной МR модели. В процессе оценки пользы применения MR модели хирургами во время лапароскопической резекции почки были получены высокие баллы по всем утверждениям в предложенной анкете. Насколько нам известно, это первое исследование по интраоперационному использованию технологии смешанной реальности для лапароскопической резекции почки.
Наше исследование имеет некоторые ограничения. Во-первых, мы полагаемся на точную сегментацию предоперационного КТ-изображения почки и МР-модель, соответствующую эндоскопической картине в операционной в реальном времени. Это делается вручную и может привести к человеческим ошибкам. Решением может быть использование программного обеспечения для автоматической сегментации для получения более точных изображений сегментации и интраоперационной автоматической калибровки МR модели. Во-вторых, размер выборки нашего исследования был ограничен из-за новизны этой технологии. В-третьих, для использования программного обеспечения HLOIA© и модели MR нужны смарт-очки, которые относительно дороги в России.
Несмотря на вышеупомянутые ограничения, наши результаты демонстрируют экономию времени в процессе выделения сосудистой ножки почки и идентификации опухоли почки в пользу экспериментальной группы.
Выводы
Использование технологии смешанной реальности во время лапароскопической резекции почки с использованием программного обеспечения HLOIA© и смарт-очков показало улучшение с точки зрения времени выделения почечной ножки и времени идентификации опухоли почки без ущерба для безопасности и эффективности.
Список литературы Применение смешанной реальности при лапароскопической резекции почки
- Campbell S., Uzzo R.G., Allaf M.E. et al. Renal Mass and Localized Renal Cancer: AUA Guideline. J. Urol., 2017, № 198, рр. 520–529. https://doi.org/10.1016/j.juro.2017.04.100
- You C., Du Y., Wang H. et al: Laparoscopic Versus Open Partial Nephrectomy: A Systemic Review and Meta-Analysis of Surgical, Oncological, and Functional Outcomes. Front. Oncol., 2020, № 10, рр. 1–11.
- Orvieto M.A., Chien G.W., Tolhurst S.R. et al. Simplifying laparoscopic partial nephrectomy: Technical considerations for reproducible outcomes. Urology, 2005, № 66, рр. 976–980.
- Spana G., Haber G.P., Dulabon L.M. et al. Complications after robotic partial nephrectomy at centers of excellence: Multi-institutional analysis of 450 cases. J. Urol., 2011, № 186: 417–422. https://doi.org/10.1016/j.juro.2011.03.127
- Ramani A.P., Desai M.M., Steinberg A.P. et al. Complications of laparoscopic partial nephrectomy in 200 cases. J. Urol., 2005, № 173, рр. 42–47.
- Yang F., Zhou Q., Li X. et al. The methods and techniques of identifying renal pedicle vessels during retroperitoneal laparoscopic radical and partial nephrectomy. World J. Surg. Oncol., 2019, № 17, 1–8.
- Arora S. and Rogers C. Partial Nephrectomy in Central Renal Tumors. J. Endourol., 2018, № 32, рр.63–67.
- Lasser M.S., Doscher M., Keehn A. et al. Virtual surgical planning: A novel aid to robot-assisted laparoscopic partial nephrectomy. J. Endourol., 2012, № 26, рр. 1372–1379.
- Hekman M.C.H., Rijpkema M., Langenhuijsen J.F. et al. Intraoperative Imaging Techniques to Support Complete Tumor Resection in Partial Nephrectomy. Eur. Urol. Focus, 2018, № 4, рр. 960–968. https://doi.org/10.1016/j.euf.2017.04.008
- Komai Y., Sugimoto M., Gotohda N. et al. Patient-specific 3-dimensional Printed Kidney Designed for 4D Surgical Navigation: A Novel Aid to Facilitate Minimally Invasive Off-clamp Partial Nephrectomy in Complex Tumor Cases. Elsevier Inc., 2016, № 91, рр. 226–233. https://doi.org/10.1016/j.urology.2015.11.060
- Li K.C. and Wong B.T.M. A literature review of augmented reality, virtual reality, and mixed reality in language learning. Int. J. Mob. Learn. Organ., 2021, № 15,рр. 164–178.
- Fan G., Li J., Li M. et al. Three-Dimensional Physical Model-Assisted Planning and Navigation for Laparoscopic Partial Nephrectomy in Patients with Endophytic Renal Tumors. Sci. Rep., 2018, № 8, рр. 4–9. https://doi.org/10.1038/s41598-017-19056-5
- Bernhardt S., Nicolau S.A., Soler L. et al. The status of augmented reality in laparoscopic surgery as of 2016. Med. Image Anal., 2017, № 37, рр. 66–90. https://doi.org/10.1016/j.media.2017.01.007
- Porpiglia F., Checcucci E., Amparore D. et al. Three-dimensional Augmented Reality Robot-assisted Partial Nephrectomy in Case of Complex Tumours (PADUA ≥10): A New Intraoperative Tool Overcoming the Ultrasound Guidance. Eur. Urol., 2020, № 78, рр. 229–238. https://doi.org/10.1016/j.eururo.2019.11.024
- Гаджиев Н.К., Погосян Р.Р., Останин М.А., Петров С.Б., Семенякин И.В. Лапароскопическая резекция почки с использованием технологии дополненной реальности: новый вектор развития оперативной урологии? Урология, 2020. № 5. С. 37–40. https://doi.org/10.18565/urology.2020.5.37-40


