Применение смешанной реальности в онкоурологической практике (обзор литературы)
Автор: Измайлов А.А., Семенякин И.В., Гаджиев Н.К., Фомин В.С.
Журнал: Московский хирургический журнал @mossj
Рубрика: Литературные обзоры
Статья в выпуске: 4 (90), 2024 года.
Бесплатный доступ
За последние 5 лет ежегодно растет число научных публикаций, посвященных применению технологии смешанной реальности (СР) в хирургической практике. Одной из составляющих СР является технология виртуальной реальности (ВР), которая используется в медицинской практике в целях обучения с конца 20 века. СР пришла на смену виртуальной реальности (ВР) и расширила возможности применения технологии для хирургических вмешательств, в том числе с возможностью применения непосредственно во время операции. В онкоурологической практике СР активно применяется при резекциях почки, забрюшинных и спасительных лимфаденэктомиях. Нами представлен обзор литературы по возможностям и результатам применения технологии.
Виртуальная реальность, смешанная реальность, рак почки, резекция почки, рак предстательной железы, спасительная лимфаденэктомия, интраоперационная навигация, забрюшинная лимфаденэктомия
Короткий адрес: https://sciup.org/142243822
IDR: 142243822 | УДК: 616-089.8-035, | DOI: 10.17238/2072-3180-2024-4-263-270
Текст обзорной статьи Применение смешанной реальности в онкоурологической практике (обзор литературы)
Contribution of the authors: all authors made an equivalent contribution to the work.
Актуальность
За последние 5 лет ежегодно растет число научных публикаций, посвященных применению технологии смешанной реальности (СР) в хирургической практике.
СР – это технология, объединяющая виртуальную и дополненную реальности, которая обеспечивает получение виртуальных моделей и накладывание их на реальную среду, позволяя взаимодействовать с этими объектами (вращать, переставлять, разбирать и т.д.) [1]. В наше время система СР стала более портативной, реалистичной и удобной для применения в режиме реального времени [2]. Технология СР изучается и внедряется в медицинскую практику во многих направлениях, таких как ортопедия, нейрохирургия, гепатопанкреатобилиарная хирургия, урология, гинекология, реконструктивно-пластическая хирургия [3].
Одной из составляющих СР является технология виртуальной реальности (ВР), которая используется в медицинской практике в целях обучения с конца 20 века. Использование ВР при обучении хирургическим специальностям позволяет обучаемому выполнять этапы и определенные действия с виртуальным пациентом. В 1994 году Satava впервые описал использование ВР-симуляции для обучения анатомии и техническим навыкам хирургов [4]. С тех пор ВР постепенно внедрялась с образовательной целью [5]. В настоящее время ВР активно используется для обучения лапароскопической и роботической хирургии. Одна из целей создания лапароскопического ВР-симулятора заключается в том, чтобы улучшить мануальные навыки молодых хирургов и обучающихся. В 2002 году Gallagher A.G. и соавт. опубликовали работу по анализу кривой обучения на тренажерах ВР [6]. Они разделили хирургов на опытных, неопытных, начинающих и проанализировали операции каждой группы в тренажере ВР. При анализе первой попытки была существенная разница в показателях, измеряющих мануальные навыки. Однако все группы улучшили свои показатели при повторных попытках, причем наибольшие улучшения были достигнуты в группе новичков и в группе неопытных хирургов. Дальнейшие повторные тренировки позволили улучшить показатели до уровня опытных хирургов. Это исследование демонстрирует эффективность ВР для приобретения хирургами мануальных навыков и частичного прохождения кривой обучения.
Ряд рандомизированных контролируемых исследований показывают важную роль тренажеров ВР как безопасного, этичного и эффективного способа обучения базовым хирургическим навыкам [7, 8].
Дополнительные доказательства обучающего эффекта симуляторов ВР были продемонстрированы при анализе кривой обучения начинающих и опытных хирургов на тренажерах LapSim и LAP Mentor [9, 10]. Moritz и соавт. проанализировали результаты обучения хирургов на трех самых популярных тренажерах ВР: LaparoS (VirtaMed), LapSim (Surgical Science) и LapMentor III (Simbionix), где было показано значительное улучшение мануальных навыков уже за короткие промежутки времени. Все тренажеры продемонстрировали эффективность в обучении лапароскопическим мануальным навыкам [11].
СР пришла на смену ВР и расширила возможности применения технологии для хирургических вмешательств, в том числе с возможностью применения непосредственно во время операции. В онкоурологической практике СР активно применяется при резекциях почки, забрюшинных и спасительных лимфаденэктомиях.
Резекции почки
Почечно-клеточный рак (ПКР) является ведущей локализацией в общей структуре онкологической заболеваемости Российской Федерации и занимает 10 место (3,9 %) в 2022 г [12]. По данным ВОЗ в 2020 году во всем мире впервые выявлено 431288 новых случаев рака почки, а к 2040 году прогнозируется увеличение заболеваемости до 605726 случаев [13]. Большинство впервые выявленных случаев ПКР диагностируются на ранних стадиях, где основным методом лечения является хирургическое лечение в объеме резекции почки или нефрэктомии. Опубликовано множество работ, демонстрирующих лучшие онкологические и функциональные результаты у больных, которым выполнена резекция почки, в том числе при 3 стадии заболевания [14, 15].
Стандартным методом обследования пациентов с ПКР является мультиспиральная компьютерная томография (МСКТ) с внутривенным контрастированием, позволяющая получить информацию о точном расположении опухоли, количестве и расположении артериальных и венозных сосудов почки, а также данные о взаимоотношении опухоли с собирательной системой почки [16]. Информация МСКТ является определяющей для подготовки хирурга к оперативному вмешательству на дооперационном этапе, однако на сегодняшний день нет единой методики интраоперационной визуализации. Большинство опухолей почки расположено экстраренально и основным методом интраоперационной диагностики является зрительная детекция опухоли. Для интраренальных образований наиболее часто используемым методом является интраоперационное ультразвуковое исследование (ИОУЗИ). В работе Каприна и соавт. показано, что применение ИОУЗИ способствовало уменьшению частоты выполнения нефрэктомии (11,9 % – в группе сравнения и 8,7 % – в основной группе), снижению частоты интраоперационных осложнений, а также позволило подробно охарактеризовать анатомические особенности опухоли и ее васкуляризацию, осуществить прогноз по шкале RENAL [17]. Различные дополнительные методы визуализации, такие как флуоресцентная визуализация, оптическая когерентная томография и магнитно-резонасная томография могут быть использованы для улучшения интраоперационной детекции опухоли, однако в реальной клинической практике они используются крайне редко [18, 19]. В 2014 году J. Silberstein и соавт. опубликовали работу по использованию 3D-печатных моделей почки для предоперационного планирования оперативного вмешательства, однако не были получены статистические преимущества в интраоперационных и функциональных результатах при использовании 3D-моделей [20]. В более поздних работах главным преимуществом 3D-моделей являлась более тщательная предоперационная подготовка, отказ от ИОУЗИ, а также возможность взять модель в операционную. Помимо этого, отмечены преимущества 3D-печатных моделей при общении с пациентами для более полного понимания больным планируемого объема хирургического вмешательства [21].
В исследовании, сравнивающем 3D модель ВР с ИОУЗИ при резекциях сложных опухолей (PADUA ≥10) было отмечено, что использование 3D-моделей позволяет более точно идентифицировать локализацию опухоли и интрапаренхиматозные структуры по сравнению с ИОУЗИ. Это привело к более низкой частоте тотальной ишемии, более высокой частоте выполнения энуклеации и более низкой частоте повреждения собирательной системы почки [22].
С развитием технологии СР необходимость печати 3D моделей становится сомнительной ввиду временных и денежных затрат. В Российской Федерации разработана система смешанной реальности HLOIA, позволяющая подготовить виртуальную 3D модель в течение менее 20 мин Программа HLOIA (Healthy life: operations with innovative assistanсe) позволяет создать и использовать 3D модель органа в смешанной реальности (СР) во время хирургического вмешательства. Созданная 3D модель экспортируется в виде STL – файла в веб-библиотеку HLOIA. Далее с помощью веб-редактора структуры 3D модели окрашиваются и формируется готовая модель (рис. 1).
Следующим этапом хирург со своих очков СР заходит в облачное хранилище HLOIA, выгружая раннее созданную 3D-модель, которая становится автономной. Модель может быть привязана к любой точке окружающего пространства, а масштабирование и перемещение возможны при помощи жестов (не касаясь очков, сохраняя стерильность). Далее 3D модель совмещается с интраоперационным изображением, помогая хирургу получить четкое представление о расположении всех отрисованных структур (рис. 2).
Одно из первых исследований, посвященное интраоперационному использованию СР при лапароскопической РП выявило статистически значимое преимущество во времени выхода на почечные сосуды и времени до диагностики опухоли
(р<0,001). В исследовании для контроля выполнялось ИОУЗИ, которое подтвердило наличие опухоли в 100 % случаев в экспериментальной группе, что свидетельствует о точности выявления опухоли почки с использованием СР [23].
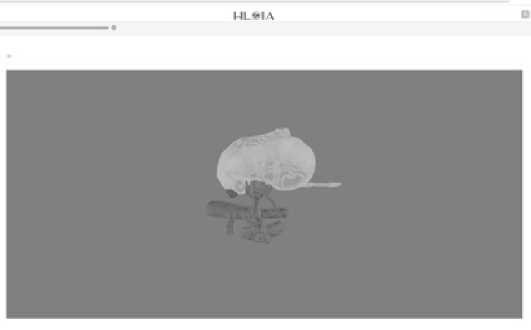
Рис. 1. 3D модель в веб-интерфейсе HLOIA
Fig. 1. 3D model in the HLOIA web interface
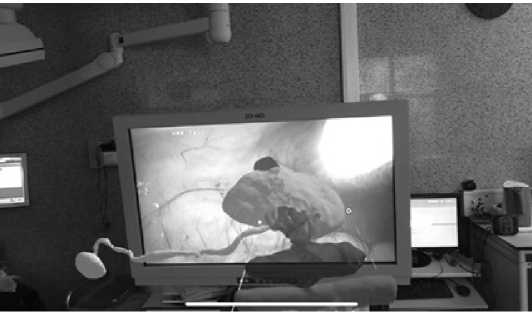
Рис. 2. Интраоперационное фото с очков смешанной реальности Fig. 2. Intraoperative photo from mixed reality glasses
В проспективном исследовании проф. Н.К. Гаджиева по использованию СР при резекциях почки продемонстрировано статистически значимое уменьшение времени до выхода на почечную ножку и выхода на опухоль почки при отсутствии достоверных различий в показателях эффективности и безопасности [24].
Лимфаденэктомия
В онкоурологической практике лимфаденэктомии рутинно выполняются только у больных раком предстательной железы (РПЖ) и мышечно-инвазивным раком мочевого пузыря (МИРМП), причем при МИРМП тазовая лимфаденэктомия входит в стандарт хирургического лечения в объеме радикальной цистпростатвезикулэктомии. При РПЖ тазо- вая лимфаденэктомия выполняется в расширенном варианте (рТЛАЭ). Согласно рекомендациям Ассоциации онкологов России (АОР) рТЛАЭ рекомендована пациентам, у которых риск лимфогенного метастазирования превышает 5 %. Риск метастатического поражения лимфатических узлов (ЛУ) также может быть рассчитан с помощью номограмм (например, номограммы Briganti), которые учитывают предоперационный уровень ПСА, степень дифференцировки опухоли по шкале Gleason, стадию заболевания и количество положительных и отрицательных биоптатов [25].
Выполнение тазовой лимфаденэктомии при первичном лечении больных РМП и РПЖ не сопровождаются высокой частотой интраоперационных осложнений ввиду стандартизации техники и этапов выполнения [26].
Более сложными вариантами лимфаденэктомий в онкоу-рологической практике являются сальважные (спасительные) лимфаденэктомии (СЛАЭ) при олигометастическом прогрессирование у больных РПЖ и забрюшинные лимфаденэктомии (ЗЛАЭ) у больных раком яичка.
СЛАЭ является одним из вариантов локального метастаз-направленного лечения у больных РПЖ при олигометасти-ческом прогрессировании. Сегодня стандартом диагностики при прогрессировании является позитронно-эмиссионная томография, совмещенная с компьютерной томографией (ПЭТ/ КТ) с 18F-ПСМА или 68Ga-ПСМА. Оба трейсера показали сопоставимые результаты с положительными прогностическими значениями в диапазоне от 84 % до 92 % при ПСА ≥ 1 нг/мл [27, 28].
В систематическом обзоре, включающем 26 исследований, где СЛАЭ была выполнена у больных с метастатическим поражением лифоузлов, выявленным при ПЭТ/КТ с ПСМА, у 44,3 % зарегистрирован полный ПСА-ответ (снижение уровня ПСА до нулевых значений) при медиане наблюдения 29,4 месяца, 2-летняя ВБП составила от 23 % до 64 %, 5-летняя общая выживаемость (ОВ) – 84 % [29]. Однако, СЛАЭ это повторное вмешательство, которое производится в том числе в зоне раннее выполненной рТЛАЭ и характеризуется высокой частотой интраоперационных осложнений. Так, в метаанализе Fossati, включающим 654 пациента, интраоперационные осложнения встретились у 28 (4 %) больных и включали повреждение мочеточника (n=11), повреждение магистральных сосудов (n=12), повреждение запирательных нервов (n=3) и другие осложнения (n=2) [30]. Другой проблемой СЛАЭ является интраоперационная диагностика ЛУ. На сегодняшний день нет cтандартных методик обнаружения метастатических ЛУ во время проведения хирургического вмешательства. Хирург изучает DICOM изображения ПЭТ/КТ и, ориентируюсь на область поражения, визуально детектирует пораженные ЛУ. Так, в работе Широкорада В.И. и соавт. у 37,5 % пациентов не было выявлено поражения удаленных ЛУ по данным планового патоморфологического исследования, что может быть связано с трудностью интраоперационной визуализации метастических ЛУ [31].
Одним из методов, который демонстрирует многообещающие результаты, является флуоресцентная интраоперационная диагностика. В нескольких исследования, включающих системное введение цетуксимаба-IRDye800 или панитумумаба-IRDye800, была обнаружена значительная разница в интенсивности флуоресценции (ИФ) между метастическими и непораженными ЛУ. Флуоресценция предсказывала наличие метастатических узлов со 100 % чувствительностью, 85,8 % специфичностью и 100 % отрицательной прогностической ценностью [32, 33, 34]. Однако этот метод исследован только для опухолей головы и шеи. Одной из важных особенностей ЛУ является четкая привязка к артериальным и венозным сосудам, что делает возможным применение СР для улучшения интраоперационной диагностики. Хирургу достаточно визуализировать основные артериальные и венозные сосуды предполагаемой зоны поражения, совместить 3D-модель (рис. 3) с операционным изображением и детектировать пораженный ЛУ с большей точностью.
Возможность построения 3D-модели также является важной составляющей предоперационного планирования.

Рис. 3. 3D модель пораженного ЛУ (в HLOIA) Fig. 3. 3D model of the affected LU (in HLOIA)
Другим сложным вариантом лимфаденэктомии является ЗЛАЭ у больных раком яичка. У пациентов с несеминомными опухолями после окончания химиотерапии первой линии рекомендуется удалить остаточные образования размером ≥1 см с целью снижения риска рецидива и прогрессирования [35, 36]. Наиболее часто остаточные образования находятся в области крупных магистральных сосудов забрюшинного пространства. Поэтому крайне важно тщательное планирование хирургического вмешательства. В клинических рекомендациях АОР сказано, что при размере забрюшинных остаточных опухолевых узлов <5 см предпочтительно использовать модифицированные односторонние трафареты для ЗЛАЭ. Однако в рутинной клинической практики трафареты не используются, и многие хирурги не знают о возможности их применения.
Аналогично с СЛАЭ, использование 3D моделей ВР позволяет тщательно спланировать оперативное вмешательство на предо- перационном этапе, а при выполнении ЗЛАЭ использовать СР для определения локализации остаточных образований путем совмещения 3D модели с магистральными сосудами забрюшинного пространства.
Заключение
Таким образом, технология СР является перспективным направлением развития медицинских технологий в области хирургии.
При органосохранном лечении почечно-клеточного рака СР позволяет улучшить интраоперационную визуализацию опухоли, уменьшить время до выхода на почечную ножку, обеспечить более тщательное планирование оперативного вмешательства.
При выполнении СЛАЭ и ЗЛАЭ 3D модели позволяют тщательно спланировать оперативное вмешательство, а совмещение 3D модели с операционным полем при помощи СР позволяет облегчить хирургу интраоперационную диагностику.
Список литературы Применение смешанной реальности в онкоурологической практике (обзор литературы)
- Azuma R.T. A Survey of Augmented Reality. Presence: Teleoperators & Virtual Environments, 1997, Aug; № 6(4), рр. 355-385. https://doi.org/10.1162/pres.1997.6.4.355
- Slater M., Sanchez-Vives M.V. Enhancing Our Lives with Immersive Virtual Reality. Front. Robot. AI., 2016, Dec 19; № 3, рр. 74. https://doi.org/10.3389/frobt.2016.00074
- Asadi Z., Asadi M., Kazemipour N., Léger É., Kersten-Oertel M. A decade of progress: bringing mixed reality image-guided surgery systems in the operating room. Comput Assist Surg (Abingdon), 2024, Dec; № 29(1), рр. 2355897. https://doi.org/10.1080/24699322.2024.2355897
- Satava R.M. Emerging medical applications of virtual reality: a surgeon’s perspective. Artif Intell Med., 1994, Aug; № 6(4), рр. 281-288. https://doi.org/10.1016/0933-3657(94)90033-7. PMID: 7812423
- Figert P.L., Park A.E., Witzke D.B., Schwartz R.W. Transfer of training in acquiring laparoscopic skills. J Am Coll Surg., 2001, Nov; № 193(5), рр. 533-537. https://doi.org/10.1016/s1072-7515(01)01069-9
- Gallagher A.G., Satava R.M. Virtual reality as a metric for the assessment of laparoscopic psychomotor skills. Learning curves and reliability measures. Surg Endosc., 2002, № 16(12), рр. 1746e52.
- Ahlberg G., Enochsson L., Gallagher A.G., Hedman L., Hogman C., McClusky D.A.3rd, Ramel S., Smith C.D., Arvidsson D. Proficiency-based virtual reality training significantly reduces the error rate for residents during their first 10 laparoscopic cholecystectomies. Am J Surg., 2007, Jun; № 193(6), рр. 797-804. https://doi.org/10.1016/j.amjsurg.2006.06.050
- Mazzone E., Puliatti S., Amato M., Bunting B., Rocco B., Montorsi F., Mottrie A., Gallagher A.G. A Systematic Review and Meta-analysis on the Impact of Proficiency-based Progression Simulation Training on Performance Outcomes. Ann Surg., 2021, Aug 1; № 274(2), рр. 281-289. https://doi.org/10.1097/SLA.0000000000004650
- Andreatta P.B., Woodrum D.T., Birkmeyer J.D., Yellamanchilli R.K., Doherty G.M., Gauger P.G., Minter R.M. Laparoscopic skills are improved with LapMentor training: results of a randomized, double-blinded study. Ann Surg., 2006, Jun; № 243(6), рр. 854-860. https://doi.org/10.1097/01.sla.0000219641.79092.e5
- Sherman V., Feldman L.S., Stanbridge D., Kazmi R., Fried G.M. Assessing the learning curve for the acquisition of laparoscopic skills on a virtual reality simulator. Surg Endosc., 2005, May; № 19(5), рр. 678-682. https://doi.org/10.1007/s00464-004-8943-5
- Sparn M.B., Teixeira H., Chatziisaak D., Schmied B., Hahnloser D., Bischofberger S. Virtual reality simulation training in laparoscopic surgery - does it really matter, what simulator to use? Results of a crosssectional study. BMC Med Educ., 2024, May 28; № 24(1), рр. 589. https://doi.org/10.1186/s12909-024-05574-0
- Под ред. Каприна А.Д., Старинского В.В., Шахзадово А.О. Злокачественные новообразования в России в 2022 году (заболеваемость и смертность) М. : МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2023. 275 с.
- Sung H., Ferlay J., Siegel R.L. et al. Global cancer statistics 2020:gLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin., 2021, № 71(3), рр. 209-249.
- Van Poppel H., Da Pozzo L., Albrecht W., Matveev V., Bono A., Borkowski A., Marechal J.M., Klotz L., Skinner E., Keane T., Claessens I., Sylvester R. European Organization for Research and Treatment of Cancer (EORTC); National Cancer Institute of Canada Clinical Trials Group (NCIC CTG); Southwest Oncology Group (SWOG); Eastern Cooperative Oncology Group (ECOG). A prospective randomized EORTC intergroup phase 3 study comparing the complications of elective nephron-sparing surgery and radical nephrectomy for low-stage renal cell carcinoma. Eur Urol., 2007, Jun; № 51(6), рр. 1606-1615. https://doi.org/10.1016/j.eururo.2006.11.013
- Janssen M.W.W., Linxweiler J., Terwey S., Rugge S., Ohlmann C.H., Becker F., Thomas C., Neisius A., Thüroff J.W., Siemer S., Stöckle M., Roos F.C. Survival outcomes in patients with large (≥7cm) clear cell renal cell carcinomas treated with nephron-sparing surgery versus radical nephrectomy: Results of a multicenter cohort with long-term follow-up. PLoS One, 2018, May 3; № 13(5), рр. e0196427. https://doi.org/10.1371/journal.pone.0196427
- Клинические рекомендации МЗ РФ. Рак паренхимы почки. Режим доступа: https://old.oncology-association.ru/clinical-guidelinesupdate. Ссылка активна на 15.12.2022.
- Каприн А.Д., Костин А.А., Степанов С.О., Воробьев Н.В., Беспалов П.Д., Димитров В.О. Анализ возможностей применений интраоперационного ультразвукового исследования при хирургическом лечении опухолей почек. Research’n Practical Medicine Journal, 2019, № 6(1), рр. 50-59. https://doi.org/10.17709/2409-2231-2019-6-1-5
- Chopra S., Bove A.M., Gill I.S. Robotic Partial Nephrectomy: Advanced Techniques and Use of Intraoperative Imaging. In: Su, LM. (eds) Atlas of Robotic Urologic Surgery. Springer, Cham., 2017. https://doi.org/10.1007/978-3-319-45060-5_7
- Wunderlich H., Reichelt O., Schubert R., Zermann D.H., Schubert J. Preoperative simulation of partial nephrectomy with three-dimensional computed tomography. BJU Int., 2000, Nov; № 86(7), рр. 777-781. https://doi.org/10.1046/j.1464-410x.2000.00898.x
- Silberstein J.L., Maddox M.M., Dorsey P., Feibus A., Thomas R., Lee B.R. Physical models of renal malignancies using standard cross-sectional imaging and 3-dimensional printers: a pilot study. Urology, 2014, Aug; № 84(2), рр. 268-272. https://doi.org/10.1016/j.urology.2014.03.042
- Komai Y., Sugimoto M., Gotohda N., Matsubara N., Kobayashi T., Sakai Y., Shiga Y., Saito N. Patient-specific 3-dimensional Printed Kidney Designed for «4D» Surgical Navigation: A Novel Aid to Facilitate Minimally Invasive Off-clamp Partial Nephrectomy in Complex Tumor Cases. Urology, 2016, May; № 91, рр. 226-233. https://doi.org/10.1016/j.urology.2015.11.060
- Porpiglia F., Checcucci E., Amparore D., Piramide F., Volpi G., Granato S., Verri P., Manfredi M., Bellin A., Piazzolla P., Autorino R., Morra I., Fiori C., Mottrie A. Three-dimensional Augmented Reality Robot-assisted Partial Nephrectomy in Case of Complex Tumours (PADUA ≥10): A New Intraoperative Tool Overcoming the Ultrasound Guidance. Eur Urol., 2020, Aug; № 78(2), рр. 229-238. https://doi.org/10.1016/j.eururo.2019.11.024
- Семенякин И.В., Гаджиев Н.К., Габдуллин А.Ф., Погосян Р.Р., Джалилов И.Б., Кузьмина И.Н., Моршнев А.В. Применение смешанной реальности при лапароскопической резекции почки. Московский хирургический журнал, 2021. № 4. C. 47-57. https://doi.org/10.17238/2072-3180-2021-4-47-57
- Gadzhiev N, Semeniakin I, Morshnev A., Alcaraz A., Gauhar V., Okhunov Z. Role and Utility of Mixed Reality Technology in Laparoscopic Partial Nephrectomy: Outcomes of a Prospective RCT Using an Indigenously Developed Software. Adv Urol., 2022, May 16; № 2022, рр. 8992051. https://doi.org/10.1155/2022/8992051
- Gandaglia G., Ploussard G., Valerio M., Mattei A., Fiori C., Fossati N., Stabile A., Beauval J.B., Malavaud B., Roumiguié M., Robesti D., Dell’Oglio P., Moschini M., Zamboni S., Rakauskas A., De Cobelli F., Porpiglia F., Montorsi F., Briganti A. A Novel Nomogram to Identify Candidates for Extended Pelvic Lymph Node Dissection Among Patients with Clinically Localized Prostate Cancer Diagnosed with Magnetic Resonance Imaging-targeted and Systematic Biopsies. European Urology, Volume 75, Issue 3, 2019, рр. 506-514. https://doi.org/10.1016/j.eururo.2018.10.012
- Keegan K.A., Cookson M.S. Complications of pelvic lymph node dissection for prostate cancer. Curr Urol Rep., 2011, Jun; № 12(3), рр. 203- 208. https://doi.org/10.1007/s11934-011-0179-z
- Morris M.J., Rowe S.P., Gorin M.A., Saperstein L., Pouliot F., Josephson D., Wong J.Y.C., Pantel A.R., Cho S.Y., Gage K.L., Piert M., Iagaru A., Pollard J.H., Wong V., Jensen J., Lin T., Stambler N., Carroll P.R., Siegel B.A. CONDOR Study Group. Diagnostic Performance of 18F-DCFPyLPET/CT in Men with Biochemically Recurrent Prostate Cancer: Results from the CONDOR Phase III, Multicenter Study. Clin Cancer Res., 2021, Jul 1; № 27(13), рр. 3674-3682. https://doi.org/10.1158/1078-0432.CCR20-4573
- Fendler W.P., Calais J., Eiber M., Flavell R.R., Mishoe A., Feng F.Y., Nguyen H.G., Reiter R.E., Rettig M.B., Okamoto S., Emmett L., Zacho H.D., Ilhan H., Wetter A., Rischpler C., Schoder H., Burger I.A., Gartmann J., Smith R., Small E.J., Slavik R., Carroll P.R., Herrmann K., Czernin J., Hope T.A. Assessment of 68Ga-PSMA-11 PET Accuracy in Localizing Recurrent Prostate Cancer: A Prospective Single-Arm Clinical Trial. JAMA Oncol., 2019, Jun 1; № 5(6), рр. 856-863. https://doi.org/10.1001/jamaoncol.2019.0096
- Ploussard G., Gandaglia G., Borgmann H., de Visschere P., Heidegger I., Kretschmer A., Mathieu R., Surcel C., Tilki D., Tsaur I., Valerio M., van den Bergh R., Ost P., Briganti A. EAU-YAU Prostate Cancer Working Group. Salvage Lymph Node Dissection for Nodal Recurrent Prostate Cancer: A Systematic Review. Eur Urol., 2019, Oct; № 76(4), рр. 493-504. https://doi.org/10.1016/j.eururo.2018.10.041
- Fossati N., Suardi N., Gandaglia G., Bravi C.A., Soligo M., Karnes R.J., Shariat S., Battaglia A., Everaerts W., Joniau S., Van Poppel H., Rajarubendra N., Gill I.S., Larcher A., Mottrie A., Schmautz M., Heidenreich A., Kalz A., Osmonov D., Juenemann K.P., Herlemann A., Gratzke C., Stief C., Montorsi F., Briganti A. Identifying the Optimal Candidate for Salvage Lymph Node Dissection for Nodal Recurrence of Prostate Cancer: Results from a Large, Multi-institutional Analysis. Eur Urol., 2019, Jan; № 75(1), рр. 176-183. https://doi.org/10.1016/j.eururo.2018.09.009
- Широкорад В.И., Измайлов А.А., Лупашко Д.Г. Спасительная лимфаденэктомия при олигометастатическом лимфогенном прогрессировании рака предстательной железы: анализ литературы и собственный опыт. Онкоурология, 2024. № 20(1). С. 52-59. https://doi.org/10.17650/1726-9776-2024-20-1-52-59
- Krishnan G., Berg N.Svd., Nishio N., Juniper G., Pei J., Zhou Q., Lu G., Lee Y.J., Ramos K., Iagaru A.H., Baik F.M., Colevas A.D., Martin B.A., Rosenthal E.L. Metastatic and sentinel lymph node mapping using intravenously delivered Panitumumab-IRDye800CW. Theranostics, 2021, № 11(15), рр. 7188-7198. https://doi.org/10.7150/thno.55389
- Nishio N., van den Berg N.S., van Keulen S. et al. Optical molecular imaging can differentiate metastatic from benign lymph nodes in head and neck cancer. Nat Commun, 2019, № 10(1), рр. 5044.
- Vonk J., de Wit J.G., Voskuil F.J. et al. Epidermal Growth Factor Receptor-Targeted Fluorescence Molecular Imaging for Postoperative Lymph Node Assessment in Patients with Oral Cancer. J Nucl Med., 2022, № 63(5), рр. 672-678.


