Применение виртуальной реальности в лечении нарушений ходьбы у пациентов с болезнью Паркинсона
Автор: Наталевич С.П., Калинин В.А., Повереннова И.Е., Шпилева С.А., Кривощапова Н.С.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Нервные болезни
Статья в выпуске: 1 т.17, 2021 года.
Бесплатный доступ
Цель: оценить возможность коррекции нарушений ходьбы и постуральной неустойчивости у пациентов с болезнью Паркинсона при помощи метода виртуальной реальности (ВР). Материал и методы. 20 пациентов с болезнью Паркинсона проходили 10-дневный курс занятий на тренажере «симулятор ходьбы» с блоком ВР. Для оценки моторных нарушений применялись: шкала UPDRS и опросник Freezing of Gait Questionnaire (FoG-Q). Результаты. Занятия на тренажере с блоком ВР привели к уменьшению выраженности нарушений ходьбы на 6,0% в выключенном состоянии (с 55,13 до 51,81 балла по шкале UPDRS) и на 5,6% во включенном (с 43,69 до 41,25 балла) прежде всего за счет влияния на застывания и постуральную неустойчивость. Кроме того, отмечалось улучшение субъективной оценки собственного состояния у пациентов по опроснику FoG-Q (с 9,44 до 7,38 балла). В контрольной группе статистически значимой динамики не наблюдалось. Заключение. Методики, использующие виртуальную реальность, могут быть использованы в качестве дополнительного метода коррекции моторных нарушений у пациентов с болезнью Паркинсона.
Постуральная неустойчивость, нарушения ходьбы, виртуальная реальность, болезнь Паркинсона
Короткий адрес: https://sciup.org/149134995
IDR: 149134995 | УДК: 616.858–008.6‑07‑08
Текст научной статьи Применение виртуальной реальности в лечении нарушений ходьбы у пациентов с болезнью Паркинсона
ского), участвующих в управлении движениями, подержании мышечного тонуса и позы, что в конечном итоге приводит к развитию клинической картины БП, к основным симптомам которой относятся гипокинезия, мышечная ригидность, тремор покоя. В числе часто встречающихся двигательных нарушений выделяют также нарушения ходьбы и постуральную неустойчивость. Наряду с двигательной симптоматикой у пациентов развивается широкий спектр немоторных нарушений, среди которых преобладают интел-лектульно-мнестические, психические расстройства и вегетативная дисфункция [3].
Нарушения ходьбы развиваются уже на ранних стадиях болезни и проявляются уменьшением длины шага, нарушением содружественных движений рук (ахейрокинез), затруднением инициации движений и шарканьем [3, 4]. При прогрессировании заболевания появляется характерный феномен «семенящей походки», возникающий, с одной стороны, вследствие укорочения шага и компенсаторного увеличения частоты шаговых движений, а с другой — как реакция на смещение центра тяжести и постуральную неустойчивость [5]. Для поздних стадий также характерно наличие застываний, характеризующихся кратковременными эпизодами блокады осуществляемого произвольного движения, которые возникают, как правило, внезапно, чаще при изменении программы движений [3, 4, 6]. На развернутой стадии БП выраженные моторные нарушения, прежде всего застывания и постуральная неустойчивость, а также развивающиеся к этому периоду когнитивные нарушения обусловливают частые падения, приводящие к существенному снижению качества жизни, потере самоэффективности, уменьшению двигательной активности и травмам [3, 7].
Застывания, также имеющие название «моторная акинезия», встречаются преимущественно на поздних стадиях заболевания (40-50% случаев), однако могут возникать и на ранних стадиях (10-15%). Блокирование движений в основном затрагивает нижние конечности, реже вовлекаются верхние конечности, веки (апраксия открывания глаз), речевой аппарат (артикуляционные застывания). Различают абсолютные застывания, когда ноги пациента как бы «прирастают» к полу, и парциальные, когда для того, чтобы продолжить движение, человек вынужден совершать серию мелких шагов на месте (топтание). Продолжительность эпизодов варьируется от 1–2 до 30–40 секунд. Чаще всего моторный блок возникает в ситуациях, связанных со сменой двигательных программ: в начале ходьбы, при поворотах, проходе через узкий дверной проем, при приближении к цели; в более тяжелых случаях он появляется и во время ходьбы по прямой [8, 9].
Постуральная неустойчивость связана с нарушением активности аксиальной мускулатуры и характеризуется затруднением удержания равновесия при изменении положении тела. В отличие от других дегенеративных заболеваний с синдромом паркинсонизма, таких как мультисистемная атрофия и прогрессирующий надъядерный паралич, у пациентов с БП постуральная неустойчивость появляется позднее других моторных симптомов, что является важным диагностическим критерием. На возникновение и степень постуральной неустойчивости могут оказывать влияние такие факторы, как прочие симптомы паркинсонизма, ортостатическая гипотензия, возрастные сенсорные изменения, способность интегрировать визуальные, вестибулярные и проприоцептивные стимулы (кинестезия). Боязнь падений также может ухудшить контроль равновесия у пациентов с БП [10].
Нейрофизиологические механизмы, лежащие в основе нарушений ходьбы у пациентов с БП, еще не до конца изучены, однако на данный момент считается установленным, что в регуляции ходьбы ведущую роль играют две подсистемы: 1) стволовые структуры, такие как субталамическое ядро, педун-кулопонтинное ядро и клиновидное ядро, составляющие мезенцефальную локомоторную зону, в которой преобладает холинергическая, ГАМКергическая и глутаматергическая импульсация; 2) высший уровень: дофаминергическая медиаторная система, базальные ганглии, моторная и премоторная кора. Данные образования реципрокно связаны друг с другом, а также с нижележащими центрами генерации ходьбы в спинном мозге, обеспечивая процесс автоматизированной регуляции ходьбы [4]. Длительное время нарушения ходьбы рассматривали как явление, производное от гипокинетической составляющей болезни Паркинсона, выраженность которой прямо пропорциональна степени дегенерации дофаминергической медиаторной системы и снижению уровня дофамина. Однако в дальнейшем данная концепция была пересмотрена под влиянием того факта, что нарушения ходьбы, застывания и постуральная неустойчивость в гораздо меньшей степени поддаются медикаментозной коррекции с помощью препаратов леводопы по сравнению с прочими гипо- и гиперкинетическими проявлениями (тремор и другие гиперкинезы, ригидность, брадикинезия), при этом резистентность к подобной коррекции увеличивается по мере прогрессирования заболевания [3, 11]. Данные наблюдения подтверждаются нейровизуализа-ционными исследованиями с использованием ПЭТ с 18F-допа: выраженность постуральных нарушений и нарушений ходьбы у пациентов с БП не коррелирует с концентрацией дофамина в скорлупе, в отличие от брадикинезии и ригидности, выраженность которых обратно пропорциональна концентрации дофамина [12, 13]. Кроме того, по данным ПЭТ головного мозга у пациентов с застываниями гиперактивность мезенцефальной локомоторной области, связанная с походкой, коррелирует с клиническими параметрами (застываниями и длительностью заболевания), но не со степенью атрофии [14]. В ряде исследований отмечено снижение выраженности нарушений ходьбы и застываний при использовании транскраниальной магнитной стимуляции зоны моторной и премоторной коры и глубокой магнитной стимуляции мезенцефальной локомоторной зоны [15, 16]. Указанные наблюдения обусловили создание модифицированной теории патогенеза нарушений ходьбы при БП, согласно которой их механизм различен в зависимости от стадии заболевания: если на ранних стадиях нарушения ходьбы во многом вторичны и обусловлены гипокинезией и ригидностью, то на поздних стадиях они относятся к расстройствам высшего уровня, интегративным нарушениям двигательного контроля, связанным с поражением лобных долей и их связей с нижележащими структурами (базальные ганглии, субталамическое, педункулопонтинное и клиновидное ядра, голубое пятно) [14]. В этом случае они могут быть обозначены как первичные, вызванные нарушением процессов выбора и инициации моторных программ, а не их реализации.
В связи с ограниченной эффективностью медикаментозного подхода в последние годы активно разрабатываются немедикаментозные методы коррекции нарушений ходьбы при БП, которые можно разделить на две основные группы: стимуляция мозга, упоминавшаяся выше, и кинезиотерапия, основанная на активном или пассивном воздействии на двигательные стереотипы пациента. Одним из перспективных кинезиотерапевтических направлений является применение виртуальной реальности (ВР). При изучении БП выявлено, что в ВР сохраняются те же паттерны моторных нарушений, что и в реальной жизни. В частности, показатели «теста на постукивание» и характеристики ходьбы в ВР обнаружили четкое соответствие с таковыми в реальности [17]. Магнитно-резонансная томография головного мозга во время симулированной ходьбы в виртуальной реальности обнаруживает дисфункцию связи между корой и подкорковыми структурами во время эпизода застывания [18].
Цель: оценить коррекцию нарушений ходьбы и постуральной устойчивости с использованием виртуальной реальности у пациентов с болезнью Паркинсона.
Материал и методы. В исследовании принимали участие 40 пациентов с установленным диагнозом БП, разделенные на две группы по 20 человек. Первая группа пациентов кроме стандартной медикаментозной терапии БП выполняла занятия на тренажере виртуальной реальности. Возраст пациентов: от 54 лет до 71 года, средний возраст 61 год (SD=5, p>0,05), мужчины составили 55,0% (11 человек), женщины 45,0% (9 человек). Стадия по HY: II — 7 человек, III — 8, IV– 5 (p>0,05). Продолжительность заболевания: от 3 до 19 лет, в среднем 7,8 года (SD=4,77, p<0,05). Вторая группа, получавшая только стандартную терапию БП: возраст пациентов от 52 до 72 лет, средний возраст 62 года (SD=5,3, p>0,05), мужчины составили 50,0% (10 человек), женщины 50,0% (10 человек). Стадия по HY: II — 6 человек, III — 9, IV– 5 (p>0,05). Продолжительность заболевания варьировалась от 2 до 20 лет, в среднем 8,4 (SD=4,9, p<0,05). Разница между группами по возрасту, стадии и продолжительности заболевания статистически не значима (p>0,05).
Выраженность моторных нарушений оценивалась по шкале UPDRS (II, III, IV части, версия от 13.08.2019) как в «выключенном», так и во «включенном» состояниях. Шкала UPDRS позволяет оценивать как ежедневную активность пациентов по их мнению (субъективная оценка), так и объективное состояние пациента, а именно: способность совершать целенаправленные движения, тремор, устойчивость, позу. Кроме того, IV раздел шкалы позволяет выявить осложнения БП и терапии БП препаратами леводопы. Шкала UPDRS является наиболее чувствительным и значимым клиническим инструментом обследования больного паркинсонизмом и валидизирована для России. Субъективная оценка нарушений ходьбы и выраженности застываний проводилась с помощью Freezing of Gait Questionnaire (FoG-Q).
Пациенты в течение 10 дней занимались на тренажере, функционирующем по принципу «симулятора ходьбы» и состоящего из блока ВР и тактильной имитации передвижения, достигаемой за счет ритмичного попеременного давления на стопы. Данное имплицитное проприоцептивное подтверждение совершаемого шага осуществлялось с помощью воздействия многокамерных пневмоманжет, раздуваемых с частотой и интенсивностью, идентичной физиологическому шагу пациента весом 70–80 кг, идущего со скоростью 5 км/ч. В условиях ВР пациентам демонстрировалась ходьба по горизонтальной поверхности от первого лица с проприоцептивным подтверждением совершаемого шага. Программа содержит несколько сюжетов: город, стадион, спортзал, парк, где в процессе занятия пациенты «проходят» несколько кругов по заданному маршруту. После окончания курса повторно производилась оценка степени моторных нарушений. Полученные результаты сопоставлялись с аналогичными показателями группы сравнения, не выполнявшей занятий на ВР-тренажере.
Статистическая обработка полученных результатов проводилась согласно требованиям, предъявляемым к статистическому анализу биомедицинских данных, использовался пакет прикладных программ Statistica 7.0 (StatSoft, USA). Для оценки нормальности распределения использовался критерий Шапиро — Уилка, показавший нормальность распределения анализируемых данных групп пациентов. Данные вариационных рядов представлены средним значением (Mean), стандартным отклонением (SD) и стандартной ошибкой (SE). Для сравнения выборок использовался параметрический t-критерий Стьюдента c 95%-м доверительным интервалом как характеристика границ ожидаемых отклонений. Критический уровень значимости анализа определен при p≤0,05.
Результаты. При анализе динамики показателей в исследуемой группе отмечено снижение выраженности моторных нарушений в среднем на 6,0% в выключенном состоянии (c 55,13 до 51,81 балла, p<0,05) и на 5,6% во включенном (с 43,69 до 41,25 балла, p<0,05) преимущественно за счет улучшения ходьбы, уменьшения постуральной неустойчивости и выраженности застываний, что также отражается в положительной динамике субъективной оценки качества ходьбы и степени застываний по опроснику FoG-Q (с 9,44 до 7,38 балла, p<0,05). В группе сравнения за аналогичный период не наблюдалось значимой динамики объективных показателей или субъективной оценки нарушений ходьбы (p>0,05). Результаты анализа эффективности по динамике показателей (баллов) шкалы UPDRS и опросника FoG-Q представлены в таблице и на рисунке.
Обсуждение. Застывания и постуральная неустойчивость наиболее выражены в ситуациях, связанных либо со сменой локомоторной или постуральной программы (начало и конец движения, повороты), либо с выполнением двух или более программ одновременно (например, ходьба+речь) [8, 14]. С нейрохимической точки зрения резистентность нарушений ходьбы и постуральной устойчивости к традиционной дофаминергической терапии может
Динамика выраженности двигательных нарушений по шкале UPDRS (II, III, IV части), опроснику FoG (в баллах)
|
Группы пациентов |
Стат. параметры |
UPDRS |
FoG-Q |
||||||
|
Выкл. |
Вкл. |
||||||||
|
Начало |
5 дней |
10 дней |
Начало |
5 дней |
10 дней |
Начало |
10 дней |
||
|
Mean |
55,13 |
53,14 |
51,81 |
43,69 |
42,27 |
41,25 |
9,44 |
7,38 |
|
|
Исслед. группа |
SE |
4,22 |
4,04 |
3,93 |
3,59 |
3,51 |
3,42 |
1,60 |
1,27 |
|
SD |
16,89 |
16,34 |
15,74 |
14,38 |
13,97 |
13,7 |
6,42 |
5,08 |
|
|
Mean |
55,51 |
55,47 |
55,43 |
43,95 |
43,9 |
43,82 |
9,51 |
9,48 |
|
|
Контрол. группа |
SE |
4,17 |
4,10 |
3,97 |
3,58 |
3,50 |
3,45 |
1,56 |
1,54 |
|
SD |
16,78 |
16,46 |
15,95 |
14,57 |
14,2 |
13,89 |
6,35 |
6,34 |
|
П р и м еч а н и е : UPDRS — унифицированная шкала оценки болезни Паркинсона; FoG-Q — опросник Freezing of Gait; вкл. — «включенное» состояние (на фоне действия препарата); выкл. — «выключенное» состояние; Mean — среднее арифметическое; SE — стандартная ошибка; SD — стандартное отклонение.
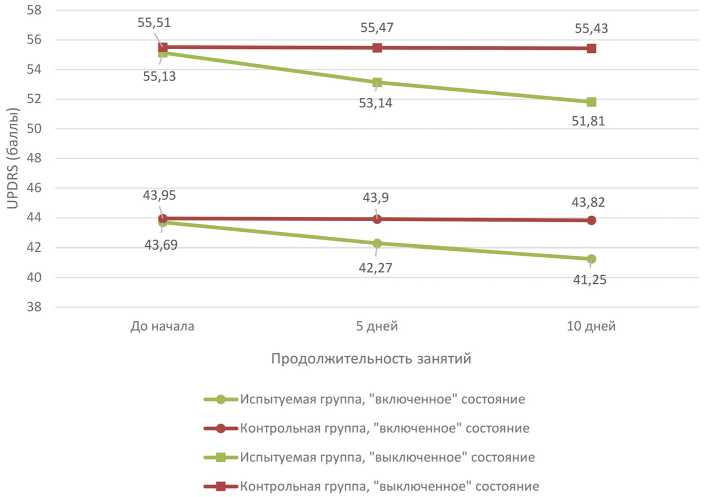
Динамика выраженности двигательных нарушений по шкале UPDRS (II, III, IV части)
быть объяснена вовлечением недофаминергических, в первую очередь норадренергических и холинергических механизмов [4].
Таким образом, можно утверждать, что нарушения ходьбы и постуральная неустойчивость являются самостоятельными признаками БП, имеющими свои патогенетические механизмы развития и требующими специфического подхода в лечении. Высказывается предположение, что двигательная активность в ВР при условии достаточной ее иммерсивности способна индуцировать те же физиологические процессы в головном мозге, что и аналогичная активность в обычной жизни [19]. Если данная гипотеза верна, это открывает большие возможности для коррекции моторных нарушений у пациентов с неврологическими заболеваниями.
Таким образом, полученные в нашем исследовании результаты продемонстрировали эффективность иммерсивной ВР при использовании в качестве вспомогательного метода двигательной реабилитации у пациентов с выраженными нарушениями ходьбы при БП. Положительный эффект наблюдался независимо от того, находился ли пациент во «включенном» состоянии после приема препарата леводопы или «выключенном» на момент оценки двигательных нарушений. В первые 5 дней занятий динамика была более существенной, чем с 5-го по 10-й день занятий, что может говорить о нецелесообразности увеличения длительности курса. Дальнейшие исследования могут быть направлены на изучение стойкости клинического улучшения, подбор оптимальной длительности сеанса и курса, модификацию программ виртуальной среды для достижения максимального положительного эффекта, изучение нейрофизиологических механизмов, лежащих в основе реабилитационного потенциала ВР.
В целом методики с использованием виртуальной реальности в последнее время активно применяются в нейрореабилитации, в частности при восстановлении движений в постинсультном периоде [20] со сходными результатами, хотя и другой «модальности». В группе пациентов с нейродегенеративными заболеваниями ВР-тренинг продемонстрировал способность уменьшать выраженность тремора покоя [19]. На данный момент есть все основания полагать, что уже в ближайшем будущем область применения ВР-методик в нейрореабилитации существенно расширится. По результатам нашего исследования можно утверждать, что именно степень иммерсивности и эксплицитности взаимодействия с объектами ВР позволит совершенствовать реабилитационные методики с учетом патогенеза заболевания и выраженности двигательных нарушений.
Заключение. ВР-тренинг является перспективным направлением немедикаментозной коррекции нарушений ходьбы и постуральной неустойчивости у пациентов с болезнью Паркинсона и может быть внедрен в практическое здравоохранение в условиях стационаров или реабилитационных центров, а также потенциально и в амбулаторных условиях ввиду безопасности данного метода. Нейропластический потенциал сенсорного взаимодействия с виртуальными объектами может быть использован для коррекции широкого спектра двигательных нарушений у пациентов с нейродегенеративными заболеваниями, в особенности в случаях малой эффективности медикаментозного воздействия. Из преимуществ ВР-методик также можно отметить интуитивную доступность интерфейса занятий, что не создает ограничений в виде наличия речевых или когнитивных нарушений у пациентов с неврологическими заболеваниями. Дальнейшие направления совершенствования данной методики реабилитации могут включать как усиление иммерсивности виртуальной среды за счет сенсорного погружения в ВР при муль-тисенсорном воздействии, так и внедрение и расширение возможности интерактивного взаимодействия пациента и ВР-среды.
Список литературы Применение виртуальной реальности в лечении нарушений ходьбы у пациентов с болезнью Паркинсона
- Барулин A. E. Курушина О. В., Черноволенко Е.П. Болезнь Паркинсона: немедикаментозные методы лечения. Волгоградский научно-медицинский журнал 2016; (2): 28-33.
- Giordano N, lemolo A, Mancini М, et al. Motor learning and metaplasticity is striatal neurons: relevance for Parkinson's disease. Brain 2018 Feb 1; 141 (2): 505-20.
- Калинин В. А, Повереннова И. E, Шпи-лева С.А. Методы диагностики нарушений ходьбы и посту-ральной устойчивости при болезни Паркинсона. Наука и инновации в медицине 2018; 2 (10): 37-40.
- Скрипкина H.A., Левин О.С. Нарушения ходьбы при болезни Паркинсона. Журнал неврологии и психиатрии 2015; 6 (2): 54-60.
- Nonnekes J, Giladi N, Guha A, et al. Gait festination in parkinsonism: introduction of two phenotypes. Journal of Neurology 2019; 266: 426-30.
- Jankovic J. Parkinson's disease: clinical features and diagnosis. Journal of Neurology, Neurosurgery and Psychiatry 2008; (79): 368-76.
- Owen C, Ibrahim K, Dennison L, et al. Falls self-management interventions for people with Parkinson's disease: a systematic review. Journal of Parkinson's Disease 2019; 9 (2): 283-99.
- Nutt JG, Bloem BR, Giladi N, et al. Freezing of gait: moving forward on a mysterious clinical phenomenon. The Lancet Neurology 2011; 10: 734-44.
- Giladi N, McDermott MP, Fahn S, et al. Freezing of gait in PD: prospective assessment in the DATATOP cohort. Neurology 2001; 56: 1712-21.
- Bloem BR, De Kam D, van Geel K, et al. Start React Effects Support Different Pathophysiological Mechanisms Underlying Freezing of Gait and Postural Instability in Parkinson's Disease. PLoS One 2015 Mar 24; 10 (3): e0122064. DOI: 10.1371/journal, pone. 0122064.
- Nallegowda M, Singh U, Handa G, et al. Role of sensory input and muscle strength in maintenance of balance, gait, and posture in Parkinson's disease: a pilot study. Journal of Physical and Rehabilitation Medicine 2004; 83: 898-908.
- Bartels AL, de Jong BM, Giladi N, et al. Striatal dopa and glucose metabolism in PD patients with freezing of gait. Movement Disorders 2006; 21: 1326-32.
- Tard C, Delval A, Devos D, et al. Brain metabolic abnormalities during gait with freezing in Parkinson's disease. Neuroscience 2015; 307: 281-301.
- Snijders AH, Leunissen I, Bakker M, et al. Gait-related cerebral alterations in patients with Parkinson's disease with freezing of gait. Brain 2011 Jan; 134 (Pt 1): 59-72.
- Alam M, Schwabe K, Krauss JK. The pedunculopontine nucleus area: critical evaluation of interspecies difference relevant for its use as a target for deep brain stimulation. Brain 2011; 134: 11-23.
- Fling BW, Cohen RG, Mancini M, et al. Asymmetric pedunculopontine network connectivity in parkisonian patients with freezing of gait. Brain 2013; 136: 2405-18.
- Gilat M, Shine JM, Bolitho SJ, et al. Variability of Stepping during a Virtual Reality Paradigm in Parkinson's Disease Patients with and without Freezing of Gait. PLoS One 2013; 8 (6): e66718. Published online 2013 Jun 21. DOI: 10.1371/journal, pone. 0066718.
- Bluett B, Bayram E, Litvan I. The virtual reality of Parkinson's disease freezing of gait: A systematic review. Parkinsonism & Related Disorders 2019 Apr; 61: 26-33.
- Arias P, Robles-Garcia V, Sanmartin G, et al. Virtual Reality as a Tool for Evaluation of Repetitive Rhythmic Movements in the Elderly and Parkinson's Disease Patients. PLoS One 2012;7(1):e30021. URL: https://doi.org/10.1371/journal. pone. 0030021
- Карпова M. И, Долганов M. В Виртуальная реальность в восстановлении функции верхней конечности после инсульта (обзор литературы). Неврология 2016; 137 (4): 62-8.


