Принципы организации системы документов СМК на предприятии - производителе лекарственных средств
Автор: Дьяконова Е.В., Рубан Т.И.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Организация производства медицинских препаратов
Статья в выпуске: 2-2 т.26, 2011 года.
Бесплатный доступ
В настоящее время отсутствует универсальный подход к построению системы документации как одной из основ организации производства лекарственных средств в соответствии с требованиями GMP. Эта задача определила необходимость разработки методики создания и функционирования документов системы менеджмента качества применительно к предприятию-производителю ЛС.
Система менеджмента качества, внутренние контролируемые документы, стандартная операционная процедура
Короткий адрес: https://sciup.org/14919468
IDR: 14919468 | УДК: 004.01
Текст научной статьи Принципы организации системы документов СМК на предприятии - производителе лекарственных средств
Согласно требованиям GMP, формализованные процессы представляют собой основу, крайне необходимую для организации надлежащего производства лекарственных средств [1, 4, 5], поэтому внедрение в практику системы управления документацией и записями, обеспечивающей достаточность информации для проведения работ, анализа результатов и своевременной актуализации процессов производства, позволяет руководству предприятия своевременно решать вопросы, связанные с качеством продукции, подготовкой персонала, расчетом технико-экономических показателей [3].
При подготовке к формированию структуры документов системы менеджмента качества (СМК) [2] на НПО “Вирион” был проведен анализ достаточности пакета имеющихся на предприятии внешних документов (базовый уровень значимости), регламентирующих организацию процесса производства. Следующим шагом стало принципиальное формирование общей структуры системы внутренних документов СМК по уровням значимости. К документам СМК верхнего уровня были отнесены “Руководство по качеству” и “Мастер-файл предприятия”, которые являются документами, действующими в масштабах всего Филиала. К среднему уровню отнесены организационные документы, действующие на уровне функционального подразделения. В отличие от фармацевтического производства, производство каждого МИБП весьма специфично и пролонгировано, поэтому к среднему уровню были отнесены “Мастер-файлы” каждого производственного подразделения, Положения об отделах и организационные программы различной направленности, не вошедшие в конкретный Мастер-файл отдельно взятого производственного подразделения. К нижнему уровню отнесены документы, связанные с производством конкретного продукта. Выстраивание всей системы в целом идет по принципу “снизу-вверх”, так как система документов нижестоящего уровня является основой для формирования системы документов вышестоящего уровня.
Предлагаемая структура системы документации связана с уровнями управления следующим образом (табл. 1): к стратегическому уровню управления относятся документы “верхнего” уровня значимости, к тактическому – документы “среднего” уровня значимости, руководящие и нормативные документы производства, к “оперативному” – документы “нижнего” уровня значимости (внутренние контролируемые документы).
Самым первым звеном в этой цепочке являются внутренние контролируемые документы (ВКД). Разработанный нами алгоритм создания и функционирования ВКД основан на принципах процессного подхода и представлен рядом последовательных организационных мероприятий: инвентаризация и систематизация имеющихся в функциональных подразделениях на рабочих местах внутренних руководящих документов, разработанных и утвержденных на предприятии, область применения которых ограничена выполнением требований технологического процесса; разработка системы идентификации ВКД; создание макетов ВКД разных групп; разработка и
Таблица 1
Взаимосвязь структуры системы документации с уровнями управления
|
Уровень управления |
Структура основных документов СМК |
|
Стратегический |
“верхний” уровень “Руководство по качеству”, “Мастер-файл предприятия” |
|
Тактический |
“средний” уровень “Мастер-файл производственного отдела (участка)”, Положения и Программы (организационные) “нижний” уровень Руководящие и нормативные документы процесса производства: регламенты производства (РП), фармакопейные статьи (ФС), фармакопейные статьи предприятия (ФСП) |
|
Оперативный |
“нижний” уровень Внутренние контролируемые документы (ВКД): стандарты предприятия, стандартные инструкции, СОПы, спецификации и др. |
Таблица 2
Этапы процесса апробации создания системы внутренних контролируемых документов
|
№ п.п. |
Этап |
Опорные элементы |
|
1 |
Моделирование |
Выбор (определение) операции Создание общей схемы выполнения операции Детализация элементов операции |
|
2 |
Идентификация |
Наблюдение за операцией Идентификация показателей, критических для операции, выявление несоответствий Разработка и проведение корректирующих действий |
|
3 |
Документирование |
Написание недостающих СОП (СИ) по элементам обеспечения Написание СОП (СИ) по выполнению операции |
|
4 |
Анализ воспроизводимости |
Проверка СОП (СИ) на адекватность Внесение необходимых изменений (актуализация) |
|
5 |
Введение в практику |
Утверждение, регистрация, распространение Первичное обучение работников |
апробация алгоритма написания этих документов.
При разработке методики написания отдельного вида ВКД – стандартных операционных процедур (СОП) мы исходили из следующих принципиальных положений, основанных на принципах процессного подхода: описываемый процесс разбивается на стандартные операционные процедуры; для каждой СОП определяются границы (где начинается, где заканчивается, что является входными и выходными данными, кто участвует, какие ресурсы задействованы); при описании СОП по возможности применяются блок-схемы; обязательно делается акцент на наиболее важные моменты; результат выполнения СОП должен быть описан и, по мере необходимости, проиллюстрирован; обязательное наличие в СОП образцов форм, заполняемых в процессе выполнения операции.
Сам процесс разработки СОП был разделен на несколько элементов, также опирающихся на принципы TQM: подробное описание процедуры; оценка правильности описания процедуры; анализ достаточности приведенной информации для выполнения операции; раз-работка/проведение корректирующих действий (при необходимости); оформление, согласование, утверждение СОП. Таким образом, в разработку документа обязательно вовлекается непосредственный исполнитель опе- рации, в процессе описания технологической процедуры устраняются выявленные отклонения технологического процесса от регламента.
Алгоритм апробации разработанного метода создания СОП приведен в таблице 2. Все выполняемые в отделении операции разделяются по группам, исходя из требований технологического процесса. Стороннее наблюдение за проведением операции позволяет выявить существующие несоответствия. На основе разработанных унифицированных форм пишутся (вносятся дополнения в существующие) СОПы. Сторонним наблюдателем проводится оценка адекватности текста СОПов выполнению процесса оператором. Окончательно оформленные СОП проходят утверждение и регистрацию по предварительно разработанному алгоритму.
Алгоритм работы с ВКД, внедренный на НПО “Вирион”, состоит из двух основных циклов. В первый цикл вошли работы с действующими ВКД: создание, регистрация, распределение, пересмотр. Во второй цикл – работы с документами, утратившими актуальность: регистрация, изъятие, архивирование, уничтожение. При этом в ходе создания документа решаются вопросы обеспечения, выполнения и контроля описываемой операции, возможно использование ВКД для обучения и аттестации персонала и нормирования труда. Работа с ВКД представляет собой самоорганизующийся процесс, позволяющий обеспечивать технологический процесс необходимыми документами управления и регистрации и своевременно проводить актуализацию существующих.
Так, через год после введения в действие системы ВКД на НПО “Вирион” количество новых версий документов по отдельным элементам организации технологического процесса составило: технологическое оборудование – 17,1%, санитария и гигиена – 55,6%, технологические – 9,5%, управление – 20%, контроль – 14,3%, спецификации – 12,6%. К апрелю 2010 г. в систему ВКД было включено 6300 документов. Динамика создания внутренних контролируемых документов за период с 2003 по 2010 гг. (%) представлена на рисунке 1.
“Управление документацией” и “Управление записями” входят в состав пяти обязательных процедур СМК. Разработанный нами и внедренный на НПО “Вирион” порядок управления документацией и записями о процессах производства структурирован в самой системе внутренних документов СМК (табл. 3).
Базовый уровень значимости (внешние документы) определяет форму, общие требования к порядку разработки, содержанию, согласованию, утверждению, экспертизе и внесению изменений во внутренние нормативные
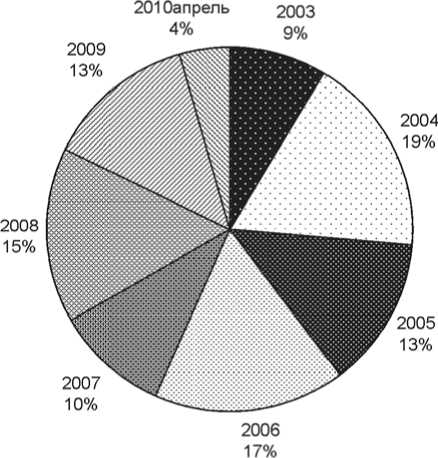
Рис. 1. Динамика создания внутренних контролируемых документов за период с 2003 по 2010 гг. (%)
Таблица 3
Регламентация порядка управления внутренними документами в системе документации
|
Блок |
Уровень значимости |
Документ |
Освещаемые аспекты управления системой документации |
|
Верхний Средний Нижний |
Руководство по качеству Мастер-файл производственного подразделения Руководящие и нормативные документы процесса производства. Внутренние контролируемые документы |
Матрица ответственности создания. Пересмотра, хранения, распространения. Действующий порядок согласования и утверждения. Перечень документов, применяемых в подразделении; сроки действия. Содержание Содержание возможной новой редакции |
|
|
1 |
Базовый |
Законы РФ, государственные и отраслевые стандарты, руководящие документы |
Формат документов, общие требования к порядку разработки, содержанию, согласованию, утверждению, экспертизе и внесению изменений. |
документы и рекомендации по этим позициям для внутренних контролируемых документов. Документы нижнего уровня значимости определяют содержание и возможное содержание новой редакции для внутренних контролируемых документов и, в добавление к этим позициям, регламентируют создание, идентификацию, распространение, сроки пересмотра, первичное обучение персонала, количество внутренних контролируемых документов. Документы среднего уровня (Мастер-файл производственного подразделения, организационные программы) содержат информацию о перечне применяемых в подразделении нормативных документов и сроке их действия, о перечне действующих ВКД, области их применения и формах регистрации (заполняемых формах) технологических и контрольных операций. В документах верхнего уровня содержится матрица ответственности создания, пересмотра, хранения, распространения документов, действующий порядок их внешнего и внутреннего согласования и утверждения.
Структурированная таким образом система документации соответствует требованиям, предъявляемым стандартами ИСО серии 9000 к управлению документами и управлению записями. Использование ВКД для обучения и аттестации персонала и нормирования труда позволя- ет снизить производственные риски, связанные с человеческим фактором и облегчает поиск внутрипроизводственных резервов экономии ресурсов.
Список литературы Принципы организации системы документов СМК на предприятии - производителе лекарственных средств
- ГОСТ Р 52249 -2009. Правила производства и контроля качества лекарственных средств. -Введ. 2009.20.05. -М.: Изд-во стандартов. -132 с.
- ГОСТ Р ИСО 9001-2008. Система менеджмента качества. Требования. -Введ. 2008.18.12. -М.: Изд-во стандартов. -25 с.
- Дьяконова Е.В., Рубан Т.И., Ставицкая Н.Х. Внутренние контролируемые документы. Порядок создания, оформления, учета и хранения//Сибирский медицинский журнал (Томск). -2004. -№ 2. -С. 90-93.
- МУ 64-04-002-2002. Производство лекарственных средств. Документация: методические указания. -Введ. 2003.15.04. -М., 2002. -18 с.
- МУ 64-04-003-2002. Производство лекарственных средств. Документация. Общие требования. Примерные формы и рекомендации по их заполнению: методические указания. -М., 2002. -23 с.


