Природная очаговость инфекционного ринотрахеита крупного рогатого скота в Московской области
Автор: Пчельников А.В., Яцентюк С.П., Красникова М.С., Долинская К.Г.
Статья в выпуске: 4 т.256, 2023 года.
Бесплатный доступ
Целью работы было определение возможной природной очаговости инфекционного ринотрахеита крупного рогатого скота. Активный рандоминизированный мониторинг животноводческих хозяйств Московской области, проведенный в 2020 г., позволил установить хозяйства с активной циркуляцией возбудителя ИРТ КРС. Молекулярно-генетические и серологические исследования материала от диких парнокопытных животных, добытых на территории Московской области в 2019-2022 гг., позволил установить факт циркуляции герпесвируса крупного рогатого скота 1 типа среди этих животных. В результате установлено, что 4 из 5 животноводческих хозяйств, в которых зафиксирована циркуляция полевых штаммов возбудителя ИРТ КРС, находятся в зоне природных очагов этой болезни. Этот факт, а также особенности механизма передачи возбудителя ИРТ КРС между дикими и домашними животными необходимо учитывать при разработке стратегии профилактики и борьбы с этой экономически значимой болезнью.
Ирт, крс, дикие жвачные, пцр, серологические исследования
Короткий адрес: https://sciup.org/142239415
IDR: 142239415 | УДК: 619:616.98:578.831.31:636.2 | DOI: 10.31588/2413_4201_1883_4_256_206
Текст научной статьи Природная очаговость инфекционного ринотрахеита крупного рогатого скота в Московской области
Домашний крупный рогатый скот ( Bos taurus taurus ) (КРС) относится к тому же подотряду Ruminantia отряда парнокопытные ( Artiodactyla ), что и современные лоси, олени и косули, в большом количестве обитающие на Европейской части Российской Федерации. У всех этих животных есть общие возбудители вирусной природы, вызывающие болезни, которые наносят значительный экономический ущерб животноводству. Среди таких возбудителей особое место занимают α-герпесвирусы КРС. В настоящее время исследователи многих стран мира все чаще обращают внимание на изучение циркуляции герпесвируса КРС 1 типа (BoHV-1), возбудителя инфекционного ринотрахеита в популяции диких парнокопытных жвачных животных, а также роли диких животных в передаче этого возбудителя крупному рогатому скоту [5, 4].
В тоже время ряд авторов, занимающихся изучением циркуляции α-герпесвирусов в популяциях диких жвачных животных, утверждают, что значительный антигенный перекрест затрудняет дифференциацию BoHV-1 от антигенно родственных α-герпесвирусов. BoHV-1 входит в кластер близкородственных вирусов семейства Alphaherpesvirinae, включающий, помимо этого вируса еще герпесвирус КРС 5-го типа (BoHV-5), герпесвирус буйвола 1-го типа (BuHV-1), герпесвирус коз 1-го типа
(CpHV-1), герпесвирус оленей 1-го типа (CvHV-1), герпесвирус оленей 2-го типа (CvHV-2) и герпесвирус лосей 1-го типа (ElkHV-1) [7]. Антитела в организме диких животных могут вырабатываться в ответ на инфицирование любым вирусом рассматриваемой группы, а, без учета близкородственных особенностей, могут интерпретироваться, как антитела к BoHV-1 по результатам серологических реакций: реакции нейтрализации (РН) или иммуноферментного анализа (ИФА).
Несмотря на то, что современные принципы ведения животноводства направлены на полное отсутствие непосредственного контакта между КРС и дикими парнокопытными жвачными животными, передача возбудителей указанных болезней между этими животными через факторы передачи возможна [3].
В Российской Федерации этот вопрос до настоящего времени изучен недостаточно.
Авторы настоящей статьи, в рамках проводимых исследований по изучению циркуляции вирусных патогенов КРС в популяции диких парнокопытных животных Московской области, постарались установить теоретическую возможность перекрестной передачи α-герпесвирусов между КРС и дикими парнокопытными жвачными животными.
Материал и методы исследований. Животноводческие хозяйства, в которых циркулирует BoHV-1 были установлены в предыдущих исследованиях [1].
Пробы патологического материала (кусочки паренхиматозных органов, смывы со слизистой оболочки носовой полости, кровь из сердца) отбирались от диких животных, отстрелянных в зимние сезоны охоты 2019-2022 гг. на территории Московской области. Отбор проб проводили посмертно ветеринарными врачами Государственной ветеринарной службы Московской области. Всего было отобрано 626 проб от 177 животных, в том числе: от 137 лосей (Alces alces); 18 косуль (Capreolus capreolus); 3 благородных оленей; 19 животных без информации о виде.
От указанных животных было исследовано 532 образца внутренних органов (носовая перегородка, верхние кольца трахеи, кусочки легкого, сердца, печени, почки), 53 пробы смывов со слизистых и 41 проба сыворотки крови (кровь отбиралась посмертно пункцией полостей сердца).
В ходе пробоподготовки из тканей органов вырезали фрагмент объемом 1 см3, который измельчали на гомогенизаторе Homogenizer type 302 (Mechanika Precyzyjna, Польша) в 10 мл физиологического раствора с добавлением 100 мг стрептомицина и 100 ЕД пенициллина. В дальнейшем гомогенат центрифугировали на центрифуге ОПн-8УХЛ4.2 (Россия) при 3000 об/мин в течение 5 мин; супернатант отбирали и использовали для дальнейших исследований.
Культура клеток. Для репродукции вирусов использовалась перевиваемая культура клеток почки теленка (MDBK).
Вирус. В работе использовался полевой изолят вируса ИРТ КРС «Куйбышев-2006» из коллекции ФГБНУ «Федеральный научный центр – Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени К.И. Скрябина и Я.Р. Коваленко Российской академии наук».
Культивирование клеток. Культивирование проводили в полистироловых культуральных матрасах с площадью роста 75 см2 и невентилируемой крышкой в условиях термостата при 37 °С. В качестве ростовой питательной среды использовали среды Игла DМЕМ («ПанЭко», Россия) с добавлением 7% сыворотки КРС (HyClone, США). Пересев культуры проводили 1 раз в неделю в соотношении 1:4.
Заражение культуры клеток. Заражение культуры клеток проводили после формирования полного монослоя на 1-2-й день после пересева клеток. Ростовую питательную среду сливали. Клеточный монослой дважды отмывали питательной средой Игла DМЕМ. После этого в матрас вносили вируссодержащей материал из расчета 1,0 ТЦД 50 /кл и помещали в термостат при 37 °С на 1 ч. Через 1 ч. содержимое матраса сливали, а в матрас вносили поддерживающую питательную среду (Игла DМЕМ без добавления сыворотки) без предварительного промывания монослоя. После этого матрас помещался в отдельный термостат при 37°С. Цитопатическое действие вирусов учитывали ежедневно визуально под малым увеличением инвертированного микроскопа до отслоения большей части монослоя от субстрата. Вируссодержащую суспензию использовали в дальнейших исследованиях. Определение инфекционного титра вируса проводили по методу Рида и Менча.
Реакция нейтрализации. Реакцию нейтрализации с постоянной дозой вируса 2 lg ТЦД 50 /мл проводили микрометодом, используя полистироловые 96-луночные культуральные планшеты. Каждая проба сыворотки крови исследовалась в двух повторах по три разведения в каждом (1:2 – 1:8). Результаты учитывали через 72 ч. после постановки реакции. Учитывая низкое качество и количество сыворотки в предоставленных пробах, а также невозможность повторного отбора проб у тех же животных, учет результатов реакции проводился качественно (без расчета титра антител в исследуемой сыворотке). Животное считалось серопозитивным при получении положительного результата (отсутствие цитопатического действия вируса) хотя бы в первом разведении сыворотки одного из повторов.
Полимеразная цепная реакция. Выделение нуклеиновых кислот проводили из 100 мкл суспензии органов или смыва со слизистой с помощью набора «РИБО-преп» («АмплиСенс», Россия) по инструкции производителя. ПЦР для выявления ДНК герпесвирусов КРС проводили с использованием тест-системы «РИНОКОР» («АмплиСенс», Россия). Для идентификации родственных α-герпесвирусов проводили амплификацию участка гена gB вирусов с использованием гнездовой ПЦР с праймерами CR30, CR31, CR32, CR33 [0] . Первый раунд с праймерами CR30, CR31 проводили в 25 мкл реакционной смеси, содержащей 2,5× PCR-mix2 blue («АмплиСенс», Россия), 0,25 мМ dNTP, 0,6 мкМ прямого и обратного праймера и 10 мкл выделенной из образца ДНК. Реакцию проводили в амплификаторе «Терцик» («ДНК-технология», Россия) по следующей программе: 5 мин. – 95 °С, 40 циклов (20 сек – 95 °С, 20 сек – 61 °С, 30 сек – 72 °С), 5 мин. – 72 °С. Второй раунд с праймерами CR32, CR33 проводили в аналогичной смеси по программе: 5 мин – 95 °С, 40 циклов (20 сек. – 95 °С, 20 сек. – 63 °С, 20 сек. – 72 °С), 5 мин. – 72 °С с использованием в качестве матрицы 1 мкл реакционной смеси первого раунда.
Секвенирование очищенных ампликонов проводили с использованием набора реагентов BrilliantDye V3.1 на генетическом анализаторе Applied Biosystems 3100 Genetic Analyzer (Life Technologies, США). Полученные нуклеотидные последовательности анализировали с помощью алгоритма BLAST на поисковом интернет-ресурсе National Center for Biotechnology Information ( www.ncbi.nlm.nih.gov ).
Статистическая обработка результатов. Статистическая обработка результатов проводились в программе Microsoft Excel 2016.
Картографический анализ. Карты строили в программе ArcGIS10.8.
Результат исследований. Активный рандомизированный мониторинг животноводческих хозяйств Московской области, проведенный в 2020
г., позволил установить 5 животноводческих хозяйств разных форм собственности, в которых циркулируют полевые штаммы BoHV-1 (Рисунок 1).
Из 177 парнокопытных, добытых на территории Московской области, пробы сыворотки крови отобраны только у 41 животного, в том числе от 36 лосей и 5 косуль. Трудности с отбором были связаны с большим промежутком времени между отстрелом животного и проведенным отбором проб, а также с низкой температурой воздуха в зимний период, что приводило к частичному гемолизу крови, полученному незначительному объему сыворотки и, как следствие, определенными трудностями при ее исследовании в реакции нейтрализации. В образцах сыворотки 19 животных (16 лосей, 3 косули) были детектированы антитела к α-герпесвирусам КРС.
В результате молекулярногенетических исследований (ПЦР) 532 образца патологического материала и 53 проб смывов со слизистых от 177 диких парнокопытных, добытых на территории Московской области, ДНК α-герпесвирусов КРС была выявлена в образцах от 9 животных: в носовых смывах 2 косуль, добытых в 2019 г. на территории г.о. Луховицы; в образцах органов 2 лосей (в образце легкого одного, а также в образцах почки и сердца другого животного), добытых в 2022 г. на территории г.о. Ступино; в носовом смыве 1 косули, добытой в 2022 г. на территории г.о. Серпухов; в образцах 2 косуль, добытых в 2022 г. на территории г.о. Луховицы; в образце 1 лося, добытого в 2022 г. на территории Клинского г.о.; в образце 1 лося, добытого в 2022 г. на территории г.о. Орехово-Зуево.
Анализ нуклеотидных последовательностей фрагмента гена gB, полученных в результате секвенирования продуктов ПЦР с общими для α-герпесвирусов праймерами, подтвердили наличие ДНК BoHV-5 в образце носового смыва от косули и ДНК BoHV-1 в двух пробах органов лосей, отстрелянных в 2022 г. Для остальных проб животных из-за низкого качества образцов не удалось провести идентификацию вирусов герпеса.
животных на территории Московской области представлена на рисунке 2.
Локация добычи указанных
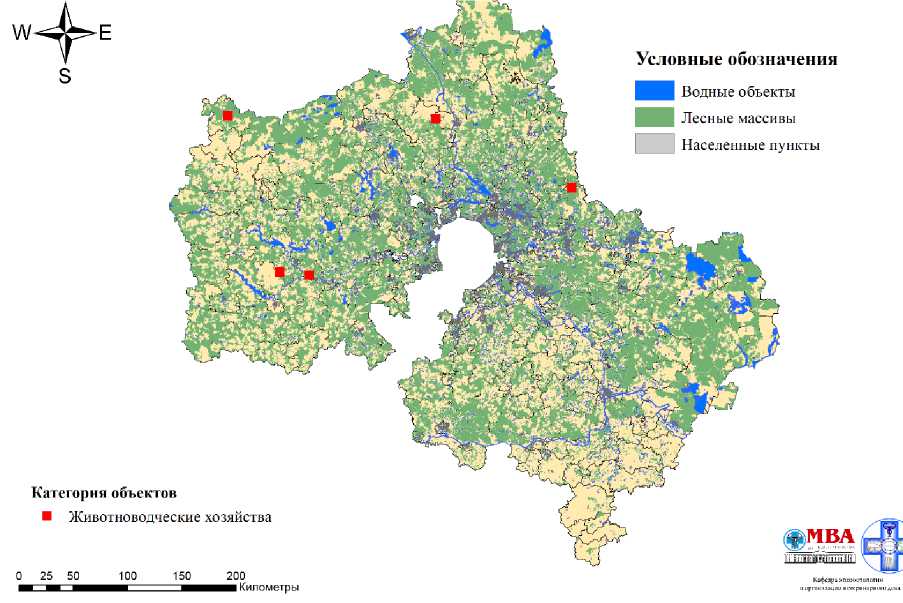
Рисунок 1 – Локация животноводческих хозяйств, в которых зарегистрирована циркуляция полевых штаммов возбудителя ИРТ КРС, на карте Московской области.
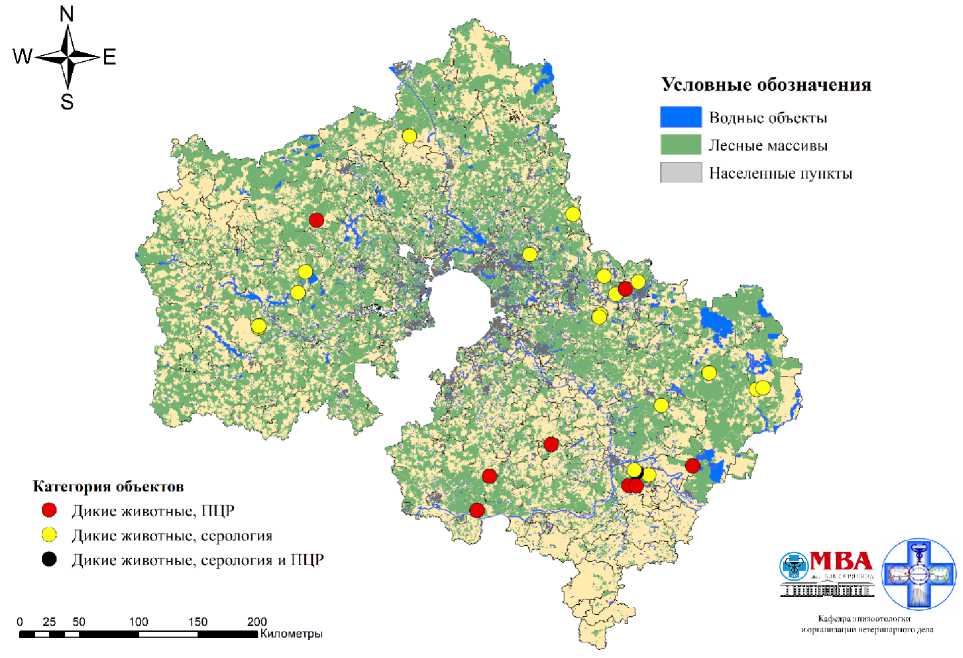
Рисунок 2 – Места добычи диких парнокопытных животных, у которых детектированы геном вируса ИРТ КРС или антитела к нему, на территории Московской области
Наложение локации животноводческих хозяйств, в которых циркулирует BoHV-1, на места добычи диких животных, признанных носителями
α-герпесвирусов, показывает, что 4 из 5 хозяйств находятся в зоне природных очагов α-герпесвирусов (Рисунок 3).
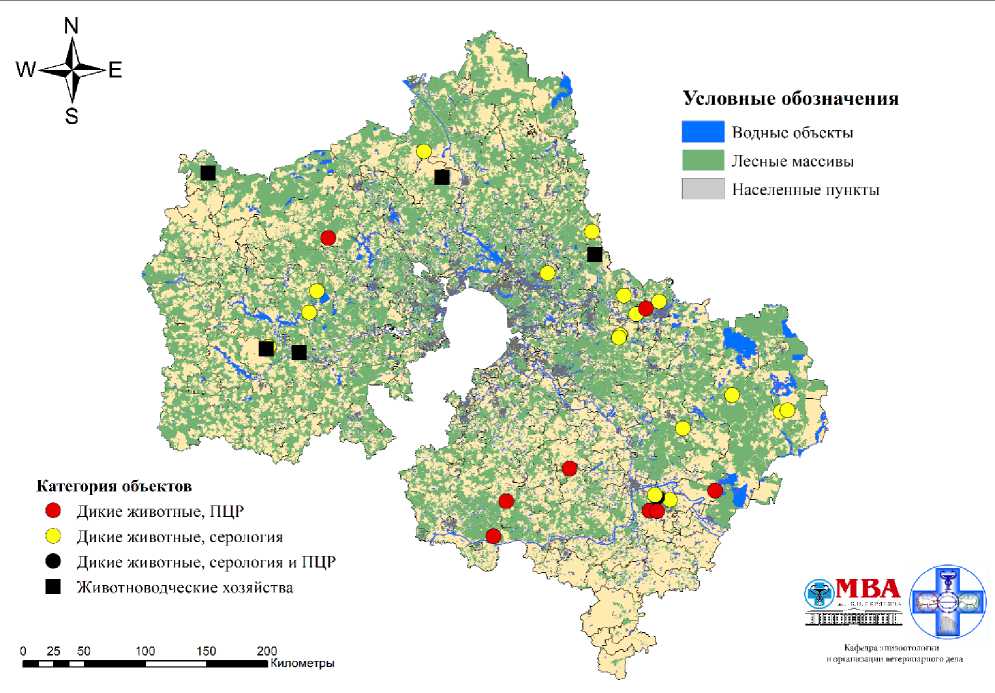
Рисунок 3 – Совмещение геопозиции животноводческих хозяйств с местами отстрела диких животных, носителей вирусов герпеса КРС.
Заключение. Ряд иностранных авторов напрямую указывают на роль диких парнокопытных животных, как природного резервуара возбудителя ИРТ КРС [4].
Нам удалось детектировать геном α-герпесвирусов в различном патологическом материале 9 животных из 177, что составляет 5 % от всей выборки. При анализе рисунка 2 видно, что все указанные животные, за исключением одного, добыты на юге Московской области.
Антитела к вирусу ИРТ КРС детектированы у 19 животных из 41 обследованного. Общая серопревалентность составила 46 %. Большинство из этих 19 животных добыты на юге, юго-востоке и востоке Московской области, 3 животных добыты на западе и 1
– на севере региона. Значительный антигенный перекрест с родственными α-герпесвирусами не позволяет нам утверждать, что все эти животные контактировали непосредственно с возбудителем ИРТ КРС. Тем не менее, факт идентификации генетического материала BoHV-1 в патологическом материале 2 животных подтверждает, что этот возбудитель также циркулирует в популяции диких парнокопытных животных Московской области.
Таким образом мы можем утверждать о наличии на территории Московской области природных очагов ИРТ КРС, носителем возбудителя которого являются дикие парнокопытные животные. На этих же территориях расположены 4 животноводческих хозяйства разной формы собственности (2 крестьянских
(фермерских) хозяйства (КФХ) и 2 мелкотоварные фермы с формой собственности АО), среди животных которых нами ранее зафиксирован факт циркуляции вируса ИРТ КРС.
Мы предполагаем, что взаимная передача α-герпесвирусов между дикими парнокопытными животными и домашним КРС возможен двумя путями:
-
1. КРС, содержащийся в КФХ, в теплый период года выгоняется на пастбища, которые в ночное время могут посещать дикие парнокопытные животные. Устойчивость возбудителя ИРТ КРС во внешней среде достаточна, чтобы обеспечить передачу возбудителя алиментарным путем.
-
2. КРС, содержащийся в мелкотоварных фермах на пастбищах не выпасается, но в теплое время года животные для обеспечения моциона выгоняются в уличные загоны. Кроме того, животноводческие помещения указанных хозяйств не защищены от проникновения насекомых. Хозяйства находятся в непосредственной близости от лесных массивов, в которых были добыты серопозитивные к BoHV-1 дикие животные. В.Н. Сюрин и ряд других авторов утверждают, что в указанных условиях передача возбудителя ИРТ КРС возможна через насекомых [2].
Таким образом факт наличия на территории Московской области природных очагов ИРТ КРС требует пересмотра подходов к профилактике и ликвидации этой болезни в животноводческих хозяйствах Московской области.
Исследование выполнено за счет гранта Российского научного фонда (проект № 22-26-00093, https://rscf.ru/project/22-26-00093/) .
Список литературы Природная очаговость инфекционного ринотрахеита крупного рогатого скота в Московской области
- Пчельников, А. В. Эпизоотическая ситуация по ИРТ КРС на территории Московской и Тверской областей / А. В. Пчельников, С. П. Яцентюк, Е. Р. Сафина // Ветеринария и кормление. - 2021. - № 2. - С. 38-41. DOI: 10.30917/ATT-VK-1814-9588-2021-2-10 EDN: WNDBHU
- Сюрин, В. Н. Вирусные болезни животных / В. Н. Сюрин, А. Я. Самуйленко, Б. В. Соловьев, Н. В. Фомина - М., ВНИТИБП, 1998, 928 с.
- Cripps, J. K.Introduced deer and their potential role in disease transmission to livestock in Australia /j. K. Cripps, C. Pacioni, M. P. Scroggie, A. P. Woolnough, D. S. L. Ramsey // Mammal. - 2019. - V. 49. - P. 60-77. -. DOI: 10.1111/mam.12142
- Lillehaug, A. Antibodies to ruminant alpha-herpesviruses and pestiviruses in Norwegian cervids / A. Lillehaug, T. Vikøren, I. L. Larsen, J. Akerstedt, J. Tharaldsen, K. Handeland //j. Wildl. Dis. - 2003. - V. 39(4). - V. 779-86. -. DOI: 10.7589/0090-3558-39.4.779
- Rola, J. Seroprevalence of bovine herpesvirus 1 related alphaherpesvirus infections in free-living and captive cervids in Poland /j. Rola, M. Larska, W. Socha, J. G. Rola [et al.] // Vet. Microbiol. - 2017. - V. 204. - P. 77-83. -. DOI: 10.1016/j.vetmic.2017.04.006
- Ros, C. Studies of genetic relationships between bovine, caprine, cervine, and rangiferine alphaherpesviruses and improved molecular methods for virus detection and identification / C. Ros, S. Belák //j. Clin. Microbiol. - 1999. - V. 37(5). - P. 1247-53. DOI: 10.1128/JCM.37.5.1247-1253.1999
- Thiry, J.Ruminant alphaherpesviruses related to bovine herpesvirus 1 /j. Thiry, V. Keuser, B. Muylkens, F. Meurens [et al.] // Vet. Res. - 2006. - V. 37(2). - V. 169-90. -:2005052. DOI: 10.1051/vetres


