Природные антиоксиданты в эмбриогенезе кур и защита от стрессов в постнатальном развитии (обзор)
Автор: Сурай П., Фисинин В.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры, проблемы, итоги
Статья в выпуске: 2 т.48, 2013 года.
Бесплатный доступ
Исследования последних лет убедительно продемонстрировали, что рацион родительского стада птицы оказывает значительный эффект на качество инкубационных яиц, а также на здоровье выведенного молодняка, рост и развитие цыплят в постнатальном онтогенезе. Аккумуляция витамина Е и каротиноидов в эмбриональных тканях рассматривается в качестве адаптивного механизма, обеспечивающего защиту цыплят от окислительного стресса при вылуплении. В постнатальном развитии особи стратегия антиоксидантной защиты изменяется от простого накопления антиоксидантов к синтезу антиоксидантных компонентов, включая антиоксидантные ферменты, и этот процесс регулируется на уровне генома. У вылупившихся цыплят иммунная и пищеварительная системы физиологически недостаточно зрелые. Они активно развиваются в первые 2 нед жизни, и в этот период молодняк нуждается в эффективной антиоксидантной защите. Повышенные дозы витамина Е, каротиноидов или селена в корме кур родительского стада способствуют переносу этих нутриентов в яйцо и усилению антиоксидантной защиты развивающегося эмбриона. Тем не менее, даже такие дозы вышеупомянутых антиоксидантов в материнском рационе не способны справиться с окислительным стрессом у молодняка. Нами разработан антистрессовый препарат нового поколения, выпаиваемый с питьевой водой и способный существенно снизить окислительный стресс постнатального развития у цыплят, который успешно испытан в условиях промышленных птицеводческих комплексов в России и Украине.
Птица, стресс, антиоксиданты, эмбриогенез, онтогенез, витамин е, каротиноиды, селен, витагены, антистрессовый препарат нового поколения
Короткий адрес: https://sciup.org/142133389
IDR: 142133389 | УДК: 636.5:636.018:616-092.18/.19:577.334
Текст обзорной статьи Природные антиоксиданты в эмбриогенезе кур и защита от стрессов в постнатальном развитии (обзор)
К основным задачам современных селекционных программ в мясном птицеводстве относится получение бройлеров с высокой скоростью роста, оптимальным выходом мясной продукции и эффективным использованием корма. Эти признаки часто отрицательно связаны со здоровьем птицы (как правило, чем выше продуктивность птицы, тем она более чувствительна к различным стрессам), что значительно усложняет селекционное решение проблемы (1). От оплодотворенной яйцеклетки до помещения цыпленка на бройлерную ферму действует ряд разнообразных факторов (качество инкубационного яйца, условия его хранения, технология инкубации, условия в период между выводом и доставкой цыплят на ферму), и взаимодействия между этими факторами играют важную роль в продуктивности растущих цыплят-бройлеров. В целом все вышеупомянутые обстоятельства представляют собой важные детерминанты качества цыплят (2). В отличие от млекопитающих, у птиц развитие эмбриона происходит в полузакрытой системе — яйце, где имеет место только обмен газов и воды. Сегодня уже ни у кого не вызывает сомнений тот факт, что успешное эмбриональное развитие цыплят зависит от состава яиц и условий их инкубации. В современной литературе представлены многочисленные доказательства того, что кормление материнского поголовья птицы — основной фактор, предопределяющий здоровье и развитие потомства (так же, как у человека и других млекопитающих). Состав яйца таков, что оно содержит в желтке и белке все питательные вещества, необходимые для развития будущего эмбриона (3). Среди различных питательных веществ материн- ского рациона, оказывающих значительное влияние на развитие эмбрионов цыплят и жизнеспособность птенцов в ранний период после вывода, важнейшую роль играют полиненасыщенные жирные кислоты (PUPA) и природные антиоксиданты. Действительно, высокое содержание эндогенных антиоксидантов в яйце и тканях эмбриона может служить основным адаптивным механизмом их защиты от окислительного стресса при вылуплении цыпленка.
Контроль за образованием свободных радикалов и их биологические функции в организме. Свободные радикалы — это атомы, молекулы или любые соединения, содержащие неспаренные электроны (один или более). Большинство биологически значимых свободных радикалов образуются с участием кислорода и азота. Следовательно, в упрощенном виде биологически важные свободные радикалы по существу представляют собой активированные молекулами кислорода или азота. Для жизнедеятельности человека и животных оба эти элемента имеют большое значение, но при определенных обстоятельствах они могут превращаться (направленно или случайно) в молекулы свободных радикалов. Свободные радикалы весьма неустойчивы, очень реактивны и способны повреждать ДНК, белки, липиды или углеводы, а также нарушать сигнальную систему клетки (4). Повреждение ДНК связано с мутациями, ошибками при передаче генетической информации, нарушениями в синтезе белков. В некоторых случаях оно приводит к раку. Повреждения белков вызывают нарушения в транспорте ионов и работе рецепторов, а также обусловливают изменение свойств у ряда важнейших ферментов. Окисление полиненасыщенных жирных кислот модифицирует состав клеточных мембран, их структуру и свойства (текучесть, проницаемость и др.), а также активность мембранно связанных ферментов. Повреждение биологических молекул оказывает заметное отрицательное влияние на рост, развитие, иммунокомпетентность и воспроизводство. В целом, в последние три десятилетия изучение негативного воздействия свободных радикалов на биологические молекулы было главным образом сосредоточено на перекисном окислении липидов как основе наблюдаемого неблагоприятного эффекта. В современных исследованиях все больше внимания уделяется негативному действию свободных радикалов на белки и ДНК (5, 6).
Клетки постоянно подвергаются атакам свободных радикалов, значительная часть которых образуется в процессе нормального обмена веществ, а также как элемент стратегии иммунной системы (с их помощью происходит разрушение вторгающихся микроорганизмов фагоцитами). Например, при нормальных физиологических условиях около 3-5 % кислорода, потребляемого клетками и поступившего в электронно-транспортную цепь митохондрий, может удаляться из нее, превращаясь в свободные радикалы (7). Если учесть, что каждая клетка крысы ежедневно перерабатывает около 1012 молекул О2, то при «утечке» 2 % кислорода это дает около 2X1Q10 реактивных молекул (свободных радикалов) на клетку в сутки. Далее, H.J. Helbock с соавт. (8) доказали, что в сутки в каждой клетке крысы ДНК выдерживает атаку примерно 100 тыс. молекул свободных радикалов и только за счет эндогенных источников повреждения ДНК каждая клетка претерпевает примерно 10 тыс. потенциальных мутагенных изменений (если они не устраняются системой защиты клетки) (9). Некоторые окислительные повреждения не поддаются репарации, и их число с возрастом нарастает. У старых крыс наблюдается около 66 тыс. окислительных повреждений ДНК на клетку (10). Интересные расчеты произвел профессор B. Halliwell (11): согласно его данным, 1-3 % потребленного кислорода может об- разовывать перекисные радикалы. При этом следует учесть, что взрослый организм в состоянии покоя потребляет 3,5 мл О2/кг живой массы в минуту, или 352,8 л/сут (при живой массе 70 кг), или 14,7 моль О2/сут. Таким образом, если всего 1 % потребленного кислорода будет превращаться в радикалы, это составит 0,147 моль/сут, или около 1,72 кг/год. В условиях стресса указанное количество значительно увеличивается. Вдобавок к свободным радикалам, образующимся в процессе естественного обмена кислорода, клетки иммунной системы продуцируют свободные радикалы как средство разрушения патогенов (12). Проведенные расчеты свидетельствуют о том, что в организме образуется значительное количество свободных радикалов, а это значит, что тысячи биологических молекул легко могут повреждаться, если их не защитить.
Природные антиоксиданты (5, 6, 13-15). Для большинства организмов на Земле жизнь без кислорода невозможна. Животные, растения и многие микроорганизмы используют кислород для эффективного образования энергии. Однако высокая концентрация кислорода в атмосфере может оказаться токсичной. Для того чтобы выжить в таких условиях, живые организмы в процессе эволюции выработали специфические механизмы защиты клеток от повреждающего действия свободных радикалов и продуктов их метаболизма, препятствующие накоплению реактивных соединений кислорода (ROS — reactive oxygen species) или азота (RNS — reactive nitrogen species). Важнейшие защитные механизмы формируют антиокисли-тельную систему. Элементы этой системы разнообразны. Она включает природные жирорастворимые антиоксиданты (витамины А, Е, каротиноиды, убихиноны и т.д.), водорастворимые антиоксиданты (аскорбиновая кислота, мочевая кислота, таурин и т.д.), антиокислительные ферменты (глутатионпероксидаза — GSH-Рх, каталаза — САТ и супероксиддисмутаза — СОД), тиоловую редокс-систему, состоящую из системы глутатиона (глута-тион/глутатионредуктаза/глутаредоксин/глутатионпероксидаза) и системы тиоредоксина (тиоредоксин/тиоредоксинпероксидаза/тиоредоксинредуктаза).
Противоокислительные соединения расположены в органеллах, субклеточных компартментах или в межклеточном пространстве и обеспечивают максимальную защиту клеток благодаря многоуровневой организации антиоксидантной системы. На первом уровне предотвращается появление свободных радикалов за счет удаления их предшественников или инактивации катализаторов с участием антиокислительных ферментов — СОД, GSH-Рх и САТ, а также металл-связывающих белков. Поскольку cупероксидные радикалы — основные свободные радикалы, образующиеся в клетках в физиологических условиях, СОД (ЕС 1.15.1.1) считается главным элементом первого уровня антиоксидантной защиты. Этот фермент дисмутирует супероксидный радикал:
2O2 * + 2H+ ----- СОД---- ► H2O2 + O2.
Продукт реакции — перекись водорода подвергается детоксикации ферментами GSH-Рх или САТ с образованием воды. Ионы металла, служащие катализаторами, ускоряют разложение гидроперекисей липидов на такие цитотоксичные продукты, как альдегиды, алкоксильные радикалы и перекисные радикалы. Поэтому металл-связывающие белки (трансферрин, лактоферрин, гаптоглобин, гемопексин, металлотионеин, церулоплазмин, ферритин, альбумин, миоглобин и т.д.) также относятся к первому уровню антиоксидантной защиты. Необходимо учитывать, что железо и медь — сильные стимуляторы свободнорадикальных реакций, следовательно, их доступность в свободной каталитической форме тщательно регулируется in vivo. Поэтому живые организмы обладают способностью безопасно хранить железо и медь в виде комплексов с белками (металлопротеинов). Это предупреждает каталитическое участие металлов в формировании гидроксильных радикалов, что существенно снижает повреждение биологических молекул.
К сожалению, эффективность первого уровня антиоксидантной защиты недостаточна для полного подавления образования свободных радикалов, части из них удается избежать детоксикации и вступить в реакции, приводящие к повреждению липидов, ДНК и белков. Поэтому важен второй уровень защиты, на котором действуют антиоксиданты, обрывающие цепные реакции окисления, — витамин Е, коэнзим Q, каротиноиды, витамин А, аскорбиновая и мочевая кислота и др. Глутатионовая и тиоре-доксиновая системы также играют значительную роль на этом уровне ан-тиокислительной защиты. Перечисленные антиоксиданты максимально ограничивают длину и разветвление свободнорадикальных цепей, тем самым предотвращая распространение реакций переокисления.
Однако даже второй уровень антиоксидантной защиты в клетке не может полностью исключить повреждающее действие ROS и RNS на липиды, белки и ДНК. В этом случае активируется третий уровень защиты, базирующийся на системах, снижающих количество поврежденных клеток или восстанавливающих поврежденные молекулы. Он включает липолитические (липазы), протеолитические (пептидазы или протеазы) и другие ферменты (ферменты, восстанавливающие ДНК, лигазы, нуклеазы, полимеразы, протеиназы, фосфолипазы и различные трансферазы).
Все вышеупомянутые антиоксиданты действуют в тесной взаимосвязи, формируя интегрированную антиоксидантную систему (16). Эффективные взаимодействия между антиоксидантами клетки жизненно важны для максимальной защиты от повреждения свободными радикалами и токсичными продуктами их обмена. Например, установлено, что витамин Е — основной антиоксидант в биологических мембранах, представляющих собой главное звено в противоокислительной системе. Однако витамин Е обычно содержится в очень низких молярных соотношениях (одна молекула на две-три тысячи молекул фосфолипидов), а его дефицит очень трудно воспроизвести во взрослом организме. Это, возможно, происходит из-за способности окисленного витамина Е превращаться в активную исходную форму при реакции с другими антиоксидантами (аскорбиновой кислотой, глутатионом, убихинолами или каротиноидами). Следовательно, антиоксидантная защита клетки зависит не только (и не столько) от количества и местонахождения витамина Е — в значительной степени она обусловлена эффективностью его рециклизации (рис. 1) (17, 18).
Действительно, если подобная рециклизация результативна, даже малых количеств витамина Е достаточно для поддержания высокого уровня антиоксидантной защиты в физиологических условиях. Например, в эмбриональном мозге птиц содержание витамина Е очень низкое, тогда как аскорбиновой кислоты и других элементов рециклизации витамина Е — весьма высокое (19). При этом эффективность противоокислительной защиты очень высока и обнаружить продукты перекисного окисления липидов в свежих образцах ткани не удается (20).
Понимание роли рециклизации антиоксидантов как одного из ключевых механизмов в системе антиоксидантной защиты наиболее важно для эволюции наших представлений о том, каким образом организм противодействует окислительному стрессу. Так, степень регенерации, или рециклизации, радикалов витамина Е может влиять как на эффективность анти- окислительных механизмов, так и на продолжительность функционирования молекул витамина Е в биологических системах (см. рис. 1).
Витамин Е хинон
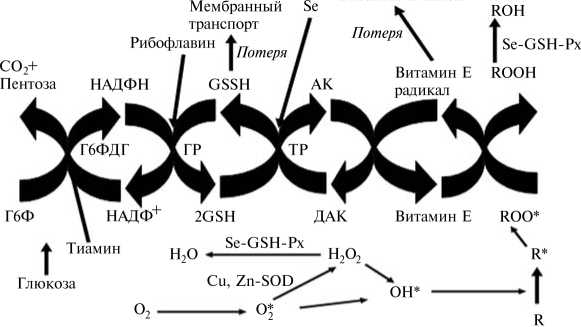
Рис. 1. Схема рециклизации витамина Е в клетке: Г6Ф и Г6ФДГ — глюкозо-6-фосфат и глю-козо-6-фосфатдегидрогеназа, GSH-Px — глутатионпероксидаза, ГР — глутатионредуктаза, ТР — тиоредоксинредуктаза, СОД — супероксиддисмутаза; GSH и GSHH — формы глутатиона (окисленная и восстановленная), АК — аскорбиновая кислота, ДАК — дегидро-аскорбиновая кислота.
Таким образом, антиоксидантная защита включает следующие основные механизмы: снижение содержания кислорода в биологических системах; предотвращение инициирования цепной реакции посредством детоксикации первичных радикалов (с участием СОД, GSH-Рх и каталазы); связывание ионов металлов (металл-связывающие белки); разложение перекисей и превращение их в нерадикальные нетоксичные продукты (Se-GSH-Рх); разрыв свободнорадикальных цепей за счет поглощения промежуточных продуктов обмена радикалов, таких как пероксильные и алкок-сильные радикалы (витамины Е и С, глутатион, мочевая кислота, убихинол, билирубин и т.д.); восстановление и удаление поврежденных молекул. К вспомогательным механизмам, предназначенным для поддержания физиологического обмена в условиях стресса, относятся рециклизация, функции системы редокс-сигнализации и экспрессия витагенов с дополнительным синтезом молекул важных антиоксидантов, включая специфические защитные белки-шапероны (белки теплового шока и т.д.) (21), а также апоптоз, способный удалять поврежденные клетки и ограничивать мутагенез.
Необходимо понимать, что все антиоксиданты в организме функционируют совместно, роль каждого из «членов противоокислительной команды» (рис. 2) хорошо изучена и важна для эффективности других антиоксидантов. Например, активность витамина Е в значительной мере зависит от результативности его рециклизации (см. рис. 1). Действительно, витамин С осуществляет регенерацию витамина Е из окисленной формы, восстанавливая его активность, в то время как глутатион выполняет ту же функцию по отношению к витамину С. Далее, витамины В1 и В2 тоже участвуют в рециклизации витамина Е. Если рацион сбалансирован и содержит достаточные количества антиоксидантов и веществ, необходимых для рециклизации витамина Е, то эффективны даже небольшие дозы такого антиоксиданта, как витамин Е. Однако в условиях окислительного стресса, когда образование свободных радикалов значительно усиливается, трудно предотвратить повреждение основных органов и систем только за счет естественного резерва организма. В частности, требуется повышение содержания в корме природных антиоксидантов, особенно витамина Е, каротиноидов и селена (см. рис. 2). Специалистам по кормлению птицы важно понимать, когда и как необходимо принимать подобные меры и насколько это экономически целесообразно.
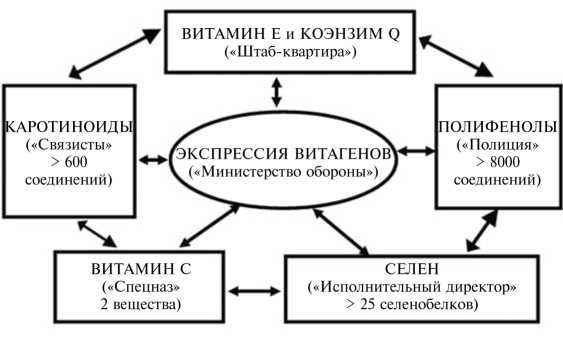
Рис. 2. Система антиоксидантной защиты («противоокислительная команда») в клетке животных.
Антиоксидантная защита развивающегося эмбриона у птицы (5, 13, 14). Показано, что интенсивность обмена веществ и потребление кислорода значительно повышаются в период вылупления цыплят из яйца и сразу после него для обеспечения эндотермии при переходе от дыхания через хориоаллантоис к легочному дыханию (22). Избежать окислительный стресс при таком быстром переходе может помочь сформированная к этому времени эффективная антиоксидантная система. К тому же в липидной фракции эмбриональных тканей цыпленка содержится большое количество полиненасыщенных жирных кислот, высокочувствительных к окислению. Поэтому у свежевылупившихся цыплят в тканях задействован весь спектр механизмов антиоксидантной защиты, в том числе природные антиоксиданты (витамин Е, каротиноиды, аскорбиновая кислота, восстановленный глутатион, коэнзим Q и т.д.) (19, 20, 2325) и ферменты (супеоксиддисмутаза, глутатионпероксидаза, каталаза) (24, 26), а также минеральные сопутствующие факторы (селен, цинк, марганец и железо) (19). Витамин Е, каротиноиды, селен, медь, железо и марганец цыпленок получает от матери через яйцо, другие компоненты синтезируются в его тканях. Необходимо подчеркнуть, что состав рациона родительского стада — основной фактор, предопределяющий развитие антиоксидантной системы в эмбриогенезе и в течение раннего постнатального онтогенеза. Витамин Е, каротиноиды и минеральные элементы, такие как селен, переносятся из корма в яичный желток, а затем в ткани эмбриона. Исследования показывают, что повышенное содержание этих компонентов в рационе родительского поголовья может значительно повысить их содержание в тканях развивающегося цыпленка и заметно снизить чувствительность последних к переокислению липидов (26-28).
Постнатальное развитие цыпленка связано с изменениями стратегии антиокислительной защиты. У евежевылупившегося цыпленка она в основном обеспечивается за счет высокого содержания в тканях природных антиоксидантов, прежде всего витамина Е (27, 29), а иногда (у диких птиц) каротиноидов (30-34). Однако в первые 10 сут после вывода количество витамина Е и каротиноидов в печени цыплят снижается в 20 раз, и то же происходит с индюшатами, утятами и гусятами (23). Чтобы компенсировать подобное снижение, в печени значительно повышается активность GSH-Рх (26). В результате главными факторами антиоксидантной за- щиты в постнатальном онтогенезе становятся противоокислительные ферменты и витагены, отвечающие за эффективную адаптацию птицы к изменяющимся условиям внешней среды (21) и обеспечивающие синтез упомянутых ферментов в нужном количестве, в нужном месте и в нужное время.
Витамин Е в яичном желтке и эмбриональных тканях птицы (13, 29). Витамин Е относится к главным антиоксидантам, содержащимся в яичном желтке, который поступает из корма и попадает в развивающийся эмбрион. У птицы витамин Е осуществляет ряд функций. В частности, он служит основным агентом, обрывающим цепи окисления, локализуясь в биологических мембранах и липидных капельках, где происходит перекисное окисление липидов.
Витамин Е существует в природе в восьми разных формах, включая четыре формы токоферола и четыре — токотриенола. Наибольшей биологической активностью обладает а -токоферол, роль других токоферолов и токотриенолов во многом определяется их защитными свойствами, которые проявляются в желудочно-кишечном тракте (35, 36). Витамин Е всасывается в тонком кишечнике, и эффективность этого процесса зависит от состава рациона, используемой дозы, возраста, пола, других индивидуальных характеристик птицы. В некотором количестве витамин Е накапливается в печени и жировой ткани, однако этого недостаточно для продолжительного удовлетворения потребностей в нем. Например, количество витамина Е, которое выводится из организма несушки с одним яйцом, больше, чем резерв этого соединения в печени (13). В то же время в печени несушки аккумулируется такое же количество витамина А, какое содержится более чем в 100 полноценных яйцах (13).
Неочищенные растительные жиры — богатейший источник витамина Е, тогда как рафинирование масла значительно снижает содержание этого витамина. В птицеводстве его количество в кормовых ингредиентах не учитывается при нормировании, и так называемые гарантирующие добавки витамина Е с премиксом в несколько раз превышают его содержание в кормовых смесях, что обеспечивает удовлетворение потребностей птицы в этом витамине независимо от его содержания в кормовых ингредиентах.
В рацион родительского стада кур мясного направления (кроссы Кобб, Росс и др.) рекомендуется добавлять витамин Е в количестве 100 г/т комбикорма. Доказано, что повышение количества витамина Е (до 250 г/т комбикорма) в рационе кур-несушек снижает отрицательные последствия теплового стресса (27, 37, 38).
Витамин Е неустойчив и легко окисляется. Препараты промышленного производства обычно содержат этерифицированные формы витамина (например, токоферолацетат), которые относительно устойчивы при хранении, но сами по себе не обладают антиоксидантной активностью, превращаясь в активный а -токоферол только после переваривания в тонком кишечнике. Витамин Е нетоксичен, даже высокие его дозы не приводят к гипервитаминозу. Препараты витамина Е сравнительно дороги, и его избыточное введение в корм должно быть экономически обоснованным.
Витамин Е легко переносится в яичный желток, а затем в развивающийся эмбрион (29). Яйца многих видов птиц в дикой природе характеризуются относительно высоким содержанием этого витамина (13, 30, 39). Существует видовая специфичность в отношении его накопления в яйцах: при одинаковом количестве витамина Е в рационе яйца у кур богаче этим витамином, чем у индеек, гусей или уток (23).
Наибольшее накопление витамина Е отмечается при выводе, при- чем накопление витамина Е в печени эмбриона считается механизмом приспособления, обеспечивающим защиту от окислительного стресса в этот критический период (19, 20). В первые 2 нед после вывода, как уже отмечалось, имеет место весьма значительное (в 10-20 раз) снижение содержания витамина Е в печени цыпленка (23).
Накопление витамина Е в яйце определяет статус цыпленка по обеспеченности витамином Е по меньшей мере в 1-ю нед после вывода (13, 19, 20). Следовательно, увеличение содержания витамина Е в рационе родительского поголовья связано с повышенным содержанием этого витамина в яичном желтке и эмбриональных тканях, а также с ростом устойчивости тканей к окислительному стрессу у вылупившихся цыплят (27). Свежевылупившиеся цыплята не обладают способностью эффективно усваивать витамин Е рациона и зависят от его резервов, накопленных в течение эмбрионального развития (13). Альтернативный подход заключается в выпаивании антистрессового препарата, содержащего водорастворимую форму витамина Е, в первые сутки жизни (40, 41), что позволяет быстро восполнить запасы этого витамина и обеспечить необходимую антиоксидантную защиту в важнейший период созревания иммунной системы, формирования структуры и становления функции кишечника.
Добавки витамина Е к рациону родительского поголовья в количестве более 100 г/т корма в производственных условиях, как правило, не приводит к росту продуктивности и улучшению качества яиц (13). Например, в недавних исследованиях не выявлено различий в выводимости между яйцами, полученными при скармливании родительскому стаду кур кормов с добавлением витамина Е в количестве 15, 150 или 300 мг/кг (42), а также 40, 80 или 120 мг/кг (43).
Каротиноиды в яичном желтке и эмбриональных тканях птицы (13, 31-34). Природные каротиноиды были включены в категорию антиоксидантов совсем недавно. Они характеризуются следующими признаками. Это желтые, оранжевые и красные пигменты растений, насекомых, птиц и морских животных. Желтая или оранжевая окраска желтка куриного яйца обусловлена именно каротиноидами. Последние функционируют в организме как составная часть антиокидант-ной системы, обеспечивая рециклизацию других антиоксидантов, в том числе витамина Е (13).
Каротиноиды легко накапливаются в яичном желтке и переносятся из него в развивающийся эмбрион (33, 34). В процессе эмбрионального развития часть аккумулированных в яичном желтке каротиноидов используется в обменных процессах, включая антиоксидантную защиту. Для многих видов птиц в дикой природе характерно высокое накопление каротиноидов в желтке (в 50-10 раз больше, чем в пищевых куриных яйцах) (30, 39). Яйца от кур родительского стада, получающих рацион на основе кукурузы, содержат по меньшей мере вдвое больше каротиноидов, чем яйца от несушек, получающих пшенично-ячменный рацион (44).
Каротиноиды участвуют во многих биохимических процессах и осуществляют различные физиологические функции, в том числе обладают выраженными иммуномодулирующими свойствами и способствуют поддержанию здоровья птицы (45). В наших исследованиях было убедительно доказано, что обусловленная каротиноидами яркая окраска оперения у самцов разных видов птиц в дикой природе указывает на их здоровье, в частности отражает высокую иммунокомпетентность (46).
Потребность животных в каротиноидах точно не установлена. Многие растительные продукты служат богатыми источниками каротиноидов, 10
однако их содержание в продуктах животного происхождения очень низкое. Каротиноиды неустойчивы и быстро окисляются при хранении кормов. Запасы каротиноидов в организме ограничены.
В процессе эмбрионального развития каротиноиды активно переходят из яичного желтка в развивающийся эмбрион с пиком содержания в печени цыпленка ко времени вывода. Как и в случае с витамином Е, подобное накопление считается механизмом приспособления к условиям стресса, связанного с выводом молодняка из яиц (20, 33, 34), и после вывода цыпленка количество каротиноидов в его печени быстро снижается (23). Цыплята из яиц с недостаточным содержанием каротиноидов не способны усваивать их из рациона так же хорошо, как цыплята из яиц, богатых каротиноидами (47, 48). Увеличенное содержание каротиноидов в корме родительского поголовья связано с ростом накопления витамина Е в яичном желтке, тканях эмбриона и повышенной сопротивляемостью птенцов в условиях окислительного стресса (28).
Среди более чем 750 известных каротиноидов кантаксантин занимает особое место, поскольку выявлено его антиоксидантное действие и другие биологически значимые функции. Высокая противоокислительная активность этого каротиноида показана на различных модельных системах in vitro, а также в экспериментах на животных in vivo. В работе, выполненной в Шотландском сельскохозяйственном колледже, мы изучали эффект кантаксантина при включении в рационы племенной птицы (28). Контрольная группа цыплят получала основной рацион с общим количеством ксантофиллов 2 мг/кг корма. В опытных группах к указанному рациону добавляли соответственно кантаксантин (3, 6, 12 и 24 мг/кг). Включение кантаксантина в рацион родительского стада кур приводило к заметному дозозависимому накоплению этого каротиноида в яичном желтке. Его окраска постепенно изменялась от бледно-желтой в контрольной группе до темно-красной у птицы, получавшей кантаксантин в дозе 24 мг/кг. Наиболее важным было установление положительного влияния кантаксантина на накопление витамина Е у развивающихся цыплят. В результате аккумуляции кантаксантина и витамина Е в печени у цыплят (как у 1-суточных, так и 7-суточных особей) значительно снизилась чувствительность тканей к перекисному окислению липидов. Этим исследованием было доказано, что рацион родительского поголовья — основной фактор, определяющий каротиноидный статус потомства на протяжении по меньшей мере 7 сут после вывода. Усиление антиокислительной системы у развивающихся цыплят в результате использования кормовых добавок в рационе родительского стада кур открывает широкие возможности для птицеводства. Как уже отмечалось, постнатальное развитие цыплят относится к критическим периодам для становления основных физиологических систем, включая иммунную, кроме того, на этом этапе онтогенеза высок риск окислительного стресса (13). Таким образом, увеличение количества каротиноидов, в особенности кантаксантина, в рационе родительского поголовья может способствовать поддержанию эффективности противоокислитель-ных систем и высокой жизнеспособности цыплят.
Идея благоприятного влияния добавок кантаксантина (СХ) к корму племенной птицы разрабатывалась далее китайскими исследователями (49). В их экспериментах курам родительского стада на протяжении 24 нед скармливали либо основной рацион, либо тот же рацион с кантаксанти-ном (6 мг/кг корма). Кантаксантин обусловил значительное увеличение интенсивности окраски желтка по шкале Роше (Р < 0,001), что свидетельствует об эффективном переносе СХ из корма в яичные желтки. Обогаще- ние яичного желтка СХ связано с заметным улучшением антиоксидантного статуса желтков (Р < 0,05). Действительно, в яичном желтке содержание малонового диальдегида (МДА) снизилось с 139,83 до 86,92 нмоль/г (Р = 0,023), в то время как общая антиоксидантная способность повысилась с 1,87 до 3,16 U/г (Р < 0,001). У выведенных цыплят анализируемый показатель при добавлении в корм родительского поголовья СХ достоверно возрастал (Р < 0,05). В плазме крови у 1-суточных цыплят наблюдалось значительное снижение количества МДА (с 4,28 до 2,61 нмоль/г, Р < 0,001). Очень важный факт — увеличение (с 98,4 до 144,7 U/мл, Р < 0,05) активности СОД в плазме крови. Интересно подчеркнуть, что добавление СХ в рацион родительского поголовья оказало также положительное влияние на общую антиоксидантную способность у только что выведенных цыплят (показатель увеличился на 33 % — с 13,8 до 18,3 U/мл, Р = 0,052).
В производственном опыте (50) было изучено влияние кантаксан-тина в рационе племенной птицы кросса Росс на антиокислительный статус потомства. Антиокисидантная активность сыворотки крови у 1-суточных цыплят оказалась значительно выше, а интенсивность перекисного окисления липидов — достоверно ниже при добавлении кантак-сантина в рацион родительского поголовья (6 мг/кг). У экспериментальных цыплят наблюдали также более низкий падеж (0 против 4 %) в первые 3 нед (21 сут) после вывода. Таким образом, подтвердилась гипотеза об усилении защиты тканей против окислительного стресса in vivo при включении СХ в рацион родительского поголовья, что может оказаться очень благоприятным фактом для птицеводства.
Следующей ступенью в оценке положительного влияния СХ в рационе родительского стада был эксперимент, проведенный в Бразилии (51). Оказалось, что кантаксантин способен повышать яйценоскость кур в отдельные периоды, однако в целом между двумя группами достоверных различий не наблюдали. Как и в более ранних исследованиях, отмечалось снижение интенсивности перекисного окисления липидов в желтках хранившихся инкубационных яиц от кур, получавших кантаксантин в качестве добавки в рационе. Снижение окисления зарегистрировали в яйцах, подвергавшихся анализу после снесения (Р < 0,05), и в яйцах, хранившихся в течение 4 сут (Р < 0,001), 8 сут (Р < 0,001) и 12 сут (Р < 0,0001).
Наиболее важным результатом обсуждаемого исследования было заключение о положительном влиянии СХ, добавленного в рацион родительского поголовья, на оплодотворенность, выводимость и эмбриональную смертность. По оплодотворенности показатели составили 92,1 против 91,0 % (Р < 0,02), по выводимости — 93,7 против 91,3 % (Р = 0,0003), по эмбриональной смертности — 3,7 против 5,5 % (Р < 0,003). В результате достоверно увеличился вывод молодняка (86,2 против 83,0 %, Р = 0,0001). Что касается эмбриональной смертности на разных стадиях развития эмбрионов, то кантаксантин наиболее эффективно предотвращает ее в первые 48 ч (1,04 против 1,80 %, Р = 0,008), а также с 15-х до 21-х сут инкубации (1,44 против 2,07 %, Р = 0,017). В этом исследовании добавление кантаксантина повышало (Р = 0,0171) оплодотворенность яиц от родительского стада (возможно, за счет лучшего выживания и сохранности спер-миев в репродуктивном тракте кур). Интересно напомнить, что при скармливании курам другого каротиноида, сходного по структуре с кантаксан-тином, — астаксантина (АХ) он тоже переносится в яичный желток и достоверно предотвращает снижение выводимости при хранении яиц (52). В выполненном исследовании после хранения при температуре 21 °С выводимость была достоверно меньше, чем при 10 °С, причем увеличение коли- чества АХ в рационе с 5 до 20 мг/кг постепенно восстанавливало показатели выводимости даже для яиц, хранившихся при 21 °C.
Селен в яичном желтке и эмбриональных тканях птицы (5, 13, 53-56). Селен входит в состав селенопротеинов, включая глутатионпероксидазу (GSH-Рх), тиоредоксинредуктазу (TrxR), иодотиро-ниндеиодиназу (ID) и некоторые другие. В целом в организме человека и животных выявлены в настоящее время 25 селенопротеинов.
Пищевые продукты и кормовые ингредиенты содержат разные количества селена, но в большинстве из них селен в дефиците. Физиологическая потребность в селене невысока, но если она не удовлетворяется, страдает антиоксидантная система, что оказывает губительное влияние на организм животного. В высоких дозах селен токсичен, однако токсичное количество селена в рационе, как правило, в 10-20 раз превышает его фактическое содержание в кормах.
Основными источниками селена для птицы служат различные селеносодержащие аминокислоты, главная из которых — селенометионин (Se-Met), а также неорганические соединения — селениты или селенаты. В целом исследования последних лет показали, что более эффективна органическая форма, однако цена таких добавок все еще достаточно высокая. Следует иметь в виду, что селенит натрия относится к так называемым соединениям ускоренного реагирования, то есть он способствует быстрому синтезу селенопротеинов в условиях селеновой недостаточности. Однако селенит не способен создавать резервы селена в тканях и должен поступать постоянно. В то же время в тканях могут формироваться резервы селенометионина, но при этом синтез селенопротеинов в ответ на его введение в рацион несколько запаздывает. Учитывая новую концепцию борьбы со стрессами (21, 57-65), основанную на выпаивании антистрессового препарата, содержащего оптимальное соотношение обеих форм селена, представляется возможным разрешить дилемму между ценой и эффективностью селеновой добавки в условиях промышленного птицеводства (по крайней мере, при выращивании бройлеров и содержании товарной несушки): при выпаивании препарата в условиях стресса отпадает необходимость создавать запасы селена в организме за счет длительного скармливания средств, содержащих селенометионин.
Количество селена в яичном белке и желтке зависит от содержания и формы селена в рационе. В органах и тканях селен распределяется в следующем порядке: печень > почки > селезенка > сердечная мышца > яйцо > кровь > грудные мышцы (независимо от дозы и источника селена). Материнский селен не только положительно влияет на накопление элемента в эмбриональных тканях цыплят, но и определяет их селеновый статус при выводе и в последующие несколько суток (66).
В последние годы появляется все больше доказательств того, что селен, аккумулированный в яйце, может влиять на экспрессию генов, обусловливающих развитие эмбриона и формирование антиоксидантной системы цыплят при выводе и в раннем постнатальном онтогенезе.
Другие антиоксиданты. Так как аскорбиновая кислота синтезируется в организме цыплят и не содержится в яйцах, ее эффект в отношении качества инкубационных яиц остается под вопросом. Полученные результаты (67) свидетельствуют об отсутствии влияния аскорбиновой кислоты, добавляемой в рацион родительского поголовья, на воспроизводительную способность кур. Однако в условиях стресса она может оказывать положительное воздействие. Предлагаемая стратегия борьбы со стрессами предполагает введение аскорбиновой кислоты как компонента анти- стрессового препарата в комбинации с другими важными элементами антистрессовой защиты (21). Напомним, что L-карнитин, обладающий антиоксидантными свойствами, скармливаемый родительскому поголовью, влияет на качество тушек полученного потомства. В частности, при добавлении L-карнитина к рациону кур уменьшается содержание жира и увеличивается выход грудной мышцы в тушках у потомства при выращивании на высокопитательном рационе (68). Кроме того, возрастает содержание L-карнитина в яичном желтке (Р = 0,001), снижается масса желточного мешка у выведенных цыплят (Р = 0,0001) и содержание липидов в желточном мешке при выводе (Р = 0,01), наконец, изменяется жирнокислотный состав желтка (69). Следовательно, включение карнитина в антистрессовый препарат вполне обосновано (70).
Предпринимались также попытки улучшить качество инкубационных яиц за счет введения в рацион племенной птицы различных растительных экстрактов, эфирных масел и некоторых других компонентов, обладающих антиоксидантными свойствами in vitro. Однако делать выводы об их эффективности пока рано.
Антиоксиданты и стрессы (5, 13, 14, 21). Приведенные в обзоре данные свидетельствуют о том, что, включая в рацион родительского стада кур повышенные дозы витмаина Е, каротиноидов и селена, можно усилить защищенность от окислительного стресса при вылуплении цыпленка и в раннем постнатальном онтогенезе. Тем не менее, следует признать, что полностью справиться с отрицательными последствиями таких стрессов с помощью различных антиоксидантов в корме родительского стада не удается.
В последние годы активное развитие получила концепция адаптации организма к отрицательным факторам внешней среды за счет активации ряда генов, получивших название витагенов. В предыдущем обзоре мы детально остановились на этом вопросе (21). При этом был рекомендован новый антистрессовый препарат, учитывающий возможности активации витагенов различными биологически активными веществами. Как оказалось, под воздействием препарата улучшается развитие цыплят в первые сутки жизни и эффективно преодолевается окислительный стресс, обусловленный незрелостью пищеварительной системы (40, 41). Важнейшую роль предложенная концепция играет в разработке эффективных приемов для защиты от кормовых стрессов, в том числе вызванных такими микотоксинами, как ДОН (60, 61), охратоксин (62, 63) и Т-2 токсин (64, 65), а также для поддержания высокой иммунокомпетентности птицы в условиях стресса (57). Кроме того, антистрессовый препарат нового поколения эффективен при других стрессах (71-73) и улучшает качество скорлупы (72). Отметим, что предложенная концепция также получила развитие в свиноводстве (74): разработанный антистрессовый препарат оказался высокоэффективным средством, позволяющим преодолеть стресс при отъеме поросят (75).
Итак, за последние годы накопилось много экспериментальных данных, подтверждающих, что рацион родительского стада кур оказывает существенное влияние на качество инкубационных яиц и выведенных из них цыплят — на их здоровье, рост и развитие. В частности, родительский рацион предопределяет развитие цыплят в процессе инкубации яиц и в первые несколько суток после вывода. Накопление витамина Е и каротиноидов в печени цыплят в период эмбрионального развития считается адаптивным механизмом приспособления к стрессу при выводе. В постнатальном онтогенезе стратегия антиокислительной защиты меняется от на- копления антиоксидантов к синтезу антиокислительных ферментов при более сложном и эффективном регулировании антиоксидантной защиты на генном уровне. Иммунная и пищеварительная системы цыплят к выводу еще не зрелые и активно развиваются в первые 2 нед после вывода, находясь в условиях риска окислительного стресса и нуждаясь в эффективной противоокислительной защите. Доказано, что повышенное содержание витамина Е, каротиноидов, селена в родительском рационе при их включении в премиксы оказывает благоприятное влияние на эмбриональное и раннее постнатальное развитие цыплят. Тем не менее, справиться с окислительным стрессом при выведении цыплят и в раннем постнатальном онтогенезе только за счет использования антиксидантов в материнском рационе не представляется возможным. Для обеспечения антиоксидантной защиты в раннем постнатальном онтогенеза цыплят, улучшения их роста и развития разработан антистрессовый препарат, выпаиваемый с водой, который успешно прошел промышленные испытания и используется на ряде птицеводческих и свиноводческих предприятий в странах ближнего и дальнего зарубежья.


