Прямая селективная электрокардиостимуляция пучка Гиса: гемодинамические преимущества и отдаленная клиническая перспектива
Автор: Жолковский Александр Владимирович, Скляров Федор Викторович, Чудинов Георгий Викторович, Пономарев Александр Владимирович, Песков Николай Андреевич, Татьянченко Андрей Андреевич, Коршунов Вячеслав Владимирович
Журнал: Клиническая практика @clinpractice
Рубрика: Случай из практики
Статья в выпуске: 1 (29), 2017 года.
Бесплатный доступ
Представлен случай успешной прямой селективной стимуляции пучка Гиса у пациентки с полной блокадой левой ножки пучка Гиса. Приведена методика интраоперационного позиционирования электрода в область пучка Гиса и алгоритм подбора параметров постоянной электрокардиостимуляции. Проведен динамический анализ параметров кардиостимуляции в отдаленном послеоперационном периоде (7 лет).
Пучок гиса, электрокардиостимуляция, эндокардиальный электрод, удаление электрода
Короткий адрес: https://sciup.org/143164631
IDR: 143164631
Текст научной статьи Прямая селективная электрокардиостимуляция пучка Гиса: гемодинамические преимущества и отдаленная клиническая перспектива
Введение.
Постоянная электрокардиостимуляция (ЭКС) за последние десятилетия стала общепризнанным подходом к лечению брадиаритмий. Не менее актуальной является проблема удаления скомпрометированных эндокардиальных электродов (ЭЭ). Однако, принятая в клинической практике стимуляция верхушки правого желудочка (ПЖ), приводит к многочисленным побочным эффектам: электрической и механической асин- хронии левого желудочка (ЛЖ), функциональной недостаточности митрального клапана (МК), систоло-диастолической дисфункции ЛЖ, повышению риска развития жизнеугрожающих нарушений ритма сердца и др., а проблема экстракции ЭЭ при соответствующих медицинских показаниях, по общему признанию, далека от своего разрешения [1,12]. Диссинхрония желудочков, обусловленная постоянной ЭКС ПЖ у пациентов с клинически значимой дисфункцией сину- сового узла и нормальной длительностью комплекса QRS, повышает риск госпитализаций по причине прогрессирующей сердечной недостаточности и фибрилляции предсердий (ФП) [4]. Установлено, что относительное преимущество предсердной стимуляции над двухкамерной у пациентов с дисфункцией синусового узла обусловлено побочными эффектами асинхронной электрической активации левого желудочка под воздействием стимуляции верхушки правого желудочка [5, 6]. В последние годы стало возможным проведение безопасной ЭКС других областей сердца [7]. В частности, прямая стимуляция системы Гиса-Пуркинье вызывает физиологическую деполяризацию желудочков, исключает развитие межжелудочковой и внутрижелудочковой диссинхро-нии, обеспечивает синхронную кинетику и адекватную коаптацию створок атриовентрикулярных клапанов (при отсутствии их дегенеративного поражения и ненарушенной функции папиллярных мышц) [8]. Совершенно очевидно, что в случае физиологической активации и сохранной проводимости неинвалидизированный миокард способен обеспечить максимально возможную фракцию изгнания (фракцию выброса - ФВ) и сердечный индекс (СИ).
В настоящее время ряд авторов, осознавая гемодинамические преимущества прямой стимуляции пучка Гиса, активно используют данный подход в лечении больных с нарушениями ритма сердца. Например,Deshmukh и соавт. показали возможность применения стимуляции пучка Гиса у пациентов с разной степенью нарушений АВ и внутрижелудочковой проводимости, что имеет очевидные преимущества по сравнению с апикальной кардиостимуляцией [9,10].
Клинический случай.
В феврале 2010 г. в РКБ ЮОМЦ ФМБА России поступила женщина 33 лет с клиническими проявлениями хронической сердечной недостаточности III ст. В анамнезе перенесенная в возрасте 11 лет (1988 г.) коррекция врожденного порока сердца – вторичного дефекта межпредсердной перегородки (ДМПП). Было выполнено ушивание ДМПП отдельными швами на синтетических прокладках в условиях искусственного кровообращения.
На момент поступления: состояние больной средней тяжести, жалобы на одышку при минимальной физической нагрузке и периодически в покое, слабость, пастозность стоп и голеней, головокружение, предобморочные состояния. При осмотре: повышенного питания, ИМТ 28, кож- ные покровы бледные, сухие, определяется акроцианоз ногтевых фаланг кистей и стоп. Нижние конечности отечны до уровня коленных суставов. Нижний край печени пальпируется на 3,0 см ниже реберной дуги по среднеключичной линии. Объективно: сердечные тоны приглушены, ритмичны, определяется систолический шум с максимумом звучания в проекции верхушки сердца. Границы относительной сердечной тупости расширены в обе стороны. ЧСС – 60 в мин., пульс – 60 в мин., АД 130/75 мм рт. ст. Гемодинамика стабильна относительно указанных цифр. В легких бронхиальное дыхание, ослаблено в базальных отделах легких, ЧДД 20 в мин. Живот мягкий, безболезненный во всех отделах, стул регулярный, сформированный. Диурез адекватен потребляемой пище и жидкости.
При обследовании: в лабораторных исследованиях обращают на себя внимание умеренная анемия – гемоглобин 105 г/л, ускоренная СОЭ – 18 мм/час по Вестергрену, лекоцитоз – 12,0 х 10*9/л без сдвига лейкоцитарной формулы, повышенный уровень натрийуретического пептида BNP 1302 пг/мл. ЭКГ – ритм синусовый, АВ блокада I ст., PQ 210 мсек., полная блокада левой ножки пучка Гиса (ПБЛНПГ), ширина QRS 160 мсек. При суточном мониторировании ЭКГ выявлена постоянная АВ блокада I ст. с усугублением ее в ночные часы до II ст. 1 и 2 типа Мобитц, максимальный R-R интервал 2020 мсек. Рентгенография органов грудной полости: тень сердца расширена в обе стороны, кардиотора-кальный индекс (КТИ) – 0,65. Результаты ЭхоКг приведены в табл.1.
Таблица 1.
Показатели ЭхоКг при поступлении
|
Показатели |
Значение |
|
Конечно-диастолический размер ЛЖ |
64 мм |
|
Конечно-систолический размер ЛЖ |
45 мм |
|
Конечно-диастолический объем ЛЖ |
195 мл |
|
Конечно-систолический объем ЛЖ |
130 мл |
|
Объем левого предсердия |
88 мл |
|
Объем правого предсердия |
90 мл |
|
ФВ ЛЖ |
33% |
|
Митральная недостаточность |
2-3 ст |
|
Трикуспидальная недостаточность |
2-3 ст |
|
Систолическое давление в легочной артерии |
40 мм ртст |
|
Ударный объем |
45 мл |
|
Межжелудочковая задержка |
55 мсек |
|
СИ |
1,7 л/м² за 1 мин |
Установлен диагноз: Врожденный порок сердца. Вторичный дефект межпредсердной перегородки. Коррекция порока в условиях ИК (1988 г.). Нарушения ритма сердца. Полная блокада левой ножки пучка Гиса. Атриовентрикулярная блокада I ст. Транзиторная атриовентрикулярная блокада II ст. 1 и 2 типа Мобитц. Арит-могенная кардиомиопатия с развитием вторичной дилатации полостей сердца. ХСН III ст. IIIФК NYHA.
Наличие указанного диагноза явилось показанием к имплантации бивентрикулярной ресинхронизирующей электрокардиостимуля-ционной системы.
Операция выполнялась под местным обезболиванием. По принятой в клинике методике, первым этапом имплантируется левожелудочковый электрод. Однако, множественные попытки катетеризации коронарного синуса с использованием как подключичного, так и бедренного доступа, оказались безрезультатны. При этом, в качестве навигационного ориентира использовалось электрофизиологическое картирование треугольника Коха (получен устойчивый спайк пучка Гиса). План операции был изменен.
Через левый подключичный доступ в полость ПП заведена доставляющая система MedtronicSelectSite C304 8,4 F с управляемым кончиком, который позиционирован в непосредственной близости с точкой регистрации потенциала Н. Через просвет доставляющей системы к целевой позиции проведен электрод MedtronicSelectSecure 3830 4,1 F. Проведено монополярное картирование эндокарда в области верхушки треугольника Коха кончиком электрода. В качестве анализатора параметров кардиостимуляции использован программатор Medtronic с блоком PSA 2290 ANALYZER с установкой максимального разрешения амплитуды регистрируемых потенциалов 0,05 мВ/ мм. Электрод позиционирован с помощью механизма активной фиксации в точке наиболее высокоамплитудного потенциала Н. Соотношение спайков А:V=1:4. Чувствительность к R волне 2 mV.Интервал H-V составил 44 мсек. Пробная биполярная декрементная стимуляция от 5 до 1 V при длительности импульса 1 mV позволила установить пороговое значение амплитуды, обеспечивавшей селективную стимуляцию пучка Гиса: 2,4V при длительности импульса 1 ms (рис. 1). При этом отсутствует как захват миокарда ПП, так и локальная деполяризация миокарда ПЖ (fusion).
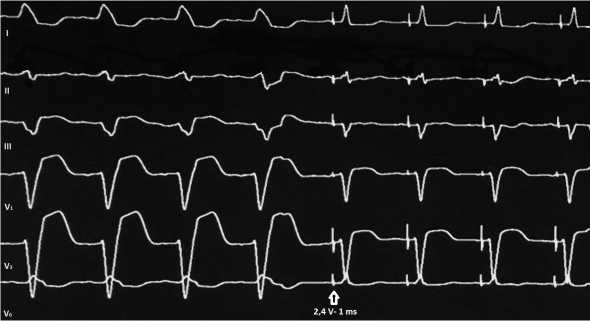
Рис. 1. Интраоперационное фото: исчезновение полной блокады левой ножки пучка Гиса (базовый ритм) в результате прямой селективной стимуляции пучка Гиса.
Система доставки электрода удалена с созданием широкой петли в полости правого предсердия. Имплантирован предсердный электрод с системой активной фиксации (рис. 2).
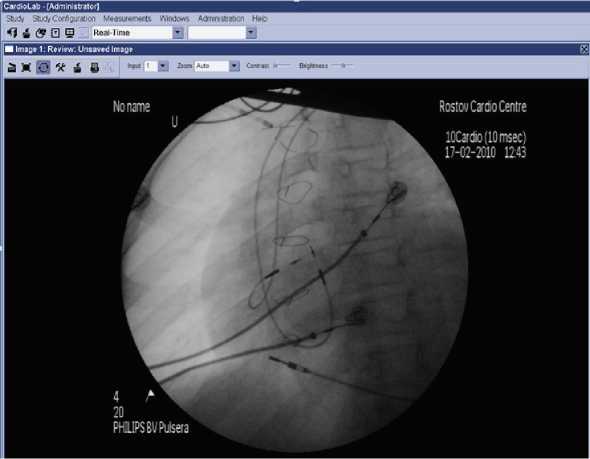
Рис. 2. Интраоперационное фото: расположение эндокардиальных электродов в полости ПП (LAO 30º).
Окончание операции типичное. Установлен режим стимуляции DDD с базовым интервалом стимуляции 1000 мсек. АВ задержка была запрограммирована в 100 мсек., что с учетом H-V интервала соответствовало 144 мсек. Остальные параметры кардиостимуляции отражены в табл. №2.
В процессе послеоперационного наблюдения определенную тревогу внушало то обстоятельство, что нельзя было запрограммировать амплитуду на желудочковом канале с двукратным превышением порога стимуляции – при этом наблюдался захват (fusion) артифициаль-ным стимулом миокарда ПЖ, усиление регургитации на МК и ТК, расширение комплекса QRS.
Таблица 2.
Параметры кардиоситмуляции в послеоперационном периоде
|
Параметр |
А |
V |
|
Амплитуда стимулирующего импульса (V) |
1,5 |
3,0 |
|
Полярность стимуляции |
Моно |
Моно |
|
Чувствительность (mV) |
1,0 |
1,5 |
|
Полярность чувствительности |
Би |
Би |
|
Импеданс электрода (Ом) |
620 |
640 |
|
SlewRate (µV/µs-определена интраоперационно). |
n/a |
3,1 |
В этой связи послеоперационное наблюдение и программирование предполагалось проводить еженедельно. Однако, уже на вторые сутки послеоперационного периода порог стимуляции по желудочковому каналу снизился до 1,25V и остается на этом уровне до настоящего времени (в течении 2010-2011 гг. послеоперационное наблюдение и программирование выполнялось ежемесячно, в последующем – 2 раза в год).
В настоящее время (февраль 2017 г.), при сохраняющейся узкокомплексной морфологии QRS (рис.3), пациентка не предъявляет жалоб, придерживается активного образа жизни, у больной отсутствуют проявления ХСН, ФВ ЛЖ стабилизировалась на уровне 48%.
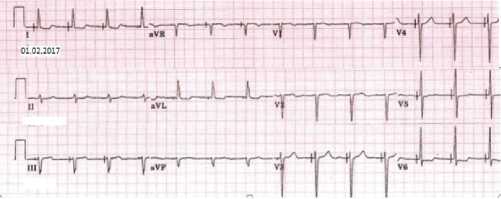
Рис. 3. ЭКГ пациентки с прямой селективной стимуляцией пучка Гиса спустя 7 лет с момента имплантации двухкамерной ЭКС системы.
Обсуждение.
Идея прямой стимуляции пучка Гиса не нова и уже давно будоражит научно-практическое кардиологическое сообщество своими очевидными преимуществами над типичной правожелудочковой кардиостимуляцией. Достижение этой цели стало возможным в последние 10-12 лет благодаря развитию медицинских технологий и усовершенствованию как расходных материалов, так и навигационного оборудования. Тем не менее, массового распространения методика не получила по ряду причин, среди которых и сложность технического выполне- ния прямой селективной стимуляции пучка Гиса, и существенное удорожание рутинной процедуры, и определенный скепсис и настороженность в отношении новой методики со стороны практиков. В этой связи уместно привести наблюдение, опубликованное группой авторов из университетской клиники Вермонта (США) в 2012 г. [12].
Исследован секционный материал, полученный при вскрытии 81-летнего пациента, чья смерть наступила в результате сепсиса, развившегося на фоне облитерирующей артериальной патологии нижних конечностей. За 2 года до смерти больному была выполнена имплантация ЭКС системы с позиционированием одного из желудочковых электродов в область пучка Гиса (рис. 4).
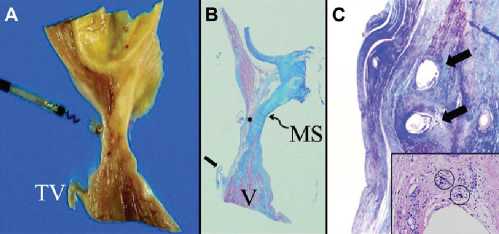
Рис. 4. Секционный материал. Микрофото и микроскопия. А. Область фиксации эндокардиального электрода (выкручен) в проекции мембранозной части МЖП. Расстояние между остатками периэлектродной фиброзной ткани и ТК - 9 мм. В. Поперечный срез этой области с фиксацией по Masson: фиброзная и рубцовая ткань окрашены в голубой цвет, миокард - в розовый. Стрелкой показана септальная створка ТК. С. Отверстия, оставленные спиралью активной фиксации эндокардиального электрода в проекции пучка Гиса. CircArrhythmElectrophysiol 2012; Vol 5:245.
Но если технический аспект вмешательства не оставляет сомнений, то с электрофизиологической позиции обеспечение надежной стимуляции пучка Гиса возможно не всегда. Во-первых, существует проблема предсердного оверсенсинга и желудочкового гипосенсинга. Идеальной возможностью осуществить прямую селективную стимуляцию пучка Гиса для оператора является ситуация, при которой наблюдается 3-5 кратная разница числовых значений чувствительности к P и R волне, например, 0,5 и 2,0 mV соответственно. В этом случае предсердный сенсинг осуществляется предсердным электродом, как в нашем наблюдении. Для преодоления ситуации в случае желудочкового гипосенсинга (интраоперационная амплитуда R волны 1 mV и ниже) необходима имплантация 3-камер- ной ресинхронизирующей ЭКС системы с позиционированием второго желудочкового электрода в среднюю часть межжелудочковой перегородки с программированием межжелудоко-вой задержки His→RV=80-100 мсек. В этом случае, при корректной работе ЭКС системы, стимуляция межжелудочковой перегородки будет осуществляться в абсолютный рефрактерный период миокарда желудочков, а в случае дислокации электрода, стимулирующего пучок Гиса, обеспечит страховочную (back-up) стимуляцию ПЖ.
Наконец, немаловажным аспектом данной медицинской проблемы является вероятность возникновения показаний к удалению эндокардиального электрода в будущем. На секционном фото (рис. 4, А) видно, что периэлектрод-ные соединительнотканные сращения выражены минимально. Вероятно, это связано как с методикой имплантации электрода (перпендикулярно к плоскости эндокарда в целевой точке), так и с анатомической локализацией пучка Гиса в непосредственной близости с центральным фиброзным телом и мембранозной частью МЖП. Скудно васкуляризированная соединительная ткань в составе пучка Гиса (коллагеновые волокна) и окружающих анатомических областей (фиброзные волокна) ограничивают степень выраженности неспецифического асептического воспаления в зоне электрод-эндокардиального контакта и препятствуют формированию плотных периэлектрод-ных сращений. Это обстоятельство, в свою очередь, существенно облегчает экстрацию ском- прометированного эндокардиального электрода, в случае возникновения показаний.
Заключение.
Приведенный клинический опыт, как и данные мировой литературы, позволяют надеяться на широкое практическое внедрение прямой селективной электрокардиостимуляции пучка Гиса. Несомненно, в случае технического успеха, подобная методика обеспечивает наиболее физиологическую стимуляцию миокарда желудочков при таких патологических состояниях как полная блокада ножек пучка Гиса и/ или предсердно-желудочковые блокады различных градаций. В то же время, имеются серьезные вызовы, связанные с электрофизиологическими особенностями целевой анатомической области. Преодоление такого рода проблем должно основываться не только на хирургическом искусстве оператора, но и на специальном техническом оснащении. В обозримой перспективе можно ожидать разработки специальных трехкамерных ЭКС систем с более прецизионным подбором параметров чувствительности и усовершенствованными алгоритмами кардиостимуляции. По мере накопления опыта возможно также появление специальной конструкции эндокардиального электрода для прямой стимуляции пучка Гиса. Наконец, перспективным навигационным инструментом представляется внутрисердечный ультразвук. Все сказанное позволяет надеяться на дальнейший прогресс затронутой проблемы и ее переход из области казуистических наблюдений в реальную клиническую практику.
Список литературы Прямая селективная электрокардиостимуляция пучка Гиса: гемодинамические преимущества и отдаленная клиническая перспектива
- Чудинов Г.В. Удаление электродов для электротерапии аритмий. Saarbrücken, Deutschland. LAP, 2013.100 p.
- Lamas GA, Lee KL, Sweeney MO, et al. MOST Investigators Ventricular pacing or dual chamber pacing for sinus node dysfunction N Engl J Med 2002;346:1854-1862.
- Sharma AD, Rizo-Patron C, Hallstrom AP, et al. DAVID Investigators Percent right ventricular pacing predicts outcomes in the DAVID Trial Heart Rhythm 2005;2:830-834.
- Sweeney MO, Prinzen FW. A new paradigm for physiologic ventricular pacing J Am Coll Cardiol 2006;47:282-288.
- Victor F, Mabo P, et al. A randomized comparison of permanent septal versus apical right ventricular pacing: short-term results. J Cardiovasc Electrophysiol 2006;17:238-42.
- De Cock CC, Giudici MC, Twisk J. Comparison of the haemodynamic effects of right ventricular outflow-tract pacing with right ventricular apex pacinga quantitative review. Europace 2003;5:275-278.
- Yee R, Klein GJ, Krahn AC, Skanes AC. Selective site pacing: tools and training. Pacing Clin Electrophysiol 2004;27:894-6.
- Occhetta E, Bortnik M, Magnani A, et al. Prevention of ventricular desynchronization by permanent para-Hisian pacing after atrioventricular node ablation in chronic atrial fibrillation: a crossover, blinded, randomized study versus apical right ventricular pacing. J Am Coll Cardiol 2006;47:1938-45.
- Deshmukh P, Casavant DA, Romanyshyn M, Anderson K. Permanent, direct His-bundle pacing: a novel approach to cardiac pacing in patients with normal His-Purkinje activation. Circulation 2000;101: 869-77.
- Deshmukh P, Romanyshyn M. Direct His-bundle pacing: present and future. Pacing ClinElectrophysiol. 2004;27:862-870.
- Lu F, Iaizzo PA, et al. Isolated Atrial Segment Pacing: An Alternative to His Bundle Pacing After Atrioventricular Junctional Ablation. J Am Coll Cardiol 2007;49:1443-1449.
- Correa de Sa D, Hardin NJ, Crespo EM, Nicholas KB,Lustgarten DL. Autopsy analysis of the implantation site of a permanent selective direct His-bundle pacing lead. Circ Arrhythm Electrophysiol 2012; Vol. 5:244-246.


