Проблема сочетания метаболического синдрома и подагры
Автор: Польская Ирина Игоревна, Марусенко Ирина Михайловна, Везикова Наталья Николаевна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Медицинские науки
Статья в выпуске: 8 (113), 2010 года.
Бесплатный доступ
Подагра, метаболический синдром, гиперурикемия, абдоминальное ожирение, кардиоваскулярный риск
Короткий адрес: https://sciup.org/14749812
IDR: 14749812
Текст статьи Проблема сочетания метаболического синдрома и подагры
Подагра - системное заболевание, при котором в различных тканях откладываются кристаллы моноурата натрия и у лиц с гиперурикемией развивается воспаление, обусловленное внешнесредовыми и/или генетическими факторами [3].
По экспертным оценкам, распространенность подагры колеблется от 1 до 3 %. Заболеваемость подагрой составляет в различных популяциях от 5 до 50 случаев на 1000 мужчин и 1-9 случаев на 1000 женщин. Соотношение мужчин и женщин составляет 7:1. Пик заболеваемости отмечают в 40-50 лет у мужчин, 60 лет и старше у женщин.
Современные эпидемиологические данные свидетельствуют об истинном увеличении распространенности болезни [6]. В ряде работ показано, что заболеваемость подагрой удвоилась за последние 10-20 лет [6], [12].
В основе прогрессирования подагры лежит неконтролируемая гиперурикемия. Ранее гиперурикемией считали уровень мочевой кислоты (МК) выше 420 мкмоль/л, однако Европейская лига по борьбе с ревматизмом рекомендует считать гипер-урикемией уровень МК выше 360 мкмоль/л (6 мг/дл), что основано на результатах исследований, продемонстрировавших 4-кратное повышение риска развития подагры у мужчин и 17-кратное у женщин при превышении указанного уровня сывороточной мочевой кислоты [15; 501]. В течении заболевания выделяют 3 периода: острый артрит, межприступный период, хроническая тофусная подагра.
В настоящее время подагра рассматривается как одна из актуальных общемедицинских проблем [10; 12]. В связи с этим в последнее время акценты в изучении подагры смещены в направлении исследования влияния гиперурикемии на прогрессирование атеросклеротического поражения сосудов.
Достоверно доказано, что клинические проявления подагры не ограничиваются поражением опорно-двигательного аппарата и почек. У значительной части больных подагрой определяется избыточная масса тела, абдоминальное ожирение [11], выявляются нарушения липидного и углеводного обмена (нарушение толерантности к глюкозе (НТГ) или сахарный диабета 2-го типа (СД 2), артериальная гипертензия (АГ)) [4]. Все вышеперечисленные нарушения являются основными компонентами МС.
Согласно новому предложению Международной федерации диабета (2005), при диагностике МС абдоминальное ожирение (окружность талии (ОТ) более 94 см для мужчин и более 80 см для женщин европеоидной расы) рассматривается как главный компонент МС. К остальным компонентам относятся: гипергликемия выше 5,6 ммоль/л, гипертриглицеридемия выше 1,7 ммоль/л, низкий уровень ХС ЛПВП (холестерин липопротеидов высокой плотности) (ниже 1 ммоль/л для мужчин и 1,2 ммоль/л для женщин), АГ (артериальное давление (АД) выше 130/85 мм рт. ст.). О необходимости изучения взаимодействия МС и подагры свидетельствуют и данные о росте в популяции заболеваемости подагрой, снижение возраста дебюта заболевания [8], [6], [7].
Настоящее исследование было предпринято с целью изучения распро страненности метаболического синдрома, оценки суммарного риска развития кардиоваскулярной патологии, а также влияния этих состояний на течение суставного синдрома у больных подагрой.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включено 56 пациентов, среди них 43 (77 %) мужчины и 13 женщин (23 %), обратившихся в ревматологическое отделение Республиканской больницы г. Петрозаводска в период с ноября 2007 года по сентябрь 2009 года с достоверным диагнозом подагры по критериям S. Wallace (1977) [13]. Средний возраст пациентов мужского пола составил 56,4 ± 15,4 года, женского – 58,9 ± 8,7 года. Возраст пациентов в дебюте заболевания равнялся в среднем 53,1 ± 9,7 года для женщин и 46,8 ± 14 лет для мужчин. Длительность болезни на момент обращения составила 5,8 ± 4 года для женщин и 7,6 ± 6,3 года для мужчин (от 6 месяцев до 33 лет). Частота рецидивов артрита за последний год болезни – 1,2 (1,0–4,0) для женщин и 2,83 (1,0–12,0) для мужчин. В среднем за все время болезни отмечалось поражение 7,5 (1,0–24,0) сустава для мужчин и 5,4 (3,0–24,0) сустава для женщин.
На момент первого осмотра только у 1 мужчины (2 %) был диагностирован острый подагрический артрит, у 20 (36 %) пациентов артрит носил затяжной характер (длительностью от 3 недель до 3 месяцев), у 35 (62 %) больных диагностирована хроническая тофусная подагра (рис. 1). Лечение аллопуринолом (от 1 недели до 1 года и более) получали 43 (77 %) больных.
Клинические методы исследования включали оценку суставного синдрома, наличия тофусов, индекса массы тела, окружности талии, уровня артериального давления. Всем пациентам выполнялось исследование уровня мочевой кислоты, уровня глюкозы плазмы натощак и постпранди-альной гликемии, креатинина, общего холестерина (ОХС), липопротеидов низкой плотности (ЛПНП), липопротеидов высокой плотности, триглицеридов (ТГ), С-реактивного белка, фибриногена, скорости оседания эритроцитов (СОЭ).
Метаболический синдром диагностировался на основании критериев Международной федерации диабета (2005). Для определения суммарного коронарного риска (СКР) была использована шкала SCORE, учитывающая возраст, пол, статус курения, уровень систолического артериального давления (САД), ОХС пациентов . Статистическую обработку проводили с использованием общепринятых методов статистики с помощью стандартно -го пакета программ прикладного статистического анализа (Statistica for Windows v. 6.0).
РЕЗУЛЬТАТЫ
АГ имела место у 53 (94 %) больных. Из них у 19 (35 %) больных была диагностирована АГ 1-й степени, у 24 (47 %) пациентов – АГ 2-й степени, у 10 (18 %) человек – АГ 3-й степени. Ишемическая болезнь сердца (ИБС) была выявлена у 12 (21 %) пациентов. У 8 (60 %) женщин и 25 (58 %) мужчин диагностировано абдоминальное ожирение на ос- новании оценки окружности талии . Среди них метаболический синдром был диагностирован у 100 % больных (33 человека), что составило 59 % от общего числа обследованных больных.
СД 2-го типа был диагностирован у 12 (21 %) обследованных пациентов с подагрой, среди них 9 пациентов с метаболическим синдромом (78 %). Повышение уровня триглицеридов выявлялось у 34 человек (60,4 %), причем у 21 (62 %) из них диагностирован метаболический синдром (рис. 2).
Частота факторов риска кардиоваскулярных катастроф в исследуемой группе больных представлена в табл. 1.
Среди основных факторов риска чаще выявлялись повышение уровня ОХС (общий холестерин), холестерина ЛПНП, систолического артериального давления, реже – возраст и увеличение уровня триглицеридов . У подавляющего большинства больных выявлено увеличение индекса массы тела (ИМТ). Средний вес составил 87,9 ± 16,9 кг (от 43 до 120 кг). Только у 9 (16 %) пациентов вес соответствовал норме, у 19 (35 %) выявлено ожирение 1-й степени, 26 (47 %) пациентов страдали ожирением 2-й степени, 1 (2 %) человек – ожирением 3-й степени.
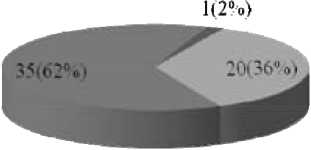
О. артрит Хр. подагрический артрит ■ Хр. тофусная подагра
Рис. 1. Вариант подагрического артрита

МС нет МС
Рис. 2. Частота диагностики метаболического синдрома
Таблица 1
Частота встречаемости факторов риска
|
ССЗ у больных подагрой (n = 56) |
||
|
Факторы риска |
n (%) Пациенты без МС |
n (%) Пациенты с МС |
|
Возраст > 55 лет для мужчин и > 65 для женщин |
13 (55 %) |
14 (44 %) |
|
ОХС > 5,0 моль/л |
17 (72 %) |
24 (72 %) |
|
ХС-ЛВП ≤ 1 моль/л |
9 (38 %) |
11 (32 %) |
|
Курение |
5 (22 %) |
6 (20 %) |
|
САД > 140 мм рт. ст. |
20 (88 %) |
34 (96 %) |
|
Сахарный диабет |
2 (11 %) |
9 (28 %) |
|
ТГ >1,7 ммоль/л |
13 (55 %) |
21 (64 %) |
|
ИМТ > 25 |
15 (66 %) |
32 (96 %) |
|
ОТ > 94 см для мужчин и > 80 см для женщин |
0 |
33 (100 %) |
|
НТГ |
4 (16 %) |
2 (8 %) |
|
ХС ЛПНП >3 ммоль/л |
15 (66 %) |
30 (92 %) |
Таблица 2
Клиническая характеристика больных подагрой в зависимости от наличия МС
|
Клиническая характеристика |
Больные без |
Больные с |
|
МС, n = 23 |
МС, n = 33 |
|
|
Длительность болезни, годы |
10,6 ± 7,6 |
4,8 ± 4,1 |
|
Возраст дебюта подагры, годы |
48,9 ± 11,9 |
47,4 ± 12,7 |
|
Количество пораженных за все |
7,9 ± 6,2 |
7,4 ± 5,9 |
|
время болезни суставов, n |
||
|
Число атак артрита |
2,8 ± 2,6 |
7,4 ± 3,01 |
|
за последний год болезни, n |
||
|
Терапия аллопуринолом, n |
14 |
29 |
|
Гипопуриновая диета |
10 |
21 |
|
Длительность последнего |
2,16 ± 1,2 |
2,76 ± 2,36 |
|
обострения, n |
При этом у пациентов с метаболическим синдромом достоверно чаще выявлялось ожирение (в 100 % случаев абдоминальный тип), увеличение ЛПНП, ОХС, триглицеридов и снижение ЛПВП.
При оценке сывороточного уровня мочевой кислоты у пациентов 2 групп выявлено, что у больных с метаболическим синдромом в среднем концентрация МК сыворотки несколько выше (484,5 ± 118) в сравнении с группой пациентов без метаболического синдрома (478,7 ± 147,3).
У 11 человек (20 %) риск ССЗ был оценен как очень высокий (10–15 %), у 16 человек (28 %) – как средний (5–9 %), у 22 человек (40 %) – как умеренный (2–5 %) и только у 7 (12 %) пациентов риск ССЗ составил < 2 %.
Кроме того, проведена оценка связи метаболического синдрома и клинических особенностей течения подагры, данные представлены в табл. 2.
Средний возраст дебюта в двух сравниваемых группах существенно не отличался. У пациентов с метаболическим синдромом суставной синдром характеризовался существенно большей частотой обострений и большей длительностью атак несмотря на суммарно меньший стаж болезни. Значимой разницы в приверженности к терапии аллопуринолом в 2 группах не было выявлено.
Также хотелось бы отметить, что в группе больных подагрой с диагностированным метаболическим синдром существенно большее число пациентов указывали на свою строгую приверженность к гипопуриновой диете. Этот факт может быть связан со строгим ограничением больных в мясе и рыбе и расширением диеты за счет легкоусвояемых углеводов (каш, сдобы, молочных продуктов).
ОБСУЖДЕНИЕ
По данным разных авторов, распространенность МС в популяции колеблется от 5 до 20 % [5]. У больных подагрой частота МС достигает 67,8 % [1], [2; 24]. Полученные нами данные соответствуют литературным (59 %). У больных подагрой без МС уровень мочевой кислоты сыворотки достоверно ниже, чем при его наличии [2; 24], что также соответствует литературным данным.
АГ, по разным данным, присутствует у 25– 50 % пациентов с подагрой, в нашем же случае частота артериальной гипертензии была значительно выше и встречалась у подавляющего числа больных вне зависимости от наличия метаболического синдрома (94 %).
Нарушения толерантности к глюкозе СД 2-го типа в разных исследованиях встречались у 7– 74 % больных с подагрой, данные исследования соответствуют литературным. С 1960-х годов появляются описания гипертриглицеридемии у 75–84 % больных подагрой. По нашим данным, повышение триглицеридов выявлено у несколько меньшего процента больных (60,4 %), при этом в большинстве случаев среди пациентов с метаболическим синдромом.
Необходимо отметить, что, по данным эпидемиологических исследований, сочетание двух, трех или более факторов у одного больного существенно повышает риск кардиоваскулярных катастроф [14; 937]. При этом сочетание нескольких, даже умеренно выраженных, кардиоваскулярных факторов риска прогностически более неблагоприятно, чем существенное нарастание одного из них [9; 2012]. По данным исследования, наличие подагры, и в большей степени подагры в сочетании с метаболическим синдромом, ассоциируется с высоким суммарным коронарным риском. Для 11 человек (20 %) риск сердечно-сосудистых заболеваний был оценен как очень высокий (10–15 %), для 16 человек (28 %) – как средний (5–9 %), для 22 человек (40 %) – как умеренный (2–5 %) и только для 7 (12 %) пациентов риск сердечнососудистых осложнений составил < 2 %.
У пациентов с МС суставной синдром характеризовался существенно большей частотой обострений и большей длительностью атак несмотря на суммарно меньший стаж болезни. Данные результаты наиболее вероятно объясняются достоверно более высоким уровнем мочевой кислоты сыворотки у пациентов с МС.
Приверженность к гипоурикемической терапии аллопуринолом в обеих группах оказалась низкой, в то время как в группе больных подагрой с диагностированным МС существенно большее число пациентов указывали на свою строгую приверженность к гипопуриновой диете (60 %). Однако необходимо отметить, что данный факт существенно не влиял на уровень мочевой кислоты сыворотки и характер суставного синдрома.
В целом полученные в ходе исследования данные соответствуют литературным.
ЗАКЛЮЧЕНИЕ
Таким образом, метаболический синдром широко распространен среди пациентов с подагрой. Наличие изолированного метаболического синдрома, а также сочетание его с другими факторами риска увеличивают вероятность развития кардиоваскулярных заболеваний у пациентов с подагрой. Данное состояние ассоциируется с более неблаго- приятным течением суставного синдрома. Основываясь на полученных данных, отметим необходимость комплексного обследования пациентов с подагрой, направленного на выявление основных факторов риска сердечно-сосудистых заболеваний и критериев метаболического синдрома.
Список литературы Проблема сочетания метаболического синдрома и подагры
- Барскова В. Г., Елисеев М. С., Насонов Е. Л. и др. Применение метформина (сиофора) у пациентов с подагрой и инсулинорезистентностью (предварительные данные 6-месячного наблюдения)//Терапевтический архив. 2005. № 12. С. 44-48.
- Елисеев М. С. Синдром инсулинорезистентности при подагре: Автореф. дис. … канд. мед. наук. М., 2006. 24 с.
- Насонова В. А., Барскова В. Г. Ранние диагностика и лечение подагры -научно обоснованное требование улучшения трудового и жизненного прогноза больных//Научно-практическая ревматология. 2004. № 1. C. 5-7.
- Тареев Е. М. Гипертоническая болезнь. М.: Медгиз, 1948. 156 с.
- Чазова И. Е., Мычка В. Б. Метаболический синдром и артериальная гипертензия//Артериальная гипертензия. 2002. № 7. С. 7-10
- Arromdee E., Michet C. J., Crowson C. S. et al. Epidemiology of Gout: Is the Incidence Rising?//J. Rheumatol. 2002. Vol. 29. P. 2403-2406.
- Chen S. Y., Chen C. L., Shen M. L. et al. Trends in the manifestations of gout in Taiwan//Rheumatology (Oxford). 2003. Vol. 42. P. 1529-1533.
- Harris C. M., Lloyd D. C., Lewis J. The prevalence and prophylaxis of gout in England//J. Clin. Epidemiol. 1995. Vol. 48. P. 1153-1158.
- Stamler J., Stamler R., Neaton J. D. et al. Low risk-factor profile and long-term cardiovascular and noncardiovascular mortality and life expectancy: findings for 5 large cohorts of young adult and middle-aged men and women//Journal of the American medical association. 1999. Vol. 282. P. 2012.
- Terkeltaub R. A. Gout. Epidemiology, pathology, and pathogenesis // Primer on the rheumatic diseases. 12th ed. Atlanta / Ed. Klippel J. H., Crofford L., Stone J. H. et al. // Arthritis Foundation. 2001. Vol. 307. P. 12.
- Vague J. The degree of masculine differentiation of obesities, a factor determining predisposition to diabetes, atherosclerosis, gout and uric calculous disease//Am. J. Clin. Nutr. 1956. Vol. 4(2). P. 20-34.
- Wallace K. L., Riedel A. A., Joseph -Ridge N., Wortmann R. Increasing prevalence of gout and hyperuricemia over 10 years among older adult in a managed care population//J. Rheumatol. 2004. Vol. 31. P. 1582-1587.
- Wal lace S. L., Robinson H., Masi A. T. et al. Preliminary criteria for the classification of the acute arthritis of gout//Arthritis Rheum. 1977. Vol. 20. P. 895-900.
- Yusuf S., Hawken S., Ounpuu S. et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study//Lancet. 2004. Vol. 364. P. 937.
- Zhang W., Doherty M., Pascual -Gomez E. et al. EULAR evidence based recommendation for the diagnosis and management of gout//Ann. Rheum. Dis. 2005. Vol. 64 (Suppl III). P. 501.


