Проблемы аттестации оборудования критических зон при производстве готовых лекарственных средств и медицинских иммунобиологических препаратов
Автор: Казьянин А.В., Орлова Е.В., Кутковой В.Б.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Организация производства медицинских препаратов
Статья в выпуске: 2-2 т.26, 2011 года.
Бесплатный доступ
В статье представлены материалы, касающиеся аттестации комплексного технологического оборудования критических зон при производстве, как медицинских иммунобиологических препаратов, так и готовых лекарственных средств.
Оборудование, критические зоны, комплексные линии, медицинские иммунобиологические препараты
Короткий адрес: https://sciup.org/14919494
IDR: 14919494 | УДК: 615.014.24
Текст научной статьи Проблемы аттестации оборудования критических зон при производстве готовых лекарственных средств и медицинских иммунобиологических препаратов
Предприятию-производителю медицинских иммунобиологических препаратов (МИБП) и готовых лекарственных средств (ГЛС) приходиться решать проблемные вопросы, связанные с аттестацией комплексных поточных линий критических зон, участвующих в финишных технологических процессах.
В настоящее время нет четких системных требований по аттестации оборудования, использующегося для про- изводства МИБП и ГЛС, все требования определяются указаниями нормативных документов – ГОСТ Р 52249, Санитарные правила СП 3.3.2.1288-03, ГОСТы серии Р ИСО [1, 2, 5]. Но в данных документах представлены общие требования к оборудованию, а на практике приходится сталкиваться с ситуациями, когда однотипное оборудование приходиться аттестовывать разными способами.
В связи с этим, целью нашей работы явилась разработка четкого алгоритма действий для решения вопросов по аттестации комплексного оборудования, используемого для производства детских вакцин, входящих в график Национального календаря прививок (АКДС-вак-цина, АДС-М-анатоксин) и готовых лекарственных средств (лидаза, кокарбоксилазы гидрохлорид).
Материал и методы
В работе использовались физико-инструментальные методы исследования для контроля параметров технологического оборудования: измерение температурного поля специальными приборами Альфалог и Технограф, измерение номинального объема препарата при помощи калиброванных шприцев. Также использовались методики выполнения измерений, рекомендуемые нормативными документами для проведения аттестационных работ – ОСТ 42-510-98, МУ 44-116 [3, 4].
зации, наполнения, сублимации и герметизации ампул объемом 2,3 мл, для производства препаратов лидазы, кокарбоксилазы гидрохлорида, даларгина.
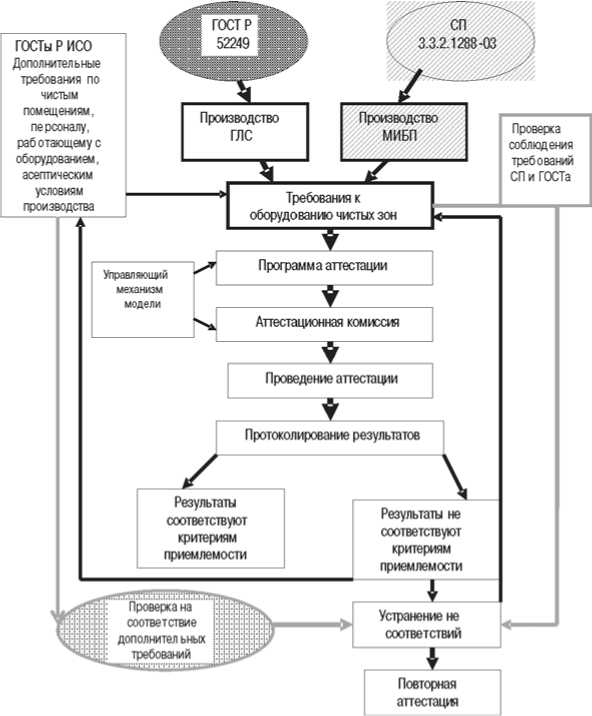
Для осуществления процесса валидации комплексного типового оборудования разработали модель алгоритма аттестации, представленную на рисунке 1.
В соответствии с разработанным алгоритмом каждую составляющую единицу оборудования комплексных линий подвергли аттестации. Большинство единиц аттес-товывали по типовым стадиям – монтаж – IQ (Installation Qualification), оснащенное состояние – OQ (Operational Qualification), функционирующее состояние PQ (Performance Qualification). В ряде случаев возникла необходимость в проведении аттестации процесса – PV (Process Validation).
Эта необходимость определялась управляющим механизмом модели – программой и комиссией по аттестации, результаты представлены в таблице.
Как видно из данных, представленных в таблице, для оборудования комплексных линий, производящих МИБП, необходимо моделирование процедуры асептического розлива.
Результаты и обсуждение
На предприятии используются 5 комплексных линий оснащенных оборудованием фирмы Роберт Бош (Германия) и Мако-фар (Италия). В составе этих линий установлено типовое моечное, разливо-запаячное и стерилизационное оборудование.
Пример состава и размещения линии по классам чистоты для производства комбинированных вакцин и анатоксинов:
-
1. Линия БОШ 2: Моечная машина RRU 3040, зона чистоты D; Стерилизационный туннель HQL-2220, зона чистоты D,С,B; Раз-ливо-запаячный комплекс ALK-3040, зона чистоты В с ламинарным модулем класса чистоты А. Линия предназначена для мойки, стерилизации, наполнения и герметизация ампул объемом 1,2 мл по методу поточного производства. Номинальная производительность линии 10 000 ампул/ ч.
-
2. Линия 5 БОШ – Макофар: Моечная машина RURE 12, класс чистоты D; Стерилизационный туннель DST 2247, класс чистоты D,С,B; Разливочный аппарат AVR-F 04, класс чистоты В, с ламинарным модулем А; Лиофильные установки ТГ-50, аппаратный зал класса чистоты С; Машина герметизации А6/FA, класс чистоты В. Номинальная производительность линии до 10 000 ампул/ч. Линия предназначена для мойки, стерили-
.1288-03
ГОСТР
'' П роверк а й соответствие дополнител ьных требований
Производство МИБП
Проверка соблюдения требований СП и ГОСТа
Устранение не соответствий
Результаты не соответствуют критериям приемлемости
ГОСТы Р ИСО Дополнительные требования по чистым помещениям, пе рсоналу, работающему с оборудованием, асептическим условиям производства
Результаты соответствуют критериям приемлемости
Требования к оборудованию чистых зон
Протоколирование результатов
Производство ГЛС
Программа апестации
Аттестационная комиссия
Управляющий механизм модели
Проведение апестации
Повторная апестация
Рис. 1. Модель алгоритма проведения аттестации комплексного оборудования чистых зон
Пример состава и размещения линии по классам чистоты для производства ГЛС:
Таблица
Стадии аттестации для оборудования комплексных линий
|
Вид оборудования |
Линия БОШ 2, производство вакцин, стадии |
Линия БОШ – Макофар, производство ГЛС, стадии |
Примечание |
|
1. Моечные машины |
IQ, OQ, PQ |
IQ, OQ, PQ |
PQ – проверка качества мойки ампул, согласно методике, рекомендуемой ОСТ 42-510-98. Чернила разливали в партию ампул, объем выборки не менее 1000 шт. |
|
2. Разливо-запаячные |
|||
|
машины |
IQ, OQ, PV1 PV2 PV3 |
IQ, OQ, PV1 PV2 - |
PV1 – контроль номинального объема препарата в запаянных ампулах при помощи калибровочных шприцев типа “Рекорд”, с ценой деления 0,1 мл, поверенных заводом-изготовителем PV2 – проверка качества очистки съемных частей, контактирующих с биопрепаратом PV3 – моделирование асептического розлива с использованием тиогликолевой среды |
|
3. Стерилизационные |
|||
|
туннели |
IQ, OQ, PQ |
IQ, OQ, PQ |
PQ – измерение высокотемпературного поля (до +300 °С) с использованием специальных приборов и методик |
Выводы
На предприятии выдвинут ряд основных требований к оборудованию, который сформирован по результатам анализа положений нормативных документов, а также по результатам аттестации оборудования линий:
-
1. Оборудование должно располагаться в виде комплексных поточных технологических линий, что минимизирует потери при транспортировании и перемещении полуфабриката.
-
2. Первичная упаковка ЛС должна обязательно подвергаться качественной автоматической мойке и выдерживать температуру депирогенизации в условиях кратковременной стерилизации в пределах 300 °С.
-
3. Все оборудование комплексных линий должны быть расположено в чистых зонах, зоны наибольшего риска (контакта с полупродуктом) должны быть обеспечены ламинарным модулем с однонаправленным потоком чистого стерильного воздуха и соответствовать классу чистоты А.
-
4. Части оборудования, контактирующего с полупродуктом, должны быть съемными, легко очищаться и выдерживать многократную стерилизацию.
-
5. На разливочном оборудовании, контактирующим с МИБП, должна моделироваться процедура асептического розлива, с использованием в качестве наполнителя питательной среды.
-
6. Оборудование линий обязательно должно аттестоваться для подтверждения качества процесса и стабильной работы, а также подвергаться повторной аттестации при реконструкции или перемещении.
Заключение
Таким образом, созданная модель алгоритма позволяет решить проблему аттестации сложного оборудования комплексных линий с использованием физико-инструментальных методов исследования, а соответствие полученных результатов аттестации установленным критериям является гарантом выпуска качественных МИБП и ГЛС, произведенных на данном оборудовании.
Успешная аттестация комплексных линий обеспечивает надлежащую работу комплексного оборудования и выпуск качественных готовых лекарственных средств и медицинских иммунобиологических препаратов.
Список литературы Проблемы аттестации оборудования критических зон при производстве готовых лекарственных средств и медицинских иммунобиологических препаратов
- ГОСТ Р 52249-2009 "Правила производства и контроля качества лекарственных средств". -М.: Стандартинформ, 2009. -120 с.
- ГОСТ Р ИСО 13408-1-2000. Асептическое производство медицинской продукции. Часть 1. Общие требования. -М.: Госстандарт России. ИПК Стандартов, 2000. -26 с.
- Методические указания МУ 44-116. Асептическое производство медицинских иммунобиологических препаратов. Департамент государственного санитарно-эпидемиологического надзора Минздрава России. -М.: 1997. -60 с.
- Отраслевой стандарт ОСТ 42-510-98 "Правила организации производства и контроля качества лекарственных средств (GMP)''. Утвержден Минздравом России 03.12.1999 г. -М.: Государственный научный центр по антибиотикам. -1999. -37 с.
- СП 3.3.2.1288-03 Санитарные правила "Медицинские иммунобиологические препараты. Надлежащая практика производства МИБП''. Утверждены главным государственным санитарным врачом РФ. 25.06.2003 г. -М.: Минюст РФ. -26 с.


