Продленная экстраплевральная анальгезия после операций на грудной клетке у детей раннего возраста
Автор: Алейникова Н.Г., Новожилов В.А., Козлов Ю.А., Павленок Т.В., Горбатых Ю.Н., Шунькин А.В., Струнин О.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Анестезиология, реаниматология и перфузиология
Статья в выпуске: 2 т.11, 2007 года.
Бесплатный доступ
Проблема обезболивания послеоперационного периода у младенцев актуальна во всех областях хирургии. При кардиохирургических вмешательствах, связанных с выполнением торакотомии, может оказаться чрезвычайно полезным опыт центра хирургии и реанимации новорожденных Ивано-Матренинской ДКБ г. Иркутска, где было выполнено обследование 29 детей, которым выполнена торакотомия по поводу врожденных пороков развития и приобретенных заболеваний органов грудной клетки. Сравнивалась эффективность послеоперационного обезболивания методом продленной экстраплевральной анальгезии (ЭПА) бупивакаином и внутривенной опиатной анальгезии (ОА) фентанилом.
Короткий адрес: https://sciup.org/142233371
IDR: 142233371
Текст научной статьи Продленная экстраплевральная анальгезия после операций на грудной клетке у детей раннего возраста
Н.Г. Алейникова*, В.А. Новожилов*, Ю.А. Козлов*, Т.В. Павленок*, Ю.Н. Горбатых**,
А.В. Шунькин**, О.В. Струнин**
* Ивано-Матренинская детская клиническая больница, Иркутск
** ФГУ «Новосибирский НИИ патологии кровообращения им. акад. Е.Н. Мешалкина Росмедтехнологий»
Проблема обезболивания послеоперационного периода у младенцев актуальна во всех областях хирургии. При кардиохирургических вмешательствах, связанных с выполнением торакотомии, может оказаться чрезвычайно полезным опыт центра хирургии и реанимации новорожденных Ивано-Матренин-ской ДКБ г. Иркутска, где было выполнено обследование 29 детей, которым выполнена торакотомия по поводу врожденных пороков развития и приобретенных заболеваний органов грудной клетки. Сравнивалась эффективность послеоперационного обезболивания методом продленной экстраплевральной анальгезии (ЭПА) бупивакаином и внутривенной опиатной анальгезии (ОА) фентанилом.
Прогресс хирургических технологий на протяжении последних десятилетий позволяет выполнять оперативное лечение разнообразных пороков развития, в том числе врожденных пороков сердца (ВПС) в группе новорожденных и детей раннего грудного возраста. Актуальной стала проблема поиска новых эффективных и безопасных методик интра- и послеоперационного обезболивания для младенцев.
В настоящее время разрабатываются различные методики лечения послеоперационной боли, однако острая и хроническая боль - состояние, ассоциированное с торакотомией, продолжает представлять проблему для клиницистов. Боль после торакотомии является значительной и интенсивной вследствие повреждения мягких тканей, ребер, мышц и периферических нервов [13], что диктует необходимость проведения массивного, преимущественно опиатного, обезболивания. Однако использование наркотических анальгетиков сопровождается, среди прочих, следующими побочными эффектами: медленным восстановлением сознания, угнетением самостоятельного дыхания и защитных рефлексов со стороны верхних дыхательных путей, что требует проведения длительной искусственной вентиляции легких (ИВЛ). При продленной ИВЛ значительно возрастает вероятность инфекционных осложнений, баро- и во-люмотравмы легких. Риск развития негативных последствий операционной травмы и интенсивной респираторной терапии значительно увеличивается в группе новорожденных, а особенно недоношенных детей.
Боль - ключевой компонент в изменении легочной функции после торакальных операций, и чрезвычайно важно предусмотреть эффективное послеоперационное обезболивание для уменьшения числа легочных осложнений и ослабления стрессовой реакции [13]. Неустранен-ные болевые ощущения у новорожденных вызывают длительно сохраняющиеся последствия. Тяжелая и неоднократная боль приводит к развитию внутрижелудочковых кровоизлияний, ишемии и перивентрикулярной лейкомаляции, увеличению риска развития сепсиса, ДВС-син-дрома, ухудшает течение и исход заболевания, повышает неонатальную смертность. Доказано, что боль, перенесенная в неонатальном периоде, изменяет развитие системы ноцицепции и приводит к необратимым функциональным и структурным изменениям ЦНС, тем самым оставляет длительную память и изменяет программу ответа на боль в будущем [1].
Увеличение нагрузки на миокард вследствие высвобождения катехоламинов и генерализованной вазоконстрикции может привести к аритмиям, инфаркту миокарда, сердечной недостаточности, что особенно актуально при проведении операций при ВПС. Другими серьезными последствиями являются иммунодефицит, илеус, задержка мочи и увеличение риска развития тромбоэмболических осложнений [12].
Метод паравертебральной невральной блокады в грудном отделе впервые предложен Kappis в 1919 г. Детальное описание паравертебрального пространства сделали Eason и Wyatt в 1979 г. [2]. Паравертебральный блок занимает полезную нишу в педиатрической практике, однако сообщения о применении данного метода у новорожденных крайне скудны [6, 9, 11]. Техника ЭПА позволяет наиболее анатомически точно обеспечить поступление местного анестетика. Раствор препарата, вводимый через ретроплевральный катетер, непосредственно «омывает» межреберные нервы. Общий объём локального анестетика распространяется на все 4 межреберных промежутка ретроплеврального пространства. На ограниченной площади создается высокая концентрация препарата, что обеспечивает эффективное местное обезболивание [4]. Методу ЭПА свойственна безопасность, особенно если используются низкие концентрации местных анестетиков. Более того, сообщается об успешном использовании ЭПА у пациентов, оперированных на молочной железе в амбулаторных условиях [4].
По данным деятельности Центра хирургии и реанимации новорожденных Ивано-Матренин-ской ДКБ г. Иркутска, в течение 12 лет патология кардиоторакальной области, требующая хирургической коррекции, в структуре заболеваемости новорожденных составляет 8-11%. С целью оптимизации антиноцицептивной защиты новорожденных и сокращения времени проведения ИВЛ в постторакотомическом периоде группой авторов из Иркутской ИМДКБ применялась методика ЭПА.
Данное исследование посвящено сравнительному анализу традиционной опиатной анальгезии и ЭПА у детей раннего возраста с хирургической патологией.
МАТЕРИАЛ И МЕТОДЫ
Настоящее исследование выполнено среди новорожденных и детей раннего грудного возраста, которым было выполнено оперативное лечение по поводу врожденной и приобретенной патологии органов грудной клетки. Для оптимизации обезболивания в постторакотомическом периоде в ЦХРН с марта 2004 по ноябрь 2006 г. у 12 детей применялась экстраплевральная анальгезия. В зависимости от характера послеоперационного обезболивания обследованные пациенты были разделены на две группы: I группа (17 детей) - обезболивание проводилось с использованием фентанила в дозе 2-3 мкг/(кг • ч), непрерывной внутривенной инфузией (ОА); II группа (12 детей) - лечение боли осуществлялось путем непрерывного введения местного анестетика через катетер, интраоперационно установленный в экстраплевральное пространство. В качестве анестетика применялся 0,25% раствор бупивакаина в дозе 0,2-0,3 мкг/(кг • ч) (ЭПА).
Выбор метода послеоперационного обезболивания в первую очередь был обусловлен техническими особенностями оперативного вмешательства (сохранение целостности паравертебрального участка париетальной плевры). Обследованные дети не получали терапии глюкокортикоидами. Всем пациентам проводилась стандартная инфузионная терапия. Распределение обследованных больных по нозологическим формам представлено в табл. 1.
Критерии исключения из исследования: крайне тяжелое, угрожаемое для жизни состо-
Таблица 1
Распределение обследованных больных по нозологическим формам
На заключительном этапе операции производили диссекцию париетальной плевры в паравертебральной области через медиальный край торакотомной раны. Затем выполняли сепарацию плеврального листка с размещением в образовавшемся ретроплевральном кармане перидурального катетера (№ 18 G фирмы «Por-tex») на 2-3-м межреберных промежутка выше линии операционного доступа. Дистальный конец катетера выводили наружу через отдельный прокол. Производили его фиксацию к межреберным мышцам и коже.
Качество послеоперационного обезболивания оценивалось в течение 48 ч после операции. Оценка адекватности анальгезии проводилась через 3, 6, 12, 24, 36, 48 ч после окончания операции по состоянию центральной и периферической гемодинамики (ЧСС, АД, диурез, скорость заполнения капилляров); уровень стрессовых индикаторов в крови (сахар,кортизол).
Контроль гемодинамики осуществлялся с помощью мониторов «Nyhon Kohden» и «Agilent М3». Концентрация кортизола крови опреде лялась иммуноферментным методом с применением набора реагентов «Стероид ИФА-кор-тизол-01» (N = 150-660 нмоль/л). Уровень гликемии измерялся глюкозооксидазным методом с использованием набора реагентов «Фотоглюкоза 2/4» (№ = 3,3-6,6 ммоль/л). Сравнивалась длительность проведения аппаратной вентиляции легких в обеих группах.
Полученные в процессе исследования результаты обрабатывались с помощью пакета программ «Statistica» (версия 6.0). Использовался непараметрический критерий Манна-Уитни. Вычислялся критерий р (при р>0,05 гипотеза об отсутствии различий средних значений в группах не отклонялась; при р<0,05 принималась гипотеза о существовании различий среднего значения).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В дооперационном периоде у всех больных оценивалась тяжесть состояния по шкале ASA, анализировался гемодинамический профиль (ЧСС, систолическое и диастолическое АД) и уровень периферической перфузии (скорость заполнения капилляров, диурез). Регистрировались масса тела и возраст пациентов на момент операции. Сравниваемые группы пациентов были статистически однородны (табл. 2).
В послеоперационном периоде средний уровень гликемии в I группе (ОА) превышал нормальные значения или приближался к верхней границе нормы (от 5,8 до 11,0 ммоль/л). Концентрация сахара в крови пациентов второй группы (ЭПА) была более стабильной (от 3,7 до
Таблица 2
Параметры показателей в исследуемых группах
|
Показатели — |
Группа |
р |
|
|
1 II |
|||
|
Возраст, сут. |
23,18 |
16,63 |
0,85 |
|
Масса тела, г |
2836,0 |
2962,3 |
0,42 |
|
Состояние по ASA |
III-IV |
III-IV |
0,58 |
|
Уровень глюкозы в крови, ммоль/л |
5,4 |
6,3 |
0,55 |
|
Уровень кортизола в крови, нмоль/л |
595,7 |
704,0 |
0,83 |
|
Частота сердечных сокращений, уд/мин |
137 |
142 |
0,58 |
|
Систолическое артериальное давление, мм рт. ст. |
73,4 |
70,4 |
0,42 |
|
Диастолическое артериальное давление, мм рт. ст. |
42,9 |
39 |
0,28 |
|
Скорость заполнения капилляров, с |
2-3 |
2-3 |
0,70 |
|
Диурез, мл/(кг . ч) |
2,8 |
2,1 |
0,20 |
5,96 ммоль/л). Через 24 и 36 ч у пациентов, получавших ОА, глюкоза крови была выше нормальных значений и ее уровень достоверно отличался (р<0,05) от группы детей, получавших ЭПА. У последних уровень гликемии соответствовал возрастным нормам (рис. 1).
Сравнительный анализ адекватности различных видов обезболивания на основе динамики показателей плазменного кортизола свидетельствовал о высокой активности стресс-реализую-щих механизмов в группе ОА и отсутствии столь выраженного ответа при проведении ЭПА. Начиная с 12-го часа после операции отмечалась отчетливая тенденция к повышению уровня кортизола крови у детей, получавших ОА. Максимальный средний уровень кортизола в этой группе составил 3110,9 нмоль/л, в то время как в группе с ЭПА он не превышал 1273,6 нмоль/л (рис. 2). Через 24 ч после операции уровень кортизола у детей, получавших обезболивание с помощью фентанила, был достоверно (р<0,1) в 6 раз выше, чем во II группе. Значительное увеличение концентрации кортизола в крови после 24-36 ч у пациентов, получавших ОА, можно объяснить развитием толерантности к фентанилу после его длительного применения [13]. Кроме того, перегрузка эндогенного рецепторного опиоидного аппарата вследствие наличия очага мощной длительно действующей болевой импульсации ведет к снижению анальгетического эффекта опиоидного анальгетика, несмотря на повышение его доз.
Несмотря на отсутствие статистически значимых отличий в частоте пульса у детей в обеих группах, у детей в I группе отмечалась отчетливая тенденция к тахикардии.У пациентов II группы значения ЧСС приближались к показателям возрастной нормы (рис. 3). Показатели среднего артериального давления продемонстрировали аналогичные тенденции.
В качестве индикаторов состояния периферической перфузии были выбраны почасовой диурез и скорость заполнения капилляров, отражающая степень вазоконстрикции под влиянием катехоламинов. Почасовой диурез в I группе ОА составил в среднем 3,2; 2,0; 3,8; 3,8; 4,2; 2,9 мл/(кг • ч) на этапах исследования. В группе ЭПА 4,0; 3,2; 3,5; 4,8; 5,2; 4,1 мл/(кг • ч). Таким образом, почасовой диурез у детей с ЭПА был достоверно выше (р = 0,06 по критерию Манна-Уитни). Скорость заполнения капилляров (симптом «белого пятна») была сопоставима в обеих группах и не превышала в среднем 3-4 с в I группе и 4-5 c во II.
Средняя продолжительность послеоперационной ИВЛ в I группе составила 136±172 ч, во II - 46,5±48 ч, что было достоверно (при р = 0,09) в 2,9 раз меньше. Минимальное время ИВЛ в послеоперационном периоде при проведении
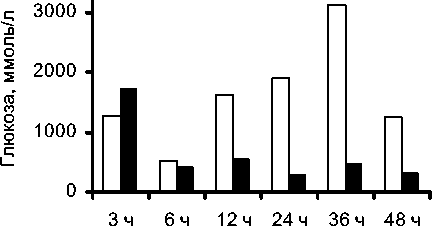
□ среднее значение в группе ОА
■ среднее значение в группе ЭПА
Рис. 1. Уровень гликемии в исследуемых группах.
8,0 -
6,0 -
4,0 -
2,0 -
0,0 -
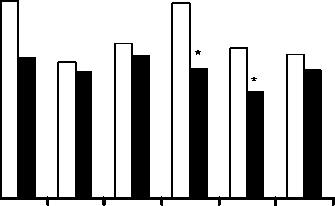
Зч 6 ч 12 ч 24 ч 36 ч 48 ч
□ среднее значение в группе ОА
■ среднее значение в группе ЭПА
* отличие достоверно при р<0,1
Рис. 2. Уровень кортизола в исследуемых группах.
Зч 6ч 12ч 24ч 36ч 48ч
-
□ среднее значение в группе ОА
-
■ среднее значение в группе ЭПА
Рис. 3. Частота сердечных сокращений за 1 минуту в исследуемых группах.
ОА - 24 ч, при использовании ЭПА - 6 ч; максимальное - 768 и 192 ч, соответственно. У пациентов с кардиохирургической патологией и скомпрометированным легочным кровотоком длительная послеоперационная ИВЛ имеет зачастую решающее значение в возрастании риска вентилятор-ассоциированной пневмонии и других осложнений.
У новорожденных и младенцев метод ЭПА менее опасен, чем каудальное введение катетера с установкой его на уровне грудных сегментов. Размещение катетера во время операции и фиксация его экстраплеврально имеет значительные преимущества также и перед чрескожным доступом. Это быстрая и более точная процедура, уменьшающая число потенциальных осложнений [7].
При проведении ЭПА развивается только односторонний блок, поэтому случаи побочных эффектов, таких как гипотензия и задержка мочи, крайне редки. При этом резко снижается риск депрессии дыхания и, соответственно, отпадает необходимость интенсивного мониторирования и специализированного лечения. Хотя экстраплевральный доступ не всегда избавляет от необходимости применения опиатов, потребность в них значительно сокращается [8].
С целью уменьшения риска развития негативных реакций у новорожденных нами использовалось непрерывное введение анестетика. Продленная инфузия местного анестетика предпочтительнее дискретных введений [5], в том числе и в педиатрической практике [10]. Дискретный невральный блок обеспечивает обезболивающий эффект максимум на 6 ч, в то время как использование ретроплеврального катетера имеет характер поддерживающей анальгезии. Кроме того, избегаются резкие колебания концентрации бупивакаина в крови, что снижает вероятность токсических эффектов и обеспечивает более стабильную гемодинамику.
Об адекватности послеоперационного обезболивания у детей с ЭПА свидетельствуют также как уровень гликемии, так и содержание кортизола в крови в послеоперационном периоде.
ВЫВОДЫ
-
1. Экстраплевральная анальгезия как метод лечения послеоперационной боли - безопасная альтернатива традиционным способам обезбо
-
2. Применение ЭПА обеспечивает сокращение времени ИВЛ в послеоперационном периоде, что снижает вероятность развития ИВЛ-ассо-циированной патологии, а экстраполяция полученных данных на пациентов кардиохирургического стационара может открыть дополнительные перспективы улучшения лечения новорожденных с ВПС.
ливания в постторакотомическом периоде у новорожденных. Более того, полученные нами данные продемонстрировали превосходство антиноцицептивной защиты при использовании ЭПА у младенцев и позволяют считать данную методику наиболее оптимальным видом обезболивания в постторакотомическом периоде у маленьких детей.
Список литературы Продленная экстраплевральная анальгезия после операций на грудной клетке у детей раннего возраста
- Жиркова Ю.В., Михельсон В.А. Проблемные вопросы профилактики и лечения боли в отделениях реанимации и интенсивной терапии новорожденных // Педиатрическая анестезиология и интенсивная терапия: Материалы III Российского конгр. М.: РГМУ, 2004. С. 32.
- Ферранте Ф.М. Послеоперационная боль. М.: Медицина, 1998. 619 с.
- Anand K.J., Hall R.W. // Arch Dis. Fetal. Neonata. Ed. 2006. Vol. 91. P. 448-453.
- Berde C.B. // Anaesth. Analg. 1992. Vol. 75. P. 164-166.
- Catala E., Casas J.I., Unzueta M.C., et al. // J. Cardiothorac. Vasc. Anesth. 1996. Vol. 10 (5). P. 586-588.


