Продуктивность и экспрессия генов у цыплят-бройлеров (Gallus gallus L.) кросса Ross 308 под влиянием антибиотиков, глифосата и штамма Bacillus sp
Автор: Тюрина Д.Г., Лаптев Г.Ю., Йылдырым Е.А., Ильина Л.А., Филиппова В.А., Бражник Е.А., Тарлавин Н.В., Калиткина К.А., Пономарева Е.С., Дубровин А.В., Новикова Н.И., Ахматчин Д.А., Молотков В.В., Меликиди В.Х., Горфункель Е.П.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетика, геномика, генетическая инженерия
Статья в выпуске: 6 т.57, 2022 года.
Бесплатный доступ
Сочетание широкого использования антибиотиков и присутствия в кормах остаточных количеств пестицидов способно поставить под угрозу терапевтические и производственные эффекты от применения антибактериальных препаратов в промышленном птицеводстве. Происходящие при этом изменения могут сопровождаться модификацией экспрессии ряда генов. В настоящей работе впервые показано, что стимуляция мясной продуктивности цыплят-бройлеров кросса Ross 308 под влиянием ветеринарных антибиотиков энрофлоксацина и колистина, вероятно, имеет связь с индукцией экспрессии гена MYOG , который способствует развитию и дифференцировке мышц, генов антимикробной ( Gal9 , Gal10 ) и антивирусной ( IRF7 ) защиты, а также провоспалительных генов IL6 , IL8 и PTGS2 . Кроме того, впервые выявлено, что глифосат подавляет экспрессию антимикробных и антивирусных генов у цыплят-бройлеров. Наша цель заключалась в оценке продуктивности и изменения экспрессии генов, ассоциированных с иммунитетом, продуктивностью и устойчивостью к токсическим и лекарственным веществам, при воздействии антибиотиков, в том числе на фоне загрязнения кормов глифосатом и введения в рацион цыплят-бройлеров штамма Bacillus sp. Эксперименты проводили в 2022 году в виварии ООО «БИОТРОФ+» на бройлерах ( Gallus gallus L.) кросса Ross 308 от 1- до 35-суточного возраста. Для кормления с 1-х по 28-е сут использовали комбикорм ПК 5 для бройлеров, с 29-х по 35-е сут - ПК 6 для бройлеров. Птицу разделили на 4 группы по 40 гол. в каждой. Бройлеры в I группе (контроль) получали рацион без антибиотиков, глифосата и штамма микроорганизма; во II опытной - рацион с добавлением ветеринарных антибиотиков энрофлоксацина и колистина в виде препарата Энрофлон К (ООО «ВИК - здоровье животных», Россия) в дозировке 1 мл/л воды с 1-х по 5-е сут выращивания и флорфеникола (ООО «Агроветзащита С.-П. НВЦ», Россия) в дозировке 1 мл/л воды с 17-х по 20-е сут; в III опытной - рацион с добавлением препарата Энрофлон К по схеме, описанной выше, а также глифосата в составе препарата Агрокиллер (ЗАО Фирма «Август», Россия) в количестве 20 мг/кг корма, что соответствовало 1ПДК для продуктов питания; в IV опытной - рацион с добавлением энрофлоксацина, колистина, флорфеникола, глифосата, а также штамма Bacillus sp. ГЛ-8, выделенного из кишечника бройлеров. Для анализа содержания глифосатов методом ИФА в кормах и питательных средах использовали cтриповый иммуноферментный анализатор STAT FAX 303+ («Awareness Technology Co. LLC», США) и тест-систему Glyphosate ELISA, Microtiter Plate («Abraxis», США). В конце эксперимента у бройлеров отбирали ткани слепых отростков кишечника и грудных мышц. Анализ экспрессии генов проводили с помощью количественной ПЦР с обратной транскрипцией. Тотальную РНК выделяли с использованием мини-набора AurumТМ Total RNA («Bio-Rad», США), следуя инструкциям производителя. Реакцию обратной транскрипции проводили для получения кДНК на матрице РНК с использованием iScriptТМ Reverse Transcription Supermix («Bio-Rad», США). Для анализа экспрессии мРНК были выбраны специфические праймеры для генов интерлейкина 6 ( IL6 ), интерлейкина 8 ( IL8 ), синтеза регуляторного фактора интерферона 7 ( IRF7 ), простагландин-эндопероксидсинтазы ( PTGS2 ), синтеза b-дефензина 9 AvBD9 ( Gal9 ), b-дефензина 10 AvBD10 ( Gal10 ), инсулиноподобного фактора роста 1 ( LGF1 ), миогенина ( MYOG ), миозенина ( MYOZ2 ) и гена GSTA3 , связанного с устойчивостью к токсическим и лекарственным веществам. ПЦР проводили с использованием амплификатора ДТлайт («ДНК-Технология», Россия) и набора SsoAdvancedТМ Universal SYBR® Green Supermix («Bio-Rad», США). Живую массу бройлеров определяли в возрасте 7, 14, 21, 28 и 35 сут. Показано, что антибиотики стимулировали (p £ 0,05) продуктивность бройлеров с 14-х сут жизни до конца эксперимента на 4,8-23,3 % (II группа по сравнению с I группой). В конце эксперимента отмечали негативное влияние глифосата на продуктивность бройлеров (III группа по сравнению со II, p £ 0,05). Результаты оценки экспрессии генов бройлеров, связанных с ростом и формированием мышечных волокон, показали, что экспрессия гена MYOG была выше у бройлеров из II и IV групп соответственно в 2,0 и 2,1 раза по сравнению с I группой (p £ 0,05). В III группе количество мРНК гена MYOG не повышалось (р > 0,05), что свидетельствует о негативном влиянии глифосата на экспрессию генов продуктивности птицы. Глифосат (III группа) выступал и как супрессор экспрессии генов антимикробной и антивирусной защиты Gal9 , Gal10 и IRF7 (по сравнению со II группой) (p £ 0,05). Интродукция штамма микроорганизма в корм на фоне глифосата и антибиотиков (IV группа) вызывала усиление экспрессии Gal9 по сравнению с наблюдаемой в III группе (p £ 0,05). Прослеживалась тенденция резкого возрастания экспрессии провоспалительных генов IL6 , IL8 и PTGS2 во II группе (соответственно в 4,6; 11,2 и 6,6 раза по сравнению с контролем, p £ 0,05).
Микотоксины, антибиотик, глифосат, бройлеры, экспрессия генов
Короткий адрес: https://sciup.org/142237388
IDR: 142237388 | УДК: 636.5.033:636.064.6:57.042:577.218 | DOI: 10.15389/agrobiology.2022.6.1147rus
Текст научной статьи Продуктивность и экспрессия генов у цыплят-бройлеров (Gallus gallus L.) кросса Ross 308 под влиянием антибиотиков, глифосата и штамма Bacillus sp
Антибиотики играют важную роль в борьбе с инфекционными заболеваниями, а также используются для стимуляции роста сельскохозяйственной птицы (1-3). Обычной практикой среди многих производителей мяса птицы считается метафилактическое введение антибиотиков, например эн-рофлоксацина, цыплятам в первые несколько суток жизни, а иногда и при дальнейшем выращивании (4, 5). Антибиотики могут негативно влиять на защитные механизмы птиц, которые определяются функционированием основных органов иммунной системы (6). Есть сведения, что, хотя энрофлок-сацин ингибирует гуморальные иммунные механизмы (7), он может способствовать клеточному иммунному ответу у цыплят (5).
Интересно, что механизм стимуляции роста сельскохозяйственных животных и птицы под влиянием антибиотиков до сих пор не ясен. Все гипотезы сводятся в основном к модуляции состава микробиоты на их фоне (8). H. Eyssen с соавт. (9) предположили, что антибиотики стимулируют рост цыплят благодаря антибактериальному действию в отношении грамположи-тельных микроорганизмов, препятствующих усвоению питательных веществ. По другой гипотезе (10), уменьшение популяции лактобацилл у животных, получавших антибиотики, снижает активность гидролазы солей желчных кислот, что увеличивает относительное обилие конъюгированных солей желчных кислот, способствует липидному обмену и синтезу энергии. В результате прирост массы животных повышается.
Тем не менее применение антибиотиков, как правило, негативно отражается на иммунитете (11). На свиньях (12) и на птице (13) показано, что диетические антибиотики могут вмешиваться в экспрессию генов.
Помимо антибиотиков, на показатели иммунитета, здоровья и продуктивности бройлеров влияют многие другие факторы (14). Так, в кормах для птиц, в особенности производимых на основе генетически модифицированной сои, присутствует значительное количество остатков гербицида глифосата (15, 16), которые могут оказывать негативное действие на организм (17, 18).
Пищеварительная система служит защитным барьером от воздействия пестицидов и патогенов (19, 20). Лимфоидные ткани в желудочнокишечном тракте у птиц хорошо развиты (21, 22) и участвуют в активации иммунных реакций (23-25). При этом важно отметить, что исследование влияния глифосатов на экспрессию генов сельскохозяйственных животных и птицы ранее не проводили.
Широкое использование антибиотиков и присутствие в кормах гли- фосатов может поставить под угрозу терапевтические и производственные эффекты от применения антибактериальных препаратов. Ранее было показано, что воздействие глифосатов увеличивало толерантность микроорганизмов Escherichia coli и Salmonella enterica серовар Typhimurium к канами-цину и цефалоспорину (26). Однако на животных-моделях совместное влияние антибиотиков и глифосатов ранее не изучалось.
Поиск средств, положительно влияющих на микробиоту кишечника птицы за счет стимуляции защитных механизмов и снижения потребности в профилактическом и терапевтическом применении антибиотиков, ведется в течение многих лет. Полезные штаммы микроорганизмов, несомненно, занимают первое место среди таких агентов (27-29) и находят широкое применение в кормлении сельскохозяйственной птицы (30). Нередко полезные бактерии применяются одновременно с антибиотиками для профилактики побочных эффектов последних (31). Доказано воздействие микроорганизмов на иммунитет (32) и экспрессию генов хозяина (33). Штаммы микроорганизмов-биодеструкторов использовали для профилактики при загрязнении кормов микотоксинами (34) и глифосатами (35). В этом отношении целесообразно исследовать, может ли интродукция штаммов микроорганизмов в рационы быть инструментом сглаживания иммуносупрессии, возникшей на фоне антибиотиков.
В настоящей работе впервые показано, что стимуляция мясной продуктивности цыплят-бройлеров кросса Ross 308 под влиянием ветеринарных антибиотиков энрофлоксацина и колистина, вероятно, имеет связь с индукцией экспрессии мРНК гена MYOG , который способствует развитию и дифференцировке мышц, генов антимикробной ( Gal9 , Gal10 ) и антивирусной ( IRF7 ) защиты, а также провоспалительных генов IL6 , IL8 и PTGS2 . Кроме того, впервые показано, что глифосат подавляет экспрессию антимикробных и антивирусных генов у цыплят-бройлеров.
Нашей целью было оценить продуктивность и изменение экспрессии генов, ассоциированных с иммунитетом, продуктивностью и устойчивостью к токсическим и лекарственным веществам, у цыплят-бройлеров при воздействии антибиотиков, в том числе на фоне загрязнения кормов глифосатом и введения в рацион штамма Bacillus sp.
Методика. Опыты проводили в 2022 году в виварии ООО «БИО-ТРОФ+» на бройлерах ( Gallus gallus L.) кросса Ross 308 от 1- до 35-суточного возраста; соблюдались требования Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETS ¹ 123, Страсбург, 1986) (36). Условия кормления и содержания соответствовали рекомендациям для кросса (37). С 1-х по 28-е сут выращивания применяли комбикорм ПК 5 для бройлеров, с 29-х по 35-е сут — ПК 6 для бройлеров.
Птицу разделили на 4 группы по 40 гол. в каждой. В I интактной группе (контроль) бройлеры получали рацион без введения антибиотиков, глифосата и штамма микроорганизма; во II опытной — рацион с добавлением ветеринарных антибиотиков энрофлоксацина и колистина в виде препарата Энрофлон К (ООО «ВИК — здоровье животных», Россия) в дозировке 1 мл/л воды с 1-х по 5-е сут выращивания и флорфеникола (ООО «Агро-ветзащита С.-П. НВЦ», Россия) с 17-х по 20-е сут в дозировке 1 мл/л воды; в III опытной — рацион с добавлением препарата Энрофлон К по схеме, описанной выше, а также глифосата в количестве 20 мг/кг корма, что соответствовало 1ПДК для продуктов питания (38); в IV опытной — рацион с добавлением энрофлоксацина, колистина, флорфеникола, глифосата, а также штамма Bacillus sp. ГЛ-8. Бактериальный препарат использовали в концентрации 106 клеток/кг корма.
Для анализа способности осуществлять биодеструкцию глифосата in vitro 11 штаммов Bacillus sp. инкубировали с глифосатом в виде гербицида Торнадо, ВР (ЗАО Фирма «Август», Россия), содержащего глифосат N-(фос-фонометил)-глицин (изопропиламинная соль) (360 г/л), в течение 2 сут. Препарат вносили в среду в количестве 20 мкл, что соответствовало 144 мг/л чистого глифосата. Штаммы культивировали на полусинтетической питательной среде (меласса — 2 %; NaCl — 0,02 %; K 2 HPO 4 — 0,2 %; MgSO 4 •7H 2 O — 0,05 %; CaCO 3 — 0,01 %) в стеклянных колбах с ватными пробками на шейкере при скорости вращения 230 об/мин и температуре 32±1,2 °С без дополнительного аэрирования. Концентрация бактерий в начале культивирования во всех вариантах — 1,0½104 клеток/мл, длительность культивирования — 2 сут. Концентрация бактерий по окончании культивирования составляла от 1,9½107±7,9½105 до 8,7½108±6,3½106 клеток/мл. Уменьшение содержания микотоксинов в питательной среде с инокулированной культурой живых бактериальных клеток по сравнению с контролем условно считали биодеструкцией глифосата.
Штамм Bacillus sp. ГЛ-8, выделенный из кишечника бройлеров, был получен из коллекции ООО «БИОТРОФ+». Штамм представлял собой аэробные неподвижные спорообразующие палочки шириной 1,2-1,5 мкм и длиной 2-5 мкм. Он образовывал эллиптические споры центрального расположения. Для получения предварительных выводов о том, что штамм Bacillus sp. ГЛ-8 не имеет факторов вирулентности и этиологической значимости в развитии инфекционных процессов, определяли его гемолитическую активность. Ее устанавливали через 24 ч при просмотре колоний, выросших на 5 % кровяном агаре.
В производственном эксперименте применяли глифосат в составе препарата Агрокиллер (ЗАО Фирма «Август», Россия), содержащего 500 г/л глифосата (изопропиламинная соль). Для этого из препарата Агрокиллер готовили рабочий раствор, который наносили на комбикорм посредством распыления в соотношении 5 мл рабочего раствора на 1 кг комбикорма, до конечного содержания чистого глифосата в комбикорме 20 мг/кг. Смешивание осуществляли механическим способом с соблюдением требований безопасности персонала. Потребление корма бройлерами составляло в среднем 150 г/сут, то есть бройлеры опытных групп ежесуточно получали глифосат в количестве 3 мг/птицу. После внесения глифосата его концентрацию в корме контролировали методом иммуноферментного анализа (ИФА). Рацион бройлеров практически не содержал фоновых количеств глифосата, что свидетельствует о чистоте эксперимента.
Для анализа содержания глифосатов методом ИФА в кормах и питательных средах использовали cтриповый иммуноферментный анализатор STAT FAX 303+ («Awareness Technology Co LLC», США) и тест-систему Glyphosate ELISA, Microtiter Plate («Abraxis», США). Тест основан на прямой конкурентной иммуноферментной реакции между глифосатом, который присутствует в образце, и ферментом, маркированным глифосатом, для связывания антител кролика к глифосату и антител козы к иммуноглобулинам кролика, иммобилизованных в микролунках. После проведения имму-ноферментной реакции интенсивность цветового сигнала раствора в лунках была обратно пропорциональна концентрации глифосата, присутствующего в образцах.
Для определения экспрессии генов в конце эксперимента у бройлеров отбирали ткани слепых отростков кишечника и грудных мышц. Образцы стабилизировали с помощью реагента RNAlater («Thermo Fisher Scientific, Inc.», США) и незамедлительно отправляли в молекулярно-генетическую лабораторию научно-производственной компании ООО «БИО-ТРОФ+» для выделения РНК.
Анализ экспрессии генов проводили с помощью количественной ПЦР. Для получения РНК ткани смешивали с жидким азотом и гомогенизировали. Тотальную РНК выделяли с использованием мини-набора AurumТМ Total RNA («Bio-Rad», США), следуя инструкциям производителя. Реакцию обратной транскрипции проводили для получения кДНК на матрице РНК с использованием iScriptТМ Reverse Transcription Supermix («Bio-Rad», США) (39). Следующие специфические праймеры были подобраны с помощью инструментария NCBI для анализа экспрессии:
Ген, его продукт
IL6 , интерлейкин 6
IL8 , интерлейкин 8
IRF7 , регуляторный фактор интерферона 7
PTGS2 , простагландин-эндопероксидсинтаза 2
AvBD9 ( Gal9 ), β -дефензин 9
AvBD10 ( Gal10 ), β -дефензин 10
LGF1 , инсулиноподобный фактор роста 1
MYOG , миогенин
MYOZ2 , миозенин ()
GSTA3 , ген, связанный с устойчивостью к токсическим и лекарственным веществам
Последовательность праймеров (5 ´ →3 ´ )
F: AGGACGAGATGTGCAAGAAGTTC
R: TTGGGCAGGTTGAGGTTGTT
F: GGAAGAGAGGTGTGCTTGGA
R: TAACATGAGGCACCGATGTG
F: ATCCCTTGGAAGCACAACGCC
R: CTGAGGCAACCGCGTAGACCTT
F: TCGAGATCACACTTGATTGACA
R: TTTGTGCCTTGTGGGTCAG
F: AACACCGTCAGGCATCTTCACA
R: CGTCTTCTTGGCTGTAAGCTGGA
F: GCTCTTCGCTGTTCTCCTCT
R: CCAGAGATGGTGAAGGTG
F: GCTGCCGGCCCAGAA
R: ACGAACTGAAGAGCATCAACCA
F: GGAGAAGCGGAGGCTGAAG
R: GCAGAGTGCTGCGTTTCAGA
F: CAACACTCAGCAACAGAGGC
R: GTATGGGCTCTCCACGATTTCT
F: TACATCGCAGGGAAATACA
R: GGAGAGAAAGGAAACACCA
В качестве референсного контроля использовали праймеры для амплификации гена «домашнего хозяйства», кодирующего белок бета-актин ACTB: F — 5´-CTGTGCCCATCTATGAAGGCTA-3´, R — 5´-ATTTCTCT-CTCGGCTGTGGTG-3´ (40). Реакцию проводили с использованием ампли-фикатора ДТлайт («ДНК-Технология», Россия) и набора SsoAdvancedТМ Universal SYBR® Green Supermix («Bio-Rad», США) в соответствии с протоколом производителя (41). Режим и условия амплификации были следующими: 5 мин при 95 °C (предварительный прогрев); 30 с при 95 °C, 30 с при 60 °C, 30 с при 70 °C (40 циклов) (42). Относительную экспрессию оценивали методом 2 -AA CT (43). Живую массу бройлеров определяли в возрасте 7, 14, 21, 28 и 35 сут (44).
Математическую и статистическую обработку результатов осуществляли методом многофакторного дисперсионного анализа (ANOVA) в программах Microsoft Excel XP/2003, R-Studio (Version 1.1.453) . Результаты представлены как средние значения (M) и стандартные ошибки средних (±SEM). Достоверность различий устанавливали по t-критерию Стьюдента, различия считали статистически значимыми при p < 0,05. Средние значения сравнивали с использованием теста достоверно значимой разницы Тьюки (HSD) и функции TukeyHSD в пакете R Stats Package .
Результаты. У 6 из 11 исследованных штаммов Bacillus sp. мы выявили способность к биодеструкции глифосата in vitro, наиболее выражен- ную у штамма Bacillus sp. ГЛ-8 по сравнению с другими (53,0±4,10 %) (табл.). Этот факт позволяет предположить присутствие в составе культуральной жидкости Bacillus sp. ГЛ-8 ферментов, связанных с биодеструкцией ксенобиотиков. При исследовании ГЛ-8 на наличие гемолитической активности на кровяном агаре мы не наблюдали зон просветления вокруг колоний.
Полученные данные могут иметь важное практическое значение для использования штамма Bacillus sp. ГЛ-8 в качестве пробиотика в популяциях сельскохозяйственной птицы, подвергающейся воздействию глифосатов. Доказано, что многие бактерии способны метаболизировать глифосат до нетоксичных соединений. Его биодеградация приводит к образованию метаболитов, которые используются в качестве источника углерода, азота и фосфора — элементов, необходимых для развития организмов (45).
Биодеструкция глифосата под влиянием штаммов Bacillus sp. из коллекции ООО «БИОТРОФ+» ( n = 3, M ±SEM; опыт in vitro, ООО «БИОТРОФ+», г. Санкт-Петербург, 2022 год)
|
Наименование штамма |
1 Биодеструкция, % |
|
Bacillus sp. ГЛ-1 Bacillus sp. ГЛ-2 Bacillus sp. ГЛ-3 Bacillus sp. ГЛ-4 Bacillus sp. ГЛ-5 Bacillus sp. ГЛ-6 Bacillus sp. ГЛ-7 Bacillus sp. ГЛ-8 Bacillus sp. ГЛ-9 Bacillus sp. ГЛ-10 Bacillus sp. ГЛ-11 |
15,4±2,40 0 19,2±3,90 6,3±0,52 0 0 0 53,0±4,10 0 13,9±2,30 25,6±2,40 |
Бактериальное разложение глифосата происходит по двум метаболическим путям. Первый путь осуществляется при участии фермента гли-фосатоксидоредуктазы, расщеплящей молекулу глифосата на два метаболита: глиоксилат, который вступает в цикл трикарбоновых кислот и в результате полного окисления образует диоксид углерода, и аминометилфосфоновую кислоту, которая с помощью фермента углерод-фосфорная лиаза (C-P-лиаза) гидролизуется до фосфата и метиламина. Последний превращается в аммиак (прямой источник азота) и формальдегид, который вступает в тетрагидрофолатный цикл. Второй путь деградации включает фермент С-Р-лиазу, которая за счет своей гидролитической активности образует фосфат и саркозин. На следующем этапе, благодаря активности фермента саркозиноксидазы, саркозин превращается в аминокислоту глицин, которая используется непосредственно для метаболизма и микробного биосинтеза, и формальдегид, который вводится в тетрагидрофолатный цикл (46). Показано, что Arthrobacter sp. GLP-1, Alcaligenes sp. GL, Pseudomonas pseudomallei 22 и Flavobacterium sp. GD1 используют глифосат в качестве источника фосфора (47). Пробиотические штаммы микроорганизмов давно применяют в качестве биодеструкторов токсичных соединений в кишечнике (48, 49). Тем не менее нельзя исключить, что в нашем эксперименте определенная доля или весь объем глифосата мог подвергаться не биодеструкции, а сорбции. Поэтому для окончательных выводов требуются более расширенные и детальные исследования.
Согласно анализу прироста живой массы птицы, антибиотики стимулировали (p ≤ 0,05) продуктивность с 14-х сут жизни до конца эксперимента на 4,8-23,3 % (II группа по сравнению с I группой) (рис. 1). Увеличение прироста живой массы бройлеров под влиянием антибиотиков известно давно (8). В конце эксперимента на фоне антибиотиков проявилось негативное воздействие глифосата на продуктивность бройлеров (III группа по сравнению со II группой) (p ≤ 0,05). Это также представляется закономерным, поскольку, во-первых, глифосат может вызывать внутриклеточные изменения и цитотоксичность (18). Известно, что глифосаты влияют на активность митохондрий и, вероятно, усиливают повреждение ДНК (17). Во-вторых, на тканевом и организменном уровнях глифосаты способны нарушать функцию нейротрансмиттера и, вероятно, действовать как эндокринные разрушители (50). Недавние исследования на моделях млекопитающих показали изменение содержания гормонов (51), нарушение полового созревания и репродукции (52). В-третьих, глифосаты могут воздействовать на организмы через изменения в микробных сообществах: шикиматный путь присутствует у большинства бактерий, причем у многих из них его ключевой фермент — энолпирувилшикимат-3-фосфат-синтаза (EPSPS) чувствителен к глифосату (53, 54). Недавно было обнаружено, что глифосаты негативно влияют на кишечные бактериальные сообщества у нескольких модельных организмов, а также в культурах in vitro (55-57).
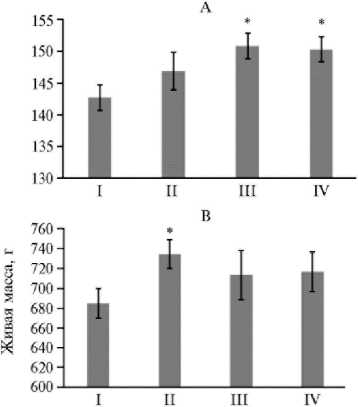
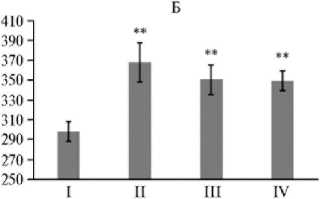
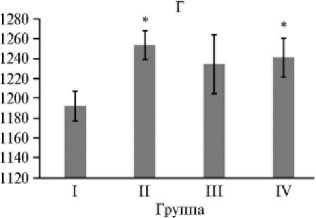
Рис. 1. Живая масса цыплят-бройлеров ( Gallus gallus L.) кросса Ross 308 при скармливании антибиотиков (энрофлоксацина, колистина и флорфеникола), глифосата и штамма Bacillus sp. ГЛ-8: А — на 7-е сут, Б — на 14-е сут, В — на 21-е сут, Г — на 28-е сут, Д — на 35-е сут. Описание групп см. в разделе «Методика» ( n = 40, M ±SEM; опыт в виварии, ООО «БИОТРОФ+», г. Санкт-Петербург, 2022 год).
* и ** Отличия от I контрольной группы статистически значимы при p ≤ 0,05 и p ≤ 0,01.
Группа
Применение Bacillus sp. ГЛ-8 в сочетании с антибиотиками и глифосатом не оказало статистически значимого эффекта на продуктивность бройлеров (см. рис. 1). Это может быть связано с различными причинами, в частности с негативным влиянием антибиотиков на выживаемость и экспрессию генов у штамма микроорганизма-биодеструктора.
В связи с выявленными различиями в продуктивности бройлеров мы провели анализ экспрессии генов, связанных с ростом и формированием мышечных волокон, в ответ на введение в рационы антибиотиков, гли- фосата и штамма микроорганизма-биодеструктора. Наиболее значительные изменения касались гена MYOG, который способствует развитию и дифференцировке мышц. Экспрессия мРНК гена MYOG была выше во II и IV группах соответственно в 2,0 и 2,1 раза по сравнению с I группой (p ≤ 0,05) (рис. 2).
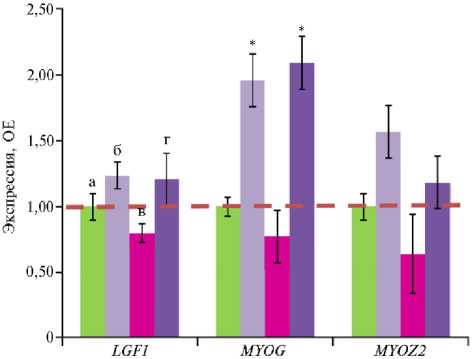
ООО «БИОТРОФ+», г. Санкт-Петербург, 2022 год).
Рис. 2. Экспрессия мРНК генов LGF1, MYOG и MYOZ 2 , связанных с ростом и формированием мышечных волокон, в грудных мышцах цыплят-бройлеров ( Gallus gallus L.) кросса Ross 308 в ответ на скармливание антибиотиков (энрофлок-сацина, колистина и флорфени-кола), глифосата и штамма Bacillus sp. ГЛ-8: а — I группа, б — II группа, в — III группа, г — IV группа. ОЕ — кратность изменений экспрессии по сравнению с I контрольной группой, в которой экспрессия принята за 1 (прерывистая красная линия — экспрессия в контроле). Описание групп см. в разделе «Методика» (данные получены на 35-е сут эксперимента; n = 3, M ± SEM; опыт в виварии,
* Отличия от I контрольной группы статистически значимы при p ≤ 0,05 и p ≤ 0,01.
Ген MYOG (миогенин) — ключевой регуляторный фактор транскрипции, участвующий в развитии мышц во время миогенеза (58). Есть также данные о роли MYOG и после завершения миогенеза. Например, сообщалось о положительной взаимосвязи между увеличением массы грудных мышц и повышением экспрессии мРНК MYOG у 38-суточных бройлеров (59). Известно, что миогенин играет важную роль в поддержании митохондриальной активности при изнурительных физических нагрузках (60).
Мы полагаем, что повышенная экспрессия MYOG в нашем эксперименте играла определенную роль в увеличении живой массы бройлеров в варианте с антибиотиком. Хотя функции MYOG прежде всего связывают с индукцией миогенеза, этот ген также вносит вклад в энергетический метаболизм птиц. Повышенная транскрипционная активность MYOG во II и IV опытных группах могла быть фактором, способствующим усилению митохондриальной функции и повышенному накоплению энергии. В III группе активацию экспрессии MYOG не отмечали (р > 0,05), что свидетельствует о негативном влиянии глифосата на экспрессию генов продуктивности птиц. В целом полученные данные свидетельствовали о некотором сглаживании негативного эффекта глифосата при интродукции штамма микроорганизма.
В экспрессии генов LGF1 (инсулиноподобный фактор роста 1) и MYOZ2 (миозенин) различий между группами мы не обнаружили (р > 0,05).
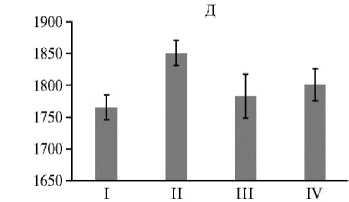
С введением антибиотиков во II группе усилилась экспрессия антимикробных и антивирусных генов Gal9, Gal10 и IRF7 соответственно в 2,6; 10,5 и 40,8 раза по сравнению с контролем (p ≤ 0,05) (рис. 3). Gal9 (AvBD9) и Gal10 (AvBD10) — это гены, связанные с синтезом β-дефензинов птиц (61). Дефензины способствуют адаптивному иммунитету посредством селективного рекрутирования моноцитов, Т-лимфоцитов, незрелых дендритных и тучных клеток в очаги инфекции (62, 63). Эти вещества повышают устойчивость птицы в отношении многих патогенов, включая Klebsiella pneumonia, Streptococcus bovis, Enterococcus faecalis, Salmonella typhimurium (64). Ген IRF7, в свою очередь, связан с синтезом регуляторного фактора интерферона 7 — члена семейства регуляторных факторов транскрипции интерферона (65). Благодаря своей ключевой роли в иммунитете IRF7 участвует в повышении устойчивости макроорганизма ко многим вирусам с помощью различных стратегий (66). Мы предполагаем, что экспрессия генов, связанных с антимикробной и антивирусной защитой, могла модулироваться как непосредственно антибиотиками, так и измененной под их влиянием просветной микробиотой, обитающей в слепой кишке бройлеров.
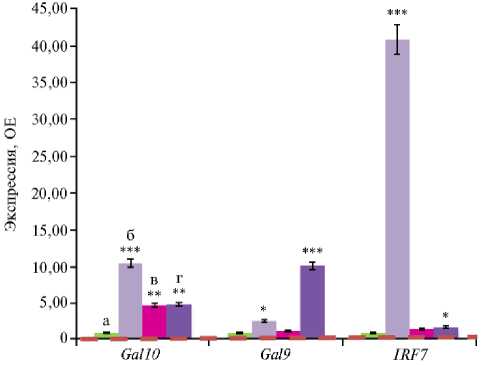
ООО «БИОТРОФ+», г. Санкт-Петербург, 2022 год).
Рис. 3. Экспрессия мРНК генов антимикробной и антивирусной защиты Gal9 , Gal10 и IRF7 в слепых отростках кишечника цыплят-бройлеров ( Gallus gallus L.) кросса Ross 308 в ответ на скармливание антибиотиков (энрофлоксацина, колистина и флорфеникола), глифосата и штамма Bacillus sp. ГЛ-8: а — I группа, б — II группа, в — III группа, г — IV группа. ОЕ — кратность изменений экспрессии по сравнению с I контрольной группой, в которой экспрессия принята за 1 (прерывистая красная линия — экспрессия в контроле). Описание групп см. в разделе «Методика» (данные получены на 35-е сут эксперимента; n = 3, M ±SEM; опыт в виварии,
*, ** и *** Отличия от I контрольной группы статистически значимы соответственно при p ≤ 0,05; p ≤ 0,01 и p ≤ 0,001.
Увеличение экспрессии описанных генов также способно внести вклад в повышение живой массы бройлеров на фоне антибиотиков в связи с возможным снижением патогенной нагрузки. Ранее Т. Terada с соавт. (67) исследовали влияние введения в рацион антибиотиков (пенициллина и стрептомицина) на экспрессию генов в слепой кишке цыплят-бройлеров. Было показано, что на 7-е сут экспрессия AvBD1 и AvBD2 снижалась. Тем не менее на 14-е сут в группе, получавшей антибиотики, экспрессия TLR21 (толл-подобный рецептор, участвующий в антимикробной защите) и генов антимикробных пептидов увеличивалась по сравнению с контролем. В другом исследовании (11) на цыплятах 6-суточного возраста, получавших эн-рофлоксацин в течение первых 5 сут жизни, антибиотик не оказывал подавляющего действия на субпопуляцию лимфоцитов.
В нашем эксперименте глифосат на фоне антибиотиков (III группа) выступал как супрессор экспрессии Gal9, Gal10 и IRF7 по сравнению со II группой (p ≤ 0,05). Снижение экспрессии генов Gal9 и IRF7 в III группе соответствовало показателям контроля без антибиотиков (p > 0,05). Полученные данные могут указывать на то, что глифосат, присутствующий в кормах даже на уровне 1ПДК, негативно воздействует на иммунную систему, одновременно снижая терапевтические и зоотехнические эффекты антибиотиков. Этим может частично объясняться негативное действие глифосата на продуктивность бройлеров в конце эксперимента. Ранее подобные данные были получены при использовании хлорорганического пестицида диль-дрина на крысах (68). Обработка дофаминергических нейрональных клеток дильдрином достоверно снижала экспрессию многих генов, включая гены противовирусного ответа (IFN) (68).
Добавление Bacillus sp. ГЛ-8 в корма на фоне глифосата и антибиотиков (IV группа) привело к усилению экспрессии Gal9 по сравнению с III группой (введение глифосата на фоне антибиотиков без штамма микроорганизма) (p ≤ 0,05). Такие результаты могут свидетельствовать об определенной перспективе снижения негативного воздействия глифосата на механизмы противомикробной и противовирусной защиты при использовании микроорганизмов с полезными свойствами.
Как и для генов антимикробной и антивирусной защиты, прослеживалась тенденция к резкому возрастанию экспрессии провоспалительных генов IL6, IL8 и PTGS2 — соответственно в 4,6; 11,2 и 6,6 раза во II группе по сравнению с контролем (p ≤ 0,05), чем еще раз подтверждается воздействие антибиотиков на иммунные процессы (рис. 4).
14,00-i
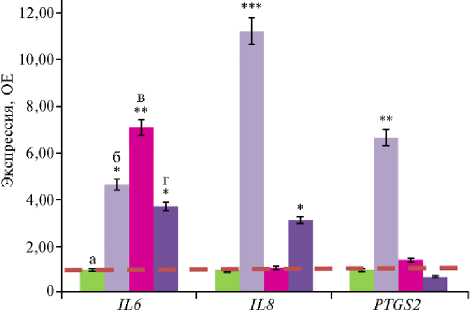
Рис. 4. Экспрессия мРНК провоспа-лительных генов IL6, IL8 и PTGS2 в слепых отростках кишечника цыплят-бройлеров (Gallus gallus L.) кросса Ross 308 в ответ на скармливание антибиотиков (энрофлоксацина, колистина и флорфеникола), глифосата и штамма Bacillus sp. ГЛ-8: а — I группа, б — II группа, в — III группа, г — IV группа. ОЕ — кратность изменений экспрессии по сравнению с I контрольной группой, в которой экспрессия принята за 1 (прерывистая красная линия — экспрессия в контроле). Описание групп см. в разделе «Методика» (данные получены на 35-е сут эксперимента; n = 3, M±SEM; опыт в ви- варии, ООО «БИОТРОФ+», г. Санкт-
Петербург, 2022 год).
*, ** и *** Отличия от I контрольной группы статистически значимы при p ≤ 0,05, p ≤ 0,01 и p ≤ 0,001.
Интересно, что фторхинолоны, к которым относится и использованный в нашем эксперименте энрофлоксацин, влияют на экспрессию генов многих цитокинов (69). Отмечено, что большинство производных фторхинолона супериндуцируют синтез интерлейкина 2 in vitro, но при этом ингибируют синтез интерлейкина 1. Усиление экспрессии провоспа-лительных генов при скармливании антибиотика может иметь различные последствия для здоровья. С одной стороны, интерлейкины (в том числе IL6, IL8) служат частью важных врожденных защитных иммунных ответов, привлекая к месту инфекции дополнительные лейкоциты, которые повышают сопротивление эпителиальных клеток (70, 71). С другой стороны, гиперпродукция провоспалительных цитокинов вовлечена в патогенез целого ряда заболеваний человека, включая COVID-19 (72), а также имеет связь со снижением продуктивности сельскохозяйственных животных (73). Доказано (74, 75), что введение препаратов на основе цитокинов здоровым животным провоцировало нежелательные симптомы. Активация провоспали-тельных цитокинов тесно связана с экспрессией гена PTGS2, поскольку цитокины способны ее индуцировать (76). Ген PTGS2 связан с синтезом эн-допероксидсинтазы простагландинов (циклооксигеназы 2), которая катализирует окислительное превращение арахидоновой кислоты в простагландин. Простагландин впоследствии метаболизируется до различных биологически активных метаболитов, таких как простациклин и тромбоксан А2, принимая участие как в местных, так и в системных воспалительных реакциях (77).
В нашем эксперименте действие глифосата, добавленного в корма, на провоспалительные гены проявилось по-разному. Так, экспрессия IL6 усилилась в III группе по сравнению со II (p ≤ 0,05), а экспрессия IL8 и PTGS2 снизилась (p ≤ 0,05). О том, что пестициды в большинстве случаев служат индукторами экспрессии IL6 , сообщалось в большинстве ранее опубликованных исследований. Так, хроническое воздействие на крыс ди-хлорвосом (фосфорорганическим инсектицидом) вызывает активацию микроглии с индукцией НАДФН-оксидазы и провоспалительных цитокинов, включая TNF-α, IL-1β и IL6 (78). Y. Zhang с соавт. (79) продемонстрировали повышение содержания малонового диальдегида и IL6 в мышцах крыс, подвергшихся воздействию ометоата — инсектицида, широко используемого в развивающихся странах. Авторы пришли к выводу, что ометоат может вызывать резистентность к инсулину. Кроме того, перекрестное исследование показало, что фермеры, оказавшиеся под воздействием фосфорорганических пестицидов в силу профессиональной деятельности, подвержены развитию диабета (79). Цитокины, продуцируемые жировой тканью, например TNF-α и IL6, контролируют секрецию С-реактивного белка из печени (80, 81). Стимуляция этого воспалительного механизма, по-види-мому, служит триггером резистентности к инсулину в периферических тканях (82).
Применение микроорганизма-биодеструктора позитивно повлияло на экспрессию провоспалительных генов. Так, экспрессия IL6 снизилась в IV группе по сравнению с III, а IL8 , напротив, повысилась (p ≤ 0,05). Действительно, некоторые полезные бактерии, ферментируя пищевые волокна, образуют короткоцепочечные жирные кислоты, в частности ацетат, пропионат и бутират, которые поглощаются клетками кишечника и используются в качестве источника энергии для их метаболизма (83). Было показано, что короткоцепочечные жирные кислоты, например бутират, ингибируют продукцию NO и снижают экспрессию генов цитокинов, таких как IL-1β, IL6, IFN-γ и IL-10 (84).
Введение в рацион бройлеров антибиотиков оказало некоторое стимулирующее действие на экспрессию гена GSTA3 (p ≤ 0,05) (рис. 5). Интересно, что добавление в рацион глифосата на фоне антибиотиков не изменяло экспрессию этого гена по сравнению с таковой во II группе (p > 0,05). Полученные результаты представляются вполне закономерными. Ген GSTA3 связан с синтезом глутатион-S-трансферазы — фермента, отвечающего за противодействие организма канцерогенам, терапевтическим препаратам, токсинам окружающей среды и продуктам окислительного стресса (85). Этот фермент катализируют нуклеофильное улавливание ксенобиотиков глутатионом, который нейтрализует свободные радикалы из-за высокой электронодонорной способности его сульфидрильной (–SH) группы и предотвращает повреждение важных клеточных компонентов, тем самым участвуя в клеточной защите от токсических веществ. Глутатион-S-трансфераза в изобилии присутствует в печени, желудочно-кишечном тракте, легких и почках (85). Общеизвестно, что кумарин, этоксикин, афлатоксин В 1 и другие соединения, такие как фенольные антиоксиданты и изотиоцианаты, действуют как индукторы ферментов ксенобиотического метаболизма (8688). Вероятно, в нашем эксперименте антибиотики выступали в роли индукторов гена GSTA3 , будучи чужеродными для организма веществами .
Штамм Bacillus sp. ГЛ-8 оказал позитивное воздействие на экспрессию GSTA3 (IV группа по сравнению с III) (p ≤ 0,05): она снизилась до контрольных значений. Ранее сообщалось, что кишечная микробиота может влиять на синтез ферментов, метаболизирующих ксенобиотики, в толстой кишке и печени. Самые высокие концентрации ферментов, метаболизирующих ксенобиотики, наблюдаются у безмикробных животных (89). Возможно, эффект от интродукции микроорганизма был связан с уменьшением токсической нагрузки под влиянием антибиотиков.
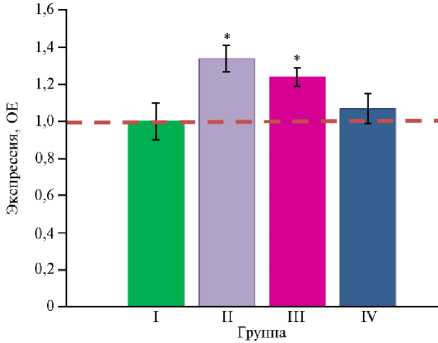
Рис. 5. Экспрессия мРНК гена GSTA3 , связанного с устойчивостью к токсическим и лекарственным веществам, в слепых отростках кишечника цыплят-бройлеров ( Gallus gallus L.) кросса Ross 308 в ответ на скармливание антибиотиков (энрофлоксацина, колистина и флорфеникола), глифосата и штамма Bacillus sp. ГЛ-8. ОЕ — кратность изменений экспрессии по сравнению с I контрольной группой, в которой экспрессия принята за 1 (прерывистая красная линия — экспрессия в контроле). Описание групп см. в разделе «Методика» (данные получены на 35-е сут эксперимента; n = 3, M ±SEM; опыт в виварии, ООО «БИОТРОФ+», г. Санкт-Петербург, 2022 год).
* Отличия от I контрольной группы статистически значимы при p ≤ 0,05.
Обсуждая полученные результаты, следует отметить, что информация о клеточных и молекулярных процессах, посредством которых антибиотики улучшают рост животных, ограничена, а предложенные гипотезы сводятся в основном к возможности модуляции микрофлоры. Вместе с тем понимание биологического механизма действия антибиотиков на стимуляцию роста сельскохозяйственных животных и птицы необходимо для создания эффективных альтернатив антибактериальным препаратам. Разрабатываемые средства должны обладать сходной стимулирующей активностью, но позволят избежать проблем возникновения устойчивости к противомик-робным агентам.
В представленном исследовании мы выявили позитивное влияние антибиотиков на показатели продуктивности бройлеров, что соответствовало уровню экспрессии ряда генов, в частности связанных с развитием и дифференцировкой мышц. По всей вероятности, механизм позитивного действия антибиотиков на продуктивность частично связан с тем, что они выступают в роли индукторов ряда важных генов.
На практике сельскохозяйственная птица подвергается воздействию не только лекарственных веществ, но и токсикантов, содержащихся в кормах, в частности остаточных количеств пестицидов. Последствия для здоровья, возникающие в результате синергетического действия антибиотиков и пестицидов, непредсказуемы. В нашем эксперименте на фоне глифосатов, вносимых в количестве, соответствующем 1ПДК, у бройлеров наблюдалось снижение эффекта стимуляции продуктивности под влиянием антибиотиков. Мы показали, что воздействие глифосатов происходит, в том числе, через нарушение активности некоторых ключевых генов птицы. Полученные данные указывают на необходимость привлечения внимания к проблеме содержания глифосатов в кормах для птицы и уточнения границ ПДК глифосатов в кормах.
Штамм Bacillus sp. ГЛ-8, проявляющий свойства биодеструктора in vitro, не способствовал достоверному улучшению показателей роста у цыплят-бройлеров при экспериментальном загрязнении кормов глифосатами. Это свидетельствует о необходимости селекции микроорганизмов с учетом комплекса свойств, включая выживаемость в желудочно-кишечном тракте, адгезию и другие пробиотические характеристики. Тем не менее наблюдаемые позитивные изменения в транскрипции ряда генов, включая гены антимикробной и антивирусной защиты, под влиянием штамма микроорганизма-биодеструктора указывают на перспективность использования пробиотиков как инструмента смягчения физиологического дисбаланса на фоне применения лекарственных веществ и загрязнения корма токсическими веществами. В дальнейшем представляет интерес точная видовая идентификация и изучение других важных пробиотических свойств и технологических характеристик штамма Bacillus sp. ГЛ-8, например его устойчивости к антибиотикам и лекарственным препаратам, применяемым для кормления сельскохозяйственной птицы.
В настоящем исследовании представлены результаты сложного многокомпонентного эксперимента, в котором мы использовали три различные по действию и назначению добавки в кормах цыплят-бройлеров (антибиотики, пестицид, штамм Bacillus sp.). Безусловно, это усложняет интерпретацию результатов. Например, бактериальный штамм мог оказать воздействие на продуктивность и экспрессию некоторых генов у птиц вне зависимости от введения антибиотиков, а антибиотики, в свою очередь, могли препятствовать колонизации кишечника птицы этим штаммом. В последующих экспериментах важно установить точное влияние бактериальных штаммов-деструкторов на продуктивность и экспрессию некоторых генов у птицы, а также прямой эффект, оказываемый антибиотиками на способность штаммов-деструкторов колонизировать кишечник птицы. Также представляет интерес изучение колонизации кишечника штаммами пробиотических микроорганизмов.
Итак, из 11 изученных штаммов бацилл наиболее выраженной способностью к биодеструкции глифосата (53,0±4,10 %) обладал штамм Bacillus sp. ГЛ-8. Антибиотики энрофлоксацин, колистин и флорфеникол стимулировали прирост живой массы у цыплят-бройлеров кросса Ross 308 с 14-х сут жизни до конца эксперимента на 4,8-23,3 %. К завершению эксперимента проявилось негативное влияние глифосата на продуктивность бройлеров на фоне антибиотиков. Экспрессия мРНК гена MYOG, который способствует развитию и дифференцировке мышц, была выше у бройлеров, получавших антибиотики отдельно или в сочетании с Bacillus sp. ГЛ-8 — соответственно в 2,0 и 2,1 раза по сравнению с контролем. При добавлении в корма глифосата на фоне антибиотика без интродукции штамма микроорганизма-биодеструктора изменений экспрессии гена MYOG не отмечали. При введении антибиотиков усилилась экспрессия генов антимикробной (Gal9, Gal10) и антивирусной (IRF7) защиты — соответственно в 2,6; 10,5 и 40,8 раза по сравнению с контролем. При этом глифосат подавлял экспрессию антимикробных и антивирусных генов. В то же время при интродукции штамма Bacillus sp. ГЛ-8 в корма на фоне глифосата и антибиотиков экспрессия Gal9 повышалась. По аналогии с генами антимикробной и антивирусной защиты у провоспалительных генов IL6, IL8 и PTGS2 прослеживалась тенденция резкого возрастания экспрессии (соответственно в 4,6; 11,2 и 6,6 раза) в вариантах с применением антибиотиков. Введение в рацион антибиотиков также оказало некоторое стимулирующее воздействие на экс- прессию гена GSTA3, связанного с устойчивостью к токсическим и лекарственным веществам.
Список литературы Продуктивность и экспрессия генов у цыплят-бройлеров (Gallus gallus L.) кросса Ross 308 под влиянием антибиотиков, глифосата и штамма Bacillus sp
- Danzeisen J.L., Clayton J.B., Huang H., Knights D., McComb B., Hayer S.S., Johnson T.J. Temporal relationships exist between cecum, ileum, and litter bacterial microbiomes in a com-mercial turkey flock, and subtherapeutic penicillin treatment impacts ileum bacterial community establishment. Frontiers in Environmental Science, 2015, 2: 56 (doi: 10.3389/fvets.2015.00056).
- Pourabedin M., Guan L., Zhao X. Xylo-oligosaccharides and virginiamycin differentially modu-late gut microbial composition in chickens. Microbiome, 2015, 3(1): 15 (doi: 10.1186/s40168-015-0079-4).
- Bohaychuk V.M., Gensler G.E., King R.K., Manninen K.I., Sorensen O., Wu J.T., Stiles M.E., McMullen L.M. Occurrence of pathogens in raw and ready-to-eat meat and poultry products collected from the retail marketplace in Edmonton, Alberta, Canada. Journal of Food Protection, 2006, 69(9): 2176-2182 (doi: 10.4315/0362-028x-69.9.2176).
- Chrząstek K., Wieliczko A. The influence of enrofloxacin, florfenicol, ceftiofur and E. coli LPS interaction on T and B cells subset in chicks. Veterinary Research Communications, 2015, 39(1): 53-60 (doi: 10.1007/s11259-015-9632-7).
- Khalifeh M.S., Amawi M.M., Abu-Basha E.A., Yonis I.B. Assessment of humoral and cellular-mediated immune response in chickens treated with tilmicosin, florfenicol, or enrofloxacin at the time of Newcastle disease vaccination. Poultry Science, 2009, 88(10): 2118-2124 (doi: 10.3382/ps.2009-00215).
- Ellakany H.F., Abu El-Azm I.M., Bekhit A.A., Shehawy M.M. Studies on the effects of enroflox-acin overdose on different health parameters in broiler chickens. Journal of Veterinary Medical Research, 2008, 18(1): 176-186 (doi: 10.21608/jvmr.2008.77869).
- Tokarzewski S. Influence of enrofloxacin and chloramphenicol on the level of IgY in serum and egg yolk after immunostimulation of hens with Salmonella enteritidis antigens. Polish Journal of Veterinary Sciences, 2002, 5(3): 151-158.
- Mehdi Y., Létourneau-Montminy M.P., Gaucher M.L., Chorfi Y., Suresh G., Rouissi T., Brar S.K., Côté C., Ramirez A.A., Godbout S. Use of antibiotics in broiler production: global impacts and alternatives. Animal Nutrition, 2018, 4(2): 170-178 (doi: 10.1016/j.aninu.2018.03.002).
- Eyssen H., de Somer P. The mode of action of antibiotics in stimulating growth of chicks. Journal of Experimental Medicine, 1963, 117(1): 127-38 (doi: 10.1084/jem.117.1.127).
- Lin J., Hunkapiller A.A., Layton A.C., Chang Y.J., Robbins K.R. Response of intestinal micro-biota to antibiotic growth promoters in chickens. Foodborne Pathogens and Disease, 2013, 10(4): 331-337 (doi: 10.1089/fpd.2012.1348).
- Jankowski J., Tykałowski B., Stępniowska A., Konieczka P., Koncicki A., Matusevičius P., Og-nik K. Immune parameters in chickens treated with antibiotics and probiotics during early life. Animals (Basel), 2022, 12(9): 1133 (doi: 10.3390/ani12091133).
- Yu M., Mu C., Yang Y., Zhang C., Su Y., Huang Z., Yu K., Zhu W. Increases in circulating amino acids with in-feed antibiotics correlated with gene expression of intestinal amino acid transporters in piglets. Amino Acids, 2017, 49(9): 1587-1599 (doi: 10.1007/s00726-017-2451-0).
- Lu P., Choi J., Yang C., Mogire M., Liu S., Lahaye L., Adewole D., Rodas-Gonzalez A., Yang C. Effects of antibiotic growth promoter and dietary protease on growth performance, apparent ileal digestibility, intestinal morphology, meat quality, and intestinal gene expression in broiler chick-ens: a comparison. Journal of Animal Science, 2020, 98(9): skaa254 (doi: 10.1093/jas/skaa254).
- Tallentire C.W., Leinonen I., Kyriazakis I. Breeding for efficiency in the broiler chicken: a review. Agronomy for Sustainable Development, 2016, 36(4): 66 (doi: 10.1007/s13593-016-0398-2).
- Cuhra M., Bøhn T., Cuhra P. Glyphosate: Too much of a good thing? Frontiers in Environment Science, 2016, 4: e28 (doi: 10.3389/fenvs.2016.00028).
- Xu J., Smith S., Smith G., Wang W., Li Y. Glyphosate contamination in grains and foods: an overview. Food Control, 2019, 106(12): 106710 (doi: 10.1016/j.foodcont.2019.106710).
- Tarazona J.V., Court-Marques D., Tiramani M., Reich H., Pfeil R., Istace F., Crivellente F. Glyphosate toxicity and carcinogenicity: a review of the scientific basis of the European Union assessment and its differences with IARC. Archives of Toxicology, 2017, 91(11): 2723-2743 (doi: 10.1007/s00204-017-1962-5).
- Székács A., Darvas B. Re-registration challenges of glyphosate in the European Union. Frontiers in Environmental Science, 2018, 6: 35 (doi: 10.3389/fenvs.2018.00078).
- Oswald I.P. Role of intestinal epithelial cells in the innate immune defence of the pig intestine. Veterinary Research, 2006, 37(3): 359-368 (doi: 10.1051/vetres:2006006).
- Nochi T., Jansen C.A., Toyomizu M., van Eden W. The well-developed mucosal immune systems of birds and mammals allow for similar approaches of mucosal vaccination in both types of ani-mals. Frontiers in Nutrition, 2018, 5: 60 (doi: 10.3389/fnut.2018.00060).
- Casteleyn C., Doom M., Lambrechts E., Van den Broeck W., Simoens P., Cornillie P. Locations of gut-associated lymphoid tissue in the 3-month-old chicken: a review. Avian Pathology, 2010, 39(3): 143-150 (doi: 10.1080/03079451003786105).
- Bar-Shira E., Sklan D., Friedman A. Establishment of immune competence in the avian GALT during the immediate post-hatch period. Developmental and Comparative Immunology, 2003, 27(2): 147-157 (doi: 10.1016/s0145-305x(02)00076-9).
- Goitsuka R., Chen C.-L.H., Benyon L., Asano Y., Kitamura D., Cooper M.D. Chicken catheli-cidin-B1, an antimicrobial guardian at the mucosal M cell gateway. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(38): 15063-15068 (doi: 10.1073/pnas.0707037104).
- Nile C.J., Townes C.L., Michailidis G., Hirst B.H., Hall J. Identification of chicken lysozyme g2 and its expression in the intestine. CMLS, Cell. Mol. Life Sci., 2004, 61(21): 2760-2766 (doi: 10.1007/s00018-004-4345-z).
- Cuperus T., van Dijk A., Dwars R.M., Haagsman H.P. Localization and developmental expres-sion of two chicken host defense peptides: cathelicidin-2 and avian β-defensin 9. Developmental and Comparative Immunology, 2016, 61: 48-59 (doi: 10.1016/j.dci.2016.03.008).
- Kurenbach B., Marjoshi D., Amábile-Cuevas C.F., Ferguson G.C., Godsoe W., Gibson P., Heinemann J.A. Sublethal exposure to commercial formulations of the herbicides dicamba, 2,4-dichlorophenoxyacetic acid, and glyphosate cause changes in antibiotic susceptibility in Esche-richia coli and Salmonella enterica serovar Typhimurium. mBio, 2015, 6(2): e00009-15 (doi: 10.1128/mBio.00009-15).
- Ognik K., Konieczka P., Stępniowska A., Jankowski J. Oxidative and epigenetic changes and gut permeability response in early-treated chickens with antibiotic or probiotic. Animals, 2020, 10(12): 2204 (doi: 10.3390/ani10122204).
- Krauze M., Abramowicz K., Ognik K. The effect of addition of probiotic bacteria (Bacillus subtilis or Enterococcus faecium) or phytobiotic containing cinnamon oil to drinking water on the health and performance of broiler. Annals of Animal Science, 2020, 20: 191-205 (doi: 10.2478/aoas-2019-0059).
- Abramowicz K., Krauze M., Ognik K. Use of Bacillus subtilis PB6 enriched with choline to improve growth performance, immune status, histological parameters and intestinal microbiota of broiler chickens. Animal Production Science, 2020, 60(5): 625-634 (doi: 10.1071/AN18737).
- Chen Y., Wen C., Zhou Y. Dietary synbiotic incorporation as an alternative to antibiotic improves growth performance, intestinal morphology, immunity and antioxidant capacity of broilers. Jour-nal of the Science of Food and Agriculture, 2018, 98(9): 3343-3350 (doi: 10.1002/jsfa.8838).
- Łukasik J., Guo Q., Boulos L., Szajewska H., Johnston B.C. Probiotics for the prevention of antibiotic-associated adverse events in children-A scoping review to inform development of a core outcome set. PLoS ONE, 2020, 15(5): e0228824 (doi: 10.1371/journal.pone.0228824).
- Cheng G., Hao H., Xie S., Wang X., Dai M., Huang L., Yuan Z. Antibiotic alternatives: The substitution of antibiotics in animal husbandry? Frontiers in Microbiology, 2014, 5: 217 (doi: 10.3389/fmicb.2014.00217).
- Nichols R.G., Davenport E.R. The relationship between the gut microbiome and host gene ex-pression: a review. Human Genetics, 2021, 140(5): 747-760 (doi: 10.1007/s00439-020-02237-0).
- Rashidi N., Khatibjoo A., Taherpour K., Akbari-Gharaei M., Shirzadi H. Effects of licorice ex-tract, probiotic, toxin binder and poultry litter biochar on performance, immune function, blood indices and liver histopathology of broilers exposed to aflatoxin-B1. Poultry Science, 2020, 99(11): 5896-5906 (doi: 10.1016/j.psj.2020.08.034).
- Firdous S., Iqbal S., Anwar S. Optimization and modeling of glyphosate biodegradation by a novel Comamonas odontotermitis P2 through response surface methodology. Pedosphere, 2017, 30(5): 618-627 (doi: 10.1016/S1002-0160(17)60381-3).
- European Convention for the Protection of Vertebrate Animals used for Experimental and other Scientific Purposes (ETS № 123) (Strasburg, 18.03.1986).
- Егоров И.А., Манукян В.А., Ленкова Т.Н., Околелова Т.М., Лукашенко В.С. Методика проведения научных и производстве нных исследований по кормлению сельскохозяйственной птицы. Молекулярно генетические методы определения микрофлоры кишечника /Под ред. В.И. Фисинина. Сергиев Посад, 2013
- СанПиН 1.2.3685-21. Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания.
- Zeka F., Vanderheyden K., De Smet E., Cuvelier C. A.A., Mestdagh P., Vandesompele J. forward and sensitive RT qPCR based gene expression analysis of FFPE samples. Scientific Re- ports , 2016, 6: 21418 (doi: 10.1038/srep21418).
- Yue H., Lei X.W., Yang F.L., Li M.Y., Tang C. Reference gene selection for normalization of PCR analysis in chicken embryo fibroblast infected with H5N1 AIV. Virol Sin .., 2010, 25(6): 425 4 31 (doi: 10.1007/s12250 010 3114 4).
- Meza Cerda M.I., Gray R., Higgins D.P. Cytokine RT qPCR and ddPCR for immunological investigations of the endangered Australian sea lion ( Neophoca cinerea ) and other mammals. PeerJ , 2020, 8: e10306 (doi: 10.7717/peerj.10306).
- Laptev G.Y., Filippova V.A., Kochish I.I., Yildirim E.A., Ilin a L.A., Dubrovin A.V., Brazhnik E.A., Novikova N.I., Novikova O.B., Dmitrieva M.E., Smol ensky V.I., Surai P.F., Griffin D.K., Romanov M.N. Examination of the expression of immunity genes and bac terial profiles in the caecum of growing chickens infected with Salmonella enteritidis and fed a phytobiotic. Animals , 2019, 9(9): 615 (doi: 10.3390/ani9090615).
- Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real time quantitative PCR and the 2 ΔΔCT method. Methods , 2001, 25(4): 402 408 (doi: 10.1006/meth.2001.1262).
- Имангулов Ш.А., Егоров И.А., Околелова Т. М., Тишенков А.Н., Ленкова Т.Н., Паньков П.Н., Езерская А.В., Игнатова Г.В., Догадаева И.В., Авдонин Б.Ф., Петрина З.А., Борисова Т.В., Громова Т.И. Методика проведения научных и производственных исследований по кормлению сельскохозяйственной птицы: рекомендации /Под ред. В.И. Фисинина, Ш.А. Иман-гулова. Сергиев Посад, 2004
- Hove Jensen B., Zechel D.L., Jochimsen B. Utilization of glyphosate as phosphate source: Biochemistry and genetics of bacterial carbon phosphorus lyase. Microbiol. Mol. Biol. Rev 2014, 78 ( 176 197 (doi: 10.1128/MMBR.00040 13)
- Zhan H., Feng Y., Fan X., Chen S. Recent advances in glyphosate biodegradation. Appl. Micro-biol. Biotechnol., 2018, 102(12): 5033-5043 (doi: 10.1007/s00253-018-9035-0).
- Balthazor T.M., Hallas L.E. Glyphosate-degrading microorganisms from industrial activated sludge. Applied and Environmental Microbiology, 1986, 51(2): 432-434 (doi: 10.1128/AEM.51.2.432-434.1986).
- Średnicka P., Juszczuk-Kubiak E., Wójcicki M., Akimowicz M., Roszko M.Ł. Probiotics as a biological detoxification tool of food chemical contamination: a review. Food Chem. Toxicol., 2021, 153: 112306 (doi: 10.1016/j.fct.2021.112306).
- Pop O.L., Suharoschi R., Gabbianelli R. Biodetoxification and protective properties of probiotics. Microorganisms, 2022, 10(7): 1278 (doi: 10.3390/microorganisms10071278).
- Gill J.P.K., Sethi N., Mohan A., Datta S., Girdhar M. Glyphosate toxicity for animals. Environ-mental Chemistry Letters, 2018, 16(10): 401-426 (doi: 10.1007/s10311-017-0689-0).
- Manservisi F., Lesseur C., Panzacchi S., Mandrioli D., Falcioni L., Bua L., Manservigi M., Spinaci M., Galeati G., Mantovani A., Lorenzetti S., Miglio R., Andrade A.M., Kristensen D.M., Perry M.J., Swan S.H., Chen J., Belpoggi F. The Ramazzini Institute 13-week pilot study glypho-sate-based herbicides administered at human-equivalent dose to Sprague Dawley rats: effects on development and endocrine system. Environmental Health, 2019, 18(1): 15 (doi: 10.1186/s12940-019-0453-y).
- Alarcón R., Ingaramo P.I., Rivera O.E., Dioguardi G.H., Repetti M.R., Demonte L.D., Mi-lesi M.M., Varayoud J., Muñoz-de-Toro M., Luque E.H. Neonatal exposure to a glyphosate-based herbicide alters the histofunctional differentiation of the ovaries and uterus in lambs. Mo-lecular and Cellular Endocrinology, 2019, 482: 45-56 (doi: 10.1016/j.mce.2018.12.007).
- Van Bruggen A., He M.M., Shin K., Mai V., Jeong K.C., Finckh M.R., Morris J.G. Jr. Envi-ronmental and health effects of the herbicide glyphosate. Science of The Total Environment, 2018, 616-617: 255-268 (doi: 10.1016/j.scitotenv.2017.10.3090).
- Leino L., Tall T., Helander M., Saloniemi I., Saikkonen K., Ruuskanen S., Puigbò P. Classifi-cation of glyphosate’s target enzyme (5-enolpyruvylshikimate-3-phosphate synthase). BioRxiv, 2020, 408: 124556 (doi: 10.1101/2020.05.27.118265).
- Aitbali Y., Ba-M'hamed S., Elhidar N., Nafis A., Soraa N., Bennis M. Glyphosate based-herbi-cide exposure affects gut microbiota, anxiety and depression-like behaviors in mice. Neurotoxicol-ogy and Teratology, 2018, 67: 44-49 (doi: 10.1016/j.ntt.2018.04.002).
- Motta E.V.S., Raymann K., Moran N.A. Glyphosate perturbs the gut microbiota of honey bees. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(41): 10305-10310 (doi: 10.1073/pnas.1803880115). 57. Mesnage R., Teixeira M., Mandrioli D., Falcioni L., Ducarmon Q.R., Zwittink R.D., Mazzacuva F., Caldwell A., Halket J., Amiel C., Panoff J.-M., Belpoggi F., Antoniou M.N. Use of shotgun metagenomics and metabolomics to evaluate the impact of glyphosate or roundup MON 52276 on the gut microbiota and serum metabolome of Sprague-Dawley rats. Environmental Health Perspectives, 2021, 129(1): CID 017005 (doi: 10.1289/EHP6990).
- Faralli H., Dilworth E.J. Turning on myogenin in muscle: a paradigm for understanding mecha-nisms of tissue-specific gene expression. Comparative and Functional Genomics, 2012, 2012: 836374 (doi: 10.1155/2012/836374).
- Xiao Y., Wu C., Li K., Gui G., Zhang G., Yang H. Association of growth rate with hormone levels and myogenic gene expression profile in broilers. Journal of Animal Science and Biotechnol-ogy, 2017, 8: 43 (doi: 10.1186/s40104-017-0170-8).
- Flynn J.E., Meadows E., Fiorotto M., Klein W.H. Myogenin regulates exercise capacity and skeletal muscle metabolism in the adult mouse. PLoS ONE, 2011, 5(10): e13535 (doi: 10.1371/journal.pone.0013535).
- van Dijk A., Veldhuizen E.J.A., Haagsman H.P. Avian defensins. Veterinary Immunology and Immunopathology, 2008, 124(1-2): 1-18 (doi: 10.1016/j.vetimm.2007.12.006).
- Yang D., Chertov O., Bykovskaia S.N., Chen Q., Buffo M.J., Shogan J., Anderson M., Schrö-der J.M., Wang J.M., Howard O.M., Oppenheim J.J. Beta-defensins: linking innate and adaptive immunity through dendritic and T cell CCR6. Science, 1999, 286(5439): 525-528 (doi: 10.1126/science.286.5439.525).
- Niyonsaba F., Iwabuchi K., Matsuda H., Ogawa H., Nagaoka I. Epithelial cell-derived human beta-defensin-2 acts as a chemotaxin for mast cells through a pertussis toxin-sensitive and phospholipase C-dependent pathway. International Immunology, 2002, 14(4): 421-426 (doi: 10.1093/intimm/14.4.421).
- Yacoub H.A., Elazzazy A.M., Abuzinadah O.A.H., Al-Hejin A.M., Mahmoud M.M., Harakeh S.M. Antimicrobial activities of chicken β-defensin (4 and 10) peptides against patho-genic bacteria and fungi. Frontiers in Cellular and Infection Microbiology, 2015, 5: 36 (doi: 10.3389/fcimb.2015.00036).
- Ning S., Pagano J.S., Barber G.N. IRF7: activation, regulation, modification and function. Genes and Immunity, 2011, 12(6): 399-414 (doi: 10.1038/gene.2011.21).
- Haller O., Kochs G., Weber F. The interferon response circuit: induction and suppression by pathogenic viruses. Virology, 2006, 344(1): 119-130 (doi: 10.1016/j.virol.2005.09.024).
- Terada T., Nii T., Isobe N., Yoshimura Y. Effect of antibiotic treatment on microbial composition and expression of antimicrobial peptides and cytokines in the chick cecum. Poultry Science, 2020, 99(7): 3385-3392 (doi: 10.1016/j.psj.2020.03.016).
- Russo M., Humes S.T., Figueroa A.M., Tagmount A., Zhang P., Loguinov A., Lednicky J.A., Sabo-Attwood T., Vulpe C.D., Liu B. Organochlorine pesticide dieldrin suppresses cellular inter-feron-related antiviral gene expression. Toxicological Sciences, 2021, 182(2): 260-274 (doi: 10.1093/toxsci/kfab064).
- Dalhoff A., Shalit I. Immunomodulatory effects of quinolones. The Lancet Infectious Diseases, 2003, 3(6): 359-371 (doi: 10.1016/S1473-3099(03)00658-3).
- Moldawer L.L., Gelin J., Scherstén T., Lundholm K.G. Circulating interleukin 1 and tumor necrosis factor during inflammation. The American Journal of Physiology, 1987, 253(6): 922-928 (doi: 10.1152/ajpregu.1987.253.6.R922).
- Cannon J.G., Tompkins R.G., Gelfand J.A., Michie H.R., Stanford G.G., van der Meer J.W., Endres S., Lonnemann G., Corsetti J., Chernow B., Wilmore D.W., Wolff S.M., Burke J.F., Dinarello C.A. Circulating IL-1 and TNF in septic shock and experimental endotoxin fever. The Journal of Infectious Diseases, 1990, 161(1): 79-84 (doi: 10.1093/infdis/161.1.79).
- Darif D., Hammi I., Kihel A., El Idrissi Saik I., Guessous F., Akarid K. The pro-inflammatory cytokines in COVID-19 pathogenesis: What goes wrong? Microbial Pathogenesis, 2021, 153: 104799 (doi: 10.1016/j.micpath.2021.104799).
- Broom L.J., Kogut M.H. Inflammation: friend or foe for animal production? Poultry Science, 2018, 97(2): 510-514 (doi: 10.3382/ps/pex314).
- Tracey K.J., Wei H., Manogue K.R., Fong Y., Hesse D.G., Nguyen H.T., Kuo G.C., Beutler B., Cotran R.S., Cerami A. Cachectin/tumor necrosis factor induces cachexia, anemia, and inflamma-tion. The Journal of Experimental Medicine, 1988, 167(3): 1211-1227 (doi: 10.1084/jem.167.3.1211).
- Fong Y., Moldawer L.L., Marano M., Wei H., Barber A., Manogue K., Tracey K.J., Kuo G. Cachectin/TNF or IL-1 alpha induces cachexia with redistribution of body proteins. The American Journal of Physiology, 1989, 256(3): R659-R665 (doi: 10.1152/ajpregu.1989.256.3.R659).
- Prescott S.M., Fitzpatrick F.A. Cyclooxygenase-2 and carcinogenesis. Biochimica et Biophysica Acta, 2000, 1470(2): 69-78 (doi: 10.1016/s0304-419x(00)00006-8).
- Thuresson E.D., Lakkides K.M., Rieke C.J., Sun Y., Wingerd B.A., Micielli R., Mulichak A.M., Malkowski M.G., Garavito R.M., Smith W.L. Prostaglandin Endoperoxide H Synthase-1: The functions of cyclooxygenase active site residues in the binding, positioning, and oxygenation of arachidonic acid 210. Journal of Biological Chemistry, 2001, 276(13): 10347-10357 (doi: 10.1074/jbc.M009377200).
- Binukumar B.K., Bal A., Gill K.D. Chronic dichlorvos exposure: microglial activation, proin-flammatory cytokines and damage to nigrostriatal dopaminergic system. Neuromolecular Medicine, 2011, 13(4): 251-265 (doi: 10.1007/s12017-011-8156-8).
- Zhang Y., Ren M., Li J., Wei Q., Ren Z., Lv J., Niu F., Ren S. Does omethoate have the potential to cause insulin resistance? Environmental Toxicology and Pharmacology, 2014, 37(1): 284-290 (doi: 10.1016/j.etap.2013.11.030).
- Wellen K.E., Hotamisligil G.S. Inflammation, stress, and diabetes. The Journal of Clinical Inves-tigation, 2005, 115(5): 1111-1119 (doi: 10.1172/JCI25102).
- Zhang K., Shen X., Wu J., Sakaki K., Saunders T., Rutkowski D.T., Back S.H., Kaufman R.J: Endoplasmic reticulum stress activates cleavage of CREBH to induce a systemic inflammatory response. Cell, 2006, 124(3): 587-599 (doi: 10.1016/j.cell.2005.11.040).
- Yudkin J.S., Stehouwer C.D., Emeis J.J., Coppack S.W. C-reactive protein in healthy subjects: associations with obesity, insulin resistance, and endothelial dysfunction: a potential role for cy-tokines originating from adipose tissue? Arteriosclerosis, Thrombosis, and Vascular Biology, 1999, 19(4): 972-978 (doi: 10.1161/01.atv.19.4.972).
- Tan J., McKenzie C., Potamitis M., Thorburn A.N., Mackay C.R., Macia L. The role of short-chain fatty acids in health and disease. Advances in Immunology, 2014, 121: 91-119 (doi: 10.1016/B978-0-12-800100-4.00003-9).
- Usami M., Kishimoto K., Ohata A., Miyoshi M., Aoyama M., Fueda Y., Kotani J. Butyrate and trichostatin A attenuate nuclear factor κB activation and tumor necrosis factor α secretion and increase prostaglandin E2 secretion in human peripheral blood mononuclear cells. Nutrition Re-search, 2008, 28(5): 321-328 (doi: 10.1016/j.nutres.2008.02.012).
- Xu C., Li C.Y., Kong A.N. Induction of phase I, II and III drug metabolism/transport by xeno-biotics. Archives of Pharmacal Research, 2005, 28(3): 249-268 (doi: 10.1007/BF02977789).
- McLellan L.I., Judah D.J., Neal G.E., Hayes J.D. Regulation of aflatoxin B1-metabolizing alde-hyde reductase and glutathione S-transferase by chemoprotectors. The Biochemical Journal, 1994, 300(1): 117-124 (doi: 10.1042/bj3000117).
- Kelly V.P., Ellis E.M., Manson M.M., Chanas S.A., Moffat G.J., McLeod R., Judah D.J., Neal G.E., Hayes J.D. Chemoprevention of aflatoxin B1 hepatocarcinogenesis by coumarin, a natural benzopyrone that is a potent inducer of aflatoxin B1-aldehyde reductase, the glutathione S-transferase A5 and P1 subunits, and NAD(P)H:quinone oxidoreductase in rat liver. Cancer Research, 2000, 60(4): 957-969.
- Murcia H.W., Diaz G.J. Protective effect of glutathione S-transferase enzyme activity against aflatoxin B1 in poultry species: relationship between glutathione S-transferase enzyme kinetic parameters, and resistance to aflatoxin B1. Poultry Science, 2021, 100(8): 101235 (doi: 10.1016/j.psj.2021.101235).
- Meinl W., Sczesny S., Brigelius-Flohé R., Blaut M., Glatt H. Impact of gut microbiota on intes-tinal and hepatic levels of phase 2 xenobiotic-metabolizing enzymes in the rat. Drug Metabolism and Disposition, 2009, 37(6): 1179-1186 (doi: 10.1124/dmd.108.025916).


