Профилактика интраоперационных и mesh-ассоциированных осложнений после трансвагинальной экстраперитонеальной коррекции пролапса тазовых органов
Автор: Колсанова А.В., Каторкина Е.С., Колсанов А.В., Миннуллина Ф.Ф., Каторкин С.Е., Чемидронов С.Н.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 2, 2025 года.
Бесплатный доступ
Использование mesh-имплантов в реконструктивной хирургии пролапса тазовых органов (ПТО) может привести к интраоперационным и mesh-ассоциированным осложнениям, имеющим серьезные последствия и снижающим качество жизни. Цель. Снизить частоту интраоперационных и mesh-ассоциированных осложнений путем применения персонализированного 3D-моделирования, планирования и интраоперационной навигации. Материалы и методы. Проведено проспективное рандомизированное исследование 93 пациенток, оперированных с использованием троакарных и анкерных mesh-систем. В 1-й (n=32) и во 2-й (n=30) группах применялись соответственно троакарная и анкерная mesh-системы без построения 3Dмодели. В 3-й группе (n=31) при установке анкерной mesh-системы применяли 3D-моделирование органов таза, планирование и интраоперационную навигацию. Регистрировались время операции, кровопотеря, перии послеоперационные осложнения. Эффективность лечения определялась достижением анатомического излечения: стадия POP-Q ≤1. Результаты. Применение 3D-моделирования и хирургической навигации в 3-й группе позволили снизить травматичность операции, кровопотерю и количество гематом, исключить повреждение тазовых органов. В 1-й группе зафиксировано по 1 (3,1 %) случаю интраоперационной травмы уретры, мочевого пузыря и тампонады мочеточника. В 2-й группе у 1 (3,3 %) чел. имело место повреждение мочевого пузыря. Объем кровопотери в 1-й группе составил 268,6±25,8 мл, во 2-й группе – 67,8±54,6 мл, в 3-й группе – 59,4±23,6 мл. В 1-й группе через 3 мес. mesh-осложнения включали: эрозии слизистой оболочки влагалища – у 3 (9,4 %) чел., вагинальные синехии – у 1 (3,1 %) чел., усадка сетки – у 1 (3,1 %) чел., диспареуния и боль – у 5 (15,6 %) чел. Во 2-й и 3-й группах пациенток эрозии слизистой оболочки влагалища выявлены в 2 (6,7 %) и 1 (3,2 %) наблюдении соответственно. Анатомический успех достигнут у 91,4 % пациентов. Выводы. Предоперационное 3D-моделирование и интраоперационная навигация позволяют выполнять коррекцию ПТО с учетом индивидуальных топографических особенностей и сократить количество осложнений.
Передне-апикальная пластика, 3D-моделирование, хирургическая навигация, осложнение с использованием сетки, пролапс тазовых органов, трансвагинальная сетка, оперативная гинекология
Короткий адрес: https://sciup.org/14132988
IDR: 14132988 | УДК: 618.182-089.84:618.1-089 | DOI: 10.34014/2227-1848-2025-2-78-93
Текст научной статьи Профилактика интраоперационных и mesh-ассоциированных осложнений после трансвагинальной экстраперитонеальной коррекции пролапса тазовых органов
Введение. По оценкам большинства исследователей, сегодня наблюдается явная тенденция к значительному росту числа заболеваний тазового дна, различные комбинации которых имеют место у 26 % женщин старше 45 лет, 30 % женщин старше 50 лет, приближаясь затем к 80 % [1]. Пациентки с пролапсом тазовых органов (ПТО), дисфункцией тазового дна, колоректальными симптомами, нарушениями мочеиспускания и сексуальной дисфункцией отмечают значительное снижение качества жизни (КЖ) во всех его проявлениях [2]. Возрастающая заболеваемость ПТО трудоспособного населения, большое количество рецидивов с необходимостью повторных оперативных вмешательств, которым подвергаются более 30 % пациенток, свидетельствуют о том, что проблема лечения данной патологии для современного здравоохранения является чрезвычайно актуальной [3].
Наиболее распространенными методами хирургической коррекции ПТО являются восстановление влагалища с использованием собственных тканей или хирургических синтетических имплантов (mesh-технологии). Однако кольпорафия имеет высокую частоту рецидивов, достигающую 50–52 % [4]. По данным сравнительного ретроспективного исследования, проведенного V. Wong et al., частота рецидивов при использовании mesh-технологий составляла 31 %, тогда как при простой кольпорафии она была статистически значимо выше – 79 % (p=0,003) [5]. Поэтому большинство национальных и международных руководств и клинических рекомендаций поддерживают использование хирургических синтетических сетчатых имплантов в реконструктивной хирургии ПТО, отмечая, что частота хороших клинических результатов как при краткосрочном, так и при долгосрочном наблюдении достигает 94–98 % [6, 7].
Однако применение синтетических имплантатов может привести к интраоперационным (кровотечение и ранение органов таза), послеоперационным (гематомы влагалища, послеоперационное расхождение швов) и связанным с использованием mesh-технологий (эрозия стенки влагалища; синехии влагалища; деформация протеза и стенки влагалища; протрузия или миграция импланта; хроническая тазовая боль; диспареуния; инфицирование и формирование свищей) осложнениям, которые могут иметь серьезные последствия [8].
В настоящее время основными групповыми факторами риска развития осложнений, связанных с установкой синтетического сетчатого импланта при коррекции ПТО, являются его характеристики, особенности реактивности организма пациентки на инородное тело и техника выполнения операции [9]. Существуют два принципиально разных способа крепления рукавов сетчатого импланта. При троакарном способе для проведения рукава импланта через ткани пациента используется металлический проводник. Для анкерного способа применяются импланты, рукава которых оснащены специальными крепежными системами, состоящими из полипропиленового анкера с прикрепленным полипропиленовым швом и надежно фиксирующими крестцовоостистую связку, вследствие чего они не нуждаются в «слепом» проведении через мягкие ткани. Для достижения целевых анатомических областей, выполнения точной и более безопасной установки анкера с минимальным хирургическим разрезом используются выдвижные эргономичные направляющие, облегчающие введение, размещение и освобождение анкера под правильным углом [10].
Но и при применении анкерной методики в ходе фиксации импланта к сакроспинальной связке существует риск травмирования органов и сосудов таза, надкостницы седалищных костей, что может привести к формированию периостита и клинически проявляется выраженным болевым синдромом. В связи с чем разработка и применение предоперационных персонализированных диагностических методов продолжают оставаться актуальными [11]. К наиболее перспективным относятся современные технологии 3D-моделирования, предоперационного планирования и виртуальной интраоперационной навигации [12]. Они способствуют выстраиванию оптимальной персонализированной тактики оперативного вмешательства, повышению его прецизионности благодаря учету индивидуальных анатомических и топографических особенностей, снижению частоты интраоперационных осложнений, проведению операций согласно технологиям Fast Track [13].
Цель исследования. Снизить частоту интраоперационных и mesh-ассоциированных осложнений после трансвагинальной экстрапе-ритонеальной хирургической коррекции ПТО с использованием троакарных и анкерных mesh-систем путем применения персонализированного предоперационного 3D-моделирования, планирования и интраоперационной навигации.
Материалы и методы. В период 2018– 2024 гг. проведено двуцентровое проспективное рандомизированное клиническое исследование, включившее 93 пациенток в возрасте 50–65 лет, которым в условиях гинекологиче- ского отделения Клиник СамГМУ и отделения гинекологии № 2 ГАУЗ ГКБ № 7 им. М.Н. Садыкова была выполнена вагинальная экстраперитонеальная кольпопексия ПТО с использованием троакарных (Prolift, John-son&Johnson, США; «Пелвикс», «Линтекс», РФ) и анкерных (Calistar S, Promedon, Аргентина) mesh-систем. В течение 36 мес. послеоперационного периода женщины находились под амбулаторным наблюдением. Это позволило всесторонне изучить и детально проанализировать особенности развития интраоперационных, ранних и поздних mesh-ассоциированных осложнений. Соблюдались этические принципы Хельсинкской декларации, Правила надлежащей клинической практики и Правила клинической практики в Российской Федерации.
Критерии включения: нефертильность женщины, возраст 50–65 лет, подтвержденный симптоматический передний ПТО (по данным акушерско-гинекологического, ультразвукового и КТ-исследований) с POP-Q ≥2 (соответствует Aa, Ba ≥-1 см и, где применимо, C ≥-1/2 TVL); состояние менопаузы; клинические признаки недифференцированной дисплазии соединительной ткани; согласие пациенток на применение mesh-систем при показаниях к оперативному лечению ПТО в соответствии с клиническими рекомендациями Минздрава России; подписанное добровольное информированное согласие на участие в исследовании.
Критерии невключения: фертильность женщины; возраст более 65 лет (в связи с возрастанием хирургического и анестезиологического рисков, а также вероятности mesh-ас-социируемых осложнений); отягощенный соматический и инфекционный анамнез; активная или латентная инфекция половых органов; воспалительные заболевания органов малого таза; рецидивирующие инфекции мочевыводящих путей; декомпенсированный сахарный диабет; текущее лечение кортикостероидами; аллергия на полипропилен; склонность к формированию келоидных или гипертрофических рубцов; отсутствие возможности или желания заполнять анкеты (самостоятельно или с помощью интервью), и/или следовать запланированным посещениям, и/или подписывать информированное согласие.
Критерии исключения: острое или декомпенсация хронического соматического заболевания; острое инфекционное заболевание; впервые выявленное онкологическое заболевание; отказ от ответов на вопросы, осмотра или инструментального обследования.
Диагностика ПТО и послеоперационных осложнений соответствовала требованиям IUGA и ICS [14]. Всем пациентам проведено предоперационное клиническое обследование согласно клиническим рекомендациями Минздрава России «Выпадение женских половых органов». Фиксировалась стадия пролапса на основе системы POP-Q [14]. Перед операцией с помощью трансвагинального УЗИ проводилась оценка эндометрия; при наличии показаний – аспирационная биопсия. Для коррекции гипоэстрогении при отсутствии противопоказаний рекомендовалось вагинальное применение эстрогенсодержащих препаратов.
Синтетические сетчатые импланты устанавливались по стандартизированным методикам в соответствии с рекомендациями фирмы-производителя и стандартами SCENIHR [15]. За 30 мин до операции проводилась краткосрочная профилактика антибиотиками («Це-фазолин» 2,0 г). Операции проводились под спинальной анестезией в положении Тренде-ленбурга. На 24 ч устанавливали трансуретральный катетер Фолея. Вагинальный разрез ушивали без иссечения влагалищного эпителия с использованием рассасывающегося шовного материала 2–0. На 24 ч во влагалище помещали марлевый тампон, пропитанный мазью «Левомеколь» (РФ). Пациентки активизировались через 8 ч после оперативного вмешательства. Проводилась ежедневная местная антисептическая обработка влагалища. В раннем послеоперационном периоде обезболивание, антибактериальная профилактика и предотвращение венозных тромбоэмболических осложнений осуществлялись в соответствии принципами ускоренного восстановления после хирургических операций ERAS, адаптированных для пациентов гинекологического профиля [16]. Контролировали объем мочи, показатели общего анализа крови, выполняли УЗИ органов малого таза. В послеоперационном периоде назначали эстриол в дозировке 0,5 мг в виде вагинальных суппозиториев на ночь на срок не менее 6 мес. Пациенткам с признаками эстрогенного дефицита проводили более длительную (до 24 мес.) местную гормональную терапию.
Для получения виртуальной топографоанатомической 3D-модели органов таза применялась разработанная Институтом инновационного развития СамГМУ система «Автоплан» (регистрационный заявки на изобретение
№ 202511129). В создании персонализированной 3D-модели участвовали гинекологи и ко-лопроктологи, рентгенологи и программисты. Полученные в результате КТ с болюсным контрастированием данные загружались в систему «Автоплан» в формате DICOM. В автоматическом режиме с помощью функции улучшенного сглаживания проводилась сегментация костей и мочеполовых органов таза, кровеносных сосудов, кишечника и мышц. Затем выполнялось построение объемной полигональной персонализированной 3D-модели органов таза и осуществлялся ее анализ (рис. 1).
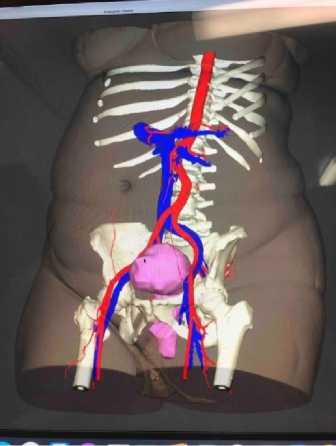
Рис. 1. Фрагмент персонализированной 3D-модели при ПТО
Fig. 1. Fragment of a personalized 3D model for pelvic organ prolapse
Этап навигации начинался с формирования предварительного плана хирургической коррекции ПТО с обозначением навигационных меток для проведения разреза и фиксации mesh-импланта. Применение программно-аппаратного комплекса позволяло на мониторах оценить объемное изображение органов таза в режиме диалога с визуализацией подтканевых структур и сосудов. Затем на адаптированной 3D-модели появлялись метки навигации, с помощью которых позиционировалось место проведения разреза и анкерной фиксации.
Для оценки результатов хирургических и mesh-осложнений были сформированы три группы:
-
- 1-я группа (n=32) – пациентки, которым хирургическая коррекция ПТО проводилась с применением троакарной mesh-системы (Prolift, Johnson&Johnson, США; «Пелвикс», «Линтекс», РФ) без построения 3D-модели органов таза;
-
- 2-я группа (n=30) – пациентки, которым хирургическая коррекция ПТО проводилась с применением анкерной mesh-системы (Calistar S, Promedon, Аргентина) без построения 3D-модели органов таза;
-
- 3-я группа (n=31) – пациентки, которым на предоперационном этапе осуществляли построение персонализированной полигональной 3D-топографической модели органов таза
и планирование оперативного вмешательства, а хирургическая коррекция ПТО с применением анкерной mesh-системы (Calistar S, Promedon, Аргентина) проводилась с интраоперационной навигацией.
Рандомизация пациенток проводилась методом конвертов, что обеспечивало случайное распределение и исключение предвзятости при формировании групп. Предварительный расчет размера выборки пациенток не производился.
В качестве основного исхода исследования изучали частоту развития интраоперационных и послеоперационных осложнений после имплантации mesh-системы, а также количество пациентов с излечением ПТО через 36 мес.
Также изучалась динамика болевого синдрома по визуальной аналоговой шкале боли (VAS), анатомический успех оперативного лечения, оценка влияния дисфункции тазового дна на КЖ пациенток.
Время операции, кровопотеря, периоперационные и послеоперационные осложнения и сроки пребывания в стационаре проспективно регистрировались у всех пациенток. В послеоперационном периоде женщины амбулаторно осматривались через 3, 6, 12, 24 и 36 мес. Оценка включала изучение жалоб, проверку анкет, гинекологический осмотр с кашлевой пробой, УЗИ органов малого таза.
Эффективность лечения определялась числом пациенток, достигших комбинированной конечной точки, включающей анатомические и субъективные компоненты: POP-Q ≤1 (Ba и C <-1 см), отсутствие симптомов ПТО. Рецидив определялся как пролапс 2 стадии или выше в соответствии с классификацией POP-Q [17].
Интенсивность болевого синдрома до операции и при последующем наблюдении оценивалась по шкале VAS (в баллах): 0 баллов – отсутствие боли; 1–3 балла – легкая боль (легкие нарушения); 4–6 баллов – умеренная боль (умеренные нарушения); 7–8 баллов – выраженная боль (тяжелые нарушения); 9–10 баллов – невыносимая боль (абсолютные нарушения) [18].
Для анализа отдаленных результатов лечения применялся опросник PFDI-20, рекомендованный IUGA [19]. По каждой из трех подшкал симптомов (обусловленные ПТО, связанные с мочеиспусканием и колоректально-анальные) необходимо было получить среднее значение по всем вопросам. Сумма оценок трех шкал составляет итоговый балл. Чем больше количество баллов, тем выражен-нее влияние дисфункции тазового дна на КЖ пациентки.
Статистическая обработка проводилась с использованием программ Statistica 10.0 (StatSoft) и Microsoft Excel 2010. При описании данных при нормальном распределении использовали среднее (M) и стандартное отклонение (SD), при ненормальном – медиану (Me) и квартили [Q1; Q3]. Для сравнения двух независимых выборок использовали параметрический t-критерий Стьюдента (при нормальном распределении). Различия считали статистически значимыми при p<0,05.
Результаты. В исследование включены 93 пациентки с ПТО, соответствующие критериям включения и исключения, подписавшие добровольное информированное согласие на участие и обследованные в соответствии с клиническими рекомендациями «Выпадение женских половых органов», а также согласно приказу № 1130н МЗ РФ «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология». Выбывших из исследования не было. Средний возраст женщин в 1-й группе составил 56,2±5,4 года, во 2-й группе – 57,4±6,3 года, в 3-й группе – 56,3±7,25 года (p>0,05). Медиана роста и ИМТ в 1, 2 и 3-й группах соответственно составили 167 [164; 175] см и 29,8 [26,7; 35,2] кг/м2, 168 [165; 173] см и 29,8 [26,8; 36,5] кг/м2, 165 [162; 170] см и 28,4 [26,5; 34,8] кг/м2 (p>0,05). Таким образом, статистически значимых различий по критериям возраста, роста и ИМТ в группах не выявлено.
При анализе структуры соматической патологии также не было выявлено статистически значимых различий. В то же время необходимо выделить сопутствующие заболевания, обусловленные врожденной или приоб- ретенной слабостью соединительной ткани, что еще раз подчеркивает связь этиологии и патогенеза этих заболеваний с ПТО и синдромом хронической тазовой боли. Хроническая венозная недостаточность нижних конечностей выявлена у 23 (71,9 %), 25 (83,3 %) и 24 (77,4 %) пациенток 1, 2 и 3-й групп соответственно, различные стадии хронического гемор- роя – у 22 (68,7 %), 19 (63,3 %) и 20 (64,5 %) женщин, а патология опорно-двигательной системы – у 21 (65,6 %), 23 (76,7 %) и 22 (70,9 %) чел.
Не было выявлено статистически значимых различий при оценке параметров становления репродуктивной функции, продолжительности менструального цикла и акушерского анамнеза (p>0,05) (табл. 1).
Таблица 1
Table 1
Obstetric and gynecological history of patients
|
Показатель Parameter |
Группа 1 (n=32) Group 1 (n=32) |
Группа 2 (n=30) Group 2 (n=30) |
Группа 3 (n=31) Group 3 (n=31) |
|
Менархе, лет (M±SD) Menarche, years (M±SD) |
12,1±2,1 |
11,4±2,4 |
11,2±1,8 |
|
Продолжительность менструального цикла, дней, Me [Q1; Q3] Menstrual cycle, days, Me [Q1; Q3] |
28 [25; 29] |
28 [26; 30] |
29 [25; 30] |
|
Длительность менструации, дней, Me [Q1; Q3] Menstrual bleeding, days, Me [Q1; Q3] |
6 [5; 7] |
6 [4; 7] |
5 [5; 7] |
|
Число беременностей, Me [Q1; Q3] Number of pregnancies, Me [Q1; Q3] |
2 [2; 4] |
2 [1; 4] |
2 [2; 5] |
|
Число прерываний беременности, Me [Q1; Q3] Number of abortions, Me [Q1; Q3] |
3 [1; 3] |
2 [1; 3] |
2 [1; 4] |
|
Число родов, Me [Q1; Q3] Number of births, Me [Q1; Q3] |
2 [1; 3] |
2 [1; 3] |
3 [2; 3] |
Акушерско-гинекологический анамнез пациенток
Интенсивность болевого синдрома по шкале VAS также не имела статистически значимых различий: 8 [5; 8], 8 [6; 9] и 7 [5; 9] баллов (p>0,05) в 1, 2 и 3-й группах соответственно. При анализе общих клинико-анамнестических характеристик выявили, что у 19 (20,4 %) исследуемых пациенток отмечались боль, чувство жжения и дискомфорт при половой жизни. У 75 (80,6 %) пациенток (р˂0,05) наблюдались жалобы на дискомфорт в области наружных половых органов, чувство тяжести и давления в малом тазу и промежности, чувство инородного тела во влагалище. Диспареунию отмечали 76 (81,7 %) женщин. Жалобы на затрудненное мочеиспускание предъявляли 26 (27,9 %) чел., стрессовым недержанием мочи страдали 20 (21,5 %), а у 36 (38,7 %) больных отмечалось учащенное мочеиспускание.
Длительность операции в первой группе пациентов (86,4±12,4 мин) оказалась статистически значимо (p<0,05) больше, чем во 2-й и 3-й группах, что соответствует результатам ранее опубликованных исследований. Среднее время операции в третьей группе было несколько больше, чем во второй, за счет установки анатомических ориентиров, выбора траектории и безопасного предела хирургического доступа: 61,4±13,8 и 48,4±16,7 мин (p>0,05) соответственно.
Средний объем интраоперационной кровопотери в 1-й группе составил 268,6±25,8 мл, в 2-й группе – 67,8±54,6 мл, в 3-й группе – 59,4±23,6 мл. В 1-й группе пациентов в одном наблюдении развилось кровотечение более 400 мл. В 2 (6,3 %) случаях ранний послеоперационный период осложнился гематомой малого таза, объем которой составил около
300 мл, что потребовало вскрытия и дренирования. У 6 (18,7 %) пациенток диагностированы промежностные гематомы. Данные осложнения можно объяснить массивной диссекцией тканей и применением троакарной mesh-системы, а также, возможно, наличием варикозно расширенных вен малого таза [20]. В 2-й группе гематомы выявлены у 5 (16,7 %) пациенток. В одном наблюдении гематома около 6 см в диаметре располагалась между сетчатым имплантом и стенкой влагалища. Она дренировалась между швов и реорганизовалась на фоне назначения антибактериальной терапии. Гематомы в области ягодиц и промежности являлись подкожными или внутрикожными и рассасывались без использования дополнительных мероприятий. В 3-й группе в раннем послеоперационном периоде у 3 (9,7 %) пациенток при УЗИ были выявлены небольшие (до 3 см в диаметре) гематомы, которые лечились консервативно (тугое тампонирование влагалища) до полного разрешения. Они рассасывались бесследно и никак не сказывались на течении послеоперационного периода.
В 1-й группе зафиксировано по 1 (3,1 %) случаю интраоперационной травмы уретры, мочевого пузыря и тампонады мочеточника. В 2-й группе отмечен 1 (3,3 %) случай повреждения мочевого пузыря, которое было немедленно устранено. После мобилизации дефект стенки ушит непрерывным швом (викрил 3–0). После ушивания выполнена интраоперационная цистоскопия для подтверждения отсутствия дефекта. Запланированная операция была завершена в полном объеме с оставлением катетера Фолея на 3 сут. В последующем имела место выписка в удовлетворительном состоянии без дальнейших побочных эффектов. В 3-й группе пациенток интраоперационных повреждений органов, сосудов или нервов или кровопотери более 200 мл не было.
Продолжительность катетеризации мочевого пузыря составила 2,26±2,73, 1,06±2,73 и 1,8±2,54 сут в 1, 2 и 3-й группах соответственно. В раннем послеоперационном периоде атония мочевого пузыря наблюдалась у 5 (15,6 %), 3 (10,0 %) и 2 (6,5 %) пациенток и купировалась в течение 2–4 сут медикаментозной и интермиттирующей катетеризацией.
Средняя длительность пребывания в стационаре в 1, 2 и 3-й группах колебалась в пределах 7,1±1,2, 5,2±1,4 и 4,3±1,2 койко-дня соответственно.
Анализа данных опросника PFDI-20 показал, что значение среднего общего итогового балла, объединяющего результаты всех доменов, до операции составляло 138,9±24,6 (от 109,6 до 147,1), 128,8±24,6 (от 106,4 до 146,2) и 132,6±25,3 (от 104,6 до 144,4) в 1-й, 2-й и 3-й группах соответственно. Через 3 мес. после операции статистически значимое улучшение КЖ отмечали все исследуемые пациентки. В последующем отмечено дальнейшее его улучшение к 6-му мес. и стабилизация показателей на протяжении всего периода наблюдения. Через 36 мес. средний общий итоговый балл в 1-й, 2-й и 3-й группах составлял 28,4±14,6 (от 19,4 до 52,7), 18,6±8,3 (от 6,2 до 44,6) и 16,2±6,5 (от 5,2 до 42,6) соответственно (p<0,05).
Отсутствие таких симптомов, как давление и тяжесть в области малого таза, чувство инородного тела в промежности, было отмечено у 90 женщин (96,8 %). Статистически значимо снизились жалобы на дискомфорт в области наружных половых органов и стрессовое недержание мочи. Их предъявляли 6 (18,7 %), 3 (10,0 %) и 2 (6,4 %) пациентки 1, 2 и 3-й групп соответственно. Назначение М-холинолитиков (на 6 мес.) имело положительный эффект. Затрудненное мочеиспускание, необходимость вправления выпячивания для мочеиспускания в группах не зарегистрированы.
В всех группах зафиксировано улучшение функциональных результатов и анатомических исходов, в т.ч. и отдаленных, что в значительной мере повышает КЖ пациенток и комплаентность. Все пациентки отметили исчезновение таких симптомов, как сухость влагалища и зуд, что, скорее всего, связано не только с восстановлением нормальной топографии органов малого таза, коррекцией функциональных расстройств, но и с назначением эстриола.
В 1-й группе через 3 мес. на контрольном осмотре выявленные mesh-осложнения включали: эрозии слизистой оболочки влагалища
(3 (9,4 %) случая), вагинальные синехии (1 (3,1 %) случай), усадка сетки (1 (3,1 %) случай), диспареуния и боль (5 (15,6 %) случаев). Лечебная тактика при эрозии заключалась в наблюдении и местном (свечи) использовании эстрогенов. В одном случае в связи с отсутствием эффекта было проведено частичное иссечение mesh-импланта с наложением швов. Уменьшение сетчатого импланта у одной пациентки, по данным УЗИ, достигало 35 % от первоначальной длины. Сморщивание mesh-импланта сопровождалось болевым синдромом, который не удалось купировать консервативно, что потребовало частичного иссечения импланта. Синехии влагалища были оперативно рассечены. Хроническая тазовая боль была отмечена у 4 (12,5 %) пациенток. Через 24 мес. после операции у одной пациентки произошла протрузия импланта в мочевой пузырь. Фрагмент сетки из мочевого пузыря удален при цистоскопии.
В 2-й и 3-й группах эрозии слизистой оболочки влагалища выявлены у 2 (6,7 %) и 1 (3,2 %) женщины соответственно. Сроки их формирования составили 12–16 мес. после операции. Эрозии были небольшого размера – пролабирование mesh-импланта не превышало 1 см. Пациенты испытывали дискомфорт во влагалище в результате раздражения слизистой оболочки и имели умеренные выделения. Консервативная лечебная тактика в 2 случаях заключалась в наблюдении, местном использовании эстрогенов в виде крема или геля, антибактериальной терапии и рекомендации сексуального воздержания. У 1 пациентки проведено иссечение и ушивание слизистой с последующей эпитализацией дефекта через 1 мес. Диспареуния de novo отмечена у 2 (6,7 %) женщин в каждой группе. Жалобы на хроническую тазовую боль статистически значимо не различались, их предъявляли 3,2 % пациенток. Во всех случаях болевой синдром был купирован консервативно. Синехий влагалища, инфицирования и протрузии импланта среди пациенток 2-й и 3-й групп выявлено не было. Таким образом, хирургическая коррекция ПТО посредством вагинальной экстрапери-тонеальной вагинопексии с применением тро-акарных и анкерных mesh-систем эффективна, но большая частота интраоперационных и mesh-осложнений троакарной методики снижает КЖ пациенток (p<0,05). Данный факт объясняется проведением проводника через большой объем мягких тканей вслепую, что исключает визуальный контроль и повышает вероятность травмы люмбо-сакрального сплетения.
В ходе исследования в группах сравнения не было зафиксировано статистически значимых различий в первичном клиническом исходе в течение послеоперационного периода наблюдения. При проведенном через 24 мес. обследовании анатомическая коррекция переднего ПТО наблюдалась во всех точках по шкале POP-Q у 88 (94,6 %) пациенток. Статистически значимых различий между сравниваемыми группами не выявлено (p>0,05) (табл. 2).
Таблица 2
Table 2
Количественная оценка пролапса тазовых органов через 24 мес. после операции
Quantitative assessment of pelvic organ prolapse 24 months after surgery
|
Показатель Parameter |
Группа 1 (n=32) Group 1 (n=32) |
Группа 2 (n=30) Group 2 (n=30) |
Группа 3 (n=31) Group 3 (n=31) |
|
Aa, см (M±SD) Aa, cm (M±SD |
-2,5±0,28 |
-2,3±0,5 |
-2,4±0,24 |
|
Ba, см (M±SD) Ba, cm (M±SD) |
-2,52±0,42 |
-2,62±0,52 |
-2,71±0,22 |
|
C, см (M±SD) C, cm (M±SD) |
-6,12±1,26 |
-6,09±1,55 |
-6,18±0,94 |
|
Ap, см (M±SD) Ap, cm (M±SD) |
-2,6±0,46 |
-2,6±0,6 |
-2,52±0,86 |
|
Bp, см (M±SD) Bp, см (M±SD) |
-2,28±1,26 |
-2,21±1,29 |
-2,46±1,02 |
|
TVL, см (M±SD) TVL, cm (M±SD) |
7,28±1,22 |
7,38±1,42 |
7,32±0,46 |
|
Субъективный показатель излечения (абс., %) Subjective cure rate (abs., %) |
24 (75,0 %) |
26 (86,7 %) |
27 (87,1 %) |
|
Объективный показатель излечения (абс., %) Objective cure rate (abs., %) |
28 (87,5 %) |
28 (93,3 %) |
29 (93,5 %) |
Примечание. Aa – расстояние от девственной плевы до шейки мочевого пузыря (в норме 3 см); Ap – расстояние от девственной плевы до проекции m. levator ani на заднюю стенку влагалища (в норме не менее 3 см); Ba – расстояние от девственной плевы до наиболее выступающей части передней стенки влагалища (в норме не менее 3 см); Bp – расстояние от девственной плевы до наиболее выступающей точки задней стенки влагалища над уровнем m. levator ani (в норме не менее 3 см); C – расстояние до самого дистального (т.е. впадающего) участка шейки матки или вершины купола (рубец после гистерэктомии) (в норме не менее 7 см); TVL – общая длина влагалища (см).
Note. Aa is the distance from the hymen to the neck of the urinary bladder (normally 3 cm); Ap is the distance from the hymen to the m. levator ani projection onto the posterior vaginal wall (normally not less than 3 cm); Ba is the distance from the hymen to the most protruding part of the anterior vaginal wall (normally not less than 3 cm); Bp is the distance from the hymen to the most protruding point of the posterior vaginal wall above m. levator ani (normally not less than 3 cm); C is the distance to the most distal (i.e. inward) part of the cervix or the apex of the dome (scar after hysterectomy), normally not less than 7 cm; TVL is the total vaginal length (cm).
На основании последнего наблюдения через 36 мес. 77 (82,8 %) пациенток достигли субъективного излечения, в то время объективного – 85 (91,4 %). Статистически значимых различий между сравниваемыми группами выявлено не было. Симптоматический передне-апикальный пролапс II стадии диагностирован у 4 (4,3 %) пациенток. Однако ни одной из них не потребовалась дополнительная операция по поводу ПТО, они сообщили о наличии симптомов лишь в редких случаях.
При оценке болевого синдрома по шкале VAS в послеоперационном периоде статистически значимых отличий в сравниваемых группах не было выявлено. Жалобы на умеренную боль во влагалище, медиальной поверхности бедер и ягодичной области через 12 мес. после операции предъявляли 9 (9,7 %), через 24 мес. – 6 (6,5 %) пациенток. Болевой синдром купировался анальгетической терапией (короткий курс НПВС в виде ректальных свечей). Если жалобы на чувство тяжести в области таза до операции предъявляли 93 (100 %) пациентки, то через 12 мес. – только 11 (11,8 %) (p<0,01). Диспареуния, наблюдавшаяся до операции у 76 (81,7 %) чел., через 6 мес. была выявлена у 8 (8,6 %), а через 12 мес. – у 3 (3,2 %) женщин (p<0,01).
Обсуждение. Исследование имеет небольшую статистическую мощность из-за ограниченного числа пациентов (n=93). Для углубленного анализа необходимо увеличение объема группы и, возможно, срока наблюдения. Результаты данной работы могут экстраполироваться на другие типы mesh-имплантов и лапароскопические операции.
Использование УЗИ, КТ или МРТ для предварительного построения 3D-модели органов таза и последующая операционная навигация способствуют улучшению диагностики заболеваний.
Персонализированная 3D-модель дает возможность планировать оперативное вмешательство с учетом индивидуальных особенностей топографии органов таза, мочеточников, сосудистых зон и мышц, а интраоперационная навигация способствует выбору оптимальной хирургической тактики и снижению травматичности. Морфометрия тазовых структур с оценкой размеров мышечных компонентов предоставляет возможность оценить состояние миофасциального комплекса, выявить нарушения топографо-анатомических взаимоотношений. Концепция динамической координации между скелетными и гладкими мышцами позволяет пересмотреть отдельные аспекты патофизиологии ПТО, улучшить диагностику и медицинскую реабилитацию пациентов с заболеваниями тазового дна и промежности.
Хирургический метод является основным в лечении ПТО. Трансвагинальные сетчатые имплантаты превосходят по объективным показателям успешности и частоты рецидивов традиционные методы [21]. Проведенное исследование продемонстрировало высокую эффективность сетчатой аугментированной передней реконструкции ПТО с использованием mesh-имплантов у нефертильных женщин. Полученные в нашем исследовании результаты объективного излечения (91,4 %) сопоставимы с результатами применения других комплектов сетчатых имплантов, таких как Elevate-A (94,0 %) и Uphold-Lite (89,8 %) [6, 22].
В то же время применение mesh-систем является одним из ведущих хирургических факторов риска интраоперационных (ранение смежных органов и кровотечение) и послеоперационных осложнений (гематомы влагалища, приводящие к эрозии cетки) [8]. Применение 3D-технологий способствует снижению интраоперационной кровопотери. Все операции были выполнены одной, прошедшей специализацию, хирургической бригадой, что также, возможно, повлияло на полученный уровень осложнений. По мнению ряда авторов, опыт хирурга является ключевым фактором в возникновении осложнений с использованием сетчатых имплантов [23].
Менее радикальная диссекция параве-зикального пространства во время имплантирования сетки, применяемая в 2-й и 3-й группах, могла привести к положительному эффекту. Анкерная фиксация mesh-импланта обеспечивает большую герметизацию и проникновение в связки, но все же осуществляется без прямой визуализации анатомической структуры. Средний объем интраоперационной кровопотери в 2-й и 3-й группах статистически значимо не различался, но был меньше, чем при трансвагинальной кольпопексии троакарными mesh-системами. В исследовании пациентов (n=677), прооперированных по поводу ПТО с использованием троакарной mesh-системы Prolift, про- веденном G. Kasyan et al., общее количество осложнений составило 22,5 %: кровотечение более 500 см3 развилось в 2,2 %, тазовые гематомы – в 5,5 %, промежностные гематомы – в 2,5 %, травмы уретры – в 0,3 %, травма мочевого пузыря – в 1,6 %, травма мочеточника – в 0,2 %, повреждение прямой кишки – в 0,7 % наблюдений [24]. По данным Кокрановского обзора 2024 г., наиболее частым интраоперационным осложнением хирургической коррекции ПТО является повреждение мочевого пузыря (4,2 %), стрессовое недержание мочи de novo фиксируется у 18,1 %. Частота эрозии импланта составила 11,8 %, причем в 6,1 % требовалось хирургическо вмешательство [25]. Применение 3D-технологий в 3-й группе пациентов способствовало исключению интраоперационных повреждений органов, сосудов или нервов, а также снижению интраоперационной кровопотери.
Вагинальная эрозия сетки зафиксирована у 6 (6,4 %) пациенток групп сравнения. Полученные результаты согласуются с данными литературы, (3,2–14 %) [9]. С увеличением возраста снижается уровень эстрогена и повышается риск атрофии влагалища, что приводит к увеличению вероятности обнажения сетки. Обнаруженные эрозии были устранены с помощью вагинальной эстрогенной терапии. Применение анкерной технологии, позволяющей нивелировать повышение давления в брюшной полости, позволило избежать складчатости сетчатых имплантов.
Заключение. При учете рекомендаций SCENIHR для синтетических имплантов, адекватном отборе пациентов и специализации хирургов на трансвагинальной реконструкции тазового дна хирургическая коррекция ПТО с применением mesh-систем высокоэффективна независимо от способа фиксации импланта, но целесообразно отдавать предпочтение анкерным технологиям. Предоперационное 3D-моделирование и интраоперационная навигация позволяют планировать и выполнять коррекцию ПТО с учетом индивидуальных особенностей топографии органов таза и сократить количество интраоперационных и mesh-ассоциированных осложнений.


