Профилактика острого повреждения миокарда при плановых эндоваскулярных вмешательствах на коронарных артериях
Автор: Вершинина Елена Олеговна, Сальникова Елена Сергеевна, Репин Алексей Николаевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: В помощь практическому врачу
Статья в выпуске: 2 т.30, 2015 года.
Бесплатный доступ
Данные многих исследователей свидетельствуют о том, что во время эндоваскулярных вмешательств на коронарных артериях (КА) происходит увеличение уровня сердечных биомаркеров, что свидетельствует о некрозе кардиомиоцитов. Риск последующих серьезных сердечных событий, таких как смерть, инфаркт миокарда (ИМ), связан со степенью повышения кардиоспецифических ферментов после вмешательства. Поэтому терапевтические стратегии, которые в состоянии уменьшить частоту перипроцедурного повреждения миокарда, могут положительно влиять на клинические исходы после эндоваскулярных вмешательств. Авторами показано, что применение высоких нагрузочных доз сильнодействующих статинов (аторвастатина и розувастатина) при плановом эндоваскулярном вмешательстве на КА у пациентов, уже длительно получающих стандартную липидснижающую терапию, оказывает сходное влияние на динамику сердечных биомаркеров после чрескожного коронарного вмешательства (ЧКВ). При этом применение нагрузочной дозы розувастатина имеет некоторое преимущество в связи с достоверно меньшим повышением тропонина I (TnI) и Мв фракции креатинфосфокиназы (КФК МВ) на 26,7 и 27,1% соответственно в течение первых 12 ч после процедуры. Второй раздел работы демонстрирует, что добавление триметазидина (ТМЗ) к стандартной терапии при эндоваскулярной реваскуляризации миокарда у пациентов с нарушениями углеводного обмена способствует уменьшению острого повреждения миокарда, хотя клиническое значение влияния этой защиты на отдаленные исходы заболевания еще требует изучения.
Ишемическая болезнь сердца, стабильная стенокардия, чрескожные коронарные вмешательства, статины, триметазидин
Короткий адрес: https://sciup.org/14920282
IDR: 14920282 | УДК: 616.12"005.4"06"037:616.132.2"007.271"089.819.1/.5
Текст научной статьи Профилактика острого повреждения миокарда при плановых эндоваскулярных вмешательствах на коронарных артериях
Многими авторами было показано, что после эндоваскулярных вмешательств на КА происходит увеличение уровня сердечных биомаркеров, что свидетельствует о некрозе кардиомиоцитов [1, 2]. Перипроцедурный ИМ, ди- агностируемый при повышении сердечных тропонинов или КФК МВ выше пяти верхних границ нормы (ВГН), как правило, развивается вследствие серьезных технических осложнений процедуры реваскуляризации миокарда (диссекция интимы, острый тромбоз стента или КА и др.). Однако у большинства пациентов происходит увеличение уровня кардиоспецифических ферментов, не достигающее этой диагностической границы и располагающееся в диапазоне от 1 х ВГН до 5 х ВГН. В этом случае перипроцедурное повреждение миокарда происходит вследствие окклюзии боковых эпикардиальных ветвей, нарушения микрососудистой циркуляции, дистальной эмболизации коронарного русла, синдрома slow или no-reflow и некоторых других причин [3].
Кроме того, в ряде исследований было показано, что риск последующих серьезных сердечных событий, таких как смерть, ИМ, связан со степенью повышения сердечных биомаркеров после вмешательства [4]. Мета-анализ, который объединил данные 23230 пациентов [5], показал, что уровень смертности в течение 1 года составил 1,7, 2,8 и 7,4% для пациентов с постпроцедурным повышением КФК МВ на 1–3 х ВГН; 3–5 х ВГН и более 5 х ВГН соответственно. Поэтому терапевтические стратегии, которые в состоянии уменьшить частоту перипроцедур-ного повреждения миокарда, могут положительно влиять на клинические исходы после эндоваскулярных вмешательств.
В данной статье представлены результаты работы сотрудников отделения реабилитации больных сердечнососудистыми заболеваниями НИИ кардиологии (Томск), посвященной изучению способов медикаментозной защиты миокарда от острого повреждения при проведении избирательных (плановых) эндоваскулярных вмешательств на КА.
Использование нагрузочных доз статинов для профилактики острого повреждения миокарда при плановых эндоваскулярных вмешательствах на КА. С начала 1990-х годов активно изучается возможность профилактики перипроцедурного некроза миокарда с помощью статинов (ингибиторов фермента 3-гидрокси-3-метилг-лютарил коэнзим А редуктазы) [6, 7]. Экспериментальные данные на мышах продемонстрировали, что острое применение статинов может снизить размер инфаркта после перевязки левой передней нисходящей артерии с последующей реперфузией [8, 9]. Эта животная модель показала, что положительный эффект аторвастатина может осуществляться за счет тех же молекулярных механизмов, что и при ишемическом прекондиционировании, то есть активации синтазы окиси азота и стимуляции циклооксигеназы и простагландина [10]. Кроме того, в эксперименте на животной модели с помощью оптической когерентной томографии было показано, что предварительное назначение аторвастатина перед ЧКВ ускоряет образование неоинтимы в стентах с лекарственным покрытием и восстанавливает эндотелиальную функцию неоинтимы, что снижает риск позднего тромбоза стентов [11].
Большинство исследований, посвященных влиянию статинов на величину повреждения миокарда при эндоваскулярных вмешательствах, было проведено с использованием аторвастатина (исследования ARMIDA, ARMIDA-RECAPTURE, NAPLES II и др.). Еще один мощный синтетический статин, розувастатин, исследован в этой клинической ситуации значительно меньше.
Считается, что защитное действие статинов на мио- кард при процедурах реваскуляризации связано не столько с их липидснижающими, сколько с плейотроп-ными эффектами. Плейотропные эффекты включают способность статинов улучшать эндотелиальную функцию, подавлять процессы воспаления, повышать биодоступность оксида азота, стабилизировать атеросклеротические бляшки и снижать протромботический потенциал [12–14].
Важно, что эти эффекты развиваются при использовании коротких курсов и даже после однократной дозы статинов. Исследование ARMIDA было первым рандомизированным плацебо-контролируемым двойным слепым проспективным исследованием, которое продемонстрировало способность статинов предотвращать повреждение миокарда во время эндоваскулярных вмешательств при стабильной стенокардии [15]. Авторами выявлено значительное уменьшение постпроцедурного повреждения миокарда, определяемого как увеличение КФК МВ более 2 х ВГН, в группе аторвастатина (5 против 18%, р=0,025). Многомерный логистический регрессионный анализ показал, что предварительный прием аторвастатина был независимо связан с более низким риском пе-рипроцедурного увеличения КФК МВ (OШ: 0,19; 95% ДИ: 0,05–0,57).
Другой значимой публикацией на эту тему явилось исследование “Naples II”, которое показало, что даже одна высокая нагрузочная доза (80 мг) аторвастатина, назначенная в течение 24 ч перед стентированием, является эффективной для снижения частоты перипроцедурного ИМ [16]. Частота повышения КФК-МВ в три и более раз выше ВГН составила 9,5% в группе аторвастатина и 15,8% – в контрольной группе (OШ: 0,56; 95% ДИ: 0,35–0,89; р=0,014). Частота повышения тропонина I (Tn I) по крайней мере в 3 раза от ВГН составила 26,6% в группе аторвастатина и 39,1% – в контрольной группе (OШ: 0,56; 95% ДИ: 0,40–0,78; р>0,001).
Эффективность назначения высоких доз розуваста-тина (40 мг) перед процедурой ЧКВ для предотвращения перипроцедурного повреждения миокарда, а также основных сердечно-сосудистых и цереброваскулярных событий (MACCE) у пациентов со стабильной ишемической болезнью сердца (ИБС) была продемонстрирована в исследовании ROMA [17]. Это исследование показало, что однократная высокая (40 мг) ударная доза розувастати-на, принятая в течение 24 ч перед плановой ЧКВ, снижает частоту перипроцедурного ИМ у пациентов, ранее не получавших статины.
Наконец, в 2011 г. были опубликованы данные метаанализа нескольких рандомизированных исследований “Клиническая эффективность предварительного назначения статинов у пациентов, подвергнутых ЧКВ”. Авторы включили в анализ 13 клинических испытаний с 3341 рандомизированными пациентами [18]. Они пришли к выводу, что предварительная нагрузка высокими дозами статинов значительно снижает риск перипроцедурного ИМ у пациентов, подвергнутых ЧКВ, и ее следует использовать в рутинном порядке у пациентов, направленных на выборочную ЧКВ.
Однако в настоящее время статины уже широко используются для первичной и вторичной профилактики
ИБС, поэтому большинство пациентов, направляемых на плановую реваскуляризацию, уже длительно получают статины на момент процедуры. Интересно, что плейо-тропные эффекты, вызываемые статинами, могут ослабевать при их длительном приеме [10] и восстанавливаться при назначении нагрузочной высокой дозы. Таким образом, остается вопрос, может ли перезагрузка большими дозами статинов перед ЧКВ быть полезной пациентам, длительно принимающим статины.
С этой целью было выполнено исследование ARMYDA RECAPTURE [19], включавшее 383 пациента со стабильной стенокардией или острым коронарным синдромом (ОКС) без подъема сегмента ST. Все пациенты исходно принимали статины продолжительностью не менее 30 дней. В группе вмешательства нагрузка аторвастатином составила 80 мг за 12 ч и еще 40 мг – за 2 ч до эндоваскулярного вмешательства. Авторами было показано, что число больных с постинтервенционным повышением сердечных маркеров выше ВГН было снижено в группе аторвастатина по сравнению с плацебо (КФК МВ: 13 против 24%, р=0,017; тропонина: 37 против 49%, р=0,021).
Исследование ROMA II имело цель – сравнить влияние нагрузочной дозы розувастатина (40 мг) и аторвастатина (80 мг), назначенных за 24 ч перед плановой процедурой ЧКВ, на снижение частоты перипроцедурного мионекроза, диагностированного при повышении КФК МВ более 3 х ВГН у пациентов, уже находящихся на длительном лечении статинами [20]. Через 12 ч различий в уровне повышения КФК-МВ между группами аторвастатина и розувастатина выявлено не было (р=0,643), но достоверно меньшее число пациентов имели уровни КФК-МВ выше 3 х ВГН в группах обоих статинов по сравнению с контрольной группой (6 и 7% по сравнению с 25%, р=0,0001 и р=0,003). Через 24 ч частота перипроцедур-ного некроза миокарда, диагностированного по увеличению КФК МВ выше 3 х ВГН, была выявлена у 8% больных в группе аторвастатина и 9% – в группе розувастати-на (р=0,834) и у 29% из тех, кто не получил перезагрузку статинами (р=0,0001 и р=0,001). Таким образом, результаты исследования ROMA II показали, что высокие нагрузочные дозы обоих статинов значимо улучшили процедурный и долгосрочный клинический исход ЧКВ у стабильных пациентов. Сравнение нагрузочной дозы розу-вастатина и аторвастатина перед ЧКВ у стабильных пациентов, уже находящихся на длительной терапии статинами, показало сходное влияние на процедурный, среднесрочный и долгосрочный исходы. Оба статина подтвердили положительное воздействие по сравнению с отсутствием перезагрузки, то есть дополнительной нагрузки статином перед ЧКВ.
Однако в этом же 2013 г. были опубликованы данные D. Zemanek с соавт., которые рандомизировали 202 пациента со стабильной стенокардией, уже длительно принимающих статины, в группы 7-дневной предпроцедур-ной нагрузки аторвастатином 80 мг/сутки и плацебо. Частота перипроцедурного ИМ, определяемого как увеличение КФК МВ или TnI более 3хВГН, была 15% в группе аторвастатина против 14% в контрольной группе (р=0,80). Авторы сделали вывод, что 7-дневная нагрузка высокой дозой аторвастатина перед процедурой ЧКВ не снижает частоту развития перипроцедурного ИМ у пациентов, уже длительно получающих статины [21]. Таким образом, данные об эффективности нагрузочных доз статинов у пациентов, уже длительно принимающих статины, остаются противоречивыми.
С целью сравнения влияния нагрузочных доз аторвастатина и розувастатина на величину острого повреждения миокарда, определяемую по динамике сердечных биомаркеров (высокочувствительного TnI и КФК МВ), при плановых эндоваскулярных вмешательствах на КА, нами было проведено открытое проспективное сравнительное клиническое исследование, включавшее 68 пациентов со стабильной ИБС, которым на базе отделения реабилитации больных сердечно-сосудистыми заболеваниями НИИ кардиологии (Томск) в течение 2012–2014 гг. выполнены эндоваскулярные вмешательства на КА. Все пациенты исходно длительно принимали статины в рамках стандартной гиполипидемической терапии.
Методом закрытых конвертов пациенты были распределены в 2 группы. В 1-ю группу включено 33 пациента, получивших нагрузочную дозу аторвастатина (Torvacard, Zentiva) 80 мг за 12 ч до вмешательства с последующим сохранением этой дозы в течение 2–6 дней. За 7 дней госпитального периода средняя общая доза препарата на одного пациента в этой группе составила 320 (260–400) мг. Во 2-ю группу включено 35 больных, принимавших розувастатин (Crestor, AstraZeneca) 40 мг/сутки во время пребывания в стационаре. В этой группе средняя общая доза розувастатина за 7 дней госпитального периода составила 260 (240–280) мг.
Коронарную ангиопластику и имплантацию стента проводили в соответствии со стандартной практикой. Ангиографический успех определялся при наличии остаточного стеноза менее 20% и TIMI потока III степени после процедуры реваскуляризации, при этом регистрировали развитие таких перипроцедурных осложнений, как перфорация миокарда, окклюзия основных сосудов или боковых ветвей, рассечение КА, феномен slow или no-reflow. В начале процедуры всем пациентам внутриартериально вводился болюс нефракционированного гепарина в дозе 70 ME/кг до достижения активированного времени свертывания более 250 с.
По основным клинико-анамнестическим показателям, сопутствующей патологии и терапии исходно группы не различались (табл. 1). Характеристика поражения КА и выполненных эндоваскулярных вмешательств представлена в таблице 2. По количеству КА с гемодинамически значимыми стенозами, локализации выполненных вмешательств, числу и характеристикам установленных стентов статистически значимых различий между группами сравнения также не было. Количественно КФК-МВ определялась исходно, через 12, 24, 48, 72 ч и на 5-е сутки после вмешательства фотометрическим методом при помощи автоанализатора Konelab 60i. ТnI определялся в тех же временных точках количественным иммунофер-ментным методом при помощи тест-системы ELISA (Biomerica, США). Увеличение КФК МВ (или ТnI) в течение 48 ч после вмешательства выше 99% ВГН свидетельствовало о развитии острого повреждения миокарда, а выше 5 х 99% ВГН – о ЧКВ-ассоциированном ИМ.
Таблица 1
Исходная клинико-анамнестическая характеристика групп
|
Показатели |
Аторвастатин, |
Розувастатин, |
р |
|
n=33 |
n=35 |
||
|
Мужчины, n/% |
29/87,8 |
31/88,6 |
1,00 |
|
Возраст, годы, M±SD |
58,9±7,2 |
57,7±10,2 |
0,61 |
|
(min-max) |
(46–76) |
(39–80) |
|
|
ИМТ, M±SD |
29±5,3 |
29,6±4,1 |
0,32 |
|
(min-max) |
(20,9–48,8) |
(20,8–36,3) |
|
|
АГ, n/% |
29/87,9 |
28/80 |
0,51 |
|
ПИКС, n/% |
24/72,7 |
29/82,9 |
0,39 |
|
Стаж ИБС, годы, Me (Q1-Q3) |
1,5 (1–3,5) |
2 (1–5) |
0,81 |
|
Предшествующие |
11/33,3 |
15/42,9 |
0,46 |
|
реваскуляризации, n/% |
|||
|
ФВ ЛЖ (В), %, M±SD |
60,8±8 |
63,4±5,5 |
0,30 |
|
(min-max) |
(39–72) |
(51–73) |
|
|
ОНМК (ТИА), n/% |
1/3,03 |
1/2,86 |
1,00 |
|
ФП, n/% |
3/9,09 |
2/5,71 |
0,67 |
|
ХОБЛ, n/% |
3/9,09 |
5/14,29 |
0,71 |
|
Курит (лет), n/% |
25/75,8 |
20/58,8 |
0,19 |
|
Отягощенная |
12/36,4 |
14/40 |
0,81 |
|
наследственность, n/% |
|||
|
СД 2 типа, n/% |
2/6,06 |
5/14,29 |
0,43 |
|
НТГ, n/% |
6/18,2 |
4/11,4 |
0,51 |
|
Стенокардия напряжения, n/ |
% |
||
|
1-й ФК |
5/15,1 |
7/20 |
0,75 |
|
2-й ФК |
13/39,4 |
14/40 |
1,00 |
|
3-й ФК |
15/45,5 |
14/40 |
0,81 |
|
ХСН, NYHA, n/% |
|||
|
1-й ФК |
13/39,4 |
14/40 |
1,00 |
|
2-й ФК |
11/33,3 |
17/48,6 |
0,23 |
|
3-й ФК |
9/27,3 |
4/11,4 |
0,13 |
|
Аспирин, n/% |
33/100 |
35/100 |
1,00 |
|
Клопидогрел, n/% |
27/81,8 |
30/85,7 |
0,75 |
|
Тикагрелор, n/% |
6/18,2 |
5/14,3 |
0,75 |
|
иАПФ, n/% |
30/90,9 |
30/85,7 |
0,71 |
|
БАБ, n/% |
24/2,7 |
28/80 |
0,57 |
|
Мочегонные, n/% |
6/18,2 |
6/17,1 |
1,00 |
|
БКК, n/% |
10/30,3 |
8/22,9 |
0,59 |
|
Нитраты, n/% |
3/9,09 |
2/5,71 |
0,67 |
|
Антиаритмики, n/% |
1/3,03 |
1/2,86 |
1,00 |
|
Метаболиты, n/% |
1/3,03 |
0/0 |
0,49 |
|
Нагрузка статинами (за 7 |
320 |
260 |
0,00003 |
|
дней), мг, Me (Q1-Q3) |
(260–400) |
(240–280) |
Прмечание: ИМТ – индекс массы тела, АГ – артериальная гипертензия, ОНМК – острое нарушение мозгового кровообращения, ТИА – транзиторная ишемическая атака, ФП – фибрилляция предсердий, ХОБЛ – хроническая обструктивная болезнь легких, ПИКС – постинфарктный кардиосклероз, ФВ ЛЖ – фракция выброса левого желудочка, иАПФ – ингибиторы ангиотен-зинпревращающего фермента, БАБ – β -адреноблокаторы, БКК – блокаторы кальциевых каналов, НТГ – нарушение толерантности к глюкозе, ХСН – хроническая сердечная недостаточность.
Ангиографический успех ЧКВ в обеих группах составил 97%. Больших сердечно-сосудистых событий (смерть, ОКС, ОНМК) в течение госпитального периода в исследуемых группах не было. Также не было эпизодов острого тромбоза стента, фибрилляции желудочков и других жизнеугрожающих аритмий во время процедур реваскуляризации. Все пациенты выписаны из стационара в удовлетворительном состоянии. Статистически значимых
Таблица 2
Характеристика поражения коронарных артерий и выполненных эндоваскулярных вмешательств
|
Показатели |
Аторвастатин, n=33 |
Розувастатин, n=35 |
р |
|
Количество пораженных сосудистых бассейнов исх., n/% 1 |
9/27,3 |
11/31,4 |
0,79 |
|
2 |
16/48,5 |
12/34,3 |
0,33 |
|
3 |
8/24,2 |
12/34,3 |
0,43 |
|
Стеноз ПНА более 50%, n/% |
28/84,9 |
27/79,4 |
0,75 |
|
Стеноз ОА более 50%, n/% |
15/45,5 |
20/58,8 |
0,33 |
|
Стеноз ПКА более 50%, n/% |
22/66,7 |
23/67,7 |
1,00 |
|
Локализация выполненного вмешательства, n/% – ствол ЛКА |
1/3,03 |
2/5,71 |
1,00 |
|
– бассейн ПНА |
15/45,5 |
20/57,1 |
0,47 |
|
– бассейн ОА |
12/36,4 |
10/28,6 |
0,61 |
|
– бассейн ПКА |
12/36,4 |
16/45,7 |
0,47 |
|
– стентирование рестенозов стентов |
2/6,06 |
3/8,57 |
1,00 |
|
Количество установленных стентов на одного больного, M±SD |
1,39±0,7 |
1,43±0,74 |
0,94 |
|
Длина стента, мм, M±SD |
30,4±14,6 |
30,5±10,3 |
0,29 |
|
Диаметр стента, мм, M±SD |
3,33±0,4 |
3,26±0,45 |
0,23 |
|
СЛП, n/% |
42/91,3 |
43/86 |
0,53 |
|
Механическая реканализация и стентирование хронической окклюзии |
6/18,2 |
4/11,4 |
0,51 |
|
Количество других артерий с одновременно выполненной БД, M±SD |
0,33±0,74 |
0,23±0,49 |
0,80 |
Примечание: ПНА – передняя нисходящая артерия, ОА – огибающая артерия, ПКА – правая коронарная артерия, ЛКА – левая коронарная артерия, СЛП – стенты с лекарственным покрытием.
различий между группами по количеству острых осложнений вмешательства не наблюдалось.
Степень перипроцедурного повреждения миокарда в нашей работе оценивалась по динамике кардиоспеци-фичных ферментов КФК-МВ и ТnI. Динамика ТnI представлена на рисунке 1. Выявлено некоторое преимущество защитного действия на миокард нагрузочной дозы розувастатина по сравнению с нагрузочной дозой аторвастатина, подтвержденное динамикой ТnI, который через 12 ч после вмешательства более значимо увеличился в группе аторвастатина. Исходно уровень TnI составил 0,58 (0,49–0,66) и 0,58 (0,49–0,64) нг/мл в 1 и 2-й группах соответственно, р=0,88. Через 12 ч после вмешательства уровень TnI достоверно повысился в обеих группах – до 1,01 (0,69–1,32) нг/мл в 1-й группе и 0,74 (0,62–0,98) нг/мл – во 2-й, р=0,045. Через 24 ч после вмешательства межгрупповые различия уровня TnI исчезли – 0,89 (0,62– 1,34) нг/мл и 0,77 (0,64–0,95) нг/мл соответственно, р=0,31. Величина этого биомаркера оставалось существенно повышенной до 3 суток наблюдения в обеих группах, но без значимых межгрупповых различий. Кроме того, не удалось выявить различий между группами по величине пикового значения TnI – 1,06 (0,69–1,49) нг/мл в 1-й группе и 0,82 (0,67–1,07) нг/мл во 2-й, р=0,17.
Динамика другого кардиоспецифического фермента – КФК МВ – представлена на рисунке 2. Исходно уровень КФК МВ составил 11 (7–15) Ед/л и 9,5 (7–14) Ед/л в 1 и
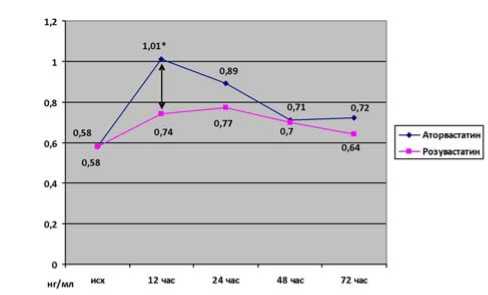
Рис. 1. Динамика TnI. * – p ≤ 0,05 – достоверность межгрупповых различий
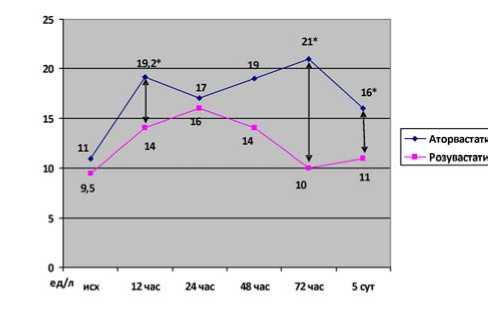
Рис. 2. Межгрупповая динамика КФК-МВ. * – p ≤ 0,05 – достоверность различий между группами
■ 12ч
□ 24ч
□ 48ч ef^jn Ато p «лет rr ии Poi/ысгатии
Рис. 3. Внутригрупповая динамика КФК-МВ. * – p ≤ 0,05 – достоверность различий по сравнению с исходным значением
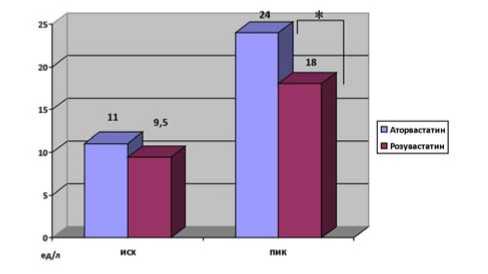
Рис. 4. Сравнение пиковых значений КФК МВ между группами. * – p ≤ 0,05 – достоверность различий между группами
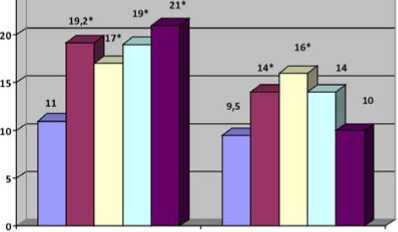
2-й группах соответственно, р=0,78. Через 12 ч после вмешательства уровень КФК МВ увеличился до 19,2 (14,5– 23) Ед/л в 1-й группе и 14 (11,6–22,1) Ед/л во 2-й, р=0,04. К концу первых суток статистически значимые межгрупповые различия исчезли вследствие некоторого снижения этого биомаркера в группе аторвастатина и продолжающегося повышения КФК МВ в группе розувастатина. Через 72 ч после вмешательства в группе розувастатина этот кардиоспецифический фермент практически вернулся к исходному значению. На фоне же нагрузки аторвастатином КФК МВ оставалась достоверно повышенной по сравнению с исходным уровнем до конца госпитального периода. Внутригрупповая динамика этого биомаркера представлена на рисунке 3. Кроме того, были выявлены статистически значимые межгрупповые различия по величине пикового значения КФК МВ – 24 (18–38) Ед/л в 1-й группе и 18 (14–26) Ед/л во 2-й, р=0,029 (рис. 4).
Защита миокарда триметазидином при плановых эндоваскулярных вмешательствах на КА у пациентов с нарушениями углеводного обмена. В последние годы наметилась тенденция к все более широкому применению ЧКВ для лечения больных высокого риска с сопутствующими заболеваниями, множественным поражением коронарного и в целом артериального русла. Пожилой возраст больных, сниженная функция ЛЖ, многососудистое поражение КА, мультифокальный атеросклероз, наличие сахарного диабета (СД) и многие другие факторы снижают выживаемость пациентов после ЧКВ.
Интервенционное лечение ИБС при наличии СД представляет сложную задачу в связи с особенностями атеросклеротических изменений венечного русла (быстрое прогрессирование, многососудистое поражение, диффузный характер атеросклероза с поражением артерий малого диаметра, сложная морфология стенозов) [22], а также высокой частотой рестенозирования в результате нарушений эндотелиальной функции при СД [23, 24]. Тем не менее от 25 до 32% больных ИБС, подвергающихся реваскуляризации миокарда, страдают диабетом, причем ЧКВ на КА выполняются у 68% из них [25]. Введение в клиническую практику стентов с лекарственным покрытием (СЛП) привело к все более широкому применению ЧКВ для лечения больных СД за счет снижения частоты рестеноза и необходимости повторной реваскуляризации [26, 27].
При СД миокард становится особенно чувствительным к ишемическо-реперфузионному повреждению [28]. Диабет рассматривается как независимый фактор риска для повреждения миокарда во время вмешательств на сердце [29]. Патофизиология повреждения миокарда при ишемии-реперфузии включает многофакторные процессы. Основные механизмы, ответственные за увеличение
Таблица 3
Исходная клинико-анамнестическая характеристика групп
|
Показатели |
Предуктал, n=32 |
Контроль, n=31 |
р |
|
Мужчины, n/% |
28/87,5 |
24/77,4 |
0,34 |
|
Возраст, годы, M±SD |
62,1±8,3 |
60,6±8,9 |
0,51 |
|
(min-max) |
(49–76) |
(39–73) |
|
|
ИМТ, Me |
31,1 |
29,7 |
0,74 |
|
(Q1-Q3) |
(26,8–36,85) |
(28,1–35,7) |
|
|
АГ, n/% |
32/100 |
31/100 |
1,00 |
|
Стаж АГ, годы, Me (Q1-Q3) |
12,5 (3,5–19) |
10 (5–15) |
0,82 |
|
Стаж ИБС, годы, Me (Q1-Q3) |
3,0 (0,7–9,5) |
4,0 (0,5–6) |
0,72 |
|
ОНМК (ТИА), n/% |
2/6,25 |
2/6,45 |
0,97 |
|
ФП, n/% |
4/14,7 |
7/22,6 |
0,34 |
|
ХОБЛ, n/% |
4/12,5 |
4/12,9 |
0,96 |
|
Курит (лет), n/% |
24/75 |
19/61,3 |
0,29 |
|
Отягощенная наследствен- |
12/37,5 |
17/54,9 |
0,13 |
|
ность, n/% |
|||
|
ПИКС, n/% |
22/68,75 |
24/77,4 |
0,57 |
|
СД 2-го типа, n/% |
22/68,75 |
25/80,6 |
0,39 |
|
Легкая степень |
4/12,5 |
4/12,9 |
0,96 |
|
Средняя степень |
18/56,25 |
21/67,7 |
0,44 |
|
НТГ, n/% |
10/31,25 |
6/19,4 |
0,39 |
|
Стаж нарушений углеводного |
1,0 |
2,0 |
0,30 |
|
обмена, годы, Me (Q1-Q3) |
(0,5–3,5) |
(0,25–9) |
|
|
HbA1c исх, %, M±SD |
5,9±0,8 |
6,2±1,2 |
0,12 |
|
Аспирин, мг, M±SD |
90,6±29,6 |
100,0±48,3 |
0,89 |
|
Клопидогрел, мг, M±SD |
84,4±25,2 |
82,3±22,5 |
0,85 |
|
иАПФ, n/% |
22/68,75 |
26/83,9 |
0,24 |
|
БАБ, n/% |
24/75 |
25/80,6 |
0,59 |
|
Мочегонные, n/% |
6/18,75 |
10/32,3 |
0,22 |
|
Варфарин, n/% |
2/6,25 |
5/16,1 |
0,21 |
|
БКК, n/% |
12/37,5 |
16/51,6 |
0,32 |
|
Нитраты, n/% |
18/56,25 |
19/61,3 |
0,68 |
|
Антиаритмики, n/% |
4/12,5 |
3/9,7 |
0,72 |
|
Статины в стационаре, n/% |
32/100 |
28/90,3 |
0,11 |
|
Сахароснижающая терапия: |
|||
|
Только диета, n/% |
10/31,25 |
8/25,8 |
0,78 |
|
Метформин, n/% |
18/56,25 |
18/58,1 |
0,88 |
|
Препараты сульфонилмоче- |
10/31,25 |
15/48,4 |
0,20 |
|
вины, n/% |
|||
|
Инсулины, n/% |
2/6,25 |
5/16,1 |
0,20 |
Примечание: HbA1c – гликозилированный гемоглобин.
повреждения миокарда на фоне диабета, до конца не поняты. Среди метаболических расстройств при СД в кардиомиоцитах главенствующее положение занимают нарушения энергетического обмена, обусловленные инсулиновой недостаточностью, которые приводят к ишемии непосредственно на уровне кардиомиоцита даже в условиях нормального кровоснабжения [30]. Обмен глюкозы в миокарде снижен из-за нарушения транспорта глюкозы в клетки. В энергетическом обмене миокарда резко преобладают жирные кислоты, что ведет к кислородозатратному типу энергетического обмена. Это делает больных СД чрезвычайно чувствительными к малейшему ограничению коронарного кровотока. Данные изменения в миокарде даже в условиях адекватного кровоснабжения аналогичны нарушениям обмена у пациентов с тяжелой формой ИБС. Также многими исследователями показано, что при СД усиливается окислительный стресс (чрезмерное образование свободных радикалов и/или
Таблица 4
Характеристика поражения КА и выполненных эндоваскулярных вмешательств
Целью этого фрагмента нашей работы было изучение влияния препарата метаболического действия ТМЗ на величину острого повреждения миокарда при плановых эндоваскулярных вмешательствах на КА у пациентов со стабильной ИБС на фоне нарушений углеводного обмена. Проведено открытое проспективное рандомизированное контролируемое клиническое исследование, включавшее 63 пациента со стабильной ИБС, которым на базе отделения реабилитации больных сердечно-сосудистыми заболеваниями НИИ кардиологии в течение 2010–2011 гг. выполнено эндоваскулярное лечение КА. Критериями включения в исследование было наличие показаний к эндоваскулярной реваскуляризации миокарда согласно национальным рекомендациям по диагностике
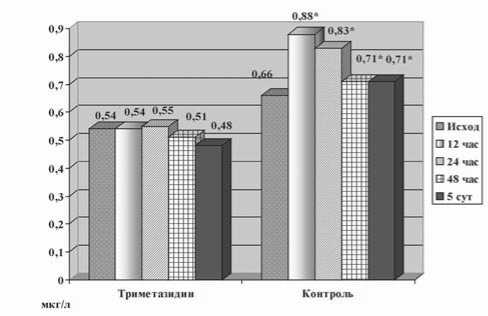
Рис. 5. Динамика ТnI. * – p ≤ 0,05 – достоверность различий внутри группы по сравнению с исходным значением
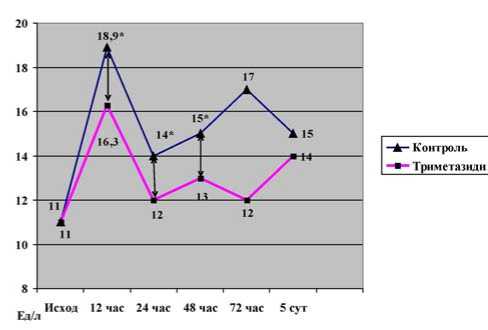
Рис. 6. Динамика КФК-МВ. * – p ≤ 0,05 – достоверность межгрупповых различий
и лечению стабильной стенокардии за 2008 г. [34], наличие фоновых нарушений углеводного обмена (СД 2-го типа или нарушение толерантности к глюкозе по данным теста толерантности к глюкозе). Пациенты основной группы (1-я группа, n=32) в течение 2 недель перед вмешательством получали ТМЗ (Предуктал МВ, Servier) 35 мг 2 раза в сутки в дополнение к стандартной терапии. Пациентам контрольной группы (2-я группа, n=31) ЧКВ и последующее наблюдение проводилось на фоне стандартной терапии без применения препаратов метаболического действия.
По клинико-анамнестическим показателям, выраженности углеводных расстройств, сопутствующей терапии исходно группы не различались (табл. 3). Характеристика поражения КА и выполненных эндоваскулярных вмешательств представлена в таблице 4. Степень перипро-цедурного некроза миокарда также оценивалась по динамике кардиоспецифичных ферментов ТnI и КФК-МВ, которые определялись в тех же временных рамках и теми же методами, что и в предыдущем фрагменте работы по изучению защитных возможностей нагрузочных доз статинов.
Ангиографический успех ЧКВ в обеих группах составил 100%. Больших сердечно-сосудистых событий (смерть, ОКС, ОНМК) в течение госпитального периода не было. Ни одно из острых осложнений не было фатальным. Все пациенты выписаны из стационара в удовлетворительном состоянии. Статистически значимых различий между группами по количеству острых осложнений не выявлено.
Динамика ТnI представлена на рисунке 5. Выявлено защитное действие ТМЗ на миокард, подтвержденное динамикой ТnI, который значимо повысился через 12 ч в группе контроля: 0,66 (0,51–0,91) нг/мл исходно и 0,88 (0,71–0,1) нг/мл через 12 ч, р≤0,05. В этой группе статистически достоверное увеличение ТnI сохранялось до 5 суток наблюдения. В основной группе статистически достоверного увеличения уровня ТnI через 12 ч по сравнению с исходным значением не выявлено: 0,54 (0,43– 0,69) нг/мл исходно и 0,54 (0,41–0,55) нг/мл через 12 ч, р≥0,05. В последующие дни значимого повышения ТnI у пациентов этой группы также не наблюдалось.
Динамика другого кардиоспецифического фермента представлена на рисунке 6. Исходно уровень КФК МВ составил 9,5 (7–13) Ед/л в основной и 11 (9–13) Ед/л в контрольной группе, р=0,37. Через 12 ч после вмешательства уровень КФК МВ увеличился до 16,3 (9,9–20,9) Ед/л и 18,9 (16,1–25,3) Ед/л соответственно, р=0,035. Статистически значимое различие между группами в величине этого фермента сохранялось до 3 суток наблюдения. Затем межгрупповые различия исчезли.
Значения кардиоспецифических ферментов после стентирования ни у одного из пациентов в обеих группах не достигли уровня перипроцедурного ИМ. Прогностически значимое перипроцедурное повреждение миокарда выявлено у 2 больных в группе контроля. В группе предуктала увеличение кардиоспецифических ферментов выше 99% не было ни у одного больного (различия статистически недостоверны).
Ишемическо-реперфузионное повреждение миокарда при выполнении ЧКВ реализуется за счет многих механизмов, включающих активацию тромбоцитов, лейкоцитов, комплемента, эндотелиальную дисфункцию, нарушения микроциркуляции и проявляется клинически оглушением миокарда, реперфузионными аритмиями, болевым синдромом и снижением сократительной и насосной функции миокарда. Окислительный стресс, дисбаланс между образованием свободных радикалов и их ликвидацией или, другими словами, детоксикацией, является принципиальным медиатором повреждения миокарда во время ишемии и реперфузии [35]. При СД окислительный стресс усиливается в большей степени, что является прямо или косвенно следствием гипергликемии, гиперлипидемии, гиперинсулинемии и резистентности к инсулину [36]. Эти нарушения либо самостоятельно, либо в комбинации, способствуют митохондриальной дисфункции, значительной активации никотинамидаде-ниндинуклеотидфосфат (NADPH) оксидазы и разобщению функционирования синтаз оксида азота (NOS разобщению). Это приводит к чрезмерному накоплению свободных радикалов в диабетическом миокарде, который не может легко адаптироваться к ишемии-реперфузии
-
[37 ]. В результате этого на фоне СД кардиомиоцит оказывается более уязвимым к ишемическо-реперфузионно-му повреждению, что приводит к последующему патологическому ремоделированию и сердечной недостаточности.
ТМЗ является метаболическим препаратом, который сдвигает энергетический обмен кардиомиоцита от окисления свободных жирных кислот в сторону окисления глюкозы, ингибируя митохондриальную длинноцепочечную 3-кетоацил коэнзим А-тиолазу (3-КАТ). Кроме того, ТМЗ ослабляет окислительный стресс, уменьшает потребление кислорода и улучшает митохондриальный обмен веществ и работу сердца на фоне ишемии. Сообщается о способности ТМЗ ослаблять активацию нейтрофилов и защиту постишемического сердца от повреждения, опосредованного нейтрофилами [38].
Продемонстрированное нами защитное действие ТМЗ на миокард в условиях фонового СД подтверждается данными других исследователей, хотя работ, посвященных применению ТМЗ для защиты миокарда при плановой реваскуляризации у пациентов с СД, мы не встретили. Так, авторы в экспериментальной работе показали, что добавление ТМЗ существенно улучшает восстановление миокарда после ишемически-реперфузионного повреждения сердец крыс как с индуцированным диабетом, так и без него по показателям гемодинамики и по биохимическим маркерам некроза миокарда. Защитное действие TMЗ на повреждение миокарда, измеренное динамикой биохимических показателей, было более очевидным в диабетических сердцах, чем в сердцах недиабетических крыс [39]. Кроме того, ранее рядом авторов доказано, что применение ТМЗ до проведения баллонной ангиопластики и стентирования КА способствует снижению процессов перекисного окисления липидов, достоверному увеличению супероксиддисмутазы и глутатионпероксидазы, достоверному снижению уровня малонового диальдегида [40]. Другими исследователями показано, что при проведении коронарной ангиопластики внутрикоронарное введение ТМЗ препятствует и заметно сокращает признаки ишемии на ЭКГ и снижает болевую симптоматику при стенокардии, а также снижает уровень ТnI во все сроки после ЧКВ по сравнению с контрольной группой [41–43].
Заключение
Полученные нами данные подтвердили, что применение высоких нагрузочных доз сильнодействующих статинов (аторвастатина и розувастатина) при плановом эндоваскулярном вмешательстве на КА оказывает сходное влияние на динамику сердечных биомаркеров в течение 72 ч после ЧКВ. При этом применение нагрузочной дозы розувастатина имеет некоторое преимущество в связи с достоверно меньшим повышением TnI и КФК МВ (на 26,7 и 27,1% соответственно) в течение первых 12 ч после процедуры.
Добавление ТМЗ – препарата метаболического действия – к стандартной терапии при эндоваскулярной реваскуляризации миокарда у пациентов с нарушениями углеводного обмена также способствует уменьшению острого повреждения миокарда, хотя клиническое зна- чение влияния этой защиты на отдаленные исходы заболевания еще требует изучения.
Список литературы Профилактика острого повреждения миокарда при плановых эндоваскулярных вмешательствах на коронарных артериях
- Califf R.M., Abdelmeguid A.E., Kunitz R.E. et al. Myonecrosis after revascularization procedures//J. Am. Coll. Cardiol. -1998. -Vol. 31. -P. 241-251.
- Klein R.W., Kramer B.L., Howard E., Lesch M. Incidence and clinical significance of transient creatine kinase elevations and the diagnosis of non-Q wave myocardial infarction associated with coronary angioplasty//J. Am. Coll. Cardiol. -1991. -Vol. 17. -P. 321-326.
- Prasad A., Herrmann J. Myocardial Infarction due to percutaneous coronary intervention//N. Eng. J. Med. -2011. -Vol. 364. -P 453-464.
- Ellis S.G., Chew D., Chan A. et al. Death following creatine kinase-MB elevation after coronary intervention. Identification of an early risk period: importance of creatine kinase-MB level, completeness of revascularization, ventricular function and and probable benefit of statin therapy//Circulation. -2002. -Vol. 106. -P. 1205-1211.
- Ioannidis J.P.A., Karvouni E., Katritis D.G. Mortality risk conferred by small elevations of creatine-kinase MB isoenzyme after percutaneous intervention//J. Am. Coll. Cardiol. -2003. -Vol. 42. -P. 1406-1411.
- Merla R., Reddy N.K., Wang F.W. et al. Meta-analysis of published reports on the effect of statin treatment before percutaneous coronary intervention on peri-procedural myonecrosis//Am. J. Cardiol. -2007. -Vol. 100. -P. 770-776.
- Veselka J., Prochazkova S., Duchnova R. et al. Pre-procedural statin therapy reduces the risk and extent of cardiac biomarkers release following percutaneous coronary intervention//Heart Vessels. -2006. -Vol. 21. -P. 146-151.
- Jones S.P., Trocha S.D., Lefer D.J. Pretreatment with simvastatin attenuates myocardial dysfunction after ischemia and chronic reperfusion//Arterioscler. Thromb. Vasc. Biol. -2001. -Vol. 21. -P. 2059-2064.
- Bell R.M., Yellon D.M. Atorvastatin, administered at the onset of reperfusion, and independent of lipid lowering, protects the myocardium by up-regulating a pro-survival pathway//J. Am. Coll. Cardiol. -2003. -Vol. 41. -P. 508-515.
- Mensah K., Mocanu M.M., Yellon D.M: Failure to protect the myocardium against ischemia/reperfusion injury after chronic atorvastatin treatment is recaptured by acute atorvastatin treatment: a potential role for phosphatase and tensin homolog deleted on chromosome ten?//J. Am. Coll. Cardiol. -2005. -Vol. 45. -Р 1287-1291.
- Wang T., Yang Y.J., Xu B. Atorvastatin pretreatment before PCI accelerates both neointimal coverage and reendothelialization after sirolimus-eluting stent implantation using a porcine model: new findings from optical coherence tomography and pathology//J. Am. Coll. Cardiol. -2012. -Vol. 59. -P. 1196-1209.
- Davignon J. Beneficial cardiovascular pleiotropic effects of statins//Circulation. -2004. -Vol. 109, No. 23, Suppl 1(III). -P. 39-43.
- Sanguigni V., Pignatelli P., Lenti L. et al. Short-term treatment with atorvastatin reduces platelet CD40 ligand and thrombin generation in hypercholesterolemic patients//Circulation. -2005. -Vol. 111. -P. 412-419.
- Hinoi T., Matsuo S., Tadehara F. et al. Acute effect of atorvastatin on coronary circulation measured by transthoracic Doppler echocardiography in patients without coronary artery disease by angiography//Am. J. Cardiol. -2005. -Vol. 96. -P. 89-91.
- Pasceri V., Patti G., Nusca A. et al. ARMYDA Investigators. Randomized trial of atorvastatin for reduction of myocardial damage during coronary intervention: results from the ARMYDA (Atorvastatin for Reduction of Myocardial Damage during Angioplasty) study//Circulation. -2004. -Vol. 110. -P. 674-678.
- Briguori C., Visconti G., Focaccio A. et al. Novel Approches for Preventing or Limiting Events (NAPLES II) trial//J. Am. Coll. Cardiol. -2009. -Vol. 54. -Р 2157-2163.
- Sardella G., Conti G., Donahue M. et al. Rosuvastatin pretreatment in patients undergoing elective PCI to reduce the incidence of myocardial periprocedural necrosis: the ROMA trial//Catheter Cardiovasc. Interv. -2013. -No. 81. -Р 36-43.
- Patti G., Cannon C.P, Murphy S.A. et al. Clinical benefit of statin pretreatment in patients undergoing percutaneous coronary intervention. A collaborative patient-level meta-analysis of 13 randomized study//Circulation. -2011. -Vol. 123. -Р 1622-1632.
- Di Sciascio G., Patti G., Pasceri V. et al. Efficacy of atorvastatin reload in patients on chronic statin therapy undergoing percutaneous coronary intervention: results of the ARMYDA-RECAPTURE (Atorvastatin for Reduction of Myocardial Damage During Angioplasty) Randomized Trial//J. Am. Coll. Cardiol. -2009. -No. 54. -Р. 558-565.
- Sardella G., Lucisano L., Mancone M. et al. Comparison of high reloading ROsuvastatin and Atorvastatin pretreatment in patients undergoing elective PCI to reduce the incidence of MyocArdial periprocedural necrosis. The ROMA II trial //Int. J. Cardiol. -2013. -URL: (дата обращения 05.04.2015) DOI: 10.1016/j.ijcard.2013.06.017
- Zemanek D., Branny M., Martinkovicova L. et al. Effect of sevenday atorvastatin pretreatment on the incidence of periprocedural myocardial infarction following percutaneous coronary intervention in patients receiving long-term statin therapy. A randomized study//Inter. J. of Cardiology. -2013. -Vol. 168. -P. 2494-2497.
- Creager M.A., Luscher T.F., Cosentino F. et al. Diabetes and vascular disease: pathophysiology, clinical consequences, and medical therapy//Circulation. -2003. -Vol. 108 (12). -P. 1527-1532.
- Вершинина Е.О., Репин А.Н., Рябова Т.Р. и др. Ближайшие и отдаленные результаты плановых эндоваскулярных вмешательств на коронарных артериях и влияние на них нарушений углеводного обмена//Сибирский медицинский журнал (Томск). -2013. -Т. 28(4). -С. 28-35.
- Carrozza J.P., Kuntz R.E., Levine M.J. et al. Angiographic and clinical outcome of intracoronary stenting: immediate and longterm results from a large single-center experience//J. Am. Coll. Cardiol. -1992. -Vol. 20. -P. 328-337.
- Ryden L., Grant P.J., Anker S.D. et al. ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. The Task Force on diabetes, prediabetes, and cardiovascular dis-eases of the European Society of Cardiology (ESC) and developed incollaboration with the European Association for the Study of Diabetes (EASD)//Eur. Heart J. -2013. -Vol. 34. -P. 3035-3087.
- Moses J.W., Leon M.B., Popma J.J. et al. Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery//N. Engl. J. Med. -2003. -Vol. 349. -P. 1315-1323.
- Grube E., Silber S., Hauptmann K.E. et al. TAXUS I: six-and twelvemonth results from a randomized, double-blind trial on a slow-release paclitaxel-eluting stent for de novo coronary lesions//Circulation. -2003. -Vol. 107. -P. 38-42.
- Scrutinio D.I., Scrutinio D., Giannuzzi P. et al. Comorbidity in patients undergoing coronary artery bypass graft surgery: impact on outcome and implications for cardiac rehabilitation//European journal of cardiovascular prevention and rehabilitation: official journal of the European Society of Cardiology, Working Groups on Epidemiology & Prevention and Cardiac Rehabilitation and Exercise Physiology. -2008. -Vol. 15. -P 379-385.
- Balakumar P., Sharma N.K. Healing the diabetic heart: Does myocardial preconditioning work?//Cellular Signalling. -2011. -Vol. 24. -P 53-59.
- Дедов И.И., Александров А.А. Диабетическое Сердце: основные закономерности//Сердце. -2004. -№ 3(1). -P 5-8.
- Folli F., Corradi D., Fanti P. et al. The role of oxidative stress in the pathogenesis of type 2 diabetes mellitus micro-and macrovascular complications: avenues for a mechanistic-based therapeutic approach//Curr. Diabetes Rev. -2011. -No. 7. -P. 313-324.
- Pantos C., Mourouzis I. Protection of the abnormal heart//Heart Fail Rev. -2007. -No. 12. -P. 319-330.
- Cokkinos D.V., Pantos С. Myocardial protection in man -from research concept to clinical practice//Heart Fail Rev. -2007. -No. 12. -P. 345-362.
- ВНОК. Диагностика и лечение стабильной стенокардии. Российские рекомендации (второй пересмотр)//Кардиоваскулярная терапия и профилактика. -2008. -№ 7(6), прил. 4. -P. 1-28.
- Raedschelders K., Ansley D.M., Chen D.D.Y. The cellular and molecular origin of reactive oxygen species generation during myocardial ischemia and reperfusion//Pharmacol. Ther. -2012. -Vol. 133. -P. 230-255.
- Folli F., Corradi D., Fanti P. et al. The role of oxidative stress in the pathogenesis of type 2 diabetes mellitus micro-and macrovascular complications: avenues for a mechanistic-based therapeutic approach//Curr. Diabetes Rev. -2011. -No. 7. -P. 313-324.
- Takayanagi R., Inoguchi T., Ohnaka K. Clinical and experimental evidence for oxidative stress as an exacerbating factor of diabetes mellitus//J. Clin. Biochem. Nutr. -2011. -No. 48. -P. 72-77.
- Kantor P.F., Lucien A., Kozak R. et al. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long-chain 3-ketoacyl coenzyme A thiolase//Circ. Res. -2000. -No. 86. -P. 580-588.
- Ikizler M., Erkasap N., Dernek S. et al. Trimetazidine-induced enhancement of myocardial recovery during reperfusion: a comparative study in diabetic and non-diabetic rat hearts//Arch. Med. Res. -2006. -Vol. 37(6). -P. 700-708.
- Люсов В.А., Волов Н.А., Гордеев И.Г. и др. Роль миокардиальной цитопротекции в коррекции ишемического и реперфузионного повреждения миокарда у больных стабильной стенокардией, перенесших транслюминальную баллонную ангиопластику и стентирование коронарных артерий//Рос. кардиол. журнал. -2006. -№ 1. -P 33-38.
- Bonello L., Sbragia P., Amabile N. et al. Protective effect of an acute oral loading dose of trimetazidine on myocardial injury following percutaneous coronary intervention//Heart. -2007. -Vol. 93. -P. 703-707.
- Iskesen I., Kurdal A.T., Eserdag M. et al. Trimetazidine may protect the myocardium during cardiac surgery//Heart Surg. Forum. -2009. -No. 12. -P. 175-179.
- Labrou A., Giannoglou G., Ziotas D. et al. Trimetazidine administration minimizes myocardial damage and improves left ventricular function after percutaneous coronary intervention//Am. J. Cardiovasc. Drugs. -2007. -No. 7. -P. 143-150.


