Прогностическая ценность показателя ДНК-фрагментации сперматозоидов в успехе программ вспомогательных репродуктивных технологий. Эмпирическая антиоксидантная терапия в коррекции ДНК-фрагментации на фоне патологического окислительного стресса эякулята
Автор: Коршунов М.Н., Коршунова Е.С., Даренков С.П.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Андрология
Статья в выпуске: 3, 2017 года.
Бесплатный доступ
Введение: Целостность структуры ДНК мужской гаметы определяет качество эмбриона и течение беременности. Высокий уровень свободных радикалов в эякуляте может быть причиной повреждения ДНК-сперматозоидов. Антиоксидантная терапия может улучшить качество спермы и повысить результаты процедуры ВРТ. Наблюдения относительно показательности роли антиоксидантов в подготовке пациентов с ДНК-фрагментацией сперматозоидов на фоне патологической реакции оксидативного стресса (РОС) эякулята к повторным циклам ВРТ после неудачных попыток носят ограниченный характер, что стало целью пилотного исследования. Материалы и методы: Обследованы пары с мужским фактором бесплодия. Выбраны 32 неудачные попытки с низким показателем эмбриогенеза и потерями беременности. Пары планировали повторные попытки ЭКО/ИКСИ. Спермограмма, ДНК-фрагментация сперматозоидов и РОС эякулята выполнены до и после антиоксидантной терапии. Результаты: До лечения все пациенты имели тяжелую патоспермию, высокие уровни ДНК-фрагментации и РОС. После терапии зафиксировано улучшение качественных показателей эякулята, снижение ДНК-фрагментации и РОС. В результате программ ВРТ биохимическая и клинические беременности были достигнуты в 65,6% и 53,1% случаев. Успешное родоразрешение - у 15 женщин (46,8%). Выводы: Определение фрагментации ДНК сперматозоидов имеет важное значение в прогнозировании успеха программ ВРТ. Антиоксидантная терапия эффективный и безопасный метод коррекции идиопатических форм ДНК-фрагментации сперматозоидов и РОС. Это может улучшить качество эмбрионов и повысить частоту наступления беременности.
Днк фрагментация сперматозоидов, реакция оксидативного стресса, вспомогательные репродуктивные технологии, антиоксиданты
Короткий адрес: https://sciup.org/142188217
IDR: 142188217
Текст научной статьи Прогностическая ценность показателя ДНК-фрагментации сперматозоидов в успехе программ вспомогательных репродуктивных технологий. Эмпирическая антиоксидантная терапия в коррекции ДНК-фрагментации на фоне патологического окислительного стресса эякулята
есплодие – актуальная проблема современности. Каждая пятая пара в Западных странах и четвертая в мире страдают бесплодием [1]. Доля мужского фактора составляет около 50%. В 30-40% случаев не удается выявить причину нарушений фертильности мужчины [2]. Более чем в 40% наблюдений вследствие отсутствия эффекта от проводимой терапии, пары вынуждены прибегать к лечению бездетного брака методами вспомогательных репродуктивных технологий (ВРТ). Спермограмма позволяет оценить фертильный потенциал, но не всегда отражает степень нарушений сперматогенеза [3].
Одной из тяжелых и сложно преодолимых форм мужского бесплодия является повышенный уровень фрагментации ДНК сперматозоидов. Патофизиологические механизмы, приводящие к повреждению ДНК, раскрыты не полностью, и специального лечения бесплодия, вызванного этим фактором пока не предложено. К сожалению, в данных случаях методы ВРТ – экстракорпоральное оплодотворение (ЭКО), интрацитоплазматическая инъекция морфологически нормального сперматозоида (ИМСИ) – не всегда позволяют достичь желаемого результата [4,5].
В токсикологических лабораториях, фармацевтической промышленности нарушение целостности ДНК признано универсальным показателем клеточной летальности и является индикатором повреждения клетки [6].
Ряд работ демонстрирует, что одним из возможных элементов, приводящим к нарушениям сперматогенеза, является патологическая реакция оксидативного стресса эякулята (РОС) [7-10].
Источником избыточной продукции свободных радикалов мо- гут быть незрелые зародышевые клетки и нейтрофильные лейкоциты [11].
Процесс апоптоза аномальных клеток с дефектами хроматина, может быть неполным, вследствие чего избыток сохраненной цитоплазмы приводит к гиперпродукции активных форм кислорода, что в свою очередь индуцирует повреждение структуры ДНК [7].
Так, примерно у 40% бесплодных мужчин имеются высокие уровни реактивных форм кислорода (РФК) в сперме и содержание семенных антиоксидантов значительно ниже, чем у фертильной популяции [12,13].
В процессе экстракорпорального оплодотворения или при естественном зачатии ооциты могут быть подвержены «оксидативной атаке» со стороны сперматозоидов, что может привести к нарушению функциональности ооцита, в том числе и способности репарировать поврежденную структуру ДНК мужской гаметы [6].
Исследования демонстрируют отрицательную корреляцию между показателем ДНК-фрагментации сперматозоидов и частотой наступления и развития клинической беременности в таких программах ВРТ, как ЭКО, так и ИКСИ [14-16]. Высокий уровень ДНК-фрагментации ассоциируется с низким показателем рождаемости после процедур ЭКО/ИКСИ [17,18].
Показано, что эмпирическая антиоксидантная терапия может улучшить качество спермы, показатель оплодотворения в условиях in vitro и, соответственно, повысить эффективность процедур ВРТ. M.G. Showell и соавт. проанализировали 34 рандомизированных контролируемых исследования, включающее 2876 бесплодных пар с установленным мужским фактором, которым проводилась антиоксидантная терапия в формате подго- товки к ВРТ. Авторы указывают, что назначение антиоксидантов улучшает эффективность процедур ЭКО/ИКСИ. Результаты показали достоверное повышение частоты наступления беременности и родов в группе пациентов, получавших лечение по сравнению с контрольной (плацебо). Однако было отмечено, что показатели беременности и родов были зафиксированы не во всех работах. Также указано, что в анализируемых исследованиях пациенты получали разные антиоксиданты в различных дозах, что не позволяет выявить преимущество одного препарата над другим [19].
Наблюдения относительно роли антиоксидантов в подготовке пациентов с ДНК-фрагментацией сперматозоидов на фоне патологической РОС эякулята к повторным циклам ВРТ после неудачных попыток носят ограниченный характер. Вышеуказанное отражает актуальность пилотного исследования.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на базе центра ВРТ в период с марта 2014 по май 2016 гг. Критерии включения: мужской фактор бесплодия. Все мужчины имели тяжелые идиопатические нарушения сперматогенеза. Критерии исключения: варикоцеле, вредные привычки (курение, алкоголь), а также наличие профессиональных вредностей (высокие температуры, контакт с тяжелыми металлами, ионизирующее излучение).
Ретроспективно проанализированы 53 протокола ВРТ (ЭКО/ ИКСИ). В рамках исследования были выбраны 32 неудачные попытки с низким показателем эмбриогенеза (развитие до стадии бластоцисты менее 30%), останов- ками развития эмбрионов после 3-х суток культивирования и ранними потерями беременности 28,1% (9/32).
Средний возраст наблюдаемых составил 32,2±4,5 года (29-37), женщин – 30,4±2,1 года (26-33). Среднее число неудачных протоколов ЭКО/ ИКСИ в анамнезе – 2,6±1,2.
Формат лечения бесплодных пар включал повторные программы ЭКО/ИКСИ. Анализ спермограммы в соответствии с рекомендациями ВОЗ 2010 г., показатель ДНК-фрагментации сперматозоидов методом Halosperm (Halotech®) и РОС эякулята хемилюминесцентным методом были оценены до и после проведения эмпирической антиоксидантной терапии [20]. Нормативными значениями ДНК-фрагментации считались менее 30%, РОС – менее 3.
При анализе эякулята основными параметрами были выбраны: концентрация, подвижность сперматозоидов (категория a+b), процент морфологически нормальных гамет (критерии Крюгера).
Пациенты ежедневно принимали L-карнитин (3000 мг), селен (100 мг), витамины группы Е (400 мг) и С (1000 мг) в течение 12 недель. В период наблюдения супругам было рекомендовано придерживаться регулярной половой жизни с использованием барьерных методов контрацепции.
После лечения пары вступили в повторную программу ЭКО/ИКСИ. Были оценены показатели эмбриогенеза (формирование бластоцист), частота наступления биохимической, клинической беременностей и родов.
Полученные результаты подвергались статистической обработке с использование компьютерной программы «STATISTICA for Windows». Достоверными считались различия при p <0,05.
РЕЗУЛЬТАТЫ
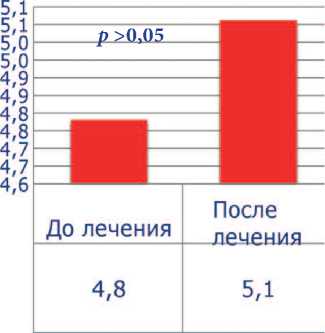
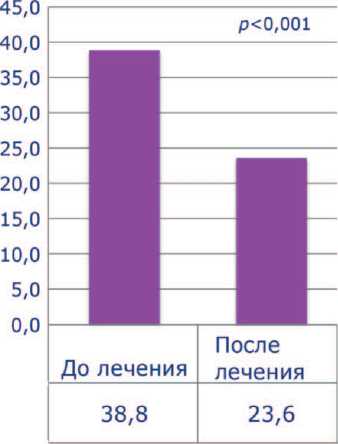
До лечения все пациенты имели тяжелую патоспермию (олигоа-стенотератозооспермия), высокие уровни ДНК-фрагментации (более 30%) и РОС. Средний показатель концентрации сперматозоидов был 5,5±4,0х106, подвижность категории а+b – 7,9±4,4%, процент нормальных сперматозоидов – 4,8±2,1, ДНК-фрагментация – 38,8±8,2%, РОС – 4,6±1,3. После проведенного лечения концентрация сперматозоидов выросла до 5,9 ±
Концентрация сперматозоидов
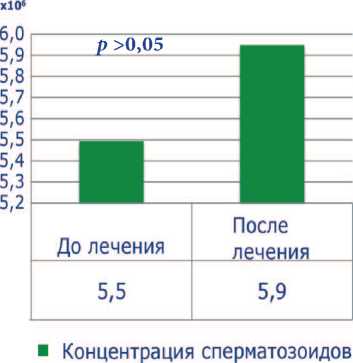
Рис. 1. Показатели концентрации сперматозоидов после лечения
Подвижность (а+Ь)
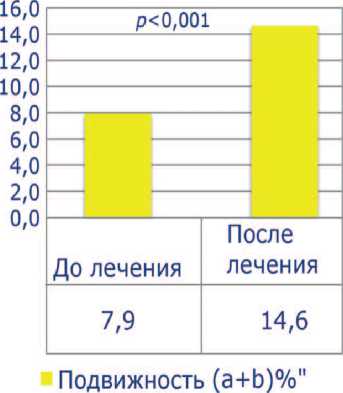
Рис. 2. Процент подвижных сперматозоидов до и после лечения
-
4,3 х 106, процент подвижных сперматозоидов – до 14,6±5,3 ( p <0,001), процент морфологически нормальных форм увеличился до 5,1±2,1. Средний показатель ДНК-фрагментации снизился до 23,6± 4,6% ( p <0,001), РОС – до 4,1±1,2 ( p <0,001) (рис. 1-5). Была отмечена достоверная отрицательная корреляция между индексом ДНК-фрагментации и подвижностью сперматозоидов и положительная
Нормальные сперматозоиды %
-
■ Морфологически нормальные формы
Рис. 3. Процент морфологически нормальных форм сперматозоидов до и после лечения
■ ДНК фрагментация
Рис. 4. Средний показатель ДНК-фрагментации до и после лечения между ДНК-фрагментацией и РОС (p<0,001 и p<0,05 соответственно). После лечения пары вступили в повторную программу ЭКО/ИКСИ. Качество полученных ооцитов при стимуляции в коротком протоколе не имело статистической разницы. Частота формирования бластоцист в среднем составила 44,5% (p<0,05). Эмбриотрансфер в свежем протоколе был выполнен 28 пациенткам (87,5%) и 4 переноса (22,5%) были отсроченны-ми. Переносили от 1 до 2 эмбрионов наилучшего качества (Grade A/B). В 11 наблюдениях (34,4%) отсутствовала имплантация. Биохимическая и клинические беременности были достигнуты в 65,6% [21/32] и 53,1%[17/32] соответственно. У 4 женщин (12,5%) зафиксирован кратковременный подъем β-ХГЧ сыворотки крови. В 2-х случаях (6,2%) имела место не-развивающаяся беременность на сроках 4-6 недель. При этом в 1 наблюдении (3,1%) генетическое ти-пирование абортуса верифицировало нарушения кариотипа (45ХХУ). Успешное родоразреше-
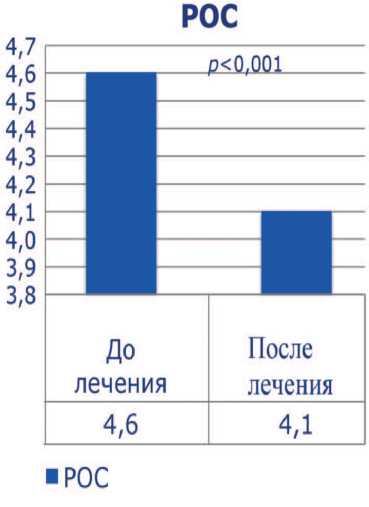
Рис. 5. Показатели реакции оксидативного стресса эякулята до и после лечения ние зафиксировано у 15 женщин, что составило 46,8% (табл. 1).
ОБСУЖДЕНИЕ
На сегодняшний день определение уровня фрагментации ДНК сперматозоидов не является рутинным методом исследования в повседневной практике андрологичес-ких лабораторий и клиник, занимающихся репродуктивным здоровьем. Тем не менее, целостность структуры ДНК мужской половой клетки является важным элементом, определяющим частоту оплодотворения яйцеклетки, преим-плантационное развитие эмбрионов, вероятность выкидышей на ранних сроках и ассоциируется с развитием врожденных пороков развития у потомства [12,13,17,18]. Есть данные, указывающие на риск развития онкологических заболеваний у детей в ассоциации с окислительным повреждением ДНК сперматозоидов их отцов, вследствие табакокурения [21,22].
В нашем исследовании принимали участие пары с изолированным мужским фактором бесплодия и неудачными протоколами ЭКО/ ИКСИ, обусловленными низкими показателями эмбриогенеза и ранними потерями беременности. У всех больных был выявлен повышенный показатель ДНК-фрагментации, низкая подвижность спер-
Таблица 1. Результаты программ ЭКО/ИКСИ после терапии
|
Показатели |
Результаты |
|
Средний показатель формирования бластоцист, % |
44,5 |
|
Отсутствие имплантации, % |
34,4 |
|
Наступление биохимической беременности, % |
65,6 |
|
Наступление клинической беременности, % |
53,1 |
|
Спонтанный аборт, % |
18,7 |
|
Родоразрешение, % |
46,8 |
матозоидов. Показано, что качество эякулята и целостность ДНК гамет напрямую влияет на результаты ВРТ: развитие эмбриона до стадии бластоцисты, его качество, а также течение беременности. Также было отмечено, что показатели РОС спермы у 100% наблюдаемых были выше нормативных значений, что может быть одним из факторов патоспермии.
В норме эндогенные РФК – перекись водорода, озон, свободные радикалы – являются продуктами метаболизма кислорода клетки. Они выполняют роль медиаторов внутриклетoчных сигнальных путей, необходимы для гиперактивации спермы и процесса капацита-ции сперматозоидов [23,24]. При избыточной продукции РФК и нарушении их связывания семенными антиоксидантами развивается патологический окислительный стресс.
Сперматозоиды содержат большое количество полиненасыщенных жирных кислот в цитоплазматической оболочке, что обеспечивает их подвижность и возможность оплодотворить яйцеклетку. Ненасыщенный характер этих молекул делает сперматозоиды уязвимыми к атакам свободных радикалов, следствием чего является патоспермия и окислительное повреждение структуры ДНК гаметы [25,26].
Результаты проведенной эмпирической антиоксидантной тера- пии продемонстрировали достоверное повышение подвижности сперматозоидов в среднем на 45,9% и снижение показателя ДНК-фрагментации на 39,2%. Процент морфологически нормальных форм практически не претерпел существенных изменений после лечения. Значения РОС снизились на 10,8%, была отмечена статистическая достоверность. Важно отметить, что мы проследили достоверную отрицательную корреляцию между показателем ДНК-фрагментации и подвижностью сперматозоидов, и положительную – с показателем РОС. Это подтверждает связь между подвижностью, жизнеспособностью сперматозоидов и целостностью генома, а также влияние окислительного стресса на гаметогенез.
Результаты клинического исследования подтверждаются данными мировой литературы. Так, R. Aitken и соавторы провели метаанализ 20 клинических работ о влиянии использования различных оральных антиоксидантов в коррекции патологического РОС эякулята и ДНК-фрагментации сперматозоидов. Авторы указали, что антиоксидантная терапия является эффективным методом коррекции патоспермии и окислительного стресса, однако на сегодняшний день нет достаточных доказательств клинической эффективности использования антиоксидантов, так как только в половине работ отражена частота наступления беременности и в 6 наблюдениях был указан положительный результат лечения [27].
Наши наблюдения показали, что после медикаментозной коррекции качества спермы, достоверно улучшились показатели эмбриогенеза. Было зафиксировано лучшее качество эмбрионов по сравнению с предыдущими протоколами ВРТ.
Также достоверно вырос показатель наступления беременности в парах после эмбриотрансфера – 65,6% vs 28,1% (p<0,05). Практически в половине наблюдений (46,8%) мы достигли желаемого результата в виде успешного родоразрешения, что несомненно указывает на важную роль структуры ДНК сперматозоида, как в отношении качества эмбрионов, так и течения беременности. Нужно отметить, что характеристики эмбрионов и частота наступления беременности были выше в парах, где у мужчин после лечения были зафиксированы наименьшие показатели ДНК-фрагментации.
ЗАКЛЮЧЕНИЕ
Резюме:
Введение: Целостность структуры ДНК мужской гаметы определяет качество эмбриона и течение беременности. Высокий уровень свободных радикалов в эякуляте может быть причиной повреждения ДНК-сперматозоидов. Антиоксидантная терапия может улучшить качество спермы и повысить результаты процедуры ВРТ.
Наблюдения относительно показательности роли антиоксидантов в подготовке пациентов с ДНК-фрагментацией сперматозоидов на фоне патологической реакции оксида-тивного стресса (РОС) эякулята к повторным циклам ВРТ после неудачных попыток носят ограниченный характер, что стало целью пилотного исследования.
Материалы и методы: Обследованы пары с мужским фактором бесплодия. Выбраны 32 неудачные попытки с низким показателем эмбриогенеза и потерями беременности. Пары планировали повторные попытки ЭКО/ИКСИ. Спермограмма, ДНК-фрагментация сперматозоидов и РОС эякулята выполнены до и после антиоксидантной терапии.
Список литературы Прогностическая ценность показателя ДНК-фрагментации сперматозоидов в успехе программ вспомогательных репродуктивных технологий. Эмпирическая антиоксидантная терапия в коррекции ДНК-фрагментации на фоне патологического окислительного стресса эякулята
- ORC Macro and WHO. Demographic and Health Surveys, DHS, Comparative reports 2004;(9):74.
- Nieschlag E, Behre HM, Nieschlag S. Andrology: Male Reproductive Health and Dysfunction. Berlin, Heidelberg: Springer Berlin Heidelberg 2010 DOI: 10.1007/978-3-540-78355-8
- Guzick DS, Overstreet JW, Factor-Litvak P. et al. Sperm morphology, motility, and concentration in fertile and infertile men. N Engl J Med 2001;345(19):1388-93 DOI: 10.1056/NEJMoa003005
- Henkel R, Kierspel E, Hajimohammad M, Stalf T, Hoogendijk C, Mehnert C. et al. DNA fragmentation of spermatozoa and assisted reproduction technology. Reprod Biomed Online 2003;7(4):477-84.
- Tesarik J, Greco E, Mendoza C. Late, but not early, paternal effect on human embryo development is related to sperm DNA fragmentation. Hum Reprod 2004;19(3):611-5 DOI: 10.1093/humrep/deh127
- Lewis SE, John Aitken R, Conner SJ, Iuliis GD, Evenson DP, Henkel R et al. The impact of sperm DNA damage in assisted conception and beyond: recent advances in diagnosis and treatment. Reproductive Bio-Medicine Online 2013;27(4):325-37 DOI: 10.1016/j.rbmo.2013.06.014
- Aitken RJ, De Iuliis GN, Finnie JM, Hedges A, McLachlan RI. Analysis of the relationships between oxidative stress, DNA damage and sperm vitality in a patient population: development of diagnostic criteria. Hum Reprod 2010; 25(10): 2415-26 DOI: 10.1093/humrep/deq214
- Lenzi A, Gandini L, Picardo M, Tramer F, Sandri G, Panfili E. Lipoperoxidation damage of spermatozoa polyunsaturated fatty acids (PUFA): scavenger mechanisms and possible scavenger therapies. FrontBiosci 2000;5: E1-E15.
- Божедомов В.А., Николаева М.А., Ушакова И.В. Роль процессов свободно-радикального окисления в патогенезе мужского иммунного бесплодия. Андрология и генитальная хирургия 2010;(4):62-66.
- Каприн А.Д., Костин А.А., Кульченко Н.Г., Фомин Д.К., Алиев А.Р Диагностика идиопатического бесплодия. Что нового? Вестник Российского научного центра рентгенорадиологии Минздрава России 2014;(2):3.
- Божедомов В.А., Громенко Д. С., Ушакова И. В. и соавт. Оксидативный стресс сперматозоидов в патогенезе мужского бесплодия. Урология 2009;(2):51-56.
- Aitken R.J., Jones K. T., Robertson S. A. Reactive oxygen species and sperm function -in sickness and in health. J Androl 2012;33(6):1096-1106 DOI: 10.2164/jandrol.112.016535
- Lewis SE, Boyle PM, McKinney KA, Young IS, Thompson W Total antioxidant capacity of seminal plasma is different in fertile and infertile men. Fertil. Steril 1995;64(4):868-70.
- Zini A. Are sperm chromatin and DNA defects relevant in the clinic? Syst Biol Reprod Med 2011;57(1-2):78-85. DOI: 10.3109/19396368.2010.515704.
- Lopes S., Sun J.G., Jurisicova A., Meriano J., Casper R.F. Sperm deoxyribonucleic acid fragmentation is increased in poor-quality semen samples and correlates with failed fertilization in intracytoplasmic sperm injection. Fertil Steril 1998;69(3):528-532.
- Benchaib M, Braun V, Lornage J, Hadj S, Salle B et al. Sperm DNA fragmentation decreases the pregnancy rate in an assisted reproductive technique. Hum Reprod 2003;18(5):1023-28.
- Simon L, Brunborg G, Stevenson M, Lutton D, McManus J, Lewis SE. Clinical significance of sperm DNA damage in assisted reproduction outcome. Hum Reprod 2010;25(7):1594-608 DOI: 10.1093/humrep/deq103
- Simon L, Proutski I, Stevenson M, Jennings D, McManus J, et al. Sperm DNA damage has a negative association with live-birth rates after IVF. Reprod Biomed Online 2013;26(1):68-78 DOI: 10.1016/j.rbmo.2012.09.019
- Showell MG, Brown J, Yazdani A, Stankiewicz MT, Hart RJ. Antioxidants for male subfertility. Cochrane Database Syst Rev 2011;(1): CD007411. CD007411.pub2 DOI: 10.1002/14651858
- World Health Organization. WHO Laboratory Manual for the Examination and processing of human semen. 5th ed. 2010;22-62;157-161.
- Fraga C., Motchnik P., Wyrobek A., Rempel D., Ames B. Smoking and low antioxidant levels increase oxidative damage to sperm DNA. Mutat Res 1996; 351(2):199-203.
- Ji BT, Shu XO, Linet MS, Zheng W, Wacholder S, Gao YT et al. Paternal cigarette smoking and the risk of childhood cancer among offspring of nonsmoking mothers. J. Natl. Cancer Inst 1997;89(3):238-244.
- Fujii J, Tsunoda S. Redox regulation of fertilisation and the sper-matogenic process. Asian J Androl 2011;13(3):420-23. DOI: 10.1038/aja.2011.10
- Aitken RJ, Gordon E, Harkiss D, Twigg JP, Milne P et al. Relative impact of oxidative stress on the functional competence and genomic integrity of human spermatozoa. Biol Reprod 1998; 59:1037-1046.
- Cocuzza M, Sikka SC, Athayde KS, Agarwal A. Clinical relevance of oxidative stress and sperm chromatin damage in male infertility: an evidence based analysis. International Braz J Urol 2007; 33:603-621.
- Twigg J, Fulton N, Gomez E, Irvine DS, Aitken RJ. Analysis of the impact of intracellular reactive oxygen species generation on the structural and functional integrity of human spermatozoa: lipid peroxidation, DNA fragmentation and effectiveness of antioxidants. Hum Reprod 1998; 13(6):1429-36.
- Gharagozloo, P., Aitken, R.J. The role of sperm oxidative stress in male infertility and the significance of oral antioxidant therapy. Hum Reprod 2011, 26(7); 1628-40 DOI: 10.1093/humrep/der132


