Прогностическая модель возникновения инфекции области хирургического вмешательства
Автор: С.Н. Тонеева, С.Ю. Клинышева, Е.А. Тонеев, О.В. Мидленко, Р.Ф. Шагдалеев, Д.С. Костяев
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 4, 2024 года.
Бесплатный доступ
Цель – определить частоту встречаемости инфекции области хирургического вмешательства (ИОХВ), факторы риска ее развития и разработать прогностическую модель для стратифика-ции пациентов по его уровню. Материалы и методы. Исследование проводилось на базе ГУЗ Ульяновская областная клиническая больница и ГУЗ Областной клинический онкологический диспансер г. Ульяновска. Было вы-полнено 1500 плановых операций с лапаротомным доступом (свидетельство о регистрации базы данных № 2024623300): 190 гастрэктомий с лимфодиссекцией D2, 882 резекции толстой киш-ки и 428 тотальных гистерэктомий. Ретроспективный анализ результатов проведен в послеопера-ционный период по единому протоколу. Статистический анализ результатов исследования вы-полнялся с использованием программ StatTech v. 4.5.0 («Статтех», Россия) и SPSS 26 for Mac (IBM Corp.), R Statistics версия 3.6.1 Результаты. Частота встречаемости ИОХВ составила 4,93 % (74/1500). Летальных исходов в группе с ИОХВ было 12 (16,2 %), в группе без ИОХВ – 15 (1,1 %). Наиболее значимыми факто-рами, влияющими на развитие послеоперационных инфекционных осложнений в области хирургического вмешательства, являются: возраст (p=0,007), наличие сахарного диабета (p<0,001), толщина подкожно-жировой клетчатки (p<0,001), нейтрофильно-лимфоцитарный индекс (p<0,001), индекс массы тела (p<0,001), продолжительность операции (p<0,001). При проведении многофакторного анализа было установлено, что только следующие параметры влияют на раз-витие ИОХВ после лапаротомного доступа: операция на толстой кишке (ОШ 8,66 (95 % ДИ 3,74–21,7); наличие сахарного диабета (ОШ 9,36 (95 % ДИ 4,22–21,65); ИМТ (ОШ 1,55 (95 % ДИ 1,42–1,71) и НЛИ (ОШ 0,07 (95 % ДИ 0,03–0,13). Была создана прогностическая модель риска развития ИОХВ, запрограммированная в виде HTML-приложения с использованием языка программирования JavaScript. Выводы. Частота встречаемости послеоперационных инфекционных осложнений в области хи-рургического вмешательства при использовании стандартной срединной лапаротомии при пла-новых вмешательствах составила 4,93 % (74/1500). Создана модель прогнозирования, которая стратифицирует пациентов в зависимости от степени риска развития ИОХВ.
Лапаротомия, инфекции области хирургического вмешательства, инфекционные раневые осложнения, прогностическая модель, машинное обучение, бутстреп данных
Короткий адрес: https://sciup.org/14132323
IDR: 14132323 | DOI: 10.34014/2227-1848-2024-4-99-111
Текст научной статьи Прогностическая модель возникновения инфекции области хирургического вмешательства
Введение. Инфекции, связанные с оказанием медицинской помощи (ИСМП), в настоящее время являются одним из наиболее частых послеоперационных осложнений [1]. В структуре ИСМП значимое место занимают инфекции области хирургического вмешательства (ИОХВ). ИОХВ – это осложнение, которое возникает в результате роста микроорганизмов в области послеоперационной раны, приводит к замедлению репаративных
процессов, ухудшает течение послеоперационного периода, значимо влияет на результат хирургического лечения и, следовательно, увеличение сроков госпитализации, что негативно влияет на систему здравоохранения [2].
При анализе отечественной и зарубежной литературы выявлено множество исследований, касающихся факторов риска возникновения ИОХВ. Своевременное выявление пациентов с высоким риском позволяет проводить
целенаправленную профилактику данного осложнения и тем самым улучшать результаты хирургического вмешательства [3, 4].
В настоящее время в клинической практике широко применяются модели прогнозирования: они лаконичны, ясны и всегда включают более одного фактора для расчета риска. Их использование в повседневной клинической практике позволяет эффективно и своевременно стратифицировать пациентов по риску развития негативного события [5].
Цель исследования. Определить частоту встречаемости ИОХВ, факторы риска ее развития и разработать прогностическую модель для стратификации пациентов по его уровню.
Материалы и методы. Ретроспективное исследование проводилось на базе двух учреждений г. Ульяновска: ГУЗ Ульяновская областная клиническая больница и ГУЗ Област-
Всего для окончательного анализа были отобраны данные 1500 пациентов. Дизайн исследования представлен на рис. 1.
Гастрэктомия/ Gastrectomy n=190
Резекция толстой кишки/ Colon resection n=882
Гистерэктомия/ hysterectomy n=428
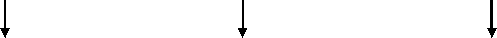
1500 лапаротомий/ laparotomies
ИОХВ/SSl n=74
Гладкий послеоперационный период/ uneventful postoperative course n=1426
Рис. 1. Дизайн ретроспективного исследования
Fig. 1. Study design (* SSI – surgical site infection)
Сбор данных проводился по единому разработанному протоколу. Оценка ИОХВ осуществлялась согласно классификации CDC
(Centers for Disease Control and Prevention). Распределение пациентов по видам ИОХВ представлено в табл. 1.
Таблица 1
Table 1
Structure of SSI according to CDC classification
|
Вид ИОХВ Types of SSI |
Количество пациентов, абс. (%) Number of patients, abs. (%) |
|
Поверхностная Superficial incisional SSI |
25 (33,8) |
|
Глубокая Deep incisional SSI |
10 (13,5) |
|
Органо-пространственная Organ or space SSI |
39 (52,7) |
Таблица 2
Table 2
Clinical and laboratory parameters of study subjects
|
Показатель Parameter |
Категория Category |
ИОХВ SSI |
p |
|
|
Нет, n=1426 No, n=1426 |
Да, n=74 Yes, n=74 |
|||
|
Возраст, лет (Ме (Q 1 –Q 3 )) Age, years old (Ме (Q1–Q3)) |
62 (49,00–70,00) |
65 (57,25–72,00) |
0,007 |
|
|
Пол, абс. (%) Sex, abs. (%) |
Женский Female |
905 (63,5) |
54 (73,0) |
0,098 |
|
Мужской Male |
520 (36,5) |
20 (27,0) |
||
|
Сахарный диабет абс. (%) Diabetes mellitus, abs. (%) |
Нет No |
1295 (90,8) |
44 (59,5) |
<0,001 |
|
Да Yes |
131 (9,2) |
30 (40,5) |
||
|
Толщина ПЖК, см (Ме (Q 1 –Q 3 )) Subcutaneous fat, sm (Ме (Q1–Q3)) |
5,80 (3,5–7,10) |
10,20 (9,22–11,10) |
<0,001 |
|
ИМТ, кг/м 2 (Ме (Q 1 –Q 3 )) BMI, kg/m 2 (Ме (Q1–Q3)) |
26,5 (23,75–29,30) |
34,60 (32,93–37,65) |
<0,001 |
|
Общий белок, г/л (Ме (Q1–Q3)) Total protein, g/l (Ме (Q1–Q3)) |
69,20 (64,35–72,50) |
71,35 (68,72–74,10) |
<0,001 |
|
НЛИ (Ме (Q1–Q3)) Neutrophil-to-Lymphocyte Ratio (Ме (Q1–Q3)) |
3,24 (2,08–5,20) |
1,33 (1,20–1,71) |
<0,001 |
|
ТЛИ (Ме (Q 1 –Q 3 )) Platelet-to-Lymphocyte Ratio (Ме (Q1–Q3)) |
144,1 (104,5–201,9) |
167,3 (110,2–274,3) |
0,287 |
|
ЛИИ (Ме (Q 1 –Q 3 )) Leukocyte intoxication index (Ме (Q1–Q3)) |
1,33 (0,64–2,36) |
2,16 (1,57–2,94) |
0,103 |
|
Продолжительность операции, мин (Ме (Q 1 –Q 3 )) Surgery duration, min (Ме (Q1–Q3)) |
90,00 (60,00–140,00) |
120,00 (90,00–150,00) |
<0,001 |
|
Кровопотеря, мл (Ме (Q 1 –Q 3 )) Blood loss, ml (Ме (Q1–Q3)) |
150,00 (100,00–300,00) |
175,00 (100,00–300,00) |
0,606 |
Таблица 3
Table 3
|
Фактор Factor |
Оценка шансов Odds ratio |
95 % доверительный интервал 95 % confidence interval |
|
Операция на толстой кишке Colon surgery |
8,66 |
3,74–21,7 |
|
Сахарный диабет Diabetes mellitus |
9,36 |
4,22–21,65 |
|
ИМТ BMI |
1,55 |
1,42–1,71 |
|
НЛИ Neutrophil-to-Lymphocyte Ratio |
0,07 |
0,03–0,13 |
Виды ИОХВ согласно классификации CDC
По данным мультиспиральной компьютерной томографии, полученным из архива, оценивалась толщина подкожно-жировой клетчатки (ПЖК). С помощью общего анализа крови, выполнявшегося за сутки до оперативного вмешательства, определялись нейтрофильно-лимфоцитарный (НЛИ), тромбоцитарно-лимфоцитарный индексы (ТЛИ), а также лейкоцитарный индекс интоксикации (ЛИИ) по В.К. Островскому [7].
НЛИ и ТЛИ рассчитывались как отношения абсолютного числа нейтрофилов к абсолютному количеству лимфоцитов и абсолютного количества тромбоцитов к абсолютному количеству лимфоцитов соответственно. ЛИИ по В.К. Островскому определяли по формуле автора [7].
Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро – Уилка (при числе исследуемых менее 50) или критерия Колмогорова – Смирнова (при числе исследуемых более 50).
В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3).
Категориальные данные описывались с указанием абсолютных значений и процентных долей. 95 % доверительные интервалы рассчитывались по методу Клоппера – Пирсона.
Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна – Уитни.
Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью критерия χ 2 Пирсона (при значениях ожидаемого явления более 10), точного критерия Фишера (при значениях ожидаемого явления менее 10)
В качестве количественной меры эффекта при сравнении относительных показателей использовалось отношение шансов с 95 % доверительным интервалом (ОШ; 95 % ДИ). В случае нулевых значений числа наблюдений в ячейках таблицы сопряженности расчет отношения шансов выполнялся с поправкой Холдейн – Энскомб.
Оценка силы связи между категориальными показателями выполнялась с помощью V Крамера, значения которого интерпретировались согласно рекомендациям [8].
Различия считались статистически значимыми при p<0,05. Статистический анализ проводился с использованием StatTech v. 4.5.0 (ООО «Статтех», Россия), SPSS 26 for Mac (IBM Corp.), R Statistics v. 3.6.1.
Результаты. Характеристика исследуемых пациентов представлена в табл. 2.
Клинико-лабораторные показатели исследуемых пациентов
Исследование показало наличие статистически значимых различий между пациентами с осложнениями и пациентами с гладким послеоперационным течением по нескольким параметрам. Так, в более старшем возрасте инфекционные осложнения развивались чаще (p=0,007). Сахарный диабет (СД) и ожирение также увеличивают вероятность развития ИОХВ (р<0,001). Кроме того, развитие инфекционных осложнений напрямую связано с уровнем общего белка до операции (p<0,001). Однако обращает на себя внимание тот факт, что содержание общего белка в группе с ИОХВ хоть и выше, чем в группе без осложнений, но все еще находится в пределах общепринятых норм (65–85 г/л), в связи с чем требуются дальнейшие исследования по данному направлению. Из воспалительных индикаторов только НЛИ в группе с ИОХВ был статистически значимо ниже (p≤0,001). Отметим также, что на риск развития ИОХВ влияет и продолжительность оперативного вмешательства (p≤0,001).
Выполнено множественное вменение данных по методу MICE (многомерное вменение с помощью цепных уравнений).
Частота прогнозируемого исхода (Outcome) – 74 из 1500 (5 %).
Проводилась проверка на мультиколинеарность для числовых переменных с использованием коэффициента Спирмена (рис. 2). Коллинеарные переменные – абсолютное значение коэффициента корреляции более 0,75.
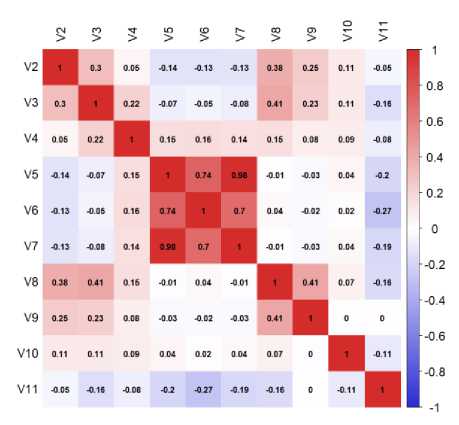
Рис. 2. Тепловая карта мультиколлинеарности
Fig. 2. Multicollinearity Heat Map
Имеется корреляция между V5 и V7. Искусственно удаляем ковариату V7 (толщина ПЖК), оставляем ИМТ. Также удаляем ковариату V6 (ожирение), так как это суррогатная характеристика ИМТ (коэффициент корреляции 0,74).
Моделирование. В качестве метода использовали бинарную (биномиальную) многофакторную логистическую регрессию с обратным пошаговым выбором предикторов по наименьшему критерию Акаике (библиотека
R «rms»). За обучающую выборку взяли весь набор данных – 1500 наблюдений. Строгую внутреннюю валидацию проводили с помощью метода бутстрепа (5000 итераций). В результате такого подхода модель тестируется 5000 раз на повторных случайных выборках с вычислением скорректированных значений метрик ее эффективности, которые становятся наиболее приближены к истине.
Формула итоговой модели, включаеющая 4 фактора (табл. 3), выглядит следующим образом:
logit (P)=V4+V5+V11+V1 (операция на толстой кишке).
Коэффициент шансов
Odds Ratio
Характеристика модели. Скорректированные характеристики модели, полученные в результате строгой внутренней валидации, выглядят следующим образом:
-
- коэффициент детерминации Негель-керке – 0,654;
-
- C-индекс (равнозначен AUC-ROC) – 0,981; 95 % ДИ: 0,9768–0,989 (DeLong);
-
- средняя абсолютная ошибка калибровки – 1,3 (средняя ошибка прогноза между предсказанными и истинными вероятностями);
-
- наклон (slope) калибровочной кривой – 0,9599 (у идеальной – 1);
-
- интерсепт калибровочной кривой – -0,0424.
Согласно калибровочной кривой прогнозируемые и истинные значения вероятностей
исхода визуально совпадают на всем протяжении, лишь в диапазоне более 0,8 отмечается наибольшее, но незначительное расхождение кривых (рис. 3). Непараметрическая калибровочная кривая близка к диагонали (slope>0,95, в идеале – 1), т.е. прогнозируемые риски хорошо соответствуют наблюдаемым. Отрицательное значение интерсепта указывает на пе-реоцененность модельных прогнозов, положительное – на их недооцененность. Вероятности, предсказанные моделью до значения 0,5, несколько ниже истинных значений, в то время как после отсечки 0,5 – более завышенные. Поэтому калибровочная кривая отклоняется на графике выше и ниже от идеальной линии соответственно. В целом калибровочную кривую модели следует считать удовлетворительной.
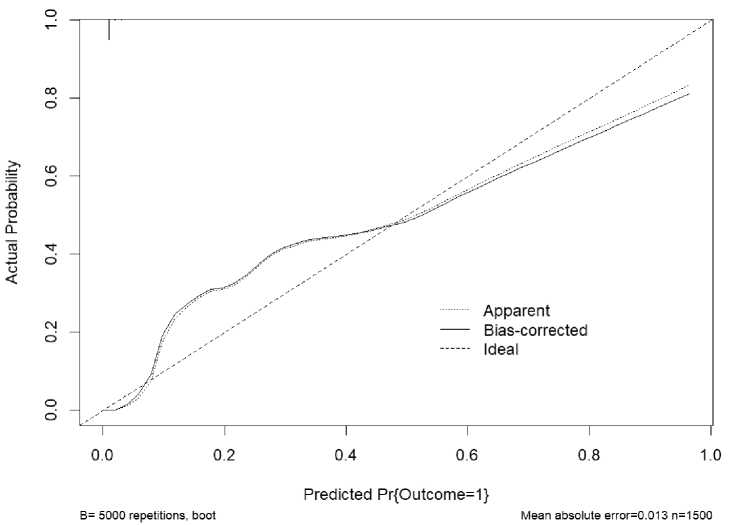
Рис. 3. Калибровочная кривая для модели прогнозирования риска развития инфекции области хирургического вмешательства после лапаротомии
Fig. 3. Calibration curve for the risk prediction model of surgical site infection development after laparotomy
Разработанная модель была запрограммирована в виде HTML-приложения с использованием языка программирования JavaScript и позволяет рассчитать вероятность инфекци-
онных осложнений. Категории риска (низкий, средний, высокий) выделены условно по порогам вероятности: <25 %, 25–85 % и >85 % (рис. 4).
Модель оценки риска развития инфекции области хирургического вмешательства после лапаротомии
У пациена есть сахарный диабет? ® Да О Нет
Операция будет выполняться на толстой кишке? © Да С Нет
Укажите индекс массы тела пациента:
1 32,9 |
Укажите соотношение нейтрофилов и лимфоцитов до операции:
1.6
|
Рассчитать |
|
|
ВЕРОЯТНОСТЬ |
ОСЛОЖНЕНИИ в % 88.7 ЦЗЗШЩЩШЕЗЙЕШИ |
|
Сбросить |
Модель оценки риска развития инфекции области хирургического вмешательства после лапаротомии
У пациена есть сахарный диабет? ©Да Нет
Операция будет выполняться на толстой кишке? © Да О Нет
Укажите индекс массы тела пациента:
30.6________________|
Укажите соотношение нейтрофилов и лимфоцитов до операции: l 1^
Рассчитать
ВЕРОЯТНОСТЬ ОСЛОЖНЕНИЙ в % | 76.5 РИСК ИНФЕКЦИИ СРЕДНИЙ
Сбросить
Модель оценки риска развития инфекции области хирургического вмешательства после лапаротомии
У пациена есть сахарный диабет? О Да © Нет
Операция будет выполняться на толстой кишке? О Да © Нет
Укажите индекс массы тела пациента:
I 30
Укажите соотношение нейтрофилов и лимфоцитов до операции:
I 2
Рассчитать
ВЕРОЯТНОСТЬ ОСЛОЖНЕНИЙ в % I 0.27
РИСК ИНФЕКЦИИ НИЗКИЙ
Сбросить
Рис. 4. Расчет вероятности инфекционных осложнений в HTML-приложении (интерфейс приложения представлен исключительно на русском языке)
Fig. 4. Calculation of probability of infectious complications in the HTML application (the application interface is presented only in Russian)
Интерактивное HTML-приложение на основе созданной прогностической модели представляет собой удобное решение для прогноза риска развития инфекций области хирургического вмешательства. Предложенная модель показала высокую степень точности и надежности, что подтверждается калибровочной кривой и картой мультиколлинеарности.
Обсуждение. ИОХВ является наиболее распространенной среди инфекций, связанных с оказанием медицинской помощи. При этом ее развитие может стать достаточно хорошо прогнозируемым даже у одного конкретного пациента, если вовремя выявить и оценить факторы риска, которые в настоящее время активно изучаются в ходе многочисленных исследований [9, 10].
В нашей работе была проведена ретроспективная оценка риска развития ИОХВ с последующим построением прогностической модели.
Многие исследования отмечают наличие сахарного диабета как независимый фактор риска развития ИОХВ при различных типах вмешательств [13, 14]. Отрицательное влияние гипергликемии на вероятность развития инфекций у больных сахарным диабетом объясняется угнетением клеточного и гуморального звеньев иммунитета, а также усилением вирулентности некоторых микроорганизмов. Кроме того, ИОХВ могут быть связаны и с сосудистыми изменениями или дисфункцией лейкоцитов, развившимися на фоне сахарного диабета.
Ожирение негативно сказывается на иммунной функции, а также на иммунологических защитных механизмах. Одна из причин заключается в том, что ожирение является воспалительным состоянием, связанным с хронической активацией иммунной системы [15, 16]. Отметим и тот факт, что послеоперационная рана при ожирении глубже, следовательно, область входных ворот – обширнее, а это в свою очередь также увеличивает риск развития инфекционных осложнений. Особый
интерес вызывает исследование Christopher John Wilson и соавт., в котором оценивается зависимость распространенности инфекционного поражения в области хирургического вмешательства от степени ожирения [17–19].
Нейтрофильно-лимфоцитарный индекс отражает соотношение неспецифической и специфической защиты организма. Данный маркер является простым в использовании и недорогим, но его значимость часто недооценивается. Анализ существующих исследований показал, что риск развития ИОХВ увеличивается с возрастанием значения нейтрофильно-лимфоцитарного соотношения в послеоперационном периоде [20–23]. Однако нами исследовался НЛИ до операции, и наши результаты говорят о том, что риск развития ИОХВ выше у тех пациентов, чей НЛИ до операции был низким. Вероятно, это связано с тем, что низкий НЛИ отображает ослабление иммунной системы, а соответственно, риск развития инфекции, особенно бактериальной природы, у таких пациентов выше.
В настоящем исследовании нами была построена модель прогнозирования риска развития инфекции области хирургического вмешательства после лапаротомии. Также разработано HTML-приложение и выделены категории риска по порогам вероятности, что позволит облегчить задачу практикующего врача при сборе данных анамнеза и разработке плана лечения. Выявление факторов риска и определение его степени способствуют ранней профилактике и тщательному контролю пациентов группы высокого риска в последствии.
Выводы:
Список литературы Прогностическая модель возникновения инфекции области хирургического вмешательства
- Strobel R.M., Leonhardt M., Förster F. The impact of surgical site infection-a cost analysis. Langenbecks Arch Surg. 2022; 407 (2): 819-828. DOI: 10.1007/s00423-021-02346-y.
- Глобальное руководство по профилактике инфекций в области хирургического вмешательства. 2-е изд. URL: https://iris.who.int/handle/10665/371536 (дата обращения: 25.09.2024).
- Морозов А.М., Сергеев А.Н., Червинец В.М. О методах профилактики инфекций области хирургического вмешательства. Амбулаторная хирургия. 2024; 21 (1): 168-176. DOI: 10.21518/akh2024-013.
- Seidelman J.L., Mantyh C.R., Anderson D.J. Surgical Site Infection Prevention: A Review. JAMA. 2023; 329 (3): 244-252. DOI: 10.1001/jama.2022.24075.
- Grant S.W., Collins G.S.., Nashef S.A.M. Statistical Primer: developing and validating a risk prediction model. Eur J Cardiothorac Surg. 2018; 54 (2): 203-208. DOI:10.1093/ejcts/ezy180.
- Тонеев Е.А., Тонеева С.Н., Куликов В.Д., Данилова Л.А., Жинов А.В., Мартынов А.А., Мидленко О.В., Мухутдинова А.Н., Клинышева С.Ю., Павлов М.О., Шагдалеев Р.Ф., Прохоров Д.Д., Мур-тазин А.Р., Мартынова Е.В., Белова М.А., Терягова А.Д. Свидетельство о государственной регистрации базы данных № 2024623300 Российская Федерация. Частота развития и факторы риска ИОХВ после плановых срединных лапаротомий: заявка № 2024623044 от 11.07.2024; опубликовано 25.07.2024.
- Островский В.К., Свитич Ю.М., Вебер В.Р. Лейкоцитарный индекс интоксикации при острых гнойных и воспалительных заболеваниях легких. Вестн. хир. им. И.И. Грекова. 1983; 131 (11): 21-24.
- ReaL.M., ParkerR.A. Designing and conducting survey research. San Francisco: Jossey-Bass, Inc.; 2014.
- Wen J., Pan T., Yuan Y.C. Nomogram to predict postoperative infectious complications after surgery for colorectal cancer: a retrospective cohort study in China. World J Surg Onc. 2021: 19: 204. DOI: https://doi.org/10.1186/s12957-021-02323-1.
- Alkaaki A., Al-Radi O.O., Khoja A. Surgical site infection following abdominal surgery: a prospective cohort study. Can J Surg. 2019; 62 (2): 111-117. DOI: 10.1503/cjs.004818.
- Mengistu D.A., Alemu A., Abdukadir A.A. Global Incidence of Surgical Site Infection Among Patients: Systematic Review and Meta-Analysis. Inquiry. 2023; 60: 469580231162549. DOI: 10.1177/ 00469580231162549.
- Taylor J.S., Marten C.A., Potts K.A. What Is the Real Rate of Surgical Site Infection? J Oncol Pract. 2016; 12 (10). DOI: 10.1200/JOP.2016.011759.
- Martin E.T., Kaye K.S., Knott C. Diabetes and Risk of Surgical Site Infection: A Systematic Review and Meta-analysis. Infect Control Hosp Epidemiol. 2016; 37 (1): 88-99. DOI: 10.1017/ice.2015.249.
- Zhao D., Liang G.H., Pan J.K. Risk factors for postoperative surgical site infections after anterior cruciate ligament reconstruction: a systematic review and meta-analysis. Br J Sports Med. 2023; 57 (2): 118-128. DOI: 10.1136/bjsports-2022-105448.
- Das U.N. Is obesity an inflammatory condition? Nutrition. 2001; 17 (11-12): 953-966. DOI: 10.1016/s0899-9007(01)00672-4.
- Monteiro R., Azevedo I. Chronic inflammation in obesity and the metabolic syndrome. Mediators Inflamm. 2010; 2010: 289645. DOI: 10.1155/2010/289645.
- Wilson C.J., Georgiou K.R., Oburu E. Surgical site infection in overweight and obese Total Knee Arthroplasty patients. J Orthop. 2018; 15 (2): 328-332. DOI: 10.1016/j.jor.2018.02.009.
- Zhai W., Yang Y., Zhang K., Sun L., Luo M., HanX., WangM., Wang Z., Gao F. Impact of visceral obesity on infectious complications after resection for colorectal cancer: a retrospective cohort study. Lipids Health Dis. 2023; 22 (1): 139. DOI: 10.1186/s12944-023-01890-4.
- Khanna D., Welch B.S., Rehman A. Pathophysiology of Obesity. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024.
- Шелыгин Ю.А., Сухина М.А., Набиев Э.Н., Пономаренко А.А., Нагудов М.А., Сушков О.И., Москалев А.И., Ачкасов С.И. Нейтрофильно-лимфоцитарное отношение как биомаркер инфекционных осложнений в колоректальной хирургии (собственные данные, систематический обзор и метаана-лиз). Колопроктология. 2020; 19 (4): 71-92. DOI: https://doi.org/10.33878/2073-7556-2020-19-4-71-92.
- Inose H., Kobayashi Y., Morishita S. Application of an index derived from the area under a neutrophil curve as a predictor of surgical site infection after spinal surgery. BMC Surg. 2021; 21 (1): 354. DOI: 10.1186/s12893-021-01345-6.
- Erciyestepe S.G., Boran A.B., Yildirim M.S., Erciyestepe M. Is it possible to predict Surgical Site Infection? Malawi Med J. 2023; 35 (3): 190-195. DOI: 10.4314/mmj.v35i3.
- Xi X., Yang M.X., Wang X.Y., Shen D.J. Predictive value of prognostic nutritional index on infection after radical gastrectomy: a retrospective study. J Gastrointest Oncol. 2022; 13 (2): 569-580. DOI: 10.21037/jgo-22-192.


