Прогностическая модель возникновения рецидива у пациенток с люминальным HER2-негативным раком молочной железы
Автор: Торосян М.Х., Шевченко Т.В., Родионов В.В., Савинов Ю.Г., Веряскина Ю.А., Кометова В.В., Шарафутдинов М.Г.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 4, 2020 года.
Бесплатный доступ
Люминальный HERl-негативный рак молочной железы (РМЖ), выявленный на ранних стадиях, характеризуется относительно благоприятным течением. Однако в ряде случаев возникает рецидив заболевания независимо от проведенного лечения. Цель исследования - выявить предикторы рецидивирования первично операбельного люминального HERl-негативного РМЖ. Материалы и методы. Исследовались биоптаты опухолей молочной железы пациенток (n=158) с люминальным HERl-негативным РМЖ стадии T1-2N0-1M0, а также анамнестические данные пациенток. Все женщины были разделены на 2 группы: с рецидивом заболевания в течение последующих 5 лет после проведения операции (n=53) и с безрецидивным течением (n=105). Изучены макроскопические характеристики опухоли, степень злокачественности, суммарный балл злокачественности, Ноттингемский прогностический индекс, Ki-67, экспрессия рецепторов к эстрогену и прогестерону и их влияние на возникновение рецидива. Проведен анализ уровней экспрессии миРНК (миРНК-21, миРНК-221, миРНК-222, миРНК-155, миРНК-205, миРНК-20а, миРНК-125Ь, миРНК-146Ь, миРНК-200а) в тканях опухолей. Статистическая обработка данных произведена с помощью программ Statistica 7 (StatSoft Inc., США) и MedCalc (версия 15.2). Результаты. Сравнительный анализ уровней экспрессии миРНК между группами пациенток с рецидивом РМЖ (n=21) и безрецидивным течением (n=20) выявил статистически значимое повышение уровней экспрессии миРНК-21, миРНК-205, миРНК-146Ъ и миРНК-200a в группе с рецидивом заболевания. Установлена предсказывающая роль соотношений уровней экспрессии потенциально онкогенных и онкосупрессорных миРНК-21/миРНК-155 и миРНК-21/миРНК-205, а также роль миРНК-20a в возникновении рецидива РМЖ в сочетании с Ki-67, стадией заболевания, размером первичной опухоли. На основе полученных данных разработана прогностическая модель определения рецидива первично операбельного люминального HER2-негативного РМЖ. Выводы. Созданная прогностическая модель позволяет четко стратифицировать прогноз первично операбельного люминального HER2-негативного РМЖ.
Первично операбельный люминальный рак молочной железы без гиперэкспрессии her2, прогноз рецидива, мирнк
Короткий адрес: https://sciup.org/14117597
IDR: 14117597 | УДК: 616-006.6-091, | DOI: 10.34014/2227-1848-2020-4-61-73
Текст научной статьи Прогностическая модель возникновения рецидива у пациенток с люминальным HER2-негативным раком молочной железы
Введение. Рак молочной железы (РМЖ) в настоящее время является одной из самых распространенных локализаций злокачественных опухолей у женщин. Ежегодно в мире регистрируется более 1,3 млн новых случаев заболевания, и этот показатель имеет постоянную тенденцию к росту. По частоте встречаемости РМЖ занимает второе место после рака легких [1–5].
Несмотря на проводимое лечение, частота рецидива люминального HER2-негативного
РМЖ, по результатам исследований 2017 г., проведенных в Институте рака Дана–Фарбер, колеблется от 3 до 15 %. По данным Университета Эмори (США, 2015), частота местных или региональных рецидивов у женщин в возрасте до 40 лет составляет 24 %, а отдаленных – 18 %. У женщин 75 лет и старше местное рецидивирование отмечается в 7 % случаев, отдаленное – в 5 % [6, 7]. При этом существующие в настоящее время прогностические морфологические индексы или генетиче- ские панели не могут в полной мере удовлетворить клиницистов ввиду большой гетерогенности РМЖ и материально-технических трудностей при их использовании [8–14]. Таким образом, поиск новых молекулярно-генетических маркеров прогноза рецидивирова-ния РМЖ является актуальной задачей современной клинической онкологии.
Цель исследования. Разработка вероятностной модели прогноза рецидива у женщин с люминальным HER2-негативным РМЖ.
Материалы и методы. Исследованы би-оптаты опухолей молочной железы 158 пациенток с диагнозом люминального HER2-нега-тивного подтипа РМЖ стадии T1-2N0-1M0, находившихся на лечении в ГУЗ Областной клинический онкологический диспансер г. Ульяновска (ОКОД) с 2008 по 2014 г. Также проведен ретропроспективный анализ историй болезни и амбулаторных карт этих пациенток для выявления клинических прогностических факторов, способных повлиять на характер течения заболевания.
Все пациентки были распределены на 2 группы: женщины с рецидивом заболевания в течение последующих 5 лет после проведения операции (n=53), составившие основную группу, и пациентки с безрецидивным течением (n=105), вошедшие в группу сравнения. В качестве рецидива РМЖ рассматривался как локальный рецидив, так и отдаленное метастазирование опухоли. Анализ уровней экспрессии миРНК (миРНК-21, миРНК-221, миРНК-222, миРНК-155, миРНК-205, миРНК-20а, миРНК-125b, миРНК-146b, миРНК-200a) проведен методом ОТ-ПЦР в реальном времени у части пациенток из основной (n=21) и контрольной групп (n=20).
Критериями включения в исследование являлись наличие добровольного информированного согласия, женский пол, возраст старше 18 лет, верифицированный диагноз РМЖ стадии рT1-2N0-1M0, положительная экспрессия рецепторов к эстрогену (ЭР) и/или прогестерону (РП) в опухоли, постменопауза, проведение радикального хирургического лечения на 1-м этапе, отсутствие другой онкологической патологии в анамнезе, соматический статус по шкале ECOG-ВОЗ – 1–2 балла. Критериями исключения – местнораспространен- ный и метастатический РМЖ, гиперэкспрессия или амплификация HER2/neu, трижды негативный подтип РМЖ, метастатическое поражение более трех подмышечных и/или подключичных лимфоузлов, метастатическое поражение контрлатеральной молочной железы.
Возраст больных, включенных в исследование, находился в диапазоне 32–89 лет, средний возраст – 61,8 (10,8) года. Средний возраст женщин в основной группе составил 60,5 (10,6) года, в группе сравнения – 64,4 (11,02) года (р=0,3).
Статистически значимых различий в группах по виду проведенного послеоперационного лечения (гормонотерапия, и/или химиотерапия, и/или лучевая терапия) выявлено не было.
Операционный материал исследовался на базе патоморфологического отделения ГУЗ ОКОД. Макроскопически оценивалась локализация и размер опухолевого узла. При обзорной микроскопии определяли гистологический вариант рака (инфильтративный дольковый, инфильтративный протоковый, инфильтративный смешанный, особые формы), степень злокачественности (G I, II, III), ядерный полиморфизм клеток (нерезкий, умеренный, выраженный), митотическую активность раковых клеток по наличию типичных и атипичных митозов (0–11 – слабая, 12–23 – умеренная, более 24 митозов с градациями – выраженная), клеточный состав (светлые и темные клетки), структуру инфильтративного компонента, наличие инвазии в кровеносных сосудах стромы, наличие опухолевых эмболов в лимфатических сосудах и их количество в строме опухоли. Оценивали суммарный балл злокачественности (СБЗ) и Ноттингемский прогностический индекс (НПИ). СБЗ рассчитывали как сумму баллов следующих параметров: степень дифференцировки первичной опухоли (1–3 балла), клеточный полиморфизм (1–3 балла), митотическая активность (1–3 балла), характер инвазивного роста (1–5 баллов), опухолевые эмболы в сосудах стромы (0–3 балла) и клеточная реакция в строме опухоли (0–3 балла). В зависимости от СБЗ пациенток делили на три группы прогноза: низкого риска рецидива (СБЗ<14 баллов), среднего (СБЗ 14– 15 баллов) и высокого (СБЗ>15 баллов). НПИ рассчитывали по формуле НПИ=G+L+0,2S, в которой G – степень злокачественности, L – количество поражённых метастазами лимфоузлов, S – максимальный размер опухолевого узла с точностью до миллиметра. НПИ<3,4 предполагает хороший прогноз заболевания, НПИ в диапазоне 3,4–5,4 – средний прогноз и НПИ>5,4 – плохой прогноз.
Помимо стандартного патоморфологиче-ского исследования все опухолевые образцы подвергали иммуногистохимическому исследованию (ИГХ), с помощью которого определяли наличие и уровень экспрессии РЭ и РП в первичной опухоли, значение индекса пролиферации Ki-67 и экспрессию HER-2/neu (метод D.C. Allred). При спорном (++) результате ИГХ-анализа на HER-2/neu проводили определение амплификации гена HER2 методом гибридизации in situ (FISH/CISH). В процессе проведения анализа использовали стандартный протокол компании «Дако».
Анализ уровней экспрессии миРНК в подготовленных образцах производили методом ОТ-ПЦР в реальном времени с использованием набора реагентов для выделения нуклеиновых кислот «Реал Бест экстракция» и готовых реакционных смесей для реакции обратной транскрипции «Реал Бест Мастер микс ОТ» (ЗАО «Вектор-Бест», Россия). ПЦР проводили на приборе CFX 96 (Bio-Rad, США).
Статистическую обработку данных производили с помощью программ Statistica 7 (StatSoft Inc., США) и MedCalc (версия 15.2). Нормальность распределения количественных данных в малых выборках определяли с помощью критерия Шапиро–Уилка, в остальных случаях – с помощью критерия χ2.
Для нормально распределенных количественных параметров вычисляли значения средней арифметической и среднеквадратического отклонения (М ( а )). Статистическую значимость оценивали t-критерием Стьюдента. В случае распределения количественных данных, отличного от нормального, и для качественных выборок рассчитывали медиану, первый и третий квартили (Me [Q1; Q3]). Статистическую значимость различий оценивали с помощью критерия Краскела–Уоллиса. Полученные результаты считали статистически значимыми при уровне p<0,05.
Для оценки взаимосвязей различных параметров использовали корреляционный анализ, метод построения логистической регрессии и ROC-анализ. В качестве коэффициента корреляции между переменными, принадлежащими к порядковой шкале, применяли коэффициент Спирмена; для переменных, принадлежащих к интервальной шкале, – коэффициент корреляции Пирсона.
Результаты и обсуждение. По качественным и количественным морфологическим характеристикам опухолей распределение гистологических форм РМЖ в группах не имело статистически значимых различий (p=0,1). В то же время внутри каждой группы наиболее часто встречался инфильтративный протоковый рак: 22 (42 %) случая в основной группе и 36 (34,3 %) случаев в группе сравнения. Статистически значимых различий между расположением опухоли в правой или левой молочной железе также выявлено не было (p=0,05 для правосторонней локализации и p=0,08 для левосторонней).
Распределение по степени злокачественности опухолей выглядело следующим образом. В обеих группах присутствовали образцы разной степени злокачественности. При этом большая часть опухолей в группах характеризовалась средней степенью злокачественности (G2): 38 (72 %) образцов в основной группе и 69 (65,7 %) – в группе сравнения. Доля опухолей G1 в группе сравнения была несколько больше: 28 (26,7 %) против 7 (13 %) случаев. Опухоли G3 имели место в 8 (15 %) случаях в основной группе и в 8 (7,6 %) случаях в группе сравнения. Несмотря на то что распределение образцов в зависимости от степени злокачественности различалось внутри групп, статистически значимой разницы между группами получено не было (p=0,22 для G1, p=0,24 для G2 и p=0,19 для G3). Полученные данные подтверждают наличие морфологической гетерогенности РМЖ и сложность прогнозировании заболевания с опорой лишь на степень злокачественности опухоли.
Анализ значений прогностических индексов опухолей молочных желез у женщин, вошедших в исследование, дал следующие результаты. Средний СБЗ в основной и сравниваемой безрецидивной группе составил 19,1 (2,5)
и 13,3 (2,3) балла соответственно. В зависимости от СБЗ все пациентки были разделены на 3 группы прогноза: низкого риска, среднего и высокого риска рецидива. При этом статистически значимых различий по уровню СБЗ между группами сравнения выявлено не было (p=0,07 для СБЗ<14 баллов, p=0,08 для СБЗ 14-15 баллов и p=0,11 для СБЗ>15 баллов). Стоит отметить, что у наибольшего числа пациенток из группы с рецидивом заболевания (21 (40 %) чел.) СБЗ характеризовал онкологический процесс как заболевание с умеренным риском метастазирования; в группе сравнения таких пациенток было 30 (28,6 %). В группе сравнения примерно половина опухолей (53 (50,5 %)) имела уровень СБЗ менее 14 баллов, что предполагает хороший прогноз в плане рецидива болезни. Образцы РМЖ с плохим прогнозом по СБЗ выявлялись в 19 (36 %) и 22 (20,9 %) случаях в основной и контрольной группах соответственно.
При анализе НПИ женщины были также разделены на 3 прогностические группы. Большая часть опухолей в обеих группах сравнения согласно НПИ характеризовалась умеренным риском рецидива (p=0,22): в основной группе таких образцов было 41 (77 %), в контрольной - 71 (67,6 %), что подтверждает необходимость поиска дополнительных критериев более четкого прогноза РМЖ. Количество больных с опухолями низкого и высокого риска рецидива по НПИ также не имело статистически значимых различий между группами сравнения (р=0,24 и p=0,25 для групп с низким и высоким риском рецидива соответственно) и составило 11 (21 %) чел. в основной группе и 28 (26,7 %) чел. в группе сравнения для НПИ<3,4 (группа хорошего прогноза), 1 (2 %) и 6 (5,7 %) чел. соответственно для НПИ>5,4 (группа плохого прогноза).
Распределение больных по статусу регионарных подмышечных лимфоузлов было примерно одинаковым в обеих группах пациенток. При этом 35 (66 %) женщин основной группы и 72 (68,6 %) пациентки из группы сравнения не имели метастазов РМЖ в регионарных лимфоузлах на стороне поражения (p=0,17). У остальных пациенток: 18 (34 %) чел. в группе с рецидивом заболевания и 33 (31,4 %) чел. в безрецидивной группе (p=0,19) - были пора- жены от 1 до 3 подмышечных лимфоузлов на стороне опухоли.
Далее, используя корреляционный анализ, мы проследили взаимосвязи между описанными выше качественными и количественными морфологическими характеристиками опухоли и рецидивированием заболевания. Были выявлены положительные корреляционные связи между наличием рецидива РМЖ и СБЗ (R=0,254; р=0,001), рецидивом и НПИ (R=0,227; р<0,001), рецидивом и длиной опухолевого узла (R=0,169; р=0,002), рецидивом и шириной опухолевого узла (R=0,134; р<0,001).
Кроме того, была обнаружена прямая достоверная зависимость между СБЗ и степенью злокачественности опухоли (G) (R=0,381; р=0,003).
Помимо этого, имели место прямые корреляции между статусом подмышечных лимфоузлов и НПИ (R=0,368; р=0,0122), НПИ и степенью злокачественности опухоли (R=0,369; р=0,026), НПИ и стадией заболевания (R=0,412; р=0,0002).
При анализе экспрессии РЭ и РП в биоп-татах опухолей статистически значимых различий между группами сравнения получено не было. Что интересно, чуть менее половины всех опухолей в каждой из групп обладали высокой или средней гормональной чувствительностью и по РЭ, и по РП: 24 (45 %) случая в группе с рецидивом заболевания и 45 (42,8 %) случаев в группе сравнения. Также было выявлено, что частота встречаемости би-оптатов с низкой экспрессией РП (как потенциальным фактором плохого прогноза) в основной группе составила 6 (17 %) случаев, а в безрецидивной группе - 7 (6,7 %) случаев.
Далее был проведен анализ экспрессии Ki-67 как наиболее ценного и широко применяемого критерия плохого прогноза РМЖ и назначения адъювантной полихимиотерапии (ПХТ) при люминальном варианте заболевания. Среднее значение Ki-67 в основной группе составило 13,8 (5,2) %, в группе сравнения - 10,8 (5,6) % (р=0,36). Таким образом, при сравнении средних значений Ki-67 между группами с рецидивом заболевания и без рецидива статистически значимых различий выявлено не было.
Далее, используя корреляционный анализ, мы проследили взаимосвязи между описанными выше ИГХ-параметрами опухоли и рецидивом заболевания, а также некоторыми морфологическими характеристиками опухоли. Получена прямая корреляционная связь между выраженностью РЭ и РП (R=0,213; p<0,001), что подтверждает данные об их взаимном участии в патогенезе РМЖ. Кроме того, обнаружена обратная корреляционная связь между уровнем экспрессии РЭ и показателем СБЗ (R=-0,233; p<0,001), т.е. чем выше чувствительность опухоли к эстрогену, тем она менее злокачественна на основании СБЗ.
Получены данные о статистически значимой прямой зависимости между уровнем Ki-67 и наступлением рецидива (R=0,435; р=0,004), между уровнем Ki-67 и значением НПИ (R=0,638; р<0,001), между уровнем Ki-67 и степенью злокачественности опухоли (R=0,319; р=0,04).
Необходимо отметить выявленную прямую корреляционную связь между уровнем Ki-67 и размером опухоли (в частности, шириной опухолевого узла) (R=0,369; р=0,01), а также между максимальным значением Ki-67 и стадией РМЖ (R=0,549; p<0,001).
Анализ литературных данных позволил сформировать панель миРНК, участвующих в патогенезе РМЖ: миРНК-21, миРНК-155, миРНК-205, миРНК-125b, миРНК-221, миРНК-20а, миРНК-146b и миРНК-200а [15–20].
Получены статистически значимые различия для уровней экспрессии миРНК-21, миРНК-205, миРНК-146b и миРНК-200a при сопоставлении основной группы и группы сравнения. При этом значение медианы уровней экспрессии миРНК-21 в основной группе было почти в 3 раза больше, чем в группе сравнения (146,68 [99,16; 303,8] против 51,9 [17,75; 149,75], р=0,03) (рис. 1), что согласуется с имеющимися в литературе данными об онкостимулирующем действии данной миРНК [17].
Медиана экспрессии миРНК-205 основной группы была почти в 27 раз выше аналогичного показателя группы сравнения (23,2 [8,32; 316,65] против 0,875 [0,04; 26,57], р=0,01) (рис. 2), что может указывать на онкогенную роль данной миРНК в патогенезе РМЖ.
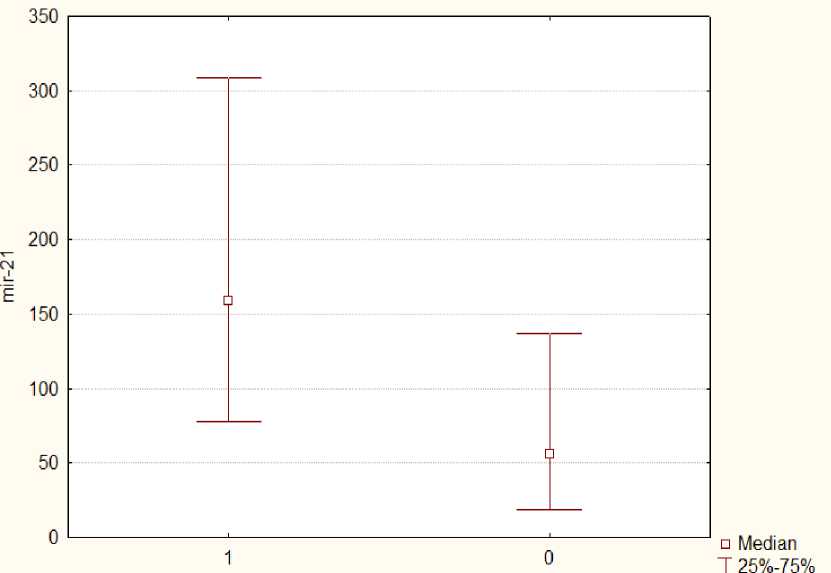
Рис. 1. Медианы относительных уровней экспрессии миРНК-21 (miR-21) в основной (1) и контрольной (0) группах
Fig. 1. Medians of relative levels of miRNA-21 (miR-21) expression in the main (1) and control (0) groups
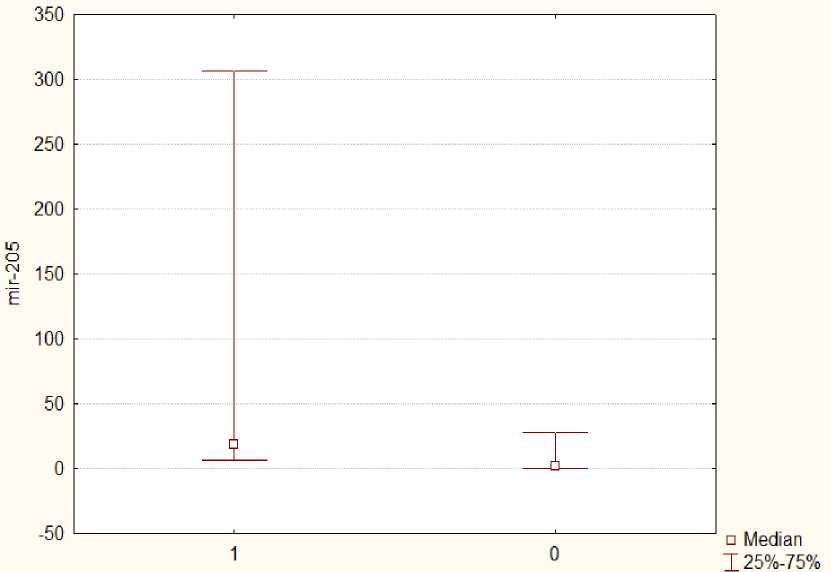
Рис. 2. Медианы относительных уровней экспрессии миРНК-205 (miR-205) в основной (1) и контрольной (0) группах
Fig. 2. Medians of relative levels of miRNA-205 (miR-205) expression in the main (1) and control (0) groups
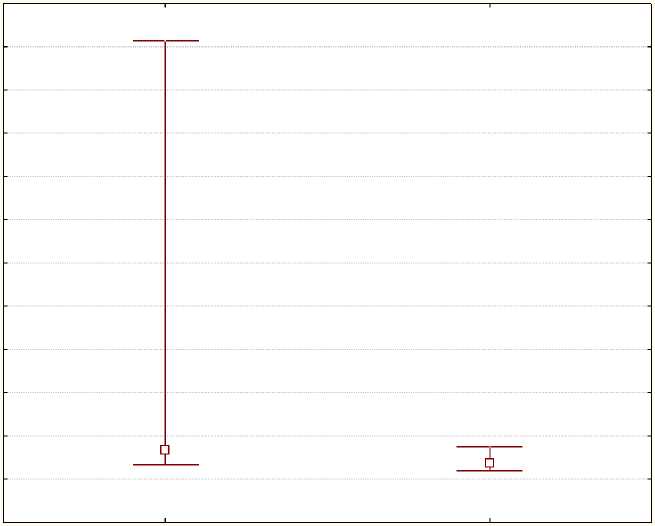
Статистически значимые различия также были зафиксированы для миРНК-146b (рис. 3) и миРНК-200a (рис. 4). Экспрессия этих миРНК в основной группе с рецидивом была выше, чем в группе сравнения, что может свидетельствовать об их онкогенном потенциале в патогенезе РМЖ. Медиана экспрессии миРНК-146b в основной группе составила 0,15 [0,07; 1,7], в группе сравнения – 0,07 [0,03; 0,13] (р=0,04); медиана экспрессии миРНК-200a – 0,15 [0,08; 0,24] и 0,02 [0,00; 0,01] соответственно (p<0,001).
Сравнительный анализ относительных уровней экспрессии миРНК-221, миРНК-222, миРНК-155, миРНК-20a и миРНК-125b между группой с рецидивом заболевания и без-рецидивной группой не выявил статистически значимых различий (р=0,21 для миРНК-221, p=0,23 для миРНК-222, p=0,72 для миРНК-155, p=0,6 для миРНК-20a и p=0,09 для миРНК-125b).
Далее методом корреляционного анализа мы проследили взаимосвязи уровней экспрессии вышеуказанных миРНК с рецидивом
РМЖ. Получены следующие результаты: выявлена прямая корреляционная связь средней силы между уровнем экспрессии миРНК-21 и наступлением рецидива (R=0,34; р=0,02), между уровнем экспрессии миРНК-146b и наступлением рецидива (R=0,324; р=0,03), между уровнем экспрессии миРНК-200a и наступлением рецидива (R=0,522; р<0,001). Таким образом, при увеличении уровней экспрессии данных миРНК в ткани опухоли возрастает частота наступления рецидива. Это подтверждается опубликованными данными об онкогенном потенциале миРНК-21 [15] и может указывать на участие миРНК-146b и миРНК-200a в прогрессировании РМЖ.
Далее с использованием метода построения логистической регрессии и ROC-анализа была построена предсказывающая модель для определения рецидива заболевания для люминальных HER2-негативных форм РМЖ. Стоит отметить, что многофакторный анализ выявил значимую роль миРНК-20a, анализ экспрессии которой не показал достоверных различий в группах сравнения.
E
2.2
-0,2
2,0
1,8
1-6
1,4
1,2
1.0
0,8
0,6
0,4
0,2
0,0
о
□ Median 125%-75%
Рис. 3. Медианы относительных уровней экспрессии миРНК-146b (miR-146b) в основной (1) и контрольной (0) группах
Fig. 3. Medians of relative levels of miRNA-146b (miR-146b) expression in the main (1) and control (0) groups
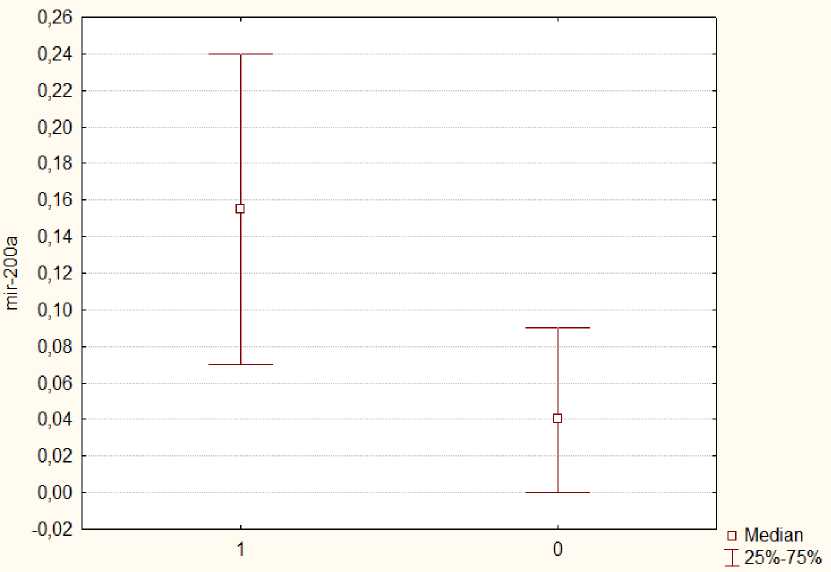
Рис. 4. Медианы относительных уровней экспрессии миРНК-200a (miR-200a) в основной (1) и контрольной (0) группах
Fig. 4. Medians of relative levels of miRNA-200a (miR-200a) expression in the main (1) and control (0) groups
Прогностическая модель была построена на основании клинико-морфологических и молекулярных данных опухолей пациенток с рецидивирующим РМЖ (n=31) и затем проверена на выборке пациенток с рецидивом заболевания (n=10).
Затем был проведен регрессионный анализ с целью определения значимости включения в прогностическую модель рецидивирова-ния люминального HER2-негативного РМЖ таких параметров, как отношение уровней экспрессии миРНК-21/миРНК-155 и миРНК-21 /миРНК-205, уровень экспрессии миРНК-20а, значение индекса пролиферативной активно-
Р = сти Ki-67, стадия РМЖ и размер опухолевого узла.
В логистическую регрессию вошли следующие параметры: Ki-67 (%), I и IIВ стадии РМЖ, миРНК-21/миРНК-155 (значения >2000), значения уровней экспрессии миРНК-20a (от 200 до 400), миРНК-21/миРНК-205 (значения >200), ширина опухолевого узла (мм). При этом наиболее значимыми показателями в построении прогноза являются Ki-67 и уровень экспрессии миРНК-20a.
Параметры логистической регрессии определялись в программе MedCalc (версия 15.2) по формулам:
миРНК -2/ х /миРНК - 155 (з группа)+4,29х миРНК-20 a (2 группа)- 0,42х
миРНК-2/ х /миРНК- 205 (2 группа)+0,29х ширина узла-10,56, где миРНК-21/миРНК-155 (2 группа) – соотношение уровней экспрессии миРНК-21/миРНК-155 от 2000 до 4000; миРНК-21/миРНК-155 (3 группа) – соотношение уровней экспрессии миРНК-21/миРНК-155 более 4000; миРНК-20a (2 группа) – уровень экспрессии миРНК-20a бо-лее 10; миРНК-21/миРНК-205 (2 группа) – соотношение уровней экспрессии миРНК-21 /миРНК-205 более 200.
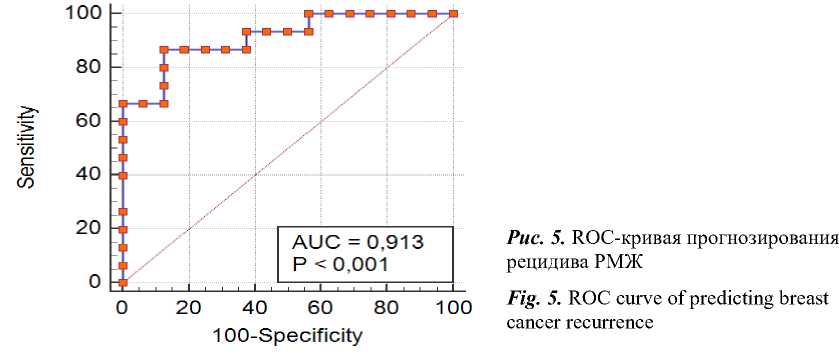
Данная модель предсказывает рецидив заболевания с точностью 87,1 %. Исход РМЖ был верно предсказан в 14 случаях из 16 у пациенток без рецидива. У 2 пациенток плохой прогноз был сделан ошибочно (специфичность метода составила 87,5 %). При этом при исследовании случаев РМЖ с рецидивом за- болевания в первые 5 лет наблюдения в 2 случаях такой исход не был предсказан, а в 13 случаях определен высокий риск рецидива (чувствительность метода составила 86,7 %). Полученные результаты наглядно продемонстрированы на рис. 5, где площадь AUC=0,9.
Так как в модели учтена проведенная адъ- миРНК-20a от 200 до 400 в сочетании с дру-
ювантная ПХТ, которая назначается с целью профилактики прогрессирования заболевания, можно предположить нечувствительность данных форм РМЖ к используемым схемам ПХТ (стандартные режимы CAF, FAC, АС). Эта гипотеза требует дальнейшей разработки и может служить предметом отдельного исследования.
Заключение. В ходе исследования были выявлены изменения уровней экспрессии миРНК-21, миРНК-205, миРНК-146b и миРНК-200a в случае прогрессирования первично операбельного люминального HER2-негативного рака молочной железы. Уровни их экспрессии были достоверно выше в группе с рецидивом заболевания в сравнении с контрольной группой.
Доказано, что пациентки с первично операбельным люминальным HER2-нега-тивным раком молочной железы имеют плохие показатели пятилетней безрецидивной выживаемости при соотношении уровней экспрессии миРНК-21/миРНК-155>200 и миРНК-21/миРНК-205>2000, значениях гими морфологическими характеристиками опухоли, что обусловливает индивидуальный подход к выбору лечебной тактики.
Установлена возможность использования прогностической системы оценки рецидиви-рования РМЖ, включающей в себя комплексный анализ отношений уровней экспрессии миРНК-21/миРНК-155 и миРНК-21/миРНК-205, а также уровня экспрессии миРНК-20a в сочетании с другими клиническими данными.
Полученные результаты свидетельствуют о неоспоримой значимости использования молекулярно-генетических маркеров, а именно миРНК, в прогнозировании течения РМЖ в комплексе со стандартными обследованиями.
Созданная прогностическая модель, основанная на определении в первичной опухолевой ткани экспрессии миРНК-20a, миРНК-21, миРНК-155 и миРНК-205 в сочетании с Ki-67 и размером опухоли, позволяет четко стратифицировать риск рецидива заболевания и в перспективе максимально персонифицировать адъювантную терапию.
Список литературы Прогностическая модель возникновения рецидива у пациенток с люминальным HER2-негативным раком молочной железы
- Абильтаева А.А., Адылханов Т.А., Мысаев А.О. Молекулярный тип рака молочной железы как прогностический фактор метастазирования (обзор литературы). Наука и здравоохранение. 2016; 4: 119-128.
- Бондаренко И.Н., Эльхажж М.Х., Чебанов К.О., Прохач А.В., Бондаренко Ю.Н. Роль молекулярных подтипов опухоли в формировании персонифицированных подходов к лечению рака молочной железы. Клиническая медицина. 2016; 21 (2): 81-84.
- Старинский В.В., Каприн А.Д., Петрова Г.В., ред. Злокачественные новообразования в России в 2016 году. М.: ФГУ МНИОИ им. П.А. Герцена Росмедтехнологий; 2018. 250.
- Гажонова В.Е., Виноградова Н.Н., Зубарев А.В. Скрининг рака молочной железы: состояние проблемы и пути решения. Кремлевская медицина. 2017; 3: 6-11.
- Писарева Л.Ф., Спивакова И.О., Ляхова Н.П., Одинцова И.Н., Коробкова Т.Н., Лысенко О.В. Состояние онкологической помощи больным раком молочной железы в Амурской области в 1999-2014 гг. Сибирский онкологический журнал. 2017; 16 (3): 12-18.
- Monticciolo D.L., Newell M.S., Moy L. Breast cancer screening in women at higher-than-average risk: recommendations from the ACR. JACR. 2018; 15 (3): 408-410.
- Fragomeni S.M., Sciallis A., Jeruss J.S. Molecular subtypes and local-regional control of breast cancer. Surgical oncology clinics of North America. 2018; 27 (1): 96-100.
- Albain K.S., Barlow W.E., ShackS. Prognostic and predictive value of the 21-gene recurrence score assay in postmenopausal women with nodepositive, oestrogen-receptor-positive breast cancer on chemotherapy: A retrospective analysis of a randomized trial. Lancet Oncol. 2010; 11: 55-65.
- Appierto V., DiCosimo S., Reduzzi C. How to study and overcome tumor heterogeneity with circulating biomarkers: the breast cancer case. Seminars in cancer biology. 2017; 44: 106-116.
- Azim H.A.Jr., Michiels S., Zagouri F. Utility of prognostic genomic tests in breast cancer practice: The IMPAKT 2012 Working Group Consensus Statement. Ann. Oncol. 2013; 24 (3): 647-654.
- Bustreo S., Osella-Abate S., Cassoni P. Optimal Ki-67 cut-off for luminal breast cancer prognostic evaluation: a large case series study with a long-term follow-up. Breast Cancer Research Treatment. 2016; 157 (2): 363-371.
- Cardoso F., van't Veer L.J., Bogaerts J. 70-Gene signatureas an aid to treatment decisions in early-stage breast cancer. N. Engl. J. Med. 2016; 375: 717-729.
- Easton D.F., Pharoah P.D., Antoniou A.C. Genepanel sequencing and the prediction of breast-cancer risk. The New England Journal of Medicine. 2015; 372 (23): 2243-2257.
- Galea M.H., Blamey L.W., Elston C.E. The Nottingham Prognostic Index in primary breast cancer. Breast Cancer Res. Treat. 1992; 22: 207-219.
- Chou J., Werb Z. MicroRNAs play a big role in regulating ovarian cancer-associated fibroblasts and the tumor microenvironment. Cancer Discov. 2012; 2 (12): 1078-1080.
- Chu P., Liang A., Jiang A. MiR-205 regulates the proliferation and invasion of ovarian cancer cells via suppressing PTEN/SMAD4 expression. Oncology letters. 2018; 15 (5): 7571-7578.
- Costa P.M., Cardoso A.L., Nobrega C. MicroRNA-21 silencing enhances the cytotoxic effect of the antiangiogenic drug sunitinib in glioblastoma. Hum. Mol. Genet. 2013; 22 (5): 904-918.
- Dimmeler S., Nicotera P. MicroRNAs in age-related diseases. EMBO Mol. Med. 2013; 5 (2): 180-190.
- Imani S., Zhang X., Hosseinifard H. The diagnostic role of microRNA-34a in breast cancer: a systemic review and meta-analysis. Oncotarget. 2017; 8: 2177-2187.
- XieX., Hu Y., Fu L. The role of миРНК-125b-mitichondria-caspase-3 pathway in doxorubicin resistance and therapy in human breast cancer. Tumor biology. 2015; 36 (9): 7185-7194.


