Прогностические модели оценки риска развития послеоперационных кардиологических и респираторных осложнений у больных раком легкого
Автор: Тонеев Е.А., Комаров А.С., Мидленко О.В., Мартынов А.А., Исаев Д.Н., Чавкин П.М.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 1, 2024 года.
Бесплатный доступ
Цель. Выявление факторов риска развития послеоперационных кардиологических и респираторных осложнений у пациентов после лобэктомии и создание номограмм для прогнозирования данных осложнений.
Лобэктомия, номограмма, респираторные осложнения, кардиологические осложнения
Короткий адрес: https://sciup.org/14129937
IDR: 14129937 | УДК: 616.831-089.87 | DOI: 10.34014/2227-1848-2024-1-41-63
Текст научной статьи Прогностические модели оценки риска развития послеоперационных кардиологических и респираторных осложнений у больных раком легкого
Введение. Хирургия занимает ключевую позицию при лечении ранних стадий немелкоклеточного рака легкого. В результате хирургического вмешательства часто происходит удаление опухолевого узла вместе с функциональной легочной тканью, что в последующем приводит к гипоксемии и ухудшению работы сердца. Большинство больных раком легкого имеют в анамнезе длительный стаж курения, которое негативно влияет на сердечно-легочную функцию [1].
Послеоперационная аритмия, особенно послеоперационная фибрилляция предсердий (ФП), является наиболее частым послеопера- ционным осложнением у больных раком легкого. Распространенность ФП, по данным отечественных и зарубежных авторов, составляет 10–15 % после лобэктомии и 20–30 % после пневмонэктомии [2, 3]. В ранее проведенных исследованиях было показано, что пожилой возраст, мужской пол, ожирение, артериальная гипертензия, низкий уровень сердечного выброса, хроническая почечная недостаточность, хроническая обструктивная болезнь легких и объем удаляемой легочной ткани являются независимыми факторами риска. Хотя ФП обычно носит транзиторный характер и купируется консервативными мероприятиями, иногда она способна приводить к тяжелым осложнениям, таким как тромбоэмболия легочной артерии, острый коронарный синдром и острая сердечно-легочная недостаточность [4]. Таким образом, ФП и ее кардиологические последствия способны увеличить продолжительность пребывания пациента в стационаре и привести к летальному исходу [5]. В доступных нам источниках уделено недостаточно внимания прогнозированию кардиальных осложнений раннего послеоперационного периода у пациентов, оперированных по поводу рака легкого. Появление прогностических моделей позволит эффективнее оценить вероятность развития кардиологических осложнений и тем самым модифицировать ведение пациентов высокого риска для предотвращения негативных последствий.
Послеоперационные легочные осложнения являются основной причиной периоперационной заболеваемости и смертности, возникающей у 14–40 % пациентов после резекции легкого [6]. Американский колледж врачей-пульмонологов (ACCP) рекомендует тщательную предоперационную физиологическую оценку легких и сердца для отбора пациентов на хирургическое лечение [7]. Перед хирургическими вмешательствами на легких обычно проводят несколько тестов: исследование функции внешнего дыхания, кардиопульмональный нагрузочный тест, функциональные пробы.
Известные нам исследования по выявлению факторов, влияющих на послеоперационные кардиореспираторные осложнения, были ограничены включением только отдельных потенциально связанных индексов. Модели прогнозирования в настоящее время широко применяются в клинической практике, поскольку они лаконичны, ясны и всегда включают более одного фактора для расчета риска [8].
Цель исследования. Построение прогностических моделей оценки риска развития послеоперационных кардиологических и респираторных осложнений на основании анализа результатов лечения пациентов, оперированных по поводу рака легкого.
Материалы и методы. В исследование были включены 162 пациента, которым была выполнена лобэктомия в период 2020–2022 гг. в условиях хирургического отделения торакальной онкологии ГУЗ Областной клинический онкологический диспансер г. Ульяновска.
Критерии включения в исследование: немелкоклеточный рак легкого I–IIIA стадии; возраст 18–80 лет; доступ: торакотомия передне-боковая или боковая; исследование функции легких и сердца за одну неделю до операции.
Критерии исключения: неполные клинические данные для анализа; противопоказания к исследованию функции легких и сердца ввиду сопутствующей патологии; выявленная тяжелая сердечная недостаточность, определяемая по данным электро- или эхокардиографии; ранее перенесенная резекция легкого; другие тяжелые цереброваскулярные заболевания или другие состояния, исключающие резекцию легкого; торакоскопическая лобэктомия; выявленная на догоспитальном этапе аритмия; сочетанная острая кардиореспира-торная патология.
Были учтены следующие клинические данные: пол, возраст, параметры функции внешнего дыхания (ФВД) (ОФВ1 – объем форсированного выдоха за 1 с; ЖЕЛ – жизненная емкость легких; ПОС – пиковая объемная скорость), индекс пачка/лет (ИПЛ), функциональные тесты: (челночный ход, лестничная проба), параметры биохимического анализа крови (общий белок, креатинин, мочевина), интраоперационные данные (время операции, кровопотеря, вид лобэктомии), использование глюкокортикостериодов (ГКС) после операции, параметры сердечной деятельности (давление в легочной артерии, фракция выброса левого желудочка), индекс массы тела (ИМТ, рассчитанный как отношение массы тела (кг) к квадрату роста (м)), наличие или отсутствие гипертонической болезни (ГБ), ишемическая болезнь сердца (ИБС).
Послеоперационные осложнения регистрировали как их наличие или отсутствие. Послеоперационными легочными осложнениями в раннем послеоперационном периоде после лобэктомии являлись:
– пневмония, характеризующаяся новой легочной инфильтрацией при визуализирующем исследовании и любым из следующих признаков: 1) лихорадка (температура тела ≥38 °C), продолжающаяся более 5 дней; 2) количество лейкоцитов >10,5×10 9 /л;
– ателектаз легкого;
– дыхательная недостаточность, требующая перевода на ИВЛ;
– продленный сброс воздуха.
Послеоперационные кардиологические осложнения в раннем послеоперационном периоде после лобэктомии включали:
– стойкую аритмию, требующую лекарственной коррекции;
– острый коронарный синдром;
– тромбоэмболия легочной артерии.
Общее число исследуемых факторов составило 18. Частота прогнозируемых кардиологических исходов – 21 (13 %), респираторных – 28 (17 %). С учетом частоты исходов и количества ковариат показатель EPP (Events per predictor) составил 28/21 (EPP=1,3) и 21/21 (EPP=1). При использовании эмпирического правила при построении регрессионных моделей показатель EPP должен равняться 10–15. В связи с недостаточной мощностью данных произведен синтез искусственных данных с аналогичным распределением по методу MICE (многомерное вменение с помощью цепных уравнений) при помощи сервиса – 1600 наблюдений.
Выборка разделена в соотношении 80/20 на тренировочный (n=1258) и валидационный (n=342) датасеты. Окончательное тестирование проведено на исходных данных (n=162).
Для построения прогностических моделей использован метод биномиальной логистической регрессии с обратным исключением переменных по их скорректированной значимости в многофакторной модели (исключены наименее значимые ковариаты) и с учетом величины информационного критерия Акаике (AIC). Дискриминативность модели (точность классификации) оценена по значению C-индекса (AUC). Доля дисперсии зависимой переменной в модели определена по значению коэффициента детерминации Не-гелькерке R 2 . Калибровка модели оценена путем построения сглаженной калибровочной кривой с оценкой уровня наклона кривой (Slope), максимальной и средней ошибок калибровки на валидационном наборе данных. В ходе построения моделей проверены допущения на линейность независимых переменных и логарифма шансов (графический метод, тест Бокса – Тидвелла), выполнена проверка на полное (квазиполное) разделение и мультиколлинеарность (через корреляционный анализ ковариат методом Спирмена и вычисление коэффициента инфляции дисперсии – VIF).
Статистический анализ проведен с использованием языка программирования R версии 4.2.1 и программного обеспечения R Studio, а также с использованием программы StatTech v. 3.1.8 (ООО «Статтех», Россия).
Результаты. Характеристики исследуемых пациентов в группе респираторных осложнений представлены в табл. 1.
Таблица 1
Table 1
Patients with respiratory complications
|
Показатель Parameter |
Категория Category |
Респираторные осложнения Respiratory complications |
p |
|
|
Нет No (134) |
Да Yes (28) |
|||
|
Пол, чел. (%) Sex, n (%) |
Женский Female |
38 (28,4) |
2 (7,1) |
0,018 |
|
Мужской Male |
96 (71,6) |
26 (92,9) |
||
|
Возраст, лет Age, years old |
65 (60–69) |
63 (58–69) |
0,935 |
|
|
ПОС, % PFER, % |
54 (41–59) |
45 (40–52) |
0,010 |
|
|
ОФВ1, % FEV, % |
81 (62–89) |
71 (64–82) |
0,154 |
|
|
ЖЕЛ, % VC, % |
81 (69–92) |
75 (65–94) |
0,391 |
|
|
ИПЛ Pack-year index |
24 (10–34) |
32 (23–38) |
0,033 |
|
|
Давление в ЛА, мм рт. ст. PA pressure, mmHg |
17 (14–21) |
17 (15–23) |
0,348 |
|
|
ФВ, % EF, % |
63 (60–65) |
62 (57–64) |
0,261 |
|
|
ИМТ BMI |
24 (22–27) |
26 (24–29) |
0,008 |
|
|
Челночный ход, м Shuttle walking test, m |
468 (426–495) |
310 (288–352) |
<0,001 |
|
|
Лестничная проба, м Stair climbing test, m |
22 (21–23) |
17 (15–18) |
<0,001 |
|
|
Общий белок, г/л Total protein, g/l |
68 (63–71) |
61 (58–64) |
<0,001 |
|
|
ГБ, абс. (%) HD, abs (%) |
Нет / No |
75 (56,0) |
10 (35,7) |
0,051 |
|
Да / Yes |
59 (44,0) |
18 (64,3) |
||
|
ИБС, абс. (%) CHD, abs (%) |
Нет / No |
119 (88,8) |
27 (96,4) |
0,219 |
|
Да / Yes |
15 (11,2) |
1 (3,6) |
||
|
Показатель Parameter |
Категория Category |
Респираторные осложнения Respiratory complications |
p |
|
|
Нет No (134) |
Да Yes (28) |
|||
|
Вид лобэктомии, абс. (%) Type of lobectomy, abs (%) |
ВЛЭ справа Right upper lobectomy |
39 (29,1) |
7 (25,0) |
0,776 |
|
СЛ Middle lobectomy |
9 (6,7) |
3 (10,7) |
||
|
НЛЭ справа Right lower lobectomy |
24 (17,9) |
3 (10,7) |
||
|
ВЛЭ слева Left upper lobectomy |
38 (28,4) |
10 (35,7) |
||
|
НЛЭ слева Left lower lobectomy |
24 (17,9) |
5 (17,9) |
||
|
Время операции, мин Operation time, min |
107±27 |
123±27 |
0,005 |
|
|
Кровопотеря, мл Blood loss, ml |
240 (200–290) |
310 (240–370) |
0,002 |
|
|
ГКС после операции, абс. (%) HCS after operation, abs (%) |
Нет / No |
84 (62,7) |
11 (39,3) |
0,022 |
|
Да / Yes |
50 (37,3) |
17 (60,7) |
||
Примечание. ЛА – легочная артерия; ВЛЭ – верхняя лобэктомия; СЛ – средняя лобэктомия; НЛЭ – нижняя лобэктомия. В скобках указан интраквартильный размах. В табл. 2 обозначения те же.
Note. PFER – peak flow expiratory rate, FEV – forced expiratory volume, VC – vital capacity, PA – pulmonary artery, EF – ejection fraction, BMI – body mass index, HD – hypertensive disease, CHD – coronary heart disease, HCS – hypercoagulable syndrome.
Статистически значимые различия в группах осложнений по сравнению с пациентами с гладким послеоперационным течением были получены по следующим параметрам. В группе осложнений преобладали мужчины (р=0,018). Из показателей ФВД только ПОС была статистически значимо ниже в группе осложнений (р=0,010). ИПЛ и ИМТ также значимо влияли на развитие осложнений (р=0,033 и р=0,008 соответственно). Вероятность развития респираторных осложнений демонстрировали неудовлетворительные предоперационные функциональные пробы (челночный ход и лестничная проба, р<0,001
и р<0,001 соответственно). Уровень общего белка в биохимическом анализе крови может свидетельствовать о низких репаративных способностях организма в послеоперационном периоде, в нашей выборке низкий уровень белка напрямую зависел от развития осложнений (р<0,001). Одним из компонентов лечения респираторных осложнений является использование ГКС, в группе с респираторными осложнениями частота использования ГКС была статистически значимо выше (p=0,022).
Параметры пациентов с кардиологическими осложнениями представлены в табл. 2.
Таблица 2
Table 2
|
Показатель Parameter |
Категория Category |
Кардиологические осложнения Cardiac complications |
p |
|
|
Нет No (141) |
Да Yes (21) |
|||
|
Пол, чел. (%) Sex |
Женский Female |
39 (27,7) |
1 (4,8) |
0,023 |
|
Мужской Male |
102 (72,3) |
20 (95,2) |
||
|
Возраст, лет Age, years old |
64 (59–69) |
69 (65–70) |
0,005 |
|
|
ПОС, % PFER, % |
51 (44–55) |
53 (41–59) |
0,848 |
|
|
ОФВ1, % FEV, % |
79 (62–88) |
74 (71–86) |
0,686 |
|
|
ЖЕЛ, % VC, % |
83 (69–93) |
69 (61–79) |
0,015 |
|
|
ИПЛ Pack year index |
24 (9–34) |
33 (26–41) |
0,001 |
|
|
Давление в ЛА, мм рт. ст. PA pressure, mmHg |
17 (14–21) |
17 (15–23) |
0,187 |
|
|
ФВ, % EF, % |
63 (60–65) |
57 (53–61) |
<0,001 |
|
|
ИМТ BMI |
24 (22–27) |
26 (24–30) |
0,020 |
|
|
Челночный ход, м Shuttle walking test, m |
460 (405–490) |
320 (280–360) |
<0,001 |
|
|
Лестничная проба, м Stair climbing test, m |
22 (21–23) |
17 (15–18) |
<0,001 |
|
|
Общий белок, г/л Total protein, g/l |
68 (63–71) |
60 (55–62) |
0,129 |
|
|
ГБ, абс. (%) HD, abs (%) |
Нет / No |
81 (57,4) |
4 (19,0) |
0,001 |
|
Да / Yes |
60 (42,6) |
17 (81,0) |
||
|
ИБС, абс. (%) CHD, abs (%) |
Нет / No |
126 (89,4) |
20 (95,2) |
0,400 |
|
Да / Yes |
15 (10,6) |
1 (4,8) |
||
|
Вид лобэктомии, абс. (%) Type of lobectomy, abs (%) |
ВЛЭ справа Right upper lobectomy |
39 (29,1) |
7 (25,0) |
0,776 |
|
СЛ Middle lobectomy |
9 (6,7) |
3 (10,7) |
||
|
НЛЭ справа Right lower lobectomy |
24 (17,9) |
3 (10,7) |
||
|
ВЛЭ слева Left upper lobectomy |
38 (28,4) |
10 (35,7) |
||
|
НЛЭ слева Left lower lobectomy |
24 (17,9) |
5 (17,9) |
||
|
Время операции, мин Operation time, min |
108±26 |
119±35 |
0,101 |
|
|
Кровопотеря, мл Blood loss, ml |
240 (200–300) |
300 (200–330) |
0,111 |
|
|
ГКС после операции, абс. (%) HCS after operation, abs (%) |
Нет / No |
88 (62,4) |
7 (33,3) |
0,012 |
|
Да / Yes |
53 (37,6) |
14 (66,7) |
||
Параметры пациентов с респираторными осложнениями
Параметры пациентов с кардиологическими осложнениями Patients with cardiac complications
Статистически значимые различия между группой осложнений и остальными пациентами были получены по 10 параметрам из 18. Обращает на себя внимание отсутствие достоверных различий между группами по показателю ИБС (p=0,400), наличие данной патологии не влияло на развитие кардиологических осложнений, что может быть связано с ее удовлетворительной коррекцией на дооперацион-
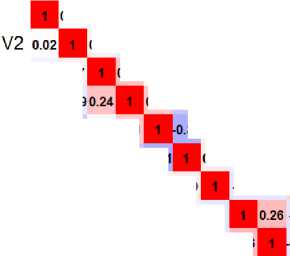
Перед построением моделей выполнялась проверка на мультиколлинеарность потенциальных предикторов методом построения тепловой корреляционной матрицы (рис. 1). Коррелирующие между собой переменные (коэффициент корреляции Спирмена rho>0,75) считались коллинеарными.
ном этапе.
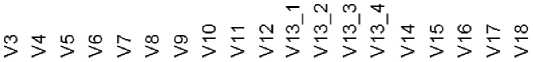
0.08-0.12-0.07-0.130.13 -0.180.17-0.17-0.010.03 0.03 -0.15-0.01 0.17-0.15
CXI
V1
0.02-0.05 0
0.07-0.09-0.2 0.23-0.080.01
0.24 0.03-0.04-0.130.12
0.21-0.23-0.010.02
.310.06 0.03
0.09-0.06.
-0.1 -0.090.17
i-0.130.08 0.06 -0.140.05-0.030.03 0.01
-0.04-0.08-0.05 0.03 0.01 0.01
V3
-0.050.07
V4
0 -0.09
V5
-0.1
-0.2
0.03 0.21
V6
-0.04-0.23-0.31
V7
0.08-0.08-0.13-0.010.06 0.09
V8
-0.120.01 0.12 0.02 0.03-0.06 -0.1
V9
-0.07-0.14 0.02 0.26 0.18-0.13-0.090.26
-0.130.04 -0.040.01
0.11 0.08 0.17 -0.1 -0.09
-0.140.04 0.05-0.040.09-0.030.07 -0.1 0.06-0.160.19 0.19 0.2
0.02-0.04 0.08 0.17 0.02 -0.09-0.08-0.05-0.14-0.03-0.12-0.010.08
0.26 0.01 0.04 0.16 0.14-0.04-0.03-0.17-0.14 0.11-0.07-0.1 -0.05
0.18 0.11 -0.23 0.12 0.08 0.11 0.01 -0.04-0.1 0.15 0.08-0.08-0.04
0.11 -0.170.15 0.16-0.02
0.14-0.05-0.13-0.030.09
V10
V11
0.13 0.05 0.08 0.04
V12
V13 1
V13 2
V13 3
V13 4
V14
V15
V16
V17
V18

0.04 -0.23 0.06 0.04-0.02-0.03-0.13-0.19 0.01
0.09-0.05 0.4 0.17-0.05-0.12-0.09-0.03 0.05-0.02-0.150.01

■0.06-0.12 0.01 -0.050.04-0.03-0.06 0.08 0.18 0.05-0.09

-0.230.06 -0.04-0.02-0.05-0.0600-0.170.05 -0.09-0.040.03 0.05
-0.18-0.040.17 0.16 0.12-0.14-0.080.54 0.4 -0.12-0.17
0.17 0.09 0.02 0.14 0.08 0.05 -0.050.04 0.17
-0.17-0.03-0.09-0.04 0.11 -0.03 0.03 -0.23-0.05-0.05-0.09-0.09-0.18
-0.010.07-0.08-0.030.01 0.03 0.01 0.06-0.120.04-0.04 0.1 -0.28-0.1
0.03 -0.1 -0.05-0.17-0.040.01 0.01 0.04-0.09-0.03 0.03-0.11-0.41-0.18-0.
0.03 0.06
-0.14-0.14-0.1 0.11 0.14-0.02-0.03-0.06 0.05-0.08-0.02 0.04-0.01
-0.15-0.16
0.8
0.6
0.4
0.2
-0.13-0.010.18-0.03
0.04-0.09 0.1 -0.11-0.08
0.24-0.23-0.12 0.1
-0.18-0.28-0.41-0.02 0.03 0.03 0.03 0.11
-0.13-0.180.04 -0.1 0.08-0.130.06
-0.29-0.010.03 0 0.04 0.07
0.02 0.05 0.09-0.17
-0.19-0.010.07 0.05
-0.04-0.090.12
0.05-0.11
-0.01 -0.1 -0.08 0.16-0.03-0.19-0.150.05
0.01 0.05 0.04
0.11
-0.01-0.230.03 0.08 0 0.05-0.01-0.0
0.18 -0.120.03 -0.130.04 0.09 0.07 -0.I
i-0.030.11 0.15-0.17-0.05-0.03 0.05 0.08-0.13 0.24 0.03 -0.1 0.03 0.02-0.1
-0.010.19-0.12-0.070.08 0.15-0.13-0.13-0.020.18
0.17 0.19
-0.15 0.2
0.08-0.05-0.04-0.02 0.09 0.01 0.01-0.09-0.03 0.1 0.11 0.06 0.07-0.170.05 0.12-0.110.02
-0.2
-0.4
-0.6
-0.8
-1
Рис. 1. Тепловая корреляционная матрица. Коллинеарных переменных не обнаружено: медиана rho=-0,003 (Мин-Макс: -0,458–0,666)
Fig. 1. Thermal correlation matrix. No collinear variables were found: median rho=-0.003 (Min-Max: -0.458–0.666)
Прогностическая модель респираторных осложнений
Характеристика модели
Logit (респираторные осложнения) = 23,4232 – 0,7427 × лестничная проба – 0,0259 × челночный ход.
Скорректированные характеристики модели методом бутстрэпа (400 итераций): C-индекс: 0,983; R 2 : 0,789.
Таблица 3Table 3
Отношение шансов респираторных осложнений Odds ratio for respiratory complications
|
Предиктор / Predictor |
ОШ / OR |
95 % ДИ / 95% CI |
|
Лестничная проба / Stair climbing test |
0,475 |
0,412–0,549 |
|
Челночный ход / Shuttle walking test |
0,974 |
0,969–0,979 |
Проверка на мультиколлинеарность
Лестничная проба: VIF=1,03; челночный ход: VIF=1,03. Показатели VIF<5, мультиколлинеарности нет.
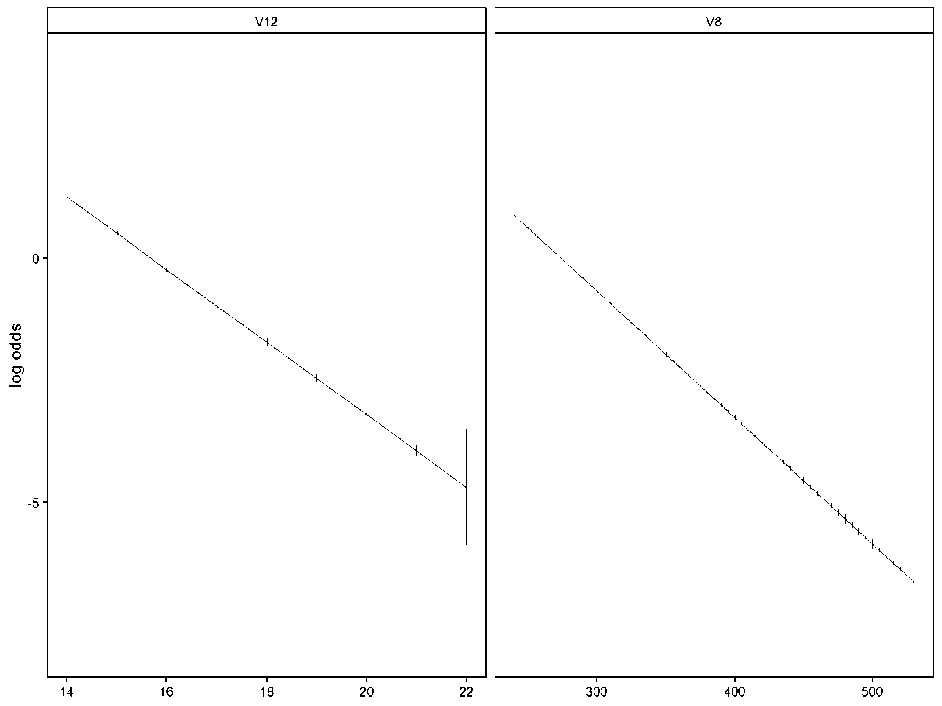
Рис. 2. Проверка линейности взаимосвязи независимых переменных и логарифма шансов
Fig. 2. Testing linear correlation between independent variables and the log odds
Тест Бокса – Тидвелла не пройден (p<0,05 для обеих переменных «лестничная проба» и «челночный ход», рис. 2). Однако визуально наблюдается линейная зависимость между значениями независимых переменных и логитом, что является допущением к построению модели логистической регрессии. Также выполнялся корреляционный анализ по Спирмену между логарифмом шансов отклика и независимыми переменными «челночный ход» (rho=-0,93) и «лестничная проба» (rho=-0,72).
Валидация и калибровка
AUC (на валидационной выборке): 0,98 (95 % ДИ: 0,97–0,99).
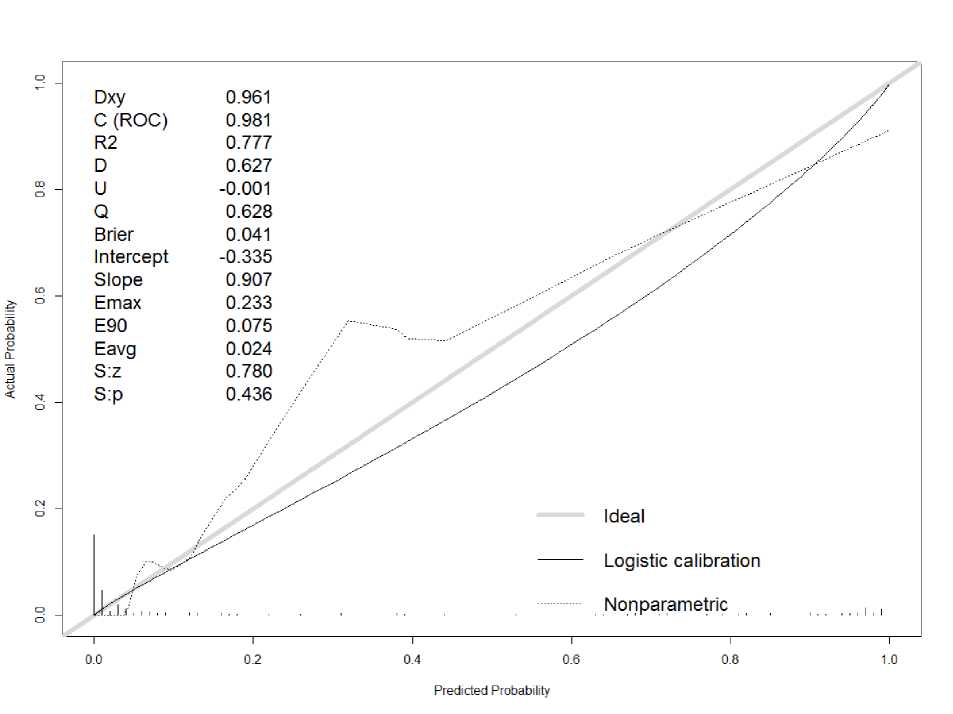
Рис. 3. Калибровочная кривая прогностической модели для респираторных осложнений
Fig. 3. Calibration curve for a predictive model of respiratory complications
Согласно калибровочной кривой (рис. 3) прогнозируемые и истинные значения вероятностей исхода наименее совпадают в диапазоне от ~0,2 до 0,4. Значения предсказанных вероятностей выше истинных с максимальной ошибкой 23 %. Средняя ошибка калибровки составляет 2,4 %. Непараметрическая калибровочная кривая близка к диагонали (slope>0,9, в идеале 1) и указывает на то, что прогнозируемые риски в целом хорошо соответствуют наблюдаемым. Отрицательное значение интерсепта указывает на переоцененность модельных прогнозов, положительное – на их недооцененность.
Не рекомендуется использовать диапазон менее 0,5 для принятия решений о рисках исхода.
Номограмма / Nomogram (рис. 4)
Баллы / Points
|
V12 |
21 22 |
19 |
17 16 |
15 |
14 |
||||
|
20 |
18 |
||||||||
|
V8 |
|||||||||
|
Сумма баллов / Total points |
600 |
550 |
500 |
450 |
400 |
350 |
300 |
250 |
200 |
|
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
|
|
Линейный предиктор / |
|||||||||
|
Linear predictor |
-8 |
-6 |
-4 |
-2 |
6 |
2 |
4 |
6 |
8 |
РИСК / RISK
0.1 0.2 0.30.40 50.60 7 0.8 0.9
Рис. 4. Номограмма для прогнозирования респираторных осложнений (V12 – лестничная проба, V8 – челночный ход)
Fig. 4. Nomogram for predicting respiratory complications (V12 – stair climbing test, V8 – shuttle walking test)
Тестирование
AUC (на тестовой выборке): 0,98 (95 % ДИ: 0,97–0,99).
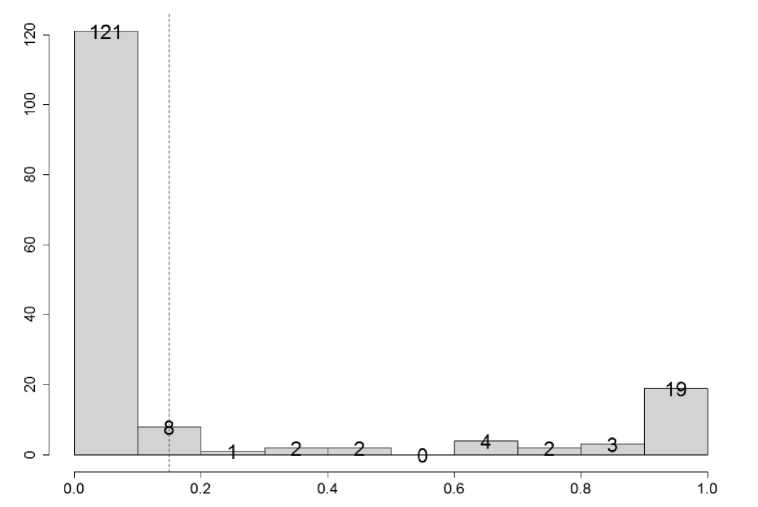
Рис. 5. Диаграмма распределения вероятностей прогноза исхода респираторных осложнений на тестовой выборке
Fig. 5. Probability distribution diagram for predicting respiratory complication outcome on the test sample
Таблица 4
Table 4
Метрики модели для респираторных осложнений при эмпирическом пороге вероятности исхода >0,5
Model metrics for respiratory complications, empirical threshold for outcome probability >0,5
|
Предсказанный исход Predicted outcome |
Истинный исход True outcome |
|
|
Нет / No |
Да / Yes |
|
|
Нет / No |
130 |
4 |
|
Да / Yes |
4 |
24 |
Характеристики матрицы ошибок: точность – 0,95; чувствительность – 0,86; специфичность – 0,97; положительная прогностическая ценность – 0,86; отрицательная прогностическая ценность – 0,97; F-мера – 0,86. Диагностические метрики можно признать хорошими. Модель обладает высокой специфичностью и чувствительностью.
Прогностическая модель кардиологических осложнений
Характеристика модели
Logit (кардиологические осложнения) = 11,1147 – 0,1247 × лестничная проба – 0,1651 × фракция выброса левого желудочка + 0,1568 × ИМТ + 1,133 × гипертоническая болезнь.
Скорректированные характеристики модели методом бутстрэпа (400 итераций): C-индекс: 0,854; R 2 : 0,329.
Отношение шансов развития кардиологических осложнений Odds ratio for developing cardiac complications
Таблица 5
Table 5
|
Предиктор / Predictor |
ОШ / OR |
95 % ДИ / 95 % CI |
|
Лестничная проба Stair climbing test |
0,882 |
0,857–0,908 |
|
Фракция выброса левого желудочка Left ventricular ejection fraction |
0,847 |
0,815–0,818 |
|
ИМТ BMI |
1,169 |
1,108–1,234 |
|
Артериальная гипертензия Arterial hypertension |
3,104 |
2,011–4,791 |
Проверка на мультиколлинеарность
Общий белок: VIF=1,04; фракция выброса левого желудочка: VIF=1,01; ИМТ: VIF=1,03; стадия гипертонической болезни: VIF=1,05. Показатели VIF<5, мультиколлинеарности нет.
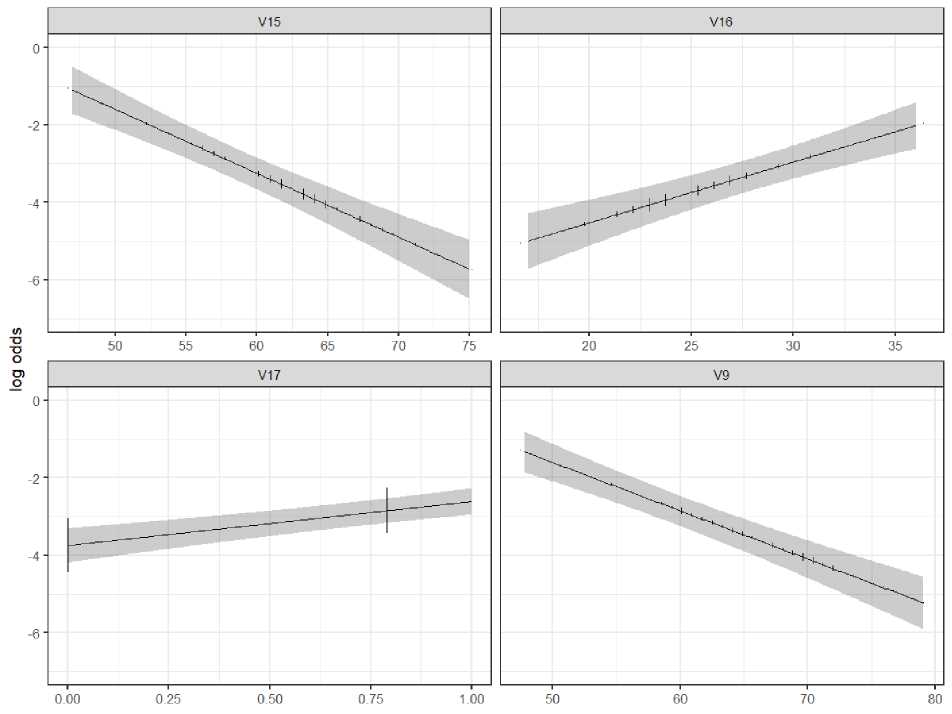
Рис. 6. Проверка линейности взаимосвязи независимых переменных и логарифма шансов
Fig. 6. Testing linear correlation between independent variables and log odds
Тест Бокса – Тидвелла пройден (p>0,05 для количественных переменных: общий белок, фракция выброса, ИМТ, стадия гипертонической болезни). Подтверждена линейная взаимосвязь между независимыми переменными и логитом модели.
Валидация и калибровка
AUC (на валидационной выборке): 0,84 (95 % ДИ: 0,78–0,9).
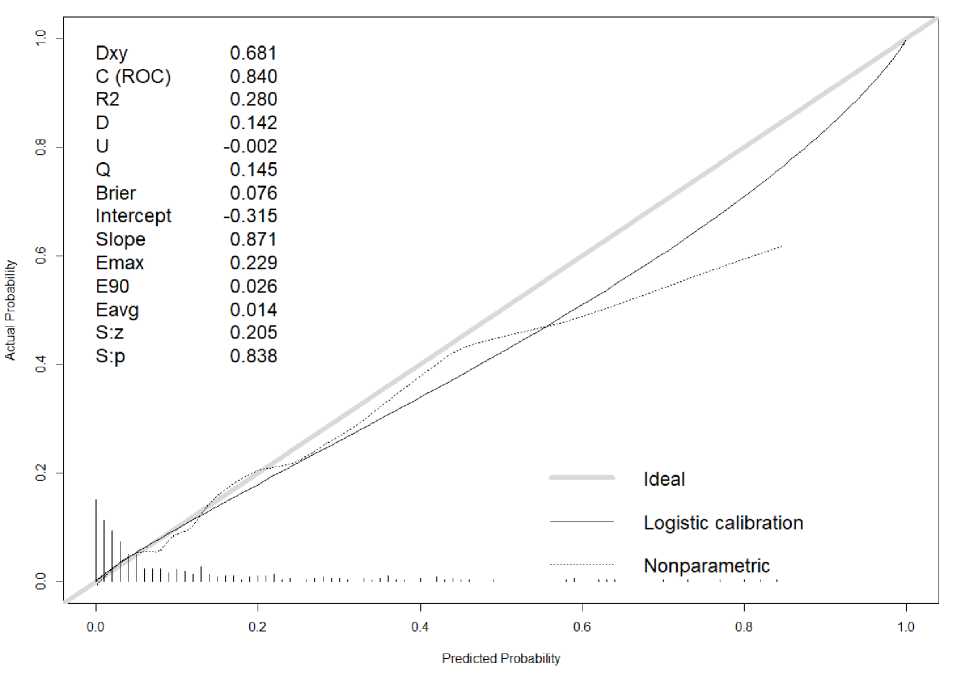
Рис. 7. Калибровочная кривая прогностической модели для кардиологических осложнений
Fig. 7. Calibration curve for a prognostic model of cardiac complications
Согласно калибровочной кривой прогнозируемые и истинные значения вероятностей исхода наименее совпадают в диапазоне выше 0,5. Значения предсказанных вероятностей выше истинных с максимальной ошибкой 22,9 %. Средняя ошибка калибровки составляет 1,4 %. Непараметрическая калибровочная кривая умеренно близка к диагонали (slope=0,87, в идеале 1) и указывает на то, что прогнозируемые риски удовлетворительно соответствуют наблюдаемым. Отрицательное значение интерсепта указывает на переоцененность модельных прогнозов, положительное – на их недооцененность.
Предсказанные моделью вероятности выше 0,5 следует считать завышенными, в связи с этим можно сдвинуть порог для принятия решений до >0,3.
Номограмма
|
Баллы / Points |
01 23456789 10 |
|
V9 |
85 80 75 70 65 60 55 50 45 40 |
|
V15 |
80 75 70 65 60 55 50 45 |
|
V16 |
16 18 20 22 24 26 28 30 32 34 36 38 |
|
V17 |
0 0.2 0.5 0.8 i |
|
Сумма баллов / Total points |
0 2 4 6 8 10 12 14 16 18 20 22 24 26 |
|
Линейный предиктор / Linear predictor |
-8-7-6-5-4-3-2-10 1 2 3 4 |
|
РИСК / RISK |
0 1 0 2 0 30 40 50 60 7 0 8 0 9 |
Рис. 8. Номограмма для прогнозирования кардиологических осложнений (V9 – лестничная проба, V15 – фракция выброса левого желудочка, V16 – ИМТ, V17 – гипертоническая болезнь)
Fig. 8. Nomogram for predicting cardiac complications (V9 – stair climbing test, V15 – left ventricular ejection fraction, V16 – ИМТ, V17 – hypertonic disease)
Тестирование
AUC (на тестовой выборке): 0,92 (95 % ДИ: 0,88–0,97).
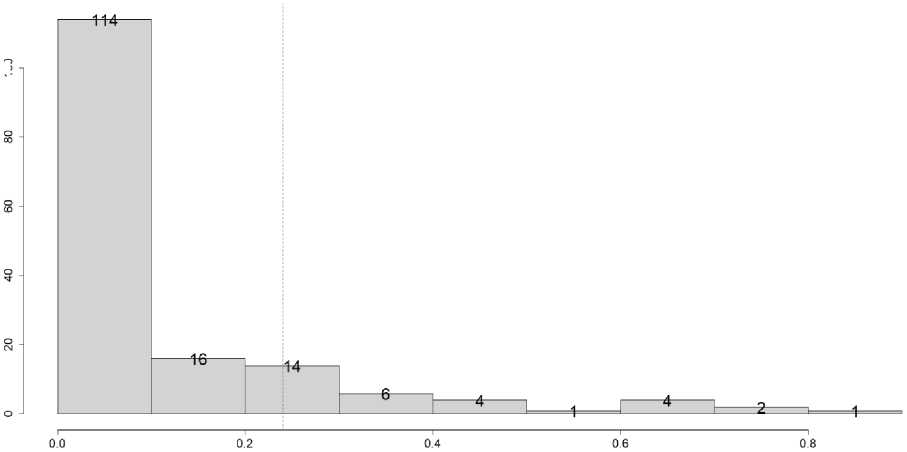
Рис. 9. Диаграмма распределения вероятностей прогноза исхода кардиологических осложнений на тестовой выборке
Fig. 9. Probability distribution diagram for predicting cardiac complication outcome on the test sample
Таблица 6
Table 6
Метрики модели для кардиологических осложнений при эмпирическом пороге вероятности исхода >0,4
Model metrics for cardiac complications, empirical threshold for outcome probability >0.4
|
Предсказанный исход Predicted outcome |
Истинный исход True outcome |
|
|
Нет / No |
Да / Yes |
|
|
Нет / No |
130 |
11 |
|
Да / Yes |
2 |
19 |
Характеристики матрицы ошибок: точность – 0,91; чувствительность – 0,63; специфичность – 0,98; положительная прогностическая ценность – 0,9; отрицательная прогностическая ценность – 0,92; F-мера – 0,74. Диагностические метрики можно признать достаточно хорошими. Модель обладает высокой специфичностью и умеренной чувствительностью. Чувствительность снижена из-за числа ложноотрицательных результатов (~8 % от всех отрицательных прогнозов модели).
Обсуждение. Известно, что рак легкого – наиболее частая причина смерти у мужчин в мире и вторая по частоте причина смерти у женщин [1]. Помимо рецидива опухоли и метастазирования, фатальным фактором для больных раком легкого являются осложнения в послеоперационном периоде.
В этом исследовании мы ретроспективно проанализировали данные 162 пациентов, которым была выполнена лобэктомия по поводу немелкоклеточного рака легкого, по 18 периоперационным параметрам. Частота кардиологических осложнений составила 13 %, респираторных – 17 %. Были разработаны модели для прогнозирования риска развития кардиологических и респираторных осложнений. Номограммы содержат 2 переменных при расчёте респираторных осложнений и 4 – при расчёте кардиологических осложнений, продемонстрирована хорошая дискриминация и калибровка как в обучающей, так и в проверочной выборке.
Острая сердечная недостаточность и мерцательная аритмия часто сосуществуют и взаимозависимы. Фибрилляция предсердий является наиболее частым кардиологическим осложнением при операциях по поводу рака легкого, ее причиной может быть повышение уровня гормонов стресса, вызванное травматичностью хирургического вмешательства и способствующее развитию неблагоприятных сердечных событий [9]. Большинство хирургических манипуляций (особенно с монопо-лярной электрокоагуляцией) при систематической ипсилатеральной медиастинальной лимфодиссекции выполняется в областях ветвей n. vagus, в частности в области сердечного сплетения и вблизи легочных вен, и может стимулировать развитие аритмии и другие кардиологические нарушения [10].
При анализе результатов кардиологических осложнений было определено, что 10 параметров из 18 имеют статистическую значимость, однако при построении логистической регрессии только 4 были включены в прогностическую модель: лестничная проба, фракция выброса, ИМТ, давление в легочной артерии.
Лестничная проба (подъем по лестнице) – функциональное обследование, рекомендуемое при подготовке пациентов к хирургическому вмешательству по поводу рака легкого [11]. Во время этого теста пациент поднимается по лестнице (как правило, высота одной ступеньки составляет 11 см), и проводится замер высоты подъема. В исследовании A. Bru- nelli et al. было установлено, что пациенты, поднимающиеся менее чем на 12 м (3 этажа), в два раза чаще страдают осложнениями после хирургического вмешательства на легких, при этом смертность среди них возрастает в 13 раз, а затраты на их лечение – в 2,5 раза по сравнению с пациентами, которые могут подняться на 22 м (5 этажей) [12].
В последнее время были опубликованы сообщения, указывающие на значимость скорости подъема по лестнице в отношении частоты развития осложнений после операций резекции легкого. В этих исследованиях было продемонстрировано, что подъем на 20 м за 80 с (скорость ≥15 м/мин) хорошо коррелирует с максимальным количеством кислорода, которое организм человека способен потребить во время нагрузки за 1 мин (VO2 max). Все пациенты, достигшие результата менее 80 с, имели VO2 max выше 20 мл/кг/мин [13]. На снижение фракции выброса левого желудочка (ФВЛЖ) приходится примерно половина диагнозов сердечной недостаточности. Наличие сниженной ФВЛЖ подтверждает наличие и стадию сердечной недостаточности [14]. В ранее проведенных исследованиях было показано, что это важный и независимый фактор риска для пациентов, перенесших вне-сердечные операции, даже при отсутствии симптомов сердечной недостаточности [15].
Ожирение, особенно абдоминальное, оказывает значительное давление на дыхательную систему. Ожирение живота и распределение жировой ткани в области грудной клетки уменьшает объем легких и ухудшает механику грудной клетки [16]. Все это приводит в конечном итоге к снижению функционирования легких и неадекватному газообмену. В раннем послеоперационном периоде после лобэктомии на фоне болевого синдрома и ожирения у больного возникает нарушение механики дыхания и кашля, что в свою очередь способствует снижению эффективности выведения мокроты, развитию застойных явлений в легких. После лобэктомии сердечно-легочная функция более уязвима, что повышает частоту сердечнолегочных осложнений. В своем исследовании O.A. Bamgbade et al. показали, что ожирение является независимым фактором риска перио- перационной заболеваемости при сравнении частоты и тяжести осложнений у хирургических пациентов с ожирением и без него [17]. Точно так же De Jong et al. сообщили, что морбидное ожирение (ИМТ>40) является одним из наиболее важных предикторов 30-дневной заболеваемости после операции [18].
Частота встречаемости АГ в нашем исследовании составила 42,6 % и 81 % в группе без осложнений и в группе с гладким послеоперационным периодом соответственно. Международное общество гипертонии (ISH) опубликовало собственные глобальные практические рекомендации, разделив пациентов с АГ на три категории [19]. Среди них пациенты из группы высокого риска имеют очень низкую толерантность к стрессовым реакциям на различные неблагоприятные раздражители. У пожилых пациентов с первичной гипертензией артериальное давление действует чрезвычайно долго в ответ на раздражители, вызывающие вазоконстрикцию, такие как боль и гипоксемия. Затем может произойти внезапное и сильное повышение артериального давления во время выхода из наркоза [20], все это в значимой мере способно спровоцировать дальнейшие неблагоприятные явления сердечнососудистой системы.
При построении номограммы производится суммирование набранных баллов, которые соответствуют вероятности исхода (риску) от 0 до 1. Было выделено 3 интервала: 0–0,3, 0,3–0,7, >0,7, в зависимости от которых мы могли оценить риск развития кардиологических осложнений и принять комплексные меры по мониторингу и купированию возникновения данного вида осложнения.
Пациенты с раком легкого, как правило, пожилого возраста, курят в анамнезе и имеют сопутствующие сердечно-сосудистые или респираторные заболевания, и эти факторы повышают риск возникновения послеоперационных респираторных осложнений [21]. В последнее десятилетие, несмотря на значительное развитие хирургии, разработку и проведение комплексных мероприятий по уходу за больными в послеоперационном периоде, частота осложнений по-прежнему остается на уровне 20–30 %.
При анализе таблицы респираторных осложнений было определено, что значимыми прогностическими параментрами являются челночный ход и лестничная проба. Проведение и анализ лестничной пробы осуществлялись также, как при оценке кардиологических осложнений.
Челночный ход представляет собой функциональную пробу, при которой пациент проходит между двумя точками, находящимися на расстоянии 10 м друг от друга, с возрастающей скоростью, заданной звуковым сигналом, характерным для теста. Расстояние, пройденное во время этого теста, хорошо коррелирует с VO2 max [22]. Предыдущие исследования рекомендовали 250 м в качестве порогового значения, при снижении которого частота развития осложнений после резекции легкого значимо возрастает [23].
Таким образом, мы построили и утвердили относительно точные клинические номограммы, которые продемонстрировали адекватное различение и калибровку при прогнозировании индивидуального риска развития кардиологических и респираторных осложнений у больных после лобэктомии. Наши результаты подчеркивают потенциал этих номограмм для улучшения индивидуального принятия клинических решений в отношении послеоперационного ведения данной категории пациентов.
Заключение. Использование предложенных номограмм у больных после лобэктомии позволяет выявлять группу высокого риска и принимать необходимые комплексные меры по предупреждению и купированию кардиологических и респираторных осложнений.
Список литературы Прогностические модели оценки риска развития послеоперационных кардиологических и респираторных осложнений у больных раком легкого
- Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018; 68: 394-424.
- Semeraro G.C., Meroni C.A., Cipolla C.M., Cardinale D.M. Atrial Fibrillation after Lung Cancer Surgery: Prediction, Prevention and Anticoagulation Management. Cancers (Basel). 2021; 13 (16): 4012. DOI: 10.3390/cancers13164012.
- Алексин А.А., Хороненко В.Э., Пикин О.В., Шеметова М.М. Влияние факторов хирургической агрессии на частоту послеоперационной фибрилляции предсердий у больных со злокачественными опухолями легких. Онкология. Журнал им. П.А. Герцена. 2015; 4 (3): 28-34. DOI: https://doi.org/10.17116/onkolog20154328-34.
- Guha A., DeyA.K., JneidH., Ibarz J.P., Addison D., FradleyM. Atrial Fibrillation in the Era of Emerging Cancer Therapies. Eur Heart J. 2019; 40 (36): 3007-3010. DOI: 10.1093/eurheartj/ehz649.
- Koshy A.N., Hamilton G., Theuerle J., The A.W., Han H.C., Gow P.J., Lim H.S., Thijs V., Farouque O. Postoperative Atrial Fibrillation Following Noncardiac Surgery Increases Risk of Stroke. Am. J. Med. 2020; 133: 311-322. DOI: 10.1016/j.amjmed.2019.07.057.
- MaoX., Zhang W., Ni Y.Q., Niu Y., JiangL.Y. A Prediction Model for Postoperative Pulmonary Complication in Pulmonary Function-Impaired Patients Following Lung Resection. J Multidiscip Healthc. 2021; 14: 3187-3194. DOI: https://doi.org/10.2147/JMDH.S327285.
- Brunelli A., Kim A. W., Berger K.I., Addrizzo-Harris D.J. Physiologic evaluation of the patient with lung cancer being considered for resectional surgery: diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013; 143: e166s-e190s.
- Grant S. W., Collins G.S., Nashef S.A.M. Statistical Primer: developing and validating a risk prediction model. Eur J Cardiothorac Surg. 2018; 54 (2): 203-208. DOI: 10.1093/ejcts/ezy180.
- Yamaji M., Tsutamoto T., Kawahara C., Nishiyama K., Yamamoto T., Fujii M., Horie M. Serum Cortisol as a useful predictor of cardiac events in patients with chronic heart failure: the impact of oxidative stress. Circulation: Heart Failure. 2009; 2 (6): 608-615.
- Al Turki A., Marafi M., Proietti R., Cardinale D., BlackwellR., Dorian P., Bessissow A., Vieira L., GreissI., Essebag V., Healey J.S., Huynh T. Major Adverse Cardiovascular Events Associated With Postoperative Atrial Fibrillation After Noncardiac Surgery: A Systematic Review and Meta-Analysis. Circ Arrhythm Electrophysiol. 2020; 13 (1): e007437. DOI: 10.1161/CIRCEP.119.007437.
- Van Nostrand D., Kjelsberg M.O., Humphrey E. W. Preresectional evaluation of risk from pneumonectomy. Surg Gynecol Obstet. 1968; 127: 306-312.
- Brunelli A., Refai M., Xiume F., Xiumé F., Salati M., Sciarra V., Socci L., Sabbatini A. Performance at symptom limited stair-climbing test is associated with increased cardiopulmonary complications, mortality, and costs after major lung resection. Ann Thorac Surg. 2008; 86: 240-247.
- Bernansconi M., Koegelenberg C.F., von Groote-Bidlingmaier F., Maree D., BarnardB.J., Diacon A.H., Bolliger C.T. Speed of ascent during stair climbing identifies operable lung resection candidates. Respiration. 2012; 84: 117-122.
- Hunt S.A., Baker D.W., Chin M.H., Cinquegrani M.P., Feldman A.M., Francis G.S., Ganiats T.G., Goldstein S., Gregoratos G., Jessup M.L., Noble R.J., Packer M., Silver M.A., Stevenson L.W., Gibbons R.J., Antman E.M., Alpert J.S., Faxon D.P., Fuster V., JacobsA.K., Hiratzka L.F., RussellR.O., Smith S.C. Jr. American College of Cardiology/American Heart Association. ACC/AHA guidelines for the evaluation and management of chronic heart failure in the adult: executive summary. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to revise the 1995 Guidelines for the Evaluation and Management of Heart Failure). J Am Coll Cardiol. 2001; 38 (7): 2101-2013. DOI: 10.1016/s0735-1097(01)01683-7.
- Lerman B.J., Popat R.A., Assimes T.L., Heidenreich P.A., Wren S.M. Association of Left Ventricular Ejection Fraction and Symptoms with Mortality after Elective Noncardiac Surgery among Patients with Heart Failure. JAMA. 2019; 321 (6): 572-579.
- Eichler L., Truskowska K., Dupree A., Busch P., Goetz A.E., Zöllner C. Intraoperative ventilation of morbidly obese patients guided by transpulmonary pressure. Obes Surg. 2018; 28: 122-129.
- Bamgbade O.A., Rutter T.W., Nafiu O.O., Dorje P. Postoperative complications in obese and nonobese patients. World J Surg. 2007; 31: 556e560.
- De Jong A., Verzilli D., Chanques G., Futier E., Jaber S. Preoperative risk and perioperative management of obese patients. Rev Mal Respir. 2019; 36: 985-1001.
- Unger T., Borghi C., Charchar F., Khan N.A., Poulter N.R., Prabhakaran D., Ramirez A., Schlaich M., Stergiou G.S., TomaszewskiM., WainfordR.D., Williams B., Schutte A.E. International Society of Hypertension Global Hypertension Practice Guidelines. Hypertension. 2020; 75 (6): 1334-1357. DOI: 10.1161/HYPERTENSIONAHA. 120.15026.
- Wen W., Luo R., TangX., TangL., HuangH.X., WenX., Hu S., PengB. Age-related progression of arterial stiffness and its elevated positive association with blood pressure in healthy people. Atherosclerosis. 2015; 238 (1): 147-152. DOI: https://doi.org/10.1016/j.atherosclerosis.2014.10.089.
- Багров В.А., Рябов А.Б., Пикин О.В., Колбанов К.И., Глушко В.А., Вурсол Д.А., Амиралиев А.М., Рудаков Р.В., Бармин В.В. Осложнения после торакоскопической лобэктомии у больных со злокачественными опухолями легких. Онкология. Журнал им. П.А. Герцена. 2018; 7 (4): 26-33. DOI: https://doi.org/10.17116/onkolog20187426.
- Singh S.J., Morgan M.D., Hardman A.E., Rowe C., Bardsley P.A. Comparison of oxygen uptake during a conventional treadmill test and the shuttle walking test in chronic airflow limitation. Eur Respir J. 1994; 7: 2016-2020.
- Trzaska-SobczakM., SkoczynskiS., Pierzchaia W. Pulmonary function tests in the preoperative evaluation of lung cancer surgery candidates. A review of guidelines. Kardiochir Torakochirurgia Pol. 2014; 11 (3): 278-282. DOI: 10.5114/kitp.2014.45677.


