Прогнозирование эмбриопродуктивности коров-доноров на основании эхографической характеристики яичников
Автор: Бригида А.В., Сорокин В.И., Ковальчук Светлана Николаевна, Пантюх К.С., Рукин И.В., Рожин К.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Репродуктивные биотехнологии
Статья в выпуске: 4 т.53, 2018 года.
Бесплатный доступ
Одно из основных ограничений широкого применения биотехнологий репродукции для ускоренного воспроизводства крупного рогатого скота - недостаточно разработанные методы отбора коров-доноров при трансплантации эмбрионов. Объективная причина заключается в вариабельности ответа яичников на введенные гонадотропины. Достоверная информация о возможности прогнозировать эмбриопродуктивность коров-доноров на этапе до введения гонадотропных препаратов до сих пор отсутствует, что существенно снижает экономическую эффективность этого биотехнологического приема. Мы применили постпрессинговую обработку эхограмм яичников для прогнозирования эмбриопродуктивности коров-доноров, сравнив ее количественные и качественные показатели при индукции суперовуляции в зависимости от эхографической характеристики яичников. Морфофункциональное состояние яичников коров-доноров (n = 30) оценивали на 10-е сут полового цикла, перед осеменением (эструс) и на 7-е сут индуцированного полового цикла, непосредственно перед извлечением эмбрионов с учетом данных постпрессинговой морфометрии яичников...
Корова, яичники, эструс, эхография, морфометрические показатели, полиовуляция, эмбрионы, эмбриопродуктивность
Короткий адрес: https://sciup.org/142216575
IDR: 142216575 | УДК: 636.2:636.082:618 | DOI: 10.15389/agrobiology.2018.4.753rus
Текст научной статьи Прогнозирование эмбриопродуктивности коров-доноров на основании эхографической характеристики яичников
Увеличение поголовья крупного рогатого скота (КРС) существенно ограничено малоплодием и длительной беременностью. При этом самки КРС обладают огромным генеративным потенциалом — сотнями тысяч яйцеклеток, и лишь незначительная их часть реализуется до конца хозяйственного пользования животного (1).
Трансплантация эмбрионов как биотехнология ускоренного воспроизводства открывает огромные возможности в реализации репродуктивнобиологического потенциала животных с заданными фенотипическими и генотипическими характеристиками и последующего максимального тиражирования их в стадах реципиентов с наименее ценными показателями (2-
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации — поддержка прикладных научных проектов по Соглашению ¹ 14.579.21.0147 о предоставлении субсидии, уникальный идентификатор работ (проекта) RFMEFI57917X0147.
-
6) . Несмотря на успехи в технологии трансплантации, актуальными остаются вопросы изыскания методов отбора доноров и реципиентов, индукции суперовуляции с более высоким выходом эмбрионов, снижения трудоемкости процесса и стрессового воздействия на животных (7-9).
Технология трансплантации эмбрионов включает много этапов (10). На первом необходим отбор коров-доноров (11) для последующей индукции полиовуляторной реакции яичников (12, 13). Обычно на этом этапе главное внимание уделяется племенной ценности и гинекологическому здоровью животного, но не прогнозированию индивидуальной реакции яичников на введенные гонадотропные препараты. В то же время именно от выбора доноров эмбрионов зависит эффективность следующих этапов и экономическая целесообразность процедуры трансплантации в целом (14).
Вариабельность реакции яичников коров на экзогенные гонадотропные препараты приводит к исключению примерно 30 % обработанных животных из группы доноров вследствие отсутствия полиовуляторного ответа на введенные гонадотропины (15). Именно высокая вариабельность делает полиовуляторный ответ яичников трудно предсказуемым (16, 17) и служит основным ограничением практического применения эмбриотрансплантации. При этом до сих пор нет достоверной информации о возможности прогнозировать эмбриопродуктивность у коров-доноров до введения гонадотропных препаратов, что существенно сказывается на экономической эффективности такой процедуры ускоренного воспроизводства КРС.
Анализ данных литературы свидетельствует, что на результативность реакции яичников коров — доноров эмбрионов экзогенные гонадотропины влияют многие факторы (18). Основными называют породные и физиологические особенности животных (19, 20), особенности метаболического (21) и гормонального статуса (22-25), генетическую предрасположенность (26-30), экологические и климатические условия содержания (31, 32). При всей множественности причин наиболее удобный объект для прогнозирования эмбриопродуктивности коров — яичники (33-35).
Ультразвуковую эхографию рассматривают как перспективный метод оценки морфофункционального состояния яичников при трансплантации эмбрионов (36). Такое обследование легко воспроизводить в производственных условиях, оно малоинвазивно и позволяет получить достаточно полную и объективную информацию в режиме реального времени.
Мы впервые использовали постпрессинговую морфометрию структур яичников для прогнозирования суперовуляторной реакции до введения гонадотропинов и на этой основе предложили экспресс-метод отбора коров для получения эмбрионов. Апробация метода показала его перспективность для оценки эмбриопродуктивности коров.
Целью исследования было сравнение данных эхографического обследования яичников, эмбриопродуктивности и эмбриосбора для разработки способа оценки ожидаемой суперовуляторной реакции и выявления перспективных доноров эмбрионов.
Методика . Исследование выполнено на поголовье коров породы казахская белоголовая (ООО «Племзавод Димитровский», Илекский р-н, Оренбургская обл.). В качестве доноров ( n = 30) отбирали клинически здоровых особей без признаков нарушения обмена веществ (ожирение, дистрофия и т.д.) при наличии данных о происхождении не менее чем по трем рядам предков, с крепкой конституцией и оценкой экстерьера не менее 8 баллов, живой массой не ниже стандарта породы, в возрасте 3-6-го отелов, с подтвержденной достоверностью происхождения (по группам крови), с первыми проявлениями охоты в срок до 50 сут после отела, легким 754
отелом и неосложненным течением послеродового периода; индекс осеменения — 1,2-1,5, состояние матки и яичников нормальное (по результатам ректогенитального обследования методом эхографической визуализации в режиме реального времени и эндоректальной пальпации репродуктивных органов). Все коровы прошли обследование на инфекционные заболевания (бруцеллез, туберкулез, вирусные респираторные заболевания, лейкоз, трихомоноз, вибриоз, ящур и др.). По итогам животных разделили на три группы (по n = 10) в зависимости от длины желтого тела (I, II и III — соответственно от 2,5; 1,5-2,5 и менее 1,5 см).
Морфофункциональную оценку яичников коров проводили в динамике (с учетом данных постпрессинговой морфометрии яичников) — на 10-е сут полового цикла до введения фолликулостимулирующих препаратов, перед осеменением (эструс) при множественных созревших доминантных фолликулах и на 7-е сут индуцированного полового цикла с полиову-лятороной реакцией яичников и наличием множественных желтых тел на поверхности яичников (непосредственно перед извлечением эмбрионов).
Для эндоректальной эхографической визуализации яичников использовали УЗИ-сканеры Tringa Linear («ESA OTES p.A», Италия) и Kaixin KX5200 («Xuzhou Kaixin Electronic Instrument Co., Ltd», Китай) с линейными датчиками (рабочая частота — 7,5 МГц); фиксировали черно-белые эхографические изображения репродуктивных органов. При постпрессинговой морфометрии эхографические изображения обрабатывали с использованием графического редактора ImageJ (National Institute of Health, США). Определяли длину, ширину и площадь яичников и желтых тел как параметры функциональной активности. Показатели рассчитывали с учетом длины прямого отрезка, ломаной линии, длины окружности неправильной формы, площади геометрической фигуры, угла проекции двух отрезков. Схематично отображали проекции структур на эхограмме. Площадь яичника и желтого тела определяли по формуле для эллипсоида: S = Rr, где R и r — соответственно большая и малая полуоси.
Половой цикл коров индуцировали Эстрофаном («Bioveta», Чехия) — препаратом простагландинового ряда F2a в дозе 2 мл/гол. (1-кратная внутримышечная инъекция), полиовуляторную реакцию яичников — препаратом ФСГ-супер (Россия) при 8-кратном введении с интервалом 12 ч (утро-вечер) в убывающих дозах (50 АЕ, 3; 3; 2,5; 2,5; 2; 2; 1,5; 1,5 мл/гол.).
Для искусственного осеменения использовали свежую сперму выдающихся быков-производителей, проверенных по качеству потомства и признанных улучшателями по таким признакам, как легкость отела и молочная продуктивность. Спермодозы соответствовали ГОСТ 26030-2015 (основные показатели: доля сперматозоидов с прямолинейно-поступательным движением — не менее 40 %, их число в одной дозе — 15 млн; объем дозы для осеменения — не менее 0,2 см3; жизнеспособность сперматозоидов при 38 ° С — не менее 5 ч). Подбор производителей и коров-доноров вели в соответствии с планом селекционно-племенной работы в хозяйстве.
Эмбрионы извлекали методом шприцевания (нагнетание жидкости в изолированную часть рога матки с помощью шприца, который подсоединен к 2-канальному катетеру, предварительно введенному в рог матки) на 7-е сут после осеменения. Использовали гибкие промывочные катетеры Neustadt Aisch/Rusch СН18 с четырьмя портами («Minitube», Германия). Для фильтрации промывочной жидкости и сбора эмбрионов применяли фильтры для КРС Em Guard («Minitube», Германия).
Для определения морфологического состояния эмбрионов их просматривали под микроскопом Биолам (АО «ЛОМО», Россия, увеличение
½60-100). Учитывали соответствие стадиям развития, форму зоны пеллюци-да и ее целостность, равномерность дробления бластомеров и общее состояние цитоплазмы.
При статистической обработке результатов рассчитывали средние ( M ) и их стандартные ошибки (±SEM). Данные обрабатывали с использованием пакета программы Microsoft Excel 2010 и Statistica 6 («StatSoft, Inc.», США). Достоверность различий сравниваемых показателей оценивали по t -критерию Стьюдента, считая их статистически значимыми при р ≤ 0,05.
Результаты . Пример использования эхографических изображений при морфометрической оценке состояния яичников коров иллюстрирует рисунок 1.
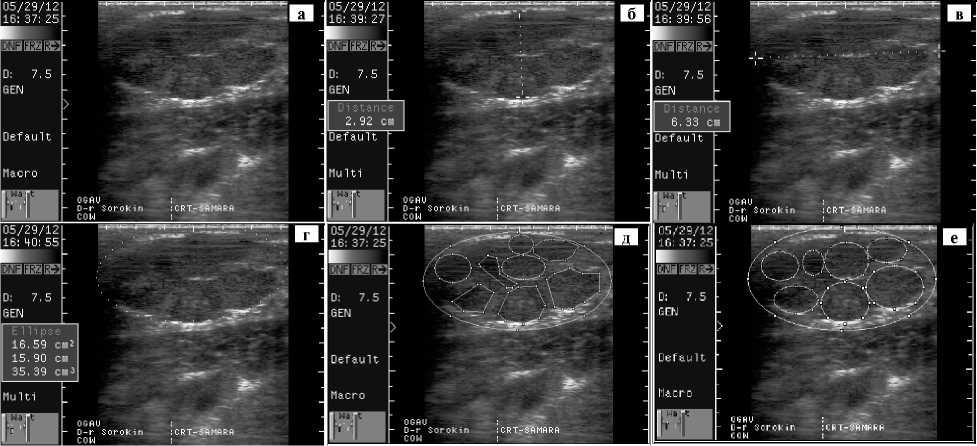
Рис. 1. Пример обработки эхографического изображения яичника коровы — донора эмбрионов ¹ 12764 (казахская белоголовая порода) при оценке полиовуляторной реакции: а — исходное изображение; б — высота яичника, в — ширина яичника, г — окружность яичника, д — границы изображенных структур, выраженные ломаными линиями окружности неправильных форм, е — проекция изображенных структур на эхограмме (сагиттальная плоскость сканирования, б-е — обработка изображений в графическом редакторе ImageJ).
Для прогнозирования ответа яичников на введенные гонадотропные препараты оценивали эмбриопродуктивность коров-доноров с помощью анализа морфометрических показателей яичников и желтых тел с последующей постпрессинговой обработкой эхограмм репродуктивных органов коров, полученных на 10-е сут полового цикла. Измерение длины, ширины яичников и желтых тел позволило нам определить их площадь, соотношение размеров желтого тела и яичника.
Результаты морфометрии линейных размеров, площади яичников и желтых тел коров-доноров представлены в таблице 1.
-
1. Морфометрические показатели яичников и желтого тела у коров — доноров эмбрионов на 10-е сут полового цикла без индукции полиовуляции ( M ±SEM, порода казахская белоголовая, ООО «Племзавод Димитровский», Оренбургская обл., 2017 год)
2. Соотношение площади яичников и желтых тел у коров — доноров эмбрионов на 10-е сут полового цикла без индукции полиовуляции
(
M
±SEM, порода казахская белоголовая, ООО «Племзавод Димитровский», Оренбургская обл., 2017 год)
|
Среднее |
Яичники |
Желтое тело |
||||
|
по группе |
длина, см |
ширина, см |
площадь, см2 |
длина, см |
ширина, см |
площадь, см2 |
|
I ( n = 10) |
4,0±0,09 |
2,5±0,11 |
7,9±0,94 |
2,7±0,02 |
2,1±0,14 |
4,5±1,21 |
|
II ( n = 10) |
3,2±0,04 |
2,3±0,34 |
5,7±0,78* |
2,0±0,90 |
1,5±0,08 |
2,4±0,24* |
|
III ( n = 10) |
2,4±0,12 |
1,8±0,04 |
3,5±0,06** |
1,4±0,08 |
1,0±0,00 |
1,1±0,25* |
Прим еч ани е. I, II и III группы — животные с длиной желтого тела соответственно до 2,5; 1,5-2,5 и менее 1,5 см.
*, ** Различия площади яичников в группах II и III по сравнению с группой I статистически значимы соответственно при Р ≤ 0,05 и Р ≤ 0,001.
Наибольшую площадь яичников выявили в I группе, наименьшую — в III группе. Этот показатель у коров из I группы превышал таковой у особей из II (на 2,2 см2, Р ≤ 0,05) и из III группы (на 4,3 см2, Р ≤ 0,001).
Средняя площадь желтых тел тоже варьировала по группам. Так, в I группе показатель был выше аналогичного во II группе на 2,08 см2 (Р ≤ 0,05), в III группе — на 3,43 см2 (Р ≤ 0,05).
|
Среднее |
Площадь, см2 |
Площадь желтого тела |
|
по группе |
яичника желтого тела |
от площади яичника, % |
I ( n = 10) 7,9±0,94 4,5±1,21
II ( n = 10) 5,7±0,78 2,4±0,24
III ( n = 10) 3,5±0,06 1,1±0,25
П р и м е ч а н и е. I, II и III группы
57,1±3,01**
42,1±2,95*
30,2±2,56
— животные с длиной
желтого тела соответственно до 2,5; 1,5-2,5 и менее 1,5 см.
*, ** Различия соотношений площади желтых тел и яичников в
I и II группах по сравнению с III группой статистически значимы соответственно при Р ≤ 0,01 и Р ≤ 0,001.
Мы сравнили соотношение площади желтых тел и яичников у каждого животного и в среднем по группам (табл. 2). Этот расчетный показатель, характеризующий размер функционально активного желтого тела перед индукцией полиовуляции, свидетельствовал о том, что величину яичников формирует размер лютеальной ткани. У животных с наименьшим размером желтого тела его лютеиновые структуры составили всего 30,2 % от размера яичников, что достоверно меньше соответствующих показателей у животных во II и III группах — соответственно на 12,0 (Р ≤ 0,01) и 27,0 см2 (Р ≤ 0,001).
В дальнейшем эхографическую визуализацию яичников проводили во время эструса перед осеменением (0-е сут полового цикла) и перед извлечением эмбрионов на 7-е сут после осеменения. Полученные эхограммы подвергали постпрессинговой обработке для определения динамики изменений, происходящих в яичниках в ответ на стимуляцию ФСГ и экзогенное введение лютеолитических препаратов простагландинового ряда F2a. При этом учитывали морфометрические показатели яичников, число и качественный состава фолликулов и желтых тел, отражающее полиову-ляторную реакцию яичников (рис. 2).
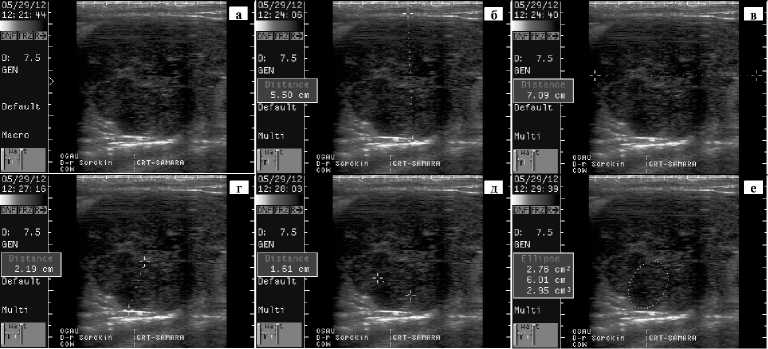
Рис. 2. Эхографическое отображение полиовуляторной реакции яичника у коровы — донора эмбрионов (казахская белоголовая порода) с длиной желтого тела 1,5-2,5 см: а — исходное изображение; б — высота яичника, в — ширина яичника, г — высота желтого тела, д — ширина желтого тела, е — окружность желтого тела (сагиттальная плоскость сканирования, обработка изображений в графическом редакторе ImageJ).
Результаты ректопальпаторного исследования яичников, а также данные, полученные при ультразвуковом сканировании и постпрессинго- вой обработке эхограмм, демонстрируют, что полиовуляторная реакция яичников и эффективность оплодотворения яйцеклеток зависят от каче- ства желтого тела в середине L-фазы (в период, предшествующий началу гонадотропной стимуляции коров-доноров) (табл. 3).
3. Стимуляция полиовуляции и эмбриопродуктивность у коров — доноров эмбрионов в зависимости от соотношения площади желтого тела и яичника ( M ±SEM, порода казахская белоголовая, ООО «Племзавод Димитровский», Оренбургская обл., 2017 год)
|
Среднее |
Площадь желтого тела |
Число |
|
по группе |
от площади яичника, % |
желтых тел эмбрионов |
I ( n = 10) 57,1±3,01 11,6±1,26 9,3±1,23
II ( n = 10) 42,1±2,95 5,7±1,24 4,6±1,01
III ( n = 10) 30,2±2,56 1,8±0,18 0,5±0,02
П р и м еч а ни е. I, II и III группы — животные с длиной желтого тела соответственно до 2,5; 1,5-2,5 и менее 1,5 см.
В I и II группах различия по числу желтых тел и полученных эмбрионов были почти 2-кратными, тогда как в III — оказались ниже практически на порядок (см. табл. 3).
При процессинге полученных данных мы использовали постпрессинговую обработку эхограмм для морфометрической оценки яичников и структур, вовлеченных в фолликулогенез и лютеогенез у коров-доноров. По сообщениям V. Kayacik с соавт. (36), постпрессинговая обработка эхографических изображений указывает на высокую эффектив- ность метода эхографии в морфометрических исследованиях.
Сопоставление данных о размере желтых тел перед индукцией полиовуляции и результатов, характеризующих эффективность проведенной суперовуляции и эмбриосбора, свидетельствуют о том, что у коров с соотношением площади желтого тела и площади яичника более 50 % удается индуцировать активную реакцию яичников с числом желтых тел в среднем 11,6±1,26, эмбрионов на одно извлечение — 9,3±1,23. Отметим, что, по данным ряда авторов (3, 8, 15, 34), средний выход эмбрионов на одно обработанное животное обычно составляет 5-6 шт.
Таким образом, ультразвуковой метод морфометрии яичников высокоинформативен, позволяет объективно оценить их функциональное состояние и прогнозировать эмбриопродуктивность у крупного рогатого скота. Обработка эхограмм в графическом редакторе ImageJ значительно повышает эффективность ультразвуковой визуализации. Показано, что реакция на стимуляцию фолликулостимулирующим гормонов и эмбриосбор зависят от размера желтого тела у потенциальных доноров на 10-е сут полового цикла (без индукции полиовуляции). Это можно использовать в качестве критерия при отборе животных в группу потенциальных доноров эмбрионов. Так, при соотношении площади желтого тела и яичника более 50 % число овулировавших фолликулов и качественных эмбрионов составляет 11,6±1,26 и 9,3±1,23 на особь.
Авторы благодарят специалистов хозяйства ООО «Племзавод Димитровский» (Илекский р-н, Оренбургская обл.) за помощь в выполнении исследований.
Список литературы Прогнозирование эмбриопродуктивности коров-доноров на основании эхографической характеристики яичников
- Анзоров В.А., Шириев В.М., Сергеев Н.И., Титов В.А., Насибов Ф.Н., Байтлесов Е.У. Сравнительная характеристика и оценка жизнеспособности эмбрионов, полученных от здоровых и племенных коров-доноров с разным уровнем молочной продуктивности. Сельскохозяйственная биология, 2005, 6: 37-41.
- Кононов В.П., Черных В.Я. Биотехника репродукции в молочном скотоводстве. М., 2009.
- Baruselli P.S., Vieira1 L.M., Batista E.O.S., Ferreira R.M., Sales J.N.S., Gimenes L.U., Torres-Junior J.R.S., Martins C.M., SáFilho M.F., Bo G.A. Updates on embryo production strategies. Anim. Reprod., 2015, 12(3): 375-382.
- Hopper R.M. Bovine reproduction. Wiley Blackwell, 2015: 696-733.
- Kugonza D.R., Kayitesi A., Semahoro F., Ingabire D., Manzi M., Hirwa C.A., Gahakwa D. Factors affecting suitability of surrogate dams for embryo transfer in cattle. Journal of Animal Science Advances, 2013, 3(4): 203-210 ( ) DOI: 10.5455/jasa.20130430123202
- Vasconcelos J.L.M., Dementrio D.G.B., Santos R.M., Chiari J.R., Rodrigues C.A., Filho O.G. Factors potentially affecting fertility of lactating dairy cow recipients. Therlogenology, 2006, 65: 192-200 ( ) DOI: 10.1016/j.theriogenology.2005.09.030
- Пташинская М. Краткое руководство по репродукции животных. Intervet International BV, 2009.
- Эрнст Л.К., Варнавский А.Н. Репродукция животных. М., 2007.
- Mapletoft J., Garcia Guerra A., Dias F.C.F., Singh J., Adams G.P. In vitro and in vivo embryo production in cattle superstimulated with FSH for 7 days. Anim. Reprod., 2015, 12 (3): 759-388.
- Petroman I., Pacala N., Petroman C., Bencsik I., Orboi M.D., Dronca D., Băneş A. Utilization of gestagen hormones and pituitary FSH extracts in inducing the superovulation at embryo donor cows. Journal of Food Agriculture & Environment, 2009, 7(2): 193-195.
- Воронин Е.С., Петров А.М., Серых М.М., Девришов Д.А. Иммунология. М, 2002.
- Косовский Г.Ю., Попов Д.В., Бригида А.В. Эффективность индукции суперовуляции у коров-доноров эмбрионов при применении различных схем введения препарата фолликулостимулирующего гормона. Ветеринария и кормление, 2016, 5: 29-31.
- Косовский Г.Ю., Попов Д.В., Бригида А.В., Волколупов Г.В. Суперовуляция у коров -доноров эмбрионов калмыцкой породы при применении пролонгированной формы препарата ФСГ. Известия Нижневолжского агроуниверситетского комплекса: наука и высшее профессиональное образование, 2015, 3(39): 106-108.
- Sanchez Z., Lammoglia M.A., Alarcon M.A., Romero J.J., Galina C.S. Is the production of embryos in small-scale farming an economically feasible enterprise? Reprod. Domest. Anim., 2015, 50(4): 574-579 ( ) DOI: 10.1111/rda.12526
- Косовский Г.Ю., Попов Д.В., Бригида А.В., Волколупов Г.В. Эмбриопродуктивность при индукции суперовуляции пролонгированной формой препарата ФСГ-супер коров калмыцкой породы в период воспроизводства. Известия Нижневолжского агроуниверситетского комплекса: наука и высшее профессиональное образование, 2015, 2(38): 148-152.
- Liang A., Salzano A., D'Esposito M., Comin A., Montillo M., Yang L., Campanile G., Gasparrini B. Anti-Mullerian hormone (AMH) concentration in follicular fluid and mRNA expression of AMH receptor in granulose cell as predictive markers of good buffalo (Bubalus bubalis) donors. Theriogenology, 2016, 86(4): 963-970 ( ) DOI: 10.1016/j.theriogenology.2016.03.020
- Rao M.M., Uma Mahesh Y., Misra A.K. Evaluation of ovarian response and embryo production pattern in Ongole cows. Indian Journal of Animal Science, 2010, 80(10): 973-975.
- Baruselli P.S., Batista E.O.S., Vieira L.M., Sales J.N.S., Gimenes L.U., Ferreira R.M. Intrinsic and extrinsic factors that influence ovarian environment and efficiency of reproduction in cattle. Anim. Reprod., 2017, 14(1): 48-60 ( ) DOI: 10.21451/1984-3143-AR907
- Ali M.S., Khandoker M.A.M.Y., Afroz M.A., Bhuiyan A.K.F.H. Ovarian response to different dose levels of follicle stimulating hormone (FSH) in different genotypes of Bangladeshi cattle. Asian-Australasian Journal of Animal Science, 2012, 25(1): 52-58 ( ) DOI: 10.5713/ajas.2011.11167
- Villaseron Gonzaleza F., de la Torre Sanchez J.F., Martinez Velazques G., Gallardo H.A., Reynozo S.P., Fránquez J.A.P., Sojo R.P., Bermúdez M.M. Characterization of the ovarian response to superovulation in Creole Coreno cattle using reduced doses of FSH. Revista Mexicana De Ciencias Pecuarias, 2017, 8(3): 225-232.
- Sartori R., Monteiro P.L.J. Jr., Wiltbank M.C. Endocrine and metabolic differences between Bos taurus and Bos indicus cows and implications for reproductive management. Anim. Reprod., 2016, 13(3): 168-181 ( ) DOI: 10.21451/1984-3143-AR868
- Aziz R.L.A., Khalil A.A.Y., Abdel-Wahab A., Hassan N.Y., Abdel-Hamied E., Kasimanickam R. Relationship among circulating anti-Mullerian hormone, insulin like growth factor 1, cadmium and superovulatory response in dairy cows. Theriogenology, 2017, 100: 72-79 ( ) DOI: 10.1016/j.theriogenology.2017.06.007
- Baruselli P.S., Batista E.O.S., Vieira L.M., Souza A.H. Relationship between follicle population, AMH concentration and fertility in cattle. Anim. Reprod., 2015, 12(3): 487-497.
- Mossa F., Jimenez-Krassel F., Scheetz D., Weber-Nielsen M., Evans A.C.O., Ireland J.J. Anti-Mullerian Hormont (AMH) and fertility management in agricultural species. Reproduction, 2017, 154(1): R1-R11 ( ) DOI: 10.1530/REP-17-0104
- Redhead A.K., Siew N., Lambie N., Carnarvon D., Ramgattie R., Knights M. The relationship between circulating conception of AMH and LH content in the follicle stimulating hormone (FSH) preparations on follicular growth and ovulatory response to superovulation in water buffaloes. Animal Reproduction Science, 2018, 188: 66-73 ( ) DOI: 10.1016/j.anireprosci.2017.11.010
- Yang W.C., Tang K.Q., Li S.J., Yang L. Association analysis between variants in bovine progesterone receptor gene and superovulation traits in Chinese Holstein cows. Reprod. Domest. Anim., 2011, 46(6): 1029-1034 ( ) DOI: 10.1111/j.1439-0531.2011.01780.x
- Yang W.C., Li S.J., Tang K.Q., Hua G.H., Zhang C.Y., Yu J.N., Han L., Yang L.G. Polymorphisms in 5´ upstream region of the FSH receptor gene, and their association with superovulation traits in Chinese Holstein cows. Animal Reproduction Science, 2010, 119(3-4): 172-177 ( ) DOI: 10.1016/j.anireprosci.2010.02.004
- Yang W.C., Tang K.Q., Li S.J., Chao L.M., Yang L.M. Polymorphisms of the bovine luteinizing hormone/choriogonadotropin receptor (LHCGR) gene and its association with superovulation traits. Molecular Biology Reports, 2012, 39(3): 2481-2487 ( ) DOI: 10.1007/s11033-011-0999-4
- Yang W.C. Li S.J., Xie Y.H., Tang K.Q., Hua G.H., Zhang C., Yang L.G. Two novel SNPs of the type I gonadotropin releasing hormone receptor gene and their associations with superovulation traits in Chinese Holstein cows. Livestock Science, 2011, 136: 164-168 ( ) DOI: 10.1016/j.livsci.2010.08.012
- Yu Y., Pang Y., Zhao H., Xu X., Wu Z., An L., Tian J. Association of a missense mutation in the luteinizing hormone/choriogonadotropin receptor gene (LHCGR) with superovulation trains in Chinese Holstein heifers. Journal of Animal Science and Biotechnology, 2012, 3(1): 35 ( ) DOI: 10.1186/2049-1891-3-35
- Bezdicek J., Makarevich A., Stadnik A., Kubovičová E., Louda F., Hegedüšová Z., Holásek R., Ducháček J., Stupka R. Analysis of factors affecting the quantity and quality of embryo production in superovulated cows. Zuchtungskunde, 2015, 87(4): 249-264.
- Mehmood M.U., Mehmood S., Riaz A., Ahmad N., Sattar A. Superovulatory response in Summer anestrus Buffaloes and cattle treated with estrus synchronization protocol. Journal of Animal and Plant Science, 2012, 22(4): 888-893.
- Глазко Т.Т., Косовский, Г.Ю., Попов Д.В., Бригида А.В. Взаимосвязь геномной нестабильности и эмбриопродуктивности у коров-доноров эмбрионов. Ветеринария Кубани, 2015, 6: 9-11.
- Косовский, Г.Ю., Попов Д.В., Бригида А.В. Методы корректировки индукции суперовуляции с целью получения оптимального количества эмбрионов, пригодных к трансплантации. Ветеринария Кубани, 2015, 5: 15-17.
- Tomac J., Cekinovich D., Arapovic J. Biology of the corpus luteum. Periodicum Biologorum, 2011, 113(1): 43-49.
- Kayacik V., Salmanoglu M.R., Polat B., Ozluer A. Evaluations of the corpus luteum size throughout the cycle by ultrasonography and progesterone assay in cows. Turk. J. Vet Anim Sci., 2005, 29: 1311-1316.


