Прогнозирование риска развития протромбогенной готовности при инфекции COVID-19 с использованием генетического тестирования
Автор: Воробьева Н.А., Воробьева А.И., Воронцова А.С.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Оценка риска в здравоохранении
Статья в выпуске: 2 (42), 2023 года.
Бесплатный доступ
Инфекция COVID-19 представляет особую опасность в отношении развития декомпенсации исходных хронических заболеваний, специфического поражения сердечно-сосудистой системы, высокого риска развития неблагоприятных исходов в виде тромботических событий. Патогенез коронавирусной инфекции сложен и до сих пор не изучен, что во многом зависит от особенностей вируса и исходного состояния системы гемостаза пациента. Осуществлен анализ молекулярно-генетических маркеров системы гемостаза у пациентов с новой коронавирусной инфекцией COVID-19 как прогностического триггера риска развития протромботической готовности. Объект исследования - госпитализированные пациенты с инфекцией COVID-19. Проведен молекулярно-генетический анализ основных генов факторов системы гемостаза - факторы V (rs6025), II (rs1799963), I (rs1800790), VII (rs6046), XIII A1 (rs5985)), IGN A2 (rs1126643), IGN B3 (rs5918), PAI-1 (rs1799889). Оценка степени выраженности тромбинемии определялась с помощью теста генерации тромбина на автоматическом коагулометре Ceveron®alpha с TGA-модулем. Полиморфизм в генах PAI-1, протромбина (FII), фибриногена (FI) определял высокий уровень тромбинемии по показателям теста кинетики тромбина (эндогенного тромбинового потенциала (AUC), пиковой концентрации тромбина (Peak thrombin), времени достижения пика генерации тромбина (tPeak), уровня фибриногена и D-димера у пациентов с COVID-19 в течение всего периода госпитализации. Показано, что повышенная генерация тромбина, проявляющаяся повышенным уровнем эндогенного тромбинового потенциала (AUC), может являться прогностическим признаком протромботического состояния у пациентов с генетическим полиморфизмом в генах PAI-1 и фибриногена. Полученные результаты свидетельствуют о генетической детерминации состояния протромботической готовности при наличии у пациентов с новой коронавирусной инфекцией аллельных вариантов в генах PAI-1, протромбина (фактора II) и фибриногена (фактора I).
Covid-19, генотип, риск, мутация, тромбинемия, полиморфизм, тромбин, тромбоз
Короткий адрес: https://sciup.org/142239893
IDR: 142239893 | УДК: 616.13+575.1 | DOI: 10.21668/health.risk/2023.2.12
Текст научной статьи Прогнозирование риска развития протромбогенной готовности при инфекции COVID-19 с использованием генетического тестирования
многом зависит от особенностей самого вируса и исходного состояния системы гемостаза пациента [2]. Известно, что провоспалительные цитокины при инфекции COVID-19 стимулируют экспрессию тканевого тромбопластина на иммунных клетках и инициируют активацию свертывания крови. Дисфункция эндотелия, вызванная воспалением, дополнительно ускоряет протромботическую готовность, повышенную генерацию тромбина, угнетает активность фибринолиза за счет уменьшения активности активатора плазминогена урокиназного типа и повышения высвобождения ингибитора активатора плазминогена 1-го типа (PAI-I) [3–7].
В настоящее время активно рассматриваются вопросы генетической предрасположенности к тяжелому течению коронавирусной инфекции. Так, ранее было показано, что изменения в гене ангио-тензинпревращающего фермента 2 (АПФ2), меняющие структуру данного рецептора могут облегчить или усложнить вирусу проникновение в клетку. Существуют отдельные данные, свидетельствующие, что дефицит функции белка ApoE при SARS-CoV-2 может способствовать прогрессированию заболевания и развитию ряда осложнений, обсуждается влияние генов гистосовместимости 1-го типа на течение ковид-инфекции [8–11].
При этом важно отметить, что роли наследственной тромбофилии высокого риска при инфекции, вызванной вирусом SARS-CoV-2, не уделяется должного внимания. Ранее было показано, что наследственно детерминированные тромбофилии высокого риска, такие как мутация фактора II (протромбина), фактора V Лейдена, а также аллельные варианты в гене PAI-1, могут не проявлять себя в течение всей жизни, но при таких триггерах, как травма, тяжелая инфекция, сепсис, беременность, могут манифестировать органными нарушениями, прогрессированием тромбинемии, тромбозами различной локализации, а в тяжелых случаях – развитием синдрома полиорганной недостаточности (СПОН) [7, 12, 13]. Следует отметить, что результаты молекулярно-генетического анализа для выявления протромбогенного полиморфизма в генах системы гемостаза могут влиять на интенсивность и длительность антитромботической терапии [7, 14–16].
В настоящее время используемые и доступные лабораторные тесты не позволяют объективно и достоверно прогнозировать риск развития и тяжесть состояния тромбинемии при инфекции COVID-19 на фоне генетической предрасположенности и, как следствие, выбрать соответствующий оптимальный режим антитромботической профилактики или терапии.
Цель исследования – анализ молекулярногенетических маркеров системы гемостаза у пациентов с новой коронавирусной инфекцией COVID-19
как прогностического триггера риска развития про-тромботической готовности.
Материалы и методы. Проспективное клинико-лабораторное исследование выполнено в период пандемии COVID-19 (апрель 2020 г. – май 2021 г.) на базе Регионального центра антитромботической терапии ГБУЗ АО «Первая городская клиническая больница им. Е.Е. Волосевич» (г. Архангельск) с включением 100 пациентов со среднетяжелым и тяжелым течением новой коронавирусной инфекции.
Критериями включения в исследование явились: подтвержденная методом ПЦР-анализа инфекция COVID-19; госпитализация в ковидное отделение; письменное добровольное информированное согласие на участие в исследовании; возраст старше 18 лет. Критерии невключения: отказ от участия в исследовании; возраст младше 18 лет. Дизайн исследования был одобрен локальным этическим комитетом Северного государственного медицинского университета (протокол № 2/20 от 23.04.2020).
Лабораторные исследования выполнены на базе Регионального центра антитромботической терапии и бактериологической лаборатории ГБУЗ АО «Первая ГКБ им. Е.Е. Волосевич» (Архангельск). Отбор образцов плазмы осуществляли трижды: первая точка – при госпитализации пациента в стационар до назначения антитромботической терапии, вторая точка – на 3–5-е сутки госпитализации на фоне антитромботической терапии низкомолекулярными гепаринами (НМГ), третья – на 9–10-е сутки госпитализации на фоне антитромботической терапии НМГ.
Материалом для молекулярно-генетического анализа протромбогенного статуса явилась венозная кровь, полученная путем венепункции локтевой вены объемом 4,5 мл в вакуумный вакутейнер с ЭДТА (этилендиаминуксусная кислота). В качестве материала исследования использовался образец геномной ДНК, полученной из лейкоцитов периферической крови. Для генотипирования полиморфизма и мутаций системы гемостаза использовался метод полимеразной цепной реакции (ПЦР) с последующим рестрикционным анализом продукта.
Для анализа коагуляционных показателей (ва-кутейнер с цитратом натрия) полученные образцы крови центрифугировали при скорости 3000 об./мин в течение 15 мин. Исходя из временных методических рекомендаций версии 11, действующих на период проведения исследования, определяли протромбиновое время (ПВ), D-димер, активированное частичное тромбопластиновое время (АЧТВ), фибриноген на автоматическом анализаторе Sysmex CS-2000i (Sysmex, Япония) в течение 30 мин с момента забора крови в вакутейнер 1 .
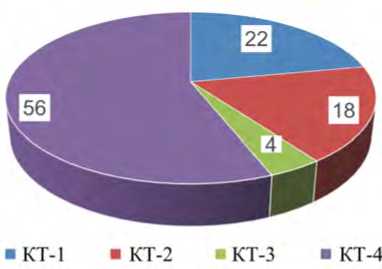
Рис. 1. Класс тяжести течения коронавирусной инфекции по данным томографии легких
Дополнительно для оценки степени выраженности тромбинемии определяли показатели кинетики тромбина на автоматическом коагулометре Ceveron® alpha с TGA-модулем с использованием реагентов Ceveron TGA High (Technoclone GmbH, Австрия). Измерены и проанализированы время лаг-фазы (tLag), время образования пика тромбина (tPeak), пик тромбина (Peak), эндогенный тромбиновый потенциал (AUC).
Статистический анализ выполнен с использованием программы SPSS Statistics, версия 20.0, и калькулятора MedCalc. Количественные переменные представлены как Me (median) и 25, 75-й процентили, качественные данные – в виде относительной частоты и 95%-ного доверительного интервала для доли. Сравнение количественных данных между зависимыми группами проводилось с помощью двухвыборочного критерия Вилкоксона. Критический уровень статистической значимости ( р ) принимался равным 0,05. Использованы методы корреляционного анализа (коэффициенты линейной корреляции Пирсона и ранговой корреляции Спирмена), регрессионного анализа (множественная линейная регрессия и множественная логистическая регрессия).
Результаты и их обсуждение. Анализ тяжести течения новой коронавирусной инфекции показал, что медианный возраст пациентов, включенных в исследование, составил 63 [31; 85] года, из них женщин – 60 %, 4-й класс тяжести коронавирусной пневмонии наблюдался в 56 % случаев (рис. 1). У госпитализированных пациентов с внегоспиталь-ными пневмониями картина по данным СКТ соответствовала классификации КТ-4, госпитальные пневмонии развились у 1/3 пациентов, где также преобладали пациенты с КТ-4.
Как демонстрирует реальная клиническая практика, лабораторная диагностика протромботи-ческой готовности (тромбинемии) определяет решающую роль как в патогенезе, так и в интенсивной терапии инфекции COVID-19. В настоящее время лабораторными критериями ковид-ассоциированной коагулопатии и воспаления являются лабораторные маркеры, рекомендованные научными обществами [17, 18]. При этом следует учитывать, что рекомендуемые стандартные или рутинные гемостазиологи-ческие тесты, такие как протромбиновое время, активированное частичное тромбопластиновое время, уровень D-димера, фибриногена, не способны выявить состояние протромботической готовности при новой коронавирусной инфекции, а также спрогнозировать тяжесть протромботического состояния. Анализ динамики рутинных лабораторных показателей системы гемостаза у пациентов с COVID-19 представлен в табл. 1.
Было выявлено, что уровень D-димера статистически значимо повышался к четвертым суткам госпитализации, несмотря на проводимую анти-тромботическую терапию НМГ, уровни фибриногена и ферритина снижались только к десятым суткам терапии (рис. 2, 3). При этом важно отметить, что указанные лабораторные тесты относятся к лабораторным маркерам диагностики как состояния гиперкоагуляции, так и системного воспаления [19, 20], рутинные клотинговые тесты (АЧТВ, МНО) не показали диагностической значимости для выявления состояния тромбинемии.
Нами выдвигалась гипотеза, согласно которой клиническому проявлению тромбинемии у части пациентов с инфекцией COVID-19 может предшествовать наличие наследственного генетически детерминированного тромбофилического состояния, характеризующегося повышенным риском развития протромбогенной готовности на фоне носительства полиморфизма в генах фибриногена, протромбина и PAI-1, связанное с регуляцией кинетики (генерации) тромбина. В связи с этим мы посчитали возможным в группе пациентов с диагнозом новой коронавирусной инфекции провести молекулярно-генетическое исследование на предмет наличия генетического полиморфизма в системе гемостаза, указывающего на наследственно детерминированное тром-бофилическое состояние.
Таблица 1
Динамика рутинных показателей коагулограммы у пациентов с COVID-19 ( Me [ Q 1 – Q 3 ])
|
Показатель |
Сутки госпитализации |
||
|
первые |
четвертые |
десятые |
|
|
Тромбоциты, 109/л |
246 [85–407] |
287 [70–615] |
319 [179–500]* |
|
АЧТВ, с |
34,7 [30–47] |
36,8 [30–49] |
34,2 [23–79] |
|
Фибриноген, г/л |
5,4 [2,3–6,8] |
5,8 [3,2–6,5] |
4,4 [2,8–7,2]** |
|
D-димер, мг/мл |
1,16 [0,2–7,0] |
1,6 [0,3–5,5]* |
1,2 [0,1–4,2]** |
|
МНО, ед. |
1,02 [0,8–1,0] |
1,1 [0,9–1,1] |
1,2 [1,0–1,2] |
П р и м е ч а н и е : * р < 0,05 – различия статистически значимы по сравнению с первыми сутками; ** р < 0,05 – различия статистически значимы по сравнению с четвертыми сутками.
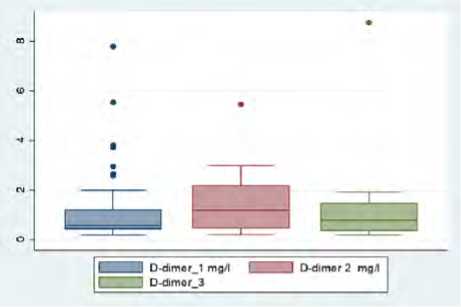
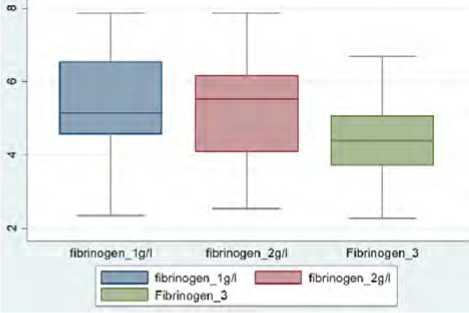
Рис. 2. Динамика показателей D-димера (мг/л), фибриногена (г/л) за время госпитализации: первые, четвертые, десятые сутки ( n = 100)
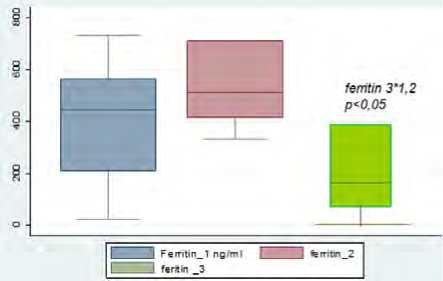
Рис. 3. Динамика показателей ферритина (нг/мл), СРБ (мг/л) за время госпитализации: первые, четвертые, десятые сутки ( n = 100)
Исходя из основной цели нашего исследования, был выполнен молекулярно-генетический анализ основных генов факторов системы гемостаза, детерминирующих коагуляционное звено (Factor V (rs6025), Factor II (rs1799963), Factor I (rs1800790), Factor VII (rs6046), Factor XIII A1 (rs5985)), тромбоцитарное звено (IGN A2 (rs1126643), IGN B3 (rs5918)) и активность фибринолиза (PAI-1 (rs1799889)), рекомендуемых для проведения персонифицированной фармакотерапии (табл. 2) [21]. Данные проведенного молекулярно-генетического тестирования показали, что самым распространенным генетическим полиморфизмом по всем исследуемым генам системы гемостаза в данной выборке пациентов явился «дикий тип», и только в гене PAI-1 (rs1799889) преобладал гетерозиготный полиморфизм – в 49 % и гомозиготный – в 34 % случаев (табл. 2).
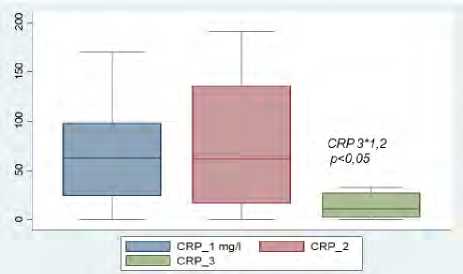
Следующим этапом исследования явился анализ взаимосвязи генетического полиморфизма факторов системы гемостаза (FII 20210 G > A (rs1799963), FV 1691 G > A (rs6025), PAI-1 675 5G > 4G (rs1799889)) с тяжестью ковид-ассоциированной коагулопатии с использованием рекомендуемых рутинных тестов. Анализ показал статистически значимый рост уровня фибриногена к четвертым суткам (более 6,0 г/л; р < 0,001) на фоне носительства гетерозиготного аллельного варианта в генах PAI-1, фактора V и II. При этом уровень D-димера изменялся недостоверно с тенденцией к повышению у большинства пациентов независимо от генотипа исследуемых факторов системы гемостаза (табл. 3).
Согласно Международной классификации болезней 10-го пересмотра (МКБ-10) к наследственным тромбофилиям высокого риска относятся мутации в генах факторов II и V. В связи с этим нами проведен анализ наличия возможной взаимосвязи генетического полиморфизма в генах факторов протромбина FII 20210 G > A, V Лейден G > A с уровнем тромбинемии у пациентов с COVID-19. Анализ подтвердил, что уровень тромбинемии был выше у пациентов с наличием генетического полиморфизма в указанных генах (рис. 4).
Регрессионный анализ независимых предикторов тромбинемии и зависимой переменной D-димера при госпитализации (первые сутки) показал, что риск повышения уровня D-димера более 0,5 мг/л возрастал у пациентов с наличием генетического полиморфизма в генах PAI-1 (гетерозиготный аллельный вариант – β 95 % ДИ: 1,4 [0,6–2,13], p = 0,001; гомозиготный – β 95 % ДИ: 2,0 [0,3–1,5], p = 0,008) и гетерозиготного полиморфизма в гене фактора II (протромбин) (табл. 4).
По данным многофакторного анализа, на повышение уровня D-димера выше референсных значений достоверно влияло наличие генетического полиморфизма в гене PAI-1 и уровень ферритина выше 200 пг/мл (табл. 5).
Таблица 2
Распространенность генетических полиморфизмов генов системы гемостаза у пациентов с инфекцией
COVID-19, n = 100
|
Исследуемый ген |
Генотип |
Частота встречаемости, % |
95 % ДИ |
|
Factor XIII A1 (rs5985) |
103 (G/G) |
47,0 |
41,0; 53,8 |
|
103 (G/T) |
40,0 |
33,7; 46,0 |
|
|
103 (T/T) |
12,0 |
10,0; 15,4 |
|
|
IGN A2 (rs1126643) |
807 (C/C) |
43,0 |
45,0; 59,0 |
|
807 (C/T) |
38,0 |
31,5; 44,0 |
|
|
807 (T/T) |
19,0 |
17,0; 22,4 |
|
|
IGN B3 (rs5918) |
1565 (Т/Т) |
66,0 |
60,0; 73,0 |
|
1565 (Т/С) |
26,0 |
19,0; 31,0 |
|
|
1565 (С/С) |
12,0 |
10,0; 15,4 |
|
|
Factor V (rs6025) |
1691 (G/G) |
91,0 |
89,2; 92,8 |
|
1691 (G/A) |
6,0 |
4,2; 7,8 |
|
|
1691 (A/A) |
0 |
- |
|
|
Factor II (rs1799963) |
20210 (G/G) |
93,0 |
90,6; 94,0 |
|
20210 (G/A) |
2,0 |
1,2; 4,4 |
|
|
20210 (A/A) |
0 |
- |
|
|
PAI-1 (rs1799889) |
–675 5G/5G |
17,0 |
11,95; 22,51 |
|
–675 4G/5G |
49,0 |
42,2; 56,1 |
|
|
675 4G/4G |
34,0 |
30,8; 40,8 |
|
|
Factor I (rs1800790) |
455 G/G |
57,0 |
51,0; 63,8 |
|
–455 G/A |
37,0 |
30,7; 42,9 |
|
|
–455 A/A |
6,0 |
3,7; 9,4 |
|
|
Factor (VII rs6046) |
10976 G/G |
72,0 |
65,1; 78,2 |
|
10976 G/A |
23,0 |
17,0; 29,8 |
|
|
10976 A/A |
5,0 |
3,5; 7,9 |
Таблица 3
Уровень тромбинемии в зависимости от наличия аллельных вариантов в генах факторов II, V, PAI-1
|
Генетический полиморфизм |
Сутки госпитализации |
|||||
|
первые |
четвертые |
десятые |
первые |
четвертые |
десятые |
|
|
D-димер, мг/л ( Ме ) |
Фибриноген, г/л ( Ме ) |
|||||
|
PAI-I675 5G > 4G (rs1799889) |
||||||
|
5G/5G ( n = 17) |
0,9 |
1,5 |
3,2 |
4,9 |
4,6 |
4,0 |
|
4G/5G ( n = 49) |
1,4 |
1,5 |
1,5 |
5,5 |
5,0 |
4,6 |
|
4G/4G ( n = 34) |
0,9 |
0,9 |
0,7 |
5,3 |
5,7 |
4,1 |
|
FV 1691 G > A (rs6025) |
||||||
|
GG ( n = 91) |
1,3 |
1,8 |
1,2 |
5,4 |
5,0 |
4,5 |
|
GA ( n = 6) |
0,7 |
0,5 |
1,1 |
5,9 |
6,7 |
3,7 |
|
FII 20210 G > A (rs1799963) |
||||||
|
GG ( n = 93) |
0,6 |
1,5 |
3,03 |
5,0 |
5,15 |
4,4 |
|
GA ( n = 2) |
2,6 |
0,2 |
0,4 |
6,0 |
6,7 |
4,1 |
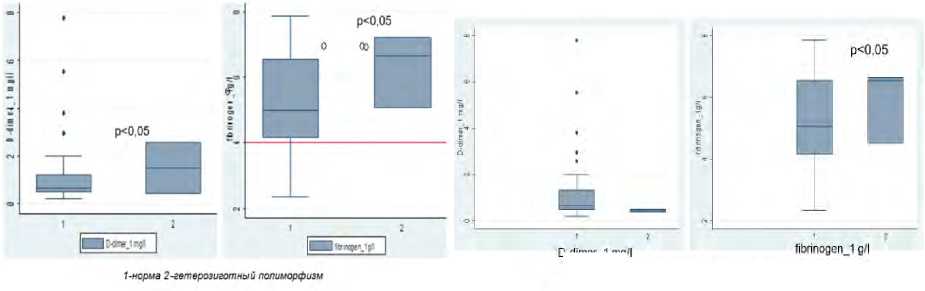
D-dimer_1 mgn
1 -норма 2-гетерозиготный полиморфизм
Рис. 4. Уровень D-димера и фибриногена при поступлении при наличии полиморфизма в гене FII 20210 G > A и в гене FV 1691 G > A
Таблица 4
Линейный регрессионный анализ (D-димер и генетический полиморфизм)
|
Независимый предиктор |
D-димер |
||
|
β |
р |
95 % ДИ |
|
|
FV (rs6025) дикий тип |
1,2 |
0,1 |
-2,4; 2,27 |
|
– гетерозиготный полиморфизм |
0,7 |
0,2 |
0,1; 1,1 |
|
– гомозиготный полиморфизм |
1,0 |
0,3 |
0,31; 1,5 |
|
PAI-I (rs1799889) дикий тип |
0,9 |
0,1 |
-0,43; 1,2 |
|
– гетерозиготный полиморфизм |
1,4 |
0,001 |
0,61; 2,13 |
|
– гомозиготный полиморфизм |
2,0 |
0,008 |
0,31; 1,5 |
|
FII (rs1799963) дикий тип |
1,0 |
0,6 |
|
|
– гетерозиготный полиморфизм |
0,3 |
0,01 |
0,3; 1,9 |
Таблица 5
Регрессионный анализ независимых предикторов тромбинемии и зависимой переменной D-димера при поступлении (первые сутки)
|
Предиктор тромбинемии |
ОШ [95 % ДИ] |
р |
|
Наличие генетического полиморфизма в гене PAI-I (rs1799889) |
1,2 [0,1 - 2,5] |
0,005 |
|
Уровень ферритина более 200 пг/л |
2,4 [1,1–5,4] |
0,036 |
|
Уровень СРБ более 5,0 мг/л |
0,1 [0,01-0,7] |
0,999 |
Таблица 6
Показатели теста кинетики тромбина у пациентов с COVID-19 на момент включения в исследование до назначения антикоагулянтной терапии
|
Анализируемый показатель |
Me [ Q1 ; Q3 ] |
Референсный показатель |
|
Время инициации свертывания (Tlag), мин |
2,46 [1,3–4,2] |
7,8–13,6 |
|
Эндогенный тромбиновый потенциал (AUC, nM), нМоль/мин |
4425,1 [3400–5070] |
1379,4–1735,9 |
|
Пиковое количество тромбина в образце (Peak), нМоль/мин |
862,43 [680,4–1040] |
98,4–153,7 |
|
Время достижения пика (tPeak), мин |
5,87 [4,4–7,5] |
16,7–23,2 |
Для объективизации лабораторной оценки состояния тромбинемии был использован тест генерации (кинетики) тромбина (ТГТ), который отражает количество генерируемого тромбина, кинетику его образования, и, таким образом, оценивается состояние протромбогенной готовности [22, 23]. Результаты анализа теста кинетики тромбина в нашем исследовании указывали на повышение прокоагулянтного потенциала крови у пациентов с COVID-19 уже при госпитализации в стационар. Так, было установлено, что у пациентов в первые сутки госпитализации статистически значимо изменялись все показатели кинетики тромбина, что свидетельствовало о значимой активации тромбина и состоянии тромбинемии – протромботической готовности (табл. 6).
Заключительным этапом данного исследования явился анализ взаимосвязи полиморфизма генов системы гемостаза с тестом кинетики тромбина как прогностического триггера риска развития протром-ботической готовности на фоне новой коронавирусной инфекции COVID-19. Корреляционный анализ времени инициации свертывания (Tlag) с генотипом фактора I (фибриноген) показал отрицательную умеренную взаимосвязь, то есть наличие гетерозиготного полиморфизма в гене фибриногена ассоциировано с уменьшением времени задержки свертывания. Наличие гетерозиготного и гомозиготного полиморфизма в гене фибриногена было ассоциировано с увеличением пиковой концентрации тромбина (Peak), которая была достоверно выше, в отличие от таковой у пациентов без данного генетического полиморфизма (рис. 5).
Наличие гетерозиготного и гомозиготного полиморфизма в гене PAI-1 было ассоциировано с уменьшением времени достижения пика тромбина (tPeak), то есть у пациентов с альтернативным полиморфизмом в гене PAI-1 пик тромбина достигался быстрее (рис. 6).
Корреляционный анализ уровня эндогенного потенциала тромбина (AUC) и генотипов генов факторов свертывания I, II и PAI-1 показал, что наличие альтернативного полиморфизма в гене фибриногена, PAI-1 было ассоциировано с повышением эндогенного потенциала тромбина (рис. 7).

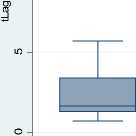
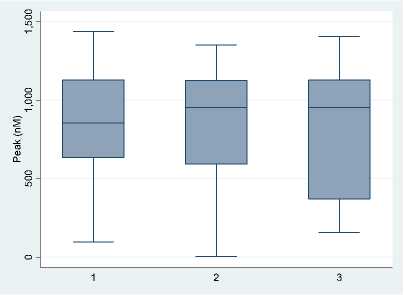
Рис. 5. Корреляционный анализ времени инициации свертывания (tLag), пиковой концентрации тромбина (Peak thrombin, nmol/l) с генотипом фактора I свертывания (фибриноген)
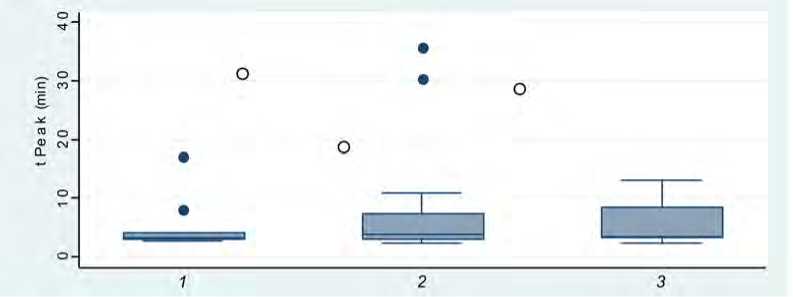
Рис. 6. Корреляционный анализ времени достижения пика генерации тромбина (tPeak, мин) с наличием генетического полиморфизма в гене PAI-1: 1 – дикий тип; 2 – гетерозиготный аллельный вариант;
3 – гомозиготный аллельный вариант
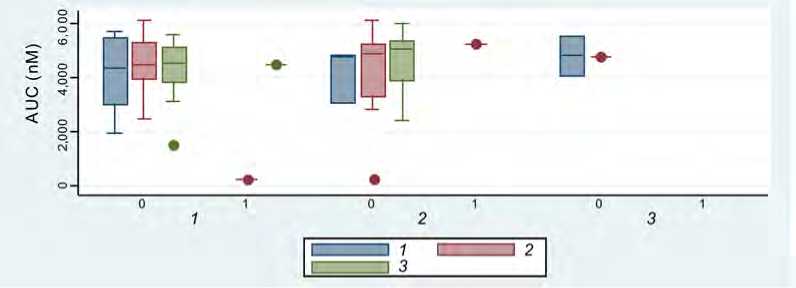
Рис. 7. Корреляционный анализ уровня эндогенного потенциала тромбина (AUC) и генотипов генов PAI-1, факторов свертывания II и I: 1 – дикий тип; 2 – гетерозиготный аллельный вариант; 3 – гомозиготный аллельный вариант
Выводы. Таким образом, полиморфизм в генах PAI-1, протромбина (FII), фибриногена (FI) определял высокий уровень тромбинемии по показателям теста кинетики тромбина (эндогенного тромбинового потенциала (AUC), пиковой концентрации тромбина (Peak thrombin), времени достижения пика генерации тромбина (tPeak), уровня фибриногена и D-димера) у пациентов с COVID-19 в течение всего периода госпитализации. Полученные результаты свидетельствуют о генетической детерминации со- стояния протромботической готовности при наличии у пациентов с новой коронавирусной инфекцией аллельных вариантов в генах PAI-1, протромбина (фактора II) и фибриногена (фактора I). Продемонстрировано, что повышенная генерация тромбина, проявляющаяся повышенным уровнем эндогенного тромбинового потенциала (AUC), может являться прогностическим признаком протромботического состояния у пациентов с генетическим полиморфизмом в генах PAI-1 и фибриногена.
Проведенное пилотное исследование показало, что молекулярно-генетическое тестирование на наличие наследственно детерминированной тромбинемии может рассматриваться в качестве прогностического маркера риска развития состояния тромбинемии – протромботической готовности у пациентов со среднетяжелым и тяжелым течением новой коронавирусной инфекции. Данные настоящего проспективного клинического исследования демонстрируют полезность предложенного молекулярно-генетического скрининга состояния тромбинемии при инфекции COVID-19. Врач-клиницист «красной» зоны ковид-ного госпиталя получает дополнительный объективный показатель, указывающий на возможность прогнозирования состояния тромбинемии на фоне острого воспаления при инфекции COVID-19.
Скрининг наличия генетического полиморфизма в медицине критических состояний необхо- дим при проведении патогенетически оправданной антитромботической терапии, а также в превентивных целях. Полученные результаты указывают на возможные молекулярные механизмы состояния тромбинемии при инфекции COVID-19 и свидетельствуют о целесообразности широкого внедрения методов ДНК-диагностики в клиническую практику для оценки тяжести и прогнозирования протромбо-генного состояния.
По результатам проведенного исследования получен патент на изобретение № 2789822 от 10 февраля 2023 г.
Финансирование. Исследование выполнено в рамках государственного задания – Рег. № НИОКТР 121030300111-7.
Список литературы Прогнозирование риска развития протромбогенной готовности при инфекции COVID-19 с использованием генетического тестирования
- Risks of deep vein thrombosis, pulmonary embolism, and bleeding after COVID-19: nationwide self-controlled cases series and matched cohort study / I. Katsoularis, O. Fonseca-Rodriguez, P. Farrington, H. Jerndal, E. Häggström Lundevaller, M. Sund, K. Lindmark, A.-M. Fors Connolly // BMJ. - 2022. - Vol. 377. - P. e069590. DOI: 10.1136/bmj-2021-069590
- COVID-19 and Thrombotic or Thromboembolic Disease: Implications for Prevention, Antithrombotic Therapy, and Follow-up: JACC State-of-the-Art Review / B. Bikdeli, M.V. Madhavan, D. Jimenez, T. Chuich, I. Dreyfus, E. Driggin, C. Der Nigoghossian, W. Ageno [et al.] // J. Am. Coll. Cardiol. - 2020. - Vol. 75, № 23. - P. 2950-2973. DOI: 10.1016/j.jacc.2020.04.031
- Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China / C. Wu, X. Chen, Y. Cai, J. Xia, X. Zhou, S. Xu, H. Huang, L. Zhang [et al.] // JAMA Intern. Med. - 2020. - Vol. 180, № 7. - P. 934-943. DOI: 10.1001/jamainternmed.2020.0994
- Soares M.P., Teixeira L., Moita L.F. Disease tolerance and immunity in host protection against infection // Nat. Rev. Immunol. - 2017. - Vol. 17, № 2. - P. 83-96. DOI: 10.1038/nri.2016.136
- Kabouridis P.S., Jury E.C. Lipid rafts and T-lymphocyte function: implications for autoimmunity // FEBS Lett. -2008. - Vol. 582, № 27. - P. 3711-3718. DOI: 10.1016/j.febslet.2008.10.006
- Mannucci P.M., Franchini M. Classic thrombophilic gene variants // Thromb. Haemost. - 2015. - Vol. 114, № 5. -Р. 885-889. DOI: 10.1160/TH15-02-0141
- Role of functional plasminogen-activator-inhibitor-1 4G/5G promoter polymorphism in susceptibility, severity, and outcome of meningococcal disease in Caucasian children / E. Haralambous, M.L. Hibberd, P.W.M. Hermans, N. Ninis, S. Nadel, M. Levin // Crit. Care Med. - 2003. - Vol. 31, № 12. - P. 2788-2793. DOI: 10.1097/01.CCM.0000100122.57249.5D
- Receptor recognition by the Novel Coronavirus from Wuhan: an analysis based on decade-long structural studies of SARS Coronavirus / Y. Wan, J. Shang, R. Graham, R.S. Baric, F. Li // J. Virol. - 2020. - Vol. 94, № 7. - P. e00127-20. DOI: 10.1128/JVI.00127-20
- Endothelial cell infection and endotheliitis in COVID-19 / Z. Varga, A.J. Flammer, P. Steiger, M. Haberecker, R. Andermatt, A.S. Zinkernagel, M.R. Mehra, R.A. Schuepbach [et al.] // Lancet. - 2020. - Vol. 395, № 10234. - P. 1417-1418. DOI: 10.1016/S0140-6736(20)30937-5
- Moore J.B., June C.H. Cytokine release syndrome in severe COVID-19 // Science. - 2020. - Vol. 368, № 6490. -P. 473-474. DOI: 10.1126/science.abb8925
- Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China / C. Huang, Y. Wang, X. Li, L. Ren, J. Zhao, Y. Hu, L. Zhang, G. Fan [et al.] // Lancet. - 2020. - Vol. 395, № 10223. - P. 497-506. DOI: 10.1016/S0140-6736(20)30183-5
- Воробьева Н.А., Недашковский Э.В. К вопросу об оптимизации интенсивной терапии острого ДВС-синдрома // Анестезиология и реаниматология. - 2003. - № 4. - С. 50-54.
- Воробьева Н.А. Место генетических полиморфизмов системы гемостаза в генезе тромбофилических состояний // Вестник Поморского университета. - 2004. - № 2 (6). - С. 14-21
- Association of mannose-binding lectin polymorphisms with sepsis and fatal outcome, in patients with systemic inflammatory response syndrome / P. Garred, J.J. Strom, L. Quist, E. Taaning, H.O. Madsen // J. Infect. Dis. - 2003. - Vol. 188, № 9. - P. 1394-1403. DOI: 10.1086/379044
- TNF and TNFR polymorphisms in severe sepsis and septic shock: a prospective multicentre study / A.C. Gordon, A.L. Lagan, E. Aganna, L. Cheung, C.J. Peters, M.F. McDermott, J.L. Millo, K.I. Welsh [et al.] // Genes Immun. - 2004. -Vol. 5, № 8. - P. 631-640. DOI: 10.1038/sj.gene.6364136
- Воробьева Н.А., Капустин С.И. Роль генетического мониторинга системы гемостаза при тяжелом течении острого ДВС-синдрома // Экология человека. - 2005. - № 12. - С. 25-30.
- Временные рекомендации Международного общества специалистов по тромбозу и гемостазу (ISTH) по выявлению и коррекции коагулопатии у пациентов с COVID-19: дайджест // Атеротромбоз. - 2020. - № 1. - С. 6-8. DOI: 10.21518/2307-1109-2020-1-6-8
- Шатохин Ю.В., Снежко И.В., Рябикина Е.В. Нарушение гемостаза при коронавирусной инфекции // ЮжноРоссийский журнал терапевтической практики. - 2021. - Т. 2, № 2. - С. 6-15. DOI: 10.21886/2712-8156-2021-2-2-6-15
- Linkins L.A., Takach Lapner S. Review of D-dimer testing: good, bad, and ugly // Int. J. Lab. Hematol. - 2017. -Vol. 39, Suppl. 1. - Р. 98-103. DOI: 10.1111/ijlh.12665
- Thachil J., Lippi G., Favaloro E.J. D-dimer testing: laboratory aspects and current issues // Methods Mol. Biol. -2017. - Vol. 1646. - Р. 91-104. DOI: 10.1007/978-1-4939-7196-1_7
- Colucci G., Tsakiris D.A. Thrombophilia screening revisited: an issue of personalized medicine // J. Thromb. Thrombolysis. - 2020. - Vol. 49, № 4. - P. 618-629. DOI: 10.1007/s11239-020-02090-y
- Thrombin generation, a function test of the haemostatic-thrombotic system / H.C. Hemker, R. Al Dieri, E. De Smedt, S. Béguin // Thromb. Haemost. - 2006. - Vol. 96, № 5. - P. 553-561.
- Ex vivo thrombin generation patterns in septic patients with and without disseminated intravascular coagulation / L. Carlier, G. Hunault, N. Lerolle, L. Macchi // Thromb. Res. - 2015. - Vol. 135, № 1. - P. 192-197. DOI: 10.1016/j.thromres.2014.11.001


