Проктэктомия с восстановлением внутреннего анального сфинктера, леватора и резервуара при низком раке прямой кишки
Автор: Баширов С.Р., Трифонов М.Н., Тихонов В.И., Баширов Р.C., Кошель А.П., Гайдаш А.А., Панкратов И.В., Карпович А.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: В помощь практическому врачу
Статья в выпуске: 1 т.25, 2010 года.
Бесплатный доступ
Семи пациентам от 38 до 74 лет по поводу рака нижнеампулярного отдела прямой кишки с распространением на анальный канал (T3N0M0 (n=4), T3N1M0 (n=1), T3N0M1 (n=1), T4N2M1 (n=1)) выполнена проктэктомия с тотальной мезоректумэктомией, резекцией внутреннего сфинктера, глубоких порций наружного сфинктера и низведением. На конце низведенной кишки созданы сфинктер из гладкомышечной манжеты, леватор из несвободного сероз но-мышечного лоскута, фиксированного к передней стенке малого таза, и резервуар из поперечно ушитой под слизистой площадки, образованной после формирования леватора. Через 6 месяцев отмечена осознанная дефе кация с позывом 1-2 раза в сутки и удержанием твердого кала, а через 1 год - возможность игнорирования позыва на 15-30 мин. У 5 пациентов T3N0M0-T3N1M0 отмечен безрецидивный период 35 лет. Прогрессирование заболевания отмечено в одном случае (T4N2M1). У пациента (T3N0M1) на фоне химиотерапии (XELOX) зафиксиро вана стабилизация процесса в течение 1,5 лет
Низкий рак прямой кишки, сфинктеролеваторопластика., sphincterlevatorplasticа
Короткий адрес: https://sciup.org/14919201
IDR: 14919201 | УДК: 616.351-006.6-089.87:616.352-089.844
Текст научной статьи Проктэктомия с восстановлением внутреннего анального сфинктера, леватора и резервуара при низком раке прямой кишки
Проблема лечения рака прямой кишки в течение последних десятилетий находится в центре внимания из-за неуклонного роста заболеваемости и неснижающегося уровня смертности. Внимание к данной проблеме заметно возросло с появлением новых сведений о характере роста так называемого “низкого” рака прямой кишки, его взаимоотношения с внутренним и наружным сфинктерами заднего прохода. Появилась возможность в строгом соответствии с онкологическими принципами и учетом степени распространения опухолевого процесса, его гистологической формой и локализацией дистального края опухоли относительно зубчатой линии выполнять новые сфинктеросохраняющие вмешательства. Речь идет о сверхнизких передних резекциях с эксцизией леваторов, интерсфинктерной резекции с полным или частичным удалением внутреннего сфинктера, а также резекции “close shave1” за линией пальпаторно определяемого края опухоли [3–5, 10].
Новое качество операций не уменьшило процент нарушений резервуарной и удерживающей функций – “low anterior resection syndrome2”. Так в мировой практике называется сочетание многомоментного и неполного опорожнения, императивных позывов, инконтиненции, обусловленных резекцией ампулы прямой кишки и слабостью сфинктерного аппарата. Прототипом искусственной ампулы стала разработка F. Lasorthes и R. Parc J-образного толстокишечного резервуара в 1986 году, используемого в настоящее время при выполнении передней, брюшно-анальной, интерсфинктерной резекций и экстирпации прямой кишки. В числе неблагоприятных отдаленных результатов методики у 1/4 больных отмечены стойкие запоры, требующие применение слабительных препаратов, очистительных клизм и даже катетеризации резервуара для его опорожнения [1]. Степень неполного опорожнения резервуара прямо пропорциональна его величине. Усугубляют эвакуацию послеоперационное расширение и опущение резервуара с уменьшением угла между его осью и тазовым дном [3, 11, 12]. Поэтому в отношении формы резервуара, техники формирования и топографии мнения расходятся. Что же касается профилактики инконтиненции после сфинктерсох-раняющих и сфинктеруносящих вмешательств, исследования последних лет показали, что использование поперечно-полосатых мышц для создания искусственного сфинктера значительно уступает в эффективности неосфинктеру из собственной мышечной оболочки кишки [2, 3, 6, 10]. Дискутабельным остается только технология его формирования.
С целью восстановления естественной и управляемой дефекации при радикальных вмешательствах у больных раком нижнеампулярного отдела прямой кишки с переходом на анальный канал нами разработана операция в объеме проктэктомии с тотальной мезоректумэктомией, резекцией внутреннего сфинктера, глубоких порций наружного сфинктера с низведением и формированием гладкомышечной манжеты, леватора из серозно-мышечного лоскута и резервуара на низведенной кишке [7–9].
Материал и методы
Экспериментальные исследования с соблюдением правил проведения работ с экспериментальными животными выполнены на 10 беспородных собаках с целью разработки способа операции и гистологической оценки морфогенеза сфинктера, леватора и резервуара. Об- разцы тканей фиксировали в 9% нейтральном формалине, приготовленном на фосфатном буфере (pH 7,0), обезвоживали в этиловом спирте возрастающей концентрации, заливали в парафин и готовили срезы толщиной до 5 мкм. Гистологические срезы окрашивали гематоксилин-эозином и пикрофуксином по Ван-Гизону. Световую микроскопию производили на микроскопе “CARL ZEISS JENA” с мультивидеокамерой DIGITAL MICRO и программой оцифровки AverMEDIA EZCapture. Оптическую систему калибровали с помощью объект-микрометра и проводили морфометрические исследования оцифрованных гистологических препаратов в редакторе Adobe Photoshop CS с использованием окулярной морфометрической сетки Салтыкова с 60 тестовыми точками нулевой толщины. С каждого препарата выполнялось 20–50 цифровых снимков, на каждый из которых наносилась сетка Салтыкова по 5 раз. Общее число тестовых точек составило 125000. Результаты морфометрии обрабатывали с помощью методов альтернативной статистики. Статистическую значимость различий средних значений оценивали по t критерию Стьюдента.
В клинике по разработанной методике оперировано 7 пациентов в возрасте от 38 да 74 лет по поводу высоко-и умереннодифференцированных аденокарцином нижнеампулярного отдела прямой кишки с расположением нижнего края опухоли от 8 до 35 мм от анального отверстия. В 4 случаях опухоль занимала 1/2 окружности кишки, прорастала стенку кишки, не имела регионарных и отдаленных метастазов (T3N0M0). У одного пациента был выявлен метастаз в параректальный лимфатический узел (T3N1M0). И два пациента были с IV стадией опухолевого процесса с билобарными множественными метастазами печени (T3N0M1 и T4N2M1). Обследование больных в течение первого года после операции производили 1 раз в 3 месяца, в течение второго года 1 раз в 6 месяцев, в дальнейшем – 1 раз в год. Для этого использовали стандартный объем диагностических методов, включающий лабораторные и инструментальные методы исследования. Изучение функции сфинктеров проводили на аппарате POLIGRAF ID с использованием баллонного водноперфузионного 8-ми канального катетера 9012Р2311 Y1731 для аноректальной манометрии и водноперфузионного 8-ми канального катетера 9012P2391 Y1631 для профилометрии. Полученные данные обрабатывались с помощью компьютерной программы POLIGRAM NET.
Результаты и обсуждение
Способ операции. Абдоминальным лапаротомным доступом выполняли мобилизацию кишки с тотальной мезоректумэктомией до уровня леваторов. Затем со стороны промежности на уровне анокутанной линии накладывали 5 нитей-держалок. Сразу за ними просвет анального канала герметизировали кисетным швом. Между держалками и кисетным швом анальный канал пересекали и проникали в межсфинктерное пространство, через которое выполняли мобилизацию внутреннего сфинктера и глубокой порции наружного сфинктера в одном фасциально-футлярном блоке с опухолью и прямой киш- кой. На конце низводимой кишки формировали гладкомышечный жом путем циркулярного отсепарирования серозномышечной оболочки высотой 12– 15 мм от подслизистой основы и фиксации ее в форме манжеты (рис. 1 на 3-й стр. обложки) [7]. Выше гладкомышечного жома на 12–20 мм рассекали серозно-мышечную оболочку в поперечном направлении на ширину противобрыжеечного участка кишки (15–18 мм). Вдоль верхнего и нижнего краев крепления брыжейки и подвесков противобрыжеечного
Таблица 1
Динамика процентного отношения клеточных структур в зоне гладкомышечной манжеты при окраске гематоксилином и эозином
|
Параметры |
Контроль, % |
Низведение 10 сут., % |
Низведение 30 сут., % |
Низведение 6 мес., % |
|
Эпителиальная пластинка |
2,07±0,14 |
5,87±0,231 |
6,20±0,231, 2 |
7,51±0,171, 2, 3 |
|
Коллагеновые волокна |
67,30±0,46 |
35,83±0,461 |
37,55±0,471, 2 |
54,29±0,321, 2, 3 |
|
70,57±0,58* |
26,40±0,561* |
50,95±0,641, 2* |
47,85±0,641, 2, 3 |
|
|
Гладкая мускулатура |
22,73±0,41 |
48,66±0,481 |
38,98±0,481, 2 |
25,38±0,281, 2, 3 |
|
Свободный интерстиций |
5,41±0,22 |
7,28±0,251 |
16,32±0,361, 2 |
11,02±0,201, 2, 3 |
|
Сосуды с просветом |
2,11±0,14 |
1,00±0,0971 |
0,34±0,0571, 2 |
0,76±0,0561, 2, 3 |
|
Сосуды облитерированные |
0,34±0,05 |
0,13±0,0351 |
0,09±0,0291, 2 |
0,55±0,0691, 2, 3 |
|
Лимфатический фолликул |
0,04±0,019 |
1,33±0,111 |
0,53±0,0711, 2 |
0,46±0,0441, 2, 3 |
* – значения, полученные с препаратов, окрашенных пикрофуксином по Ван-Гизону.
участка кишки выполняли еще два параллельных рассечения серозно-мышечной оболочки длинной 65–70 мм. Намеченный таким образом прямоугольник из серозно-мышечного слоя отсепаровывали от подслизистой оболочки, сохраняя его связь со стенкой кишки на проксимальном конце (рис. 2А на 3-й стр. обложки) [9]. Подслизистую площадку растягивали с помощью нитей-держалок в поперечном направлении и
Таблица 2
Динамика процентного отношения клеточных структур основания и средней трети лоскута-леватора при окраске по Ван-Гизону
|
Параметры |
Контроль, % |
Лоскут-леватор 10 сут., % |
Лоскут-леватор 30 сут., % |
Лоскут-леватор 6 мес., % |
|
Коллагеновые волокна |
4,21+0,3 |
16,93+0,41 |
22,51+0,61,2 |
30,25+0,71,2,3 |
|
Гладкая мускулатура |
93,67+0,4 |
79,42+0,51 |
63,32+0,81,2 |
66,95+0,71,2,3 |
|
Сосуды с просветом |
1,09+0,17 |
0,62+0,11 |
0,45+0,11,2 |
0,34+0,091,2,3 |
|
Свободный интерстиций |
1,01+0,16 |
3,03+0,21 |
13,72+0,21,2 |
2,47+0,21,2,3 |
1 – для р ≤ 0,05 относительно контроля; 2 – для р ≤ 0,05 относительно экспериментальной группы со сроком наблюдения 10 суток; 3 – для р ≤ 0,05 относительно экспериментальной группы со сроком наблюдения 30 суток.
ушивали узловыми швами до сопоставления серозно-мы шечного слоя (рис. 2Б на 3-й стр. обложки). Выполнив низведение и зафиксировав кишку в промежности, накладывали 2–4 узловых шва абдоминальным доступом между верхушкой лоскута и передней полуокружностью тазовой брюшины (рис. 3 на 3-й стр. обложки). После санации и дренирования малого таза производили низведение кишки на промежность и фиксировали ее узловыми швами за гладкомышечную манжету к кольцу подкожной порции наружного сфинктера. Избыток подслизистой оболочки кишки после формирования мышечной манжеты использовали для создания анального валика, сшивая ее с перианальной кожей [8].
Морфологические изменения модели гладкомышечного сфинктера после проктэктомии были оценены в эксперименте методом гистостереометрии с применением окулярной морфометрической сетки Салтыкова. Результаты сравнивались с параметрами аналогичных анатомических образований анального канала здоровых неоперированных собак (табл. 1).
К 10 суткам эксперимента отмечено превышение удельного объема фракции эпителиальной пластинки в среднем на 64%, к 30 суткам – на 66% и на 72% к 6 месяцу по отношению к контролю, что обусловлено анатомическими особенностями низведенного отдела ободочной кишки. Относительный объем фракции гладкой мускулатуры в области гладкомышечной манжеты к 10 суткам эксперимента превышал аналогичный объем мышечной ткани внутреннего сфинктера в контроле в среднем на 54%, это объясняется удвоением мышечной ткани при формировании манжеты. Обращает на себя внимание прогрессирующее снижение в среднем на 19% показателей объема гладкой мускулатуры в искусственном сфинктере к 30 суткам и на 47% к 180 суткам эксперимента. Учитывая, что к 6 месяцу эксперимента регистрируется в среднем снижение на 20% фракции кровеносных сосудов с действующим просветом по отношению к 10 суткам, атрофические изменения мышечной пластинки объясняем недостаточным кровоснабжением дистального отдела низведенной кишки. Одновременно происходил неоангиогенез, что подтверждалось ростом фракции сосудов с просветом к 6 месяцам по отношению к 30 суткам на 55%. Иными словами, к 30 суткам в мышечной манжете развивается ишемическая атрофия гладкой мускулатуры, которая сохраняется и к 6 месяцу. Параллельно ишемической атрофии мышечной ткани идет прогрессирующий рост коллагеновой фракции с 35,83±0,46% до 54,29±0,32%. Одновременно с этим в искусственном сфинктере к 30 суткам эксперимента наблюдается прогрессирующий интерстициальный отек по сравнению с 10 сутками, с постепенным его уменьшением к 6 месяцу, что связано со стиханием воспалительного процесса в тканях в области гладкомышечной манжеты. На это указывает увеличение фракции свободного интерстициального пространства на 55% и снижение его на 32% к 6 ме- сяцам по отношению к 30 суткам (табл. 1).
Как показали морфологические исследования, в основании и средней трети гладкомышечного лоскута-леватора на фоне стихания послеоперационного отека, облитерации половины сосудов и увеличения коллагеновых волокон отмечено снижение объема гладкой мускулатуры на 28% к концу эксперимента по сравнению с контролем (табл. 2). Наружная треть лоскута, фиксированная к стенке таза, трансформируется в соединительную ткань.
Разработанный способ был применен у 7 больных. Послеоперационной летальности не было. В двух случаях отмечено формирование абсцесса промежностной части низведенной кишки, которые устранены путем дренирования и временного выключения низведенной кишки из пассажа колостомой.
У 4 пациентов со II стадией (T3N0M0) на фоне адъювантной монохимиотерапии (кселода 2500 мг/м2/сутки, 6 месяцев) отмечено безрецидивное течение с максимальным сроком наблюдения 4,5 года. У пациента с III стадией (T3N1M0) и наличием метастаза в параректальный лимфатический узел на фоне монохимиотерапии безре-цидивный период составил 3 года. У больного с IV стадией (T3N0M1) с множественными билобарными метастазами на фоне полихимиотерапии по программе XELOX отмечено уменьшение максимальных размеров метастазов печени с 69х44х30 мм в S4 после 6 курсов ПХТ до 48 мм. У другого пациента с IV стадией заболевания (T4N2M1) с распространением опухоли в параректальную клетчатку, мочевой пузырь, поражением параректальных и подвздошных лимфатических узлов, множественными билобарными метастазами в печень проводилась терапия в режиме Мейо. Через 6 мес. у данного больного отмечено прогрессирование основного заболевания.
Пациенты в течение первых трех месяцев были вынуждены постоянно использовать памперсы из-за непроизвольной, многомоментной и длительной дефекации от 3 до 7 раз в сутки, недержания всех компонентов кишечного содержимого. Через 6 месяцев установилась осознанная дефекация 1–2 раза в сутки с предшествующим позывом, элементы держания твердого кала, пациенты используют подкладные с периодическим ношением памперса. Через 1 год установилась осознанная дефекация
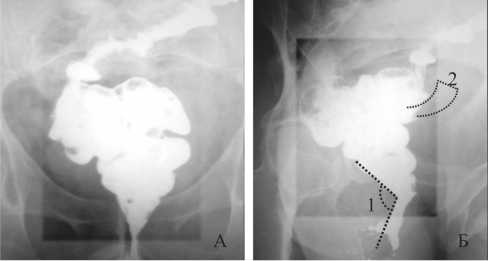
Рис. 5. Проктограммы через 1 год после операции: А – резервуар в прямой проекции; Б – резервуар в боковой проекции; пунктирными линиями выделен резервуарноанальный угол (1) и проекция гладкомышечного лоскута леватора (2)
-
1 раз в сутки. С этого же времени пациенты отмечают возможность игнорировать позыв на дефекацию более 15– 40 мин с удержанием твердого кала. Пациенты используют подкладные, посещают общественные места.
При аноректальной манометрии через 6 месяцев после проктэктомии показатели среднего давления покоя в зоне мышечной манжеты и наружного сфинктера были одинаково снижены (12,7–14,8 мм рт.ст.). Через 1,5 года отмечен прирост среднего давления покоя до 28,8±4,2 мм рт. ст. с увеличением среднего максимального значения до 77,0±21 мм рт.ст.
Функция сохраненных порций наружного сфинктера после проктэктомии оценивалась по величине максимального произвольного давления сжатия. На фоне произвольного сокращения наружного сфинктера был отмечен статистически значимый прирост давления в анальном канале. Через 6 месяцев после операции среднее давление сжатия составило 22,6±7,8 мм рт. ст., при максимальном значении 57,5±8,7 мм рт. ст. Через 1,5–2 года после операции отмечено увеличение давления сжатия до 48,6±12 мм рт. ст. при максимальном значении 121,5±17 мм рт.ст.
Длину физиологического анального канала и зону высокого давления определяли с помощью метода протягивания водноперфузионного 8-ми канального катетера для профилометрии. Зона высокого давления отличалась более высокими значениями средних и максимальных показателей давления покоя и сжатия, а длина ее увеличивалась при попытке удержания. Через 1 год после проктэктомии на фоне произвольного сокращения наружного сфинктера протяженность зоны высокого давления возрастала с 1,6–2,2 до 3,2–3,5 см.
Для построения трехмерного графического изображения давления сфинктеров низведенной кишки использовали векторный анализ объема, который позволил определить расположение искусственного сфинктера, рассмотреть асимметрию его стенок в покое и при произвольном удержании (рис. 4 на 3-й стр. обложки). Значение гладкомышечного сфинктера в формировании векторного объема оценивали при сравнительном анализе результатов профилометрии заднего прохода и зоны повышенного давления. В среднем 85,8±6% векторного объема после проктэктомии со сфинктеролеваторопла-стикой определялось в зоне повышенного давления, образованной тонусом гладкомышечной манжетки. Поэтому трудно было представить формирование непроизвольного компонента держания у больных после проктэкто-мии без участия сфинктера, сформированного из собственной мышечной пластинки низведенной кишки.
Значение лоскута-леватора у пациентов после про-ктэктомии было зафиксировано проктографией (рис. 5). Помимо образования резервуара с зоной повышенного давления в области гладкомышечного сфинктера было отмечено вертикальное положение резервуара с нормальным значением аноректального угла в боковой проекции, обеспечивающих профилактику неполного опорожнения низведенной кишки. Таким образом, сформированный лоскут-леватор препятствует опущению резервуара и уменьшению угла между его осью и тазовым дном. При изучении динамики резервуарной функции было отме- чено, что в течение первых 3 месяцев чувствительность резервуара снижена. Это подтверждается высоким пороговым объемом до 34 мл, в дальнейшем чувствительность восстанавливается. Объем дефекации приближается к нижней границе нормы через 1 год. Максимально переносимый объем в первые 6 месяцев составляет в среднем 25–35% от должного и ко второму году достигает 55–60%.
Выводы
-
1. Операция проктэктомия с восстановлением внутреннего анального сфинктера, леватора и резервуара существенно улучшает качество жизни больных в отдаленном послеоперационном периоде, не уступая в радикализме экстирпации прямой кишки с колостомой.
-
2. Гладкомышечный сфинктер способствует восстановлению элементов непроизвольного компонента держания кала за счет увеличения среднего давления покоя (28,8±4,2 мм рт.ст.) и протяженности зоны высокого давления (3,2–3,5 см) в промежностном отделе низведенной кишки. Искусственный сфинктер, при неизбежных процессах атрофии гладкой мускулатуры в дистальном отделе низведенной кишки из-за натяжения, дефицита кровообращения и окружающего деформирующего фиброза в полости таза, позволяет сохранить половину объемной массы гладкой мускулатуры (25,38±0,28%), аналогичной количеству в естественном внутреннем сфинктере здоровых собак (22,73±0,41%).
-
3. Резервуар способствует формированию ампулярного отдела низведенной кишки с одномоментным опорожнением и урежением дефекаций, не требующим применения слабительных препаратов и очистительных клизм.
-
4. Гладкомышечный лоскут-леватор препятствует опущению резервуара, обеспечивая нормальную величину аноректального угла и угла между осью резервуара и тазовым дном, определяющих продолжительность дефекации и полноту эвакуации из низведенной кишки.
Список литературы Проктэктомия с восстановлением внутреннего анального сфинктера, леватора и резервуара при низком раке прямой кишки
- Ближайшие и отдаленные результаты сфинктеросохраняющих операций с формированием толстокишечного J-образного резервуара/Г.И. Воробьев, Т.С. Одарюк, П.В. Царьков [и др.]//Хирургия. -2000. -№6. -С. 41-47.
- Воробьев Г.И., Одарюк Т.С., Царьков П.В. Создание искусственного запирательного аппарата после экстирпации по поводу рака прямой кишки//Рос. жур. гастроэнт., гепат., колопрокт. -1998. -№4. -С. 58-60.
- Жерлов Г.К., Баширов С.Р. Резервуарные и сфинктермоделирующие технологии в хирургии рака прямой кишки. -Новосибирск: Наука РАН, 2008. -184 c.
- Капуллер Л.Л., Царьков П.В., Одарюк Т.С., Талалакин А.И. Клинико морфологическое обоснование интерсфинктерной резекции прямой кишки в лечении низкого ректального рака//IV Всероссийская конференция "Актуальные проблемы колопроктологии" с международным участием. -Иркутск, 1999. -С. 164-166.
- Одарюк Т.С., Царьков П.В., Талалакин А.И. Новая сфинктеросохраняющая операция при нижнеампулярном раке прямой кишки//Российский онкологический журнал. -1998. -№6. -С. 16-20.
- Отдаленные результаты формирования гладкомышечного жома в области промежностной колостомы у больных после экстирпации прямой кишки/Т.С. Одарюк, Л.Л. Капуллер, Л.Ф. Подмаренкова [и др.]//Хирургия. -1994. -№10. -С. 23-26.
- Патент РФ №2206280. Способ формирования резервуарного колоанального анастомоза после брюшно анальной резекции прямой кишки/Г.К. Жерлов, С.Р. Баширов,И.В. Панкратов, Т.О. Хурганов. -№2001130662/14; заявл. 12.11.2001; опубл. 20.06.2003; бюл.№17.
- Патент РФ №2292846. Способ восстановления сосудистого механизма держания при формировании искусственного заднего прохода/Г.К. Жерлов, С.Р. Баширов, И.В. Панкратов. -№2004123910/14; заявл. 04.08.2004; опубл. 10.02.2007; бюл. №4.
- Приоритет на изобретение №2009113075. Способ формирования леватора на низведенной кишке при резекции прямой кишки c удалением различных порций наружного сфинктера/С.Р. Баширов, Р.С. Баширов, М.Н. Трифонов, И.В. Панкратов, А.А. Гайдаш, Р.В. Семакин. -Заявл. 07.04.2009.
- Одарюк Т.С., Воробьев Г.И., Шелыгин Ю.А. Хирургия рака прямой кишки. -М.: Дедалус, 2005. -256 с.
- Horizontal inclination of the longitudi-nal axis of the colonic J pouch: defining causes of evacuation difficulty/J. Hida,M. Yasutomi, T. Maruyama, T. Tokoro, T. Uchida, T. Wakano,R. Kubo//Dis. Colon. Rectum. -1999. -[Vol.]42. -P. 1560-1568.
- Enlargement of colonic pouch after proctectomy and coloanal anastomosis: potential cause for evacuation difficulty/J. Hida,M. Yasutomi, T. Maruyama, T. Tokoro, T. Wakano, T. Uchida//Dis. Colon. Rectum. -1999. -[Vol.]42. -P. 1181-1188.


