Промотирование алкилирования N-алкоксиалкил-пиперид-4-олов и пиперидин-4-кетоксимов
Автор: Пралиев К.Д., Тен А.Ю.
Журнал: Вестник Алматинского технологического университета @vestnik-atu
Рубрика: Международная научно-техническая конференция Казахстан-Холод
Статья в выпуске: 1 (97), 2013 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/140204635
IDR: 140204635 | УДК: 547.8
Текст статьи Промотирование алкилирования N-алкоксиалкил-пиперид-4-олов и пиперидин-4-кетоксимов
Известно, что алкилирование гидроксильной группы в спиртах вызывает значительное изменение биологических свойств многих соединений. Так, алкильные эфиры типа R-О-R′, где R алифатический радикал, обладают устойчивостью к окислению, физиологически же они зачастую вызывают наркоз. Диэтиловый эфир – простейший диалкиловый эфир является быстродействующим анестетиком, который вызывает глубокий и кратковременный наркоз. Алкилариловые эфиры являются важными растворителями и «строительными блоками» для парфюмерной, косметической, фармацевтической промышленности и производства красителей [1].
В лаборатории химии синтетических и природных лекарственных веществ Института химических наук им. А.Б. Бектурова синтезированы C- и N-замещенные производные пиперидина, являющиеся полупродуктами для синтеза целого ряда соединений, превышающих по фармакологической актив- ности применяемые в медицине лекарственные препараты.
Целью настоящей работы является разработка оптимальных условий получения феноксиалкильных эфиров N-алкоксиалкил-пиперидолов-4 и N-алкоксиалкилпиперидин-4-кетоксимов в условиях реакции Вильямсона. Классическая реакция Вильямсона (Williamson), открытая еще в середине 19-го столетия до сих пор остается одной из наиболее эффективных стратегий для синтеза симметричных и несимметричных эфиров. Реакцию широко используют как в промышленности, так и в научных исследованиях.
Синтез 4-феноксиалкоксилпиперидинов и 4-феноксиалкоксил-иминопиперидинов осуществляли в классических условиях алкилированием 4-гидроксипиперидинов и 4-кетоксипиперидинов с ароматическими бромидами в ДМФА в присутствии порошкообразного гидроксида калия при комнатной температуре. Продолжительность синтезов составляла 10-20 суток и выходы феноксиал- киловых эфиров не превышали 13-45%.
DMF, room tempreture
or
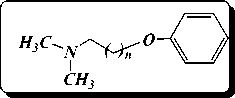
Оказалось, что во всех реакциях алкилирования с феноксиалкилбромидами наблюдается образование побочного вещества, который идентифицирован как продукт взаимодействия растворителя, диметилфор-мамида с феноксиалкилбромидом. Образование N,N-диметилфеноксиалкиламинов является следствием замещения бромида диметилформамидом и последующим разложением четвертичной соли.
Ряд синтезированных феноксиалкиль-ных эфиров N-алкоксиалкилпиперидолов-4 и N-алкоксиалкилпиперидин-4-кетоксимов проявили анальгетическую, антибактериальную, антиаритмическую, спазмолитическую и противоаллергическую активность, некоторые из них значительно превосходили таковую применяемых в медицине препаратов, взятых в качестве эталонных.
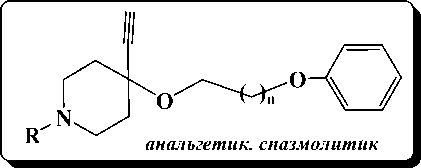
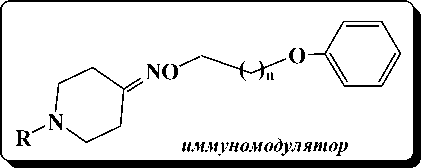
В связи с этим стал вопрос оптимизировать процесс алкилирования целевых пиперидинсодержащих спиртов и оксимов.
Вполне логичным для промотирования реакции было увеличение температуры процесса. Оказалось, что нагревание реакционной смеси в первую очередь привело к ускорению побочной реакции. А кипячение стартовых спиртов или оксимов с феноксиал-килбромидом в ацетоне в присутствии поташа в течение 20 ч приводит к появлению только следовых количеств целевых эфиров. Введение в реакционную смесь межфазного катализатора – тетрабутиламмонийбромида (ТБАБ) лишь в незначительной степени увеличило конверсию исходных соединений в целевой эфир.
В последние годы получила бурное развитие «зеленая» химия. В литературе значительно возросло количество публикаций, посвященных «зеленой» версии реакции Вильямсона [2-4], таких как проведение синтезов с использованием межфазных катализаторов, таких как соли четвертичного аммония, микроволнового излучения, применения так называемых ионных жидкостей, проведение синтезов на поверхности твердой фазы. Для создания новейших ресурсо- и энергосберегающих, экологически безопасных технологий применение микроволнового излучения представляется одним из перспективнейших направлений. В настоящее время интенсификация под воздействием микроволнового излучения применяется во многих промышленных процессах. Использование такой нетрадиционной реакции имеет несколько преимуществ: значительное сокращение времени реакции по сравнению с традиционным нагреванием, простота выполнения методики, уменьшение термического разложения и улучшение селективности.
Для исключения протекания побочного процесса и в целях повышения выхода простого эфира оптимизировались реакционные условия. Так при использовании модифицированной Д. Богдалом реакции Вильямсона взаимодействие стартовых пиперидинсодержащих спиртов и оксимов с феноксиал-килбромидами в присутствии тетрабути-ламмонийбромида (межфазный катализатор), адсорбированных на смеси карбоната и гидроксида калия при промотировании микроволновым излучением протекает в течение 60-120 сек и целевые феноксиалкиловые эфиры N-алкоксиалкилпиперидолов-4 и N-алкоксиалкилпиперидин-4-кетоксимов образуются с выходами 80-92 %.
Экспериментально показано, что ионная жидкость (ИЖ) – 1-бутил-3-метилими-дозол бромида, в реакции алкилирования может применяться как в качестве растворителя, так и промоутера, поскольку ИЖ заметно ускоряет процесс в отсутствии катализатора - КОН.
Таким образом, в результате применения микроволнового излучения удалось повысить выход реакции алкилирования, избежать побочной реакции, значительно сократить время взаимодействия и отказаться от использования высококипящего растворителя.
Разработанная методика с использованием микроволнового стимулирования применена для усовершенствования традиционных методов получения биологически активных веществ пиперидинового ряда.
Список литературы Промотирование алкилирования N-алкоксиалкил-пиперид-4-олов и пиперидин-4-кетоксимов
- Fuhrmann E., Talbiersky J. Synthesis of alkyl aryl ethers by catalytic Williamson ether synthesis with weak alkylation agents//Org. Process Res. Dev. -2005. -Vol. 9, № 2. -P. 206 -211.
- Bogdal D., Pielichowski J., Jaskot K. A rapid Williamson synthesis under microwave irradiation in dry media//Org. Prep. Proc. Int. -1998. -Vol. 30. № 4. -P. 427-432.
- Paul S., Gupta M. Zinc-catalyzed Williamson ether synthesis in the absence of base//Tetrahedron Lett. -2004. -Vol. 45, № 48. -P. 8825-8829.
- Combined microwave and ultrasound assisted Williamson ether synthesis in the absence of phase-transfer catalysts//Green Chem. -2002. -Vol. 4. -P. 349-351.


