Протезирование или сохранение митрального клапана: выбор оптимальной тактики хирургического лечения обструктивной гипертрофической кардиомиопатии
Автор: Богачев-прокофьев А.В., Железнев С.И., Фоменко Михаил Сергеевич, Афанасьев А.В., Шарифулин Р.М., Назаров В.М., Малахова О.Ю., Караськов А.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Приобретенные пороки сердца
Статья в выпуске: 4 т.19, 2015 года.
Бесплатный доступ
Сравнить клиническую и гемодинамическую эффективность двух тактических подходов хирургического лечения обструкции выходного отдела левого желудочка и митральной недостаточности у пациентов с гипертрофической кардиомиопатией. Материал и методы С ноября 2010 г. по август 2013 г. обследовали 146 пациентов с обструктивной гипертрофической кардиомиопатией. Согласно критериям включения рандомизировали 88 пациентов: I группа - расширенная миоэктомия и протезирование митрального клапана, II группа - расширенная миоэктомия и пластика митрального клапана. Средний возраст в I и II группах соответствовал 51,4±14,4 и 47,9±14,1 года (р = 0,262). Пиковый градиент на уровне выходного отдела левого желудочка в I и II группах - 89,9±27,2 и 96,6±28,1 мм рт. ст. (р = 0,168). Наблюдали выраженную митральную недостаточность в 24 (58,5%) и 23 (56,1%) случаях, умеренную митральную недостаточность - в 17 (41,5%) и 18 (43,9%) случаях в I и II группах соответственно (р = 0,823). Обнаружили БАМ-синдрому 100% пациентов. Результаты Госпитальная летальность составила 1 (2,4%) случай в I группе (р = 0,314). Осложнения: полная атриовентрикулярная блокада, дефект межжелудочковой перегородки, разрыв латеральной стенки левого желудочка - достоверно не различались (р = 1,0). Средний период наблюдения для I группы составил 23,2 мес., для II группы - 25,8 мес. Выживаемость - 78,9 и 96,6% (Log-rank test = 0,034). Свобода от тромбоэмболических осложнений составила 83,2 и 100% (Log-rank test = 0,026). Заключение Расширенная миоэктомия в сочетании как с протезированием, так и сохранением митрального клапана является высокоэффективным методом устранения обструкции выходного отдела левого желудочка и митральной недостаточности. Сохранение митральной недостаточности у пациентов с обструктивной гипертрофической кардиомиопатией снижает частоту клапанообусловленных осложнений и улучшает отдаленную выживаемость.
Гипертрофическая кардиомиопатия, миоэктомия, сердечная недостаточность, митральная регургитация
Короткий адрес: https://sciup.org/142140700
IDR: 142140700
Текст научной статьи Протезирование или сохранение митрального клапана: выбор оптимальной тактики хирургического лечения обструктивной гипертрофической кардиомиопатии
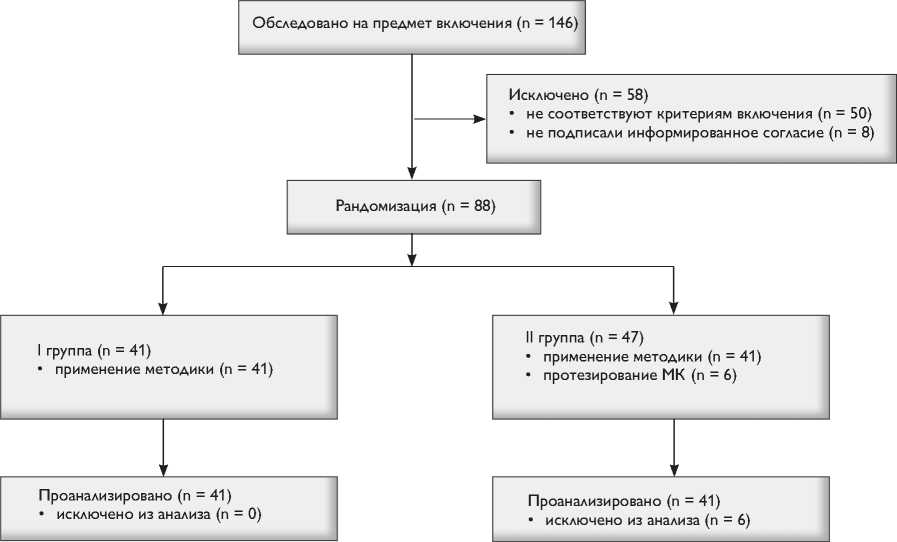
Рис. 1. CONSORT-диаграмма передвижения пациентов в исследовании
панного аппарата, мобилизации папиллярных мышц, удлинения передней створки МК, комиссуральной пластикиМК [8, 14–19]; 2) протезирование митрального клапана с полным иссечением подклапанных структур [20, 21]. Различные методы вмешательства на подклапаном аппарате МК могут устранить митральную недостаточность, однако среди вариантов нет оптимального [10]. Учитывая сложную взаимосвязь МН с хордо-папиллярным аппаратом МК и гипертрофией папиллярных мышц, нередко хирурги предпочитают протезировать митральный клапан [20, 21]. В исследовании мы сравнили две методики коррекции МН у пациентов с обструкивной гипертрофической кардиомиопатией.
Материал и методы
Клиническое исследование одобрено локальным этическим комитетом ФГБУ «ННИИПК им. акад. Е.Н. Ме-шалкина» Минздрава России. Участвовали пациенты, имеющие показания к хирургическому лечению, согласно руководству по ведению пациентов с обструктивной гипертрофической кардиомиопатией, в возрасте от 18 до 70 лет (включительно) на день подписания информированного согласия, с умеренной или выраженной МН вследствие
SAM-синдрома. На любом этапе пациенты могли отказаться от участия в исследовании без объяснения причин. Набирали клинический материал с ноября 2010 г. по август 2013 г. Обследовали 146 пациентов, включили в исследование и рандомизировали – 88. Распределили пациентов на две группы согласно дизайну исследования (рис. 1). В группе с сохранением МК в 6 случаях выполнили протезирование – этих пациентов исключили из исследования.
Критерии исключения: патология аортального клапана, требующая его протезирования; экстренное хирургическое вмешательство; органическое поражение МК; ожидаемая продолжительность жизни менее одного года.
Первичные конечные точки: функциональное состояние МК (возвратная митральная регургитация или дисфункция протеза митрального клапана) и градиент давления на уровне выходного отдела левого желудочка (ВОЛЖ).
Средний возраст в группах достоверно не различался и составил 51,4±14,4 и 47,9±14,1 года соответственно (p = 0,262). Остальные антропометрические характеристики представлены в табл. 1.
Выполняли процедуры в условиях гипотермического искусственного кровообращения (33–34 °С). В качестве кардиоплегии использовали кристаллоидный раствор Кус-
Таблица 1 Клинико-демографическая характеристика пациентов
После расширенной миоэктомии в I группе проводили обычное протезирование митрального клапана механическим протезом «МедИнж» (НПП «МедИнж», Пенза, Россия) или механическим протезом On-X (On-X Life Technologies, Inc., Техас, США). Выполнили протезирования, используя доступ по Карпантье (позади и параллельно межпредсердной борозды).
Во II группе выполняли вмешательства на подклапанных структурах МК. Вмешательства включали резекцию хорд второго порядка передней створки МК (от 2 до 4) (рис. 2, а); мобилизацию папиллярных мышц (высвобождение от всех аномальных предлежаний к стенкам ЛЖ) (рис. 2, б); продольную резекцию папиллярных мышц (если толщина мышцы более 15 мм) (рис. 2, в); резекцию аномальных хорд, идущих от створок или папиллярных мышц к стенкам ЛЖ; удаление аномальных папиллярных мышц (с сохранением функциональности митрального клапана).
Интраоперационно после основного этапа операции проводили чреспищеводную эхокардиографию с целью оценки адекватности выполнения резекции, объема резидуальной МН и отсутствия SAM-феномена.
Статистический анализ
Анализ данных проводили, используя программный пакет Statistica 10.0 (Statsoft, Inc., США) и Stata/SE 13.0 (StataCorp LP, США). Количественные признаки представлены как арифметическое среднее ± SD при нормальном распределении, количественные признаки с распределением, отличным от нормального, представлены как медиана и соответствующий интервал между 25-м и 75-м процентилями (Q1; Q3), качественные признаки – в виде
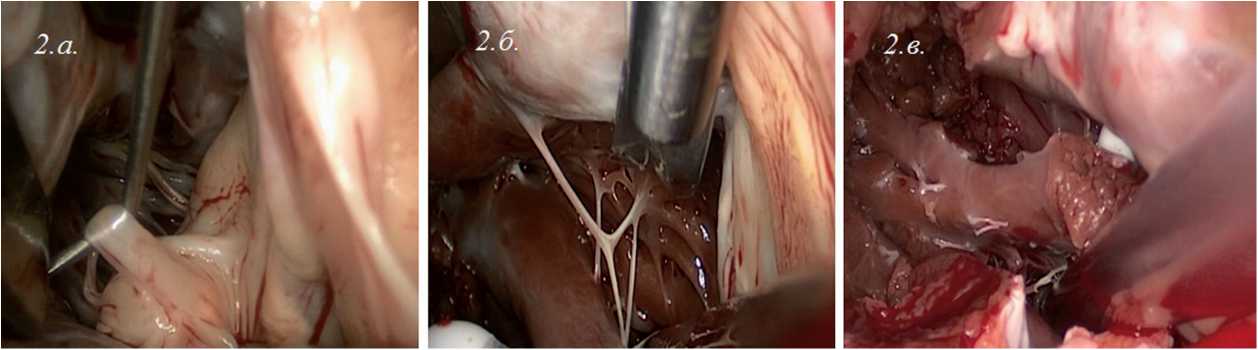
Рис. 2. Интраоперационно: а – резекция хорд второго порядка передней створки митрального клапана; б – мобилизация папиллярных мышц; в – продольная резекция папиллярных мышц
Таблица 2 Характеристика пациентов в послеоперационном периоде
Результаты
Госпитальная летальность составила 1 (2,4%) случай в I группе и отсутствовала во II группе (р = 0,314). Причиной единственного летального исхода послужил острый тромбоз протеза с дальнейшим развитием обширного острого нарушения мозгового кровообращения.
Среднее время пребывание пациентов в отделении реанимации составило для I и II групп 2 (1; 2) и 2 (1; 2) соответственно (p = 0,457). В табл. 2 предоставлена характеристика пациентов в послеоперационном периоде. Возникновение пароксизмов ФП в раннем послеоперационном периоде значительно чаще в I группе (p = 0,003).
В послеоперационном периоде у 5 пациентов в обеих группах операция осложнилась стойкой атриовентрикулярной блокадой, которая потребовала установку постоянного электрокардиостимулятора (p = 1,0), дефект межжелудочковой перегородки обнаружили в 1 (2,4%) случае в каждой из групп (р = 1,0), разрыв латеральной стенки ЛЖ произошел у 1 (2,4%) пациента в I группе (р = 1,0).
Среднее время госпитализации пациентов составило 14 (12; 22) в I и 14 (12; 16) дней во II группе (p = 0,072). На момент выписки в I–II ФК по NYHA находились 40 (97,5%) и 41 (100%) пациент из I и II групп соответственно (p = 0,314). Средний период наблюдения для I группы составил 23,2 мес. (95% ДИ 21,1–25,3), для II – 25,8 мес. (95% ДИ 25,4–26,2).
В табл. 3. представлены статистические внутригрупповые и межгрупповые эхокардиографические параметры левого желудочка в отдаленном периоде по сравнению с исходными данными. При анализе обнаружили достоверную внутригрупповую разницу и отсутствие межгрупповой разницы по объемно-размерным показателям левого желудочка.
В обеих группах не обнаружили появления SAM-синдрома и МН более 2+. Снижение толщины межжелудочковой перегородки и градиента давления в ВОЛЖ зарегистрировали в двух группах без статистической разницы (p = 0,152; p = 0,498). Внутригрупповой анализ показал регрессию массы миокарда ЛЖ в обеих группах, но при межгрупповом анализе достоверной разницы не выявили (p = 0,210).
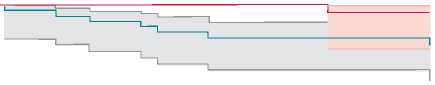
Анализ выживаемости по методу Каплана – Майера показал достоверную разницу между двумя группами: выживаемость пациентов в I группе на 12 мес. составила 87,8% (95% ДИ 73,1–94,7), на 26 мес. – 78,9% (95% ДИ 57,9–90,2); во II группе на 12 мес. – 100%, на 26 мес. – 96,6% (95% ДИ 78,6–99,5). Log-rank test = 0,034 (рис. 3, а ).
Причины летальности в I группе: 5 пациентов погибли в результате острого тромбоза механического клапана, один случай – внезапная сердечная смерть без каких-либо видимых органических причин при патологоанатомическом исследовании. Вероятно, это связано с фибрилляцией желудочков. Еще один летальный исход произошел из-за дислокации электрода электрокардиостимулятора. Во II группе 1 пациент погиб в результате ишемического острого нарушения мозгового кровообращения на 20-м мес., что, возможно, связано с сопутствующей патологией (атеросклероз брахиоцефальных артерий). Многофакторный регрессионный анализ предикторов и протекторов летального исхода не выявил достоверных параметров.
Таблица 3 Эхокардиографические параметры левого желудочка
|
I группа |
II группа |
p между |
||||||
|
группами, отдаленный период |
||||||||
|
Показатель |
исходно |
отдаленный период |
р |
исходно |
отдаленный период |
p |
группами, исходно |
|
|
Конечный диастолический |
3,9±0,5 |
4,3±0,7 |
0,006 |
3,8±0,4 |
4,5±0,5 |
<0,001 |
0,237 |
0,477 |
|
размер левого желудочка, см |
||||||||
|
Конечный диастолический |
70,1±24,6 |
97,8±34,9 |
0,025 |
64,9±18,9 |
93,2±27,7 |
<0,001 |
0,286 |
0,099 |
|
объем левого желудочка, мл |
||||||||
|
Ударный объем левого |
53,4±19,7 |
64,1±23,9 |
0,219 |
49,3±15,2 |
57,2±17,4 |
0,215 |
0,305 |
0,348 |
|
желудочка, мл |
||||||||
|
Фракция выброса левого |
72,9±6,9 |
67,1±6,6 |
0,026 |
75,7±7,2 |
66,3±7,3 |
<0,001 |
0,080 |
0,067 |
|
желудочка, % |
||||||||
|
Задняя стенка |
17,7±3,3 |
15,1±3,4 |
0,029 |
18,1±3,5 |
14,6±3,2 |
<0,001 |
0,768 |
0,223 |
|
левого желудочка, мм |
||||||||
|
Межжелудочковая |
25,5±4,3 |
17,5±3,8 |
<0,001 |
26,9±4,3 |
16,6±3,8 |
<0,001 |
0,152 |
0,498 |
|
перегородка, мм |
||||||||
|
Масса миокарда |
295,4±123,7 |
278,7±100,2 |
0,067 |
293,1±89,8 |
234,9±93,1 |
0,026 |
0,930 |
0,210 |
|
левого желудочка, гр. |
||||||||
|
Градиент в выходном |
89,1±20,4 |
13,1±6,4 |
<0,001 |
96,6±28,1 |
12,8±9,6 |
<0,001 |
0,168 |
0,934 |
|
отделе левого желудочка, torr |
||||||||
|
Митральная недостаточность, n |
(%) |
|||||||
|
незначительная |
0 |
36 (87,8) |
<0,001 |
0 |
41 (100) |
<0,001 |
1,0 |
1,0 |
|
умеренная |
17 (41,5) |
0 |
– |
18 (43,9) |
0 |
– |
0,823 |
– |
|
выраженная |
24 (58,5) |
0 |
– |
23 (56,1) |
0 |
– |
0,823 |
– |
Основная часть пациентов в отдаленном периоде находилась в I–II ФК по NYHA: 33 (97,1%) и 39 (95,1%) пациентов в I и II группах соответственно (p = 0,670). Межгрупповой анализ параметров качества жизни не выявил статистически достоверных различий между двумя группами ни по одному из параметров (табл. 4).
Показатели, отвечающие за работоспособность в профессиональной сфере, выполнение работы по дому, до операции у большинства пациентов ниже нормальных значений, у некоторых – на нижней границе нормы, на отдаленном этапе показали достоверное улучшение при внутригрупповом анализе, однако при межгрупповом сравнении статистически не различались (p = 0,236). Параметры показателей боли до операции, находящиеся на уровне ниже нормы, также статистически значимо улучшались в обеих группах, но при межгрупповом анализе статистически не различались (p = 0,781).
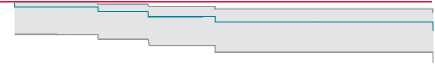
Свобода от тромбоза протеза МК в I группе на 12 мес. составила 92,5% (95% ДИ 78,6–97,5), а на 26 мес. – 83,2% (95% ДИ 77,9–93,4). Свобода от тромботических осложнений в II группе составила 100% на 12 и 26 мес. Кривая Каплана – Майера продемонстрирована на рис. 3, б. Частота тромботических осложнений в I группе достоверно выше, чем во II группе; Log-rank test = 0,026. Регрессионный анализ Кокса для выявления предикторов и протекторов тромботических осложнений показал отсутствие статистически значимых значений. В I группе среди выживших зарегистрирована транспротезная струя регургитации, которая заложена производителями как норма, а во II группе степень МН не превышала значения 2+, что свидетельствует об отсутствии умеренной митральной недостаточности. Проведя анализ по методу Каплана – Майера, получили 100% свободу от возврата умеренной МН в послеоперационном периоде у выживших пациентов.
Таблица 4 Межгрупповое сравнение параметров качества жизни
|
Параметр |
I группа, |
II группа, |
|
|
n = 34 |
n = 40 |
||
|
Общее |
|||
|
59,8±4,4 |
61,3±5,1 |
0,178 |
|
|
состояние здоровья (GH) |
|||
|
Физическое |
|||
|
76,3±8,3 |
78,6±7,4 |
0,177 |
|
|
функционирование (PF) |
|||
|
Ролевое физическое |
77,6±14,1 |
74,1±13,4 |
0,239 |
|
функционирование (RP) |
|||
|
Ролевое психическое |
|||
|
79,8±12,3 |
81,1±11,1 |
0,619 |
|
|
функционирование (RE) |
|||
|
Социальное |
48,5±8,5 |
50,3±8,7 |
0,347 |
|
функционирование (SF) |
|||
|
Интенсивность боли (BP) |
67,2±11,3 |
67,4±11,6 |
0,781 |
|
Жизненная активность (VT) |
60,7±12,7 |
62,6±12,3 |
0,504 |
|
Психическое здоровье (MH) |
61,7±8,1 |
62,5±7,3 |
0,669 |
а
1,00
0,75
0,50
0,25
б
95% ДИ
95% ДИ
I группа
II группа
Log-rank test, p = 0,034
0,00
|
Риск |
0 |
5 |
10 Время, мес. |
15 |
20 |
25 |
|
I группа |
41 |
38 |
36 |
33 |
32 |
27 |
|
II группа |
41 |
41 |
41 |
37 |
30 |
19 |
1,00
0,75
0,50
95% ДИ
95% ДИ
I группа
II группа
0,25
|
0,00 |
Log-rank test, p = 0,026 |
|||||
|
Риск |
0 |
5 |
10 Время, мес. |
15 |
20 |
25 |
|
I группа |
41 |
39 |
37 |
34 |
33 |
28 |
|
II группа |
41 |
41 |
41 |
37 |
30 |
19 |
Рис. 3. Кривая Каплана – Майера: а – частота выживаемости пациентов в отдаленном периоде; б – свобода от тромбоза протеза в отдаленном периоде
Обсуждение
На основании проспективного рандомизированного анализа мы впервые отразили сравнение двух тактических подходов хирургического лечения гипертрофической кардиомиопатии. Обструкция ВОЛЖ имеет сложную патологическую взаимосвязь с передним систолическим движением передней створки МК, вследствие чего возникает гемодинамически значимая митральная недостаточность [2, 13, 14, 9, 18, 22, 23].
В руководстве ESC 2014 по ведению пациентов c ГКМП отмечено, что до 20% пациентов нуждаются во вмешательстве на митральном клапане в объеме реконструкции или протезирования.
Протезирование митрального клапана является эффективной альтернативой лечения пациентов с обструктивной ГКМП, устраняющей как обструкцию вы- ходного тракта левого желудочка, так и митральную недостаточность вследствие SAM-синдрома. Следует также отметить, что нередко пациенты с ГКМП имеют ненормальную хордо-папиллярную привязанность, дополнительные папиллярные мышцы, что значительно осложняет обструкцию ВОЛЖ [1, 13, 24–26], поэтому часто выполняют протезирование митрального клапана вместо реконструкции [13, 26–28].
Комплексное вмешательство на подклапанных структурах в сочетании с адекватной расширенной миоэктомией практически во всех запланированных (согласно рандомизации) случаях позволило сохранить митральный клапан, полностью элиминировать SAM-синдром и митральную недостаточность. При этом градиент давления на уровне ВОЛЖ после устранения обструкции достоверно не различался в группах.
В некоторых случаях (12,7%) технически не удалось сохранить митральный клапан, что связано с грубыми фиброзными изменениями передней створки МК в результате длительного контакта с межжелудочковой перегородкой. Полученные данные коррелируют с ранее опубликованными результатами, продемонстрировавшими, что неуспешные попытки в сохранении МК могут достигать 15% [13, 18, 21].
Отдаленные результаты не показали межгруппового различия в улучшении функционального статуса пациентов, отсутствии рецидива обструкции ВОЛЖ и МН, а также продемонстрировали положительное ремоделирование левого желудочка. Сохранение митрального клапана у пациентов с обструктивной гипертрофической кардиомиопатией статистически значимо, положительно влияло на отдаленную выживаемость и свободу от тромботических осложнений в отличие от ранее опубликованных ретроспективных анализов [13, 29–31].
Заключение
Обструктивная гипертрофическая кардиомиопатия с хирургически значимой митральной недостаточностью является сложной патологией, которая характеризуется не только гипертрофией межжелудочковой перегородки, но и аномалией развития всех структур левого желудочка и связанной с ней митральной недостаточностью. Различные тактические подходы в хирургии обструктивной гипертрофической кардиомиопатии позволяют безопасно и эффективно устранить обструкцию и митральную недостаточность, улучшая функциональный статус и положительно влияя на ремоделирование левых отделов сердца как в раннем, так и отдаленном послеоперационном периоде. Сохранение митрального клапана у пациентов с обструктивной гипертрофической кардиомиопатией снижает частоту клапанообусловленных осложнений и улучшает отдаленную выживаемость. Отдаленные результаты показали достоверное улучшение функционального статуса и качества жизни пациентов в сравнении с дооперацион-ными показателями (p<0,001) без статистически достоверной разницы между группами.
Результаты, согласно полученным данным отдаленной выживаемости и свободе от тромбозов протеза, можно рассматривать для групп со сроком наблюдения не более 2 лет. Для полноты исследования и оценки ремоделирования левого желудочка требуется оценка отдаленных результатов на контрольных точках 3 и 5 лет.
Список литературы Протезирование или сохранение митрального клапана: выбор оптимальной тактики хирургического лечения обструктивной гипертрофической кардиомиопатии
- Levine R.A., Vlahakes G.J., Lefebvre X., Guerrero J.L., Cape E.G., Yoganathan A.P., Weyman A.E. Papillary muscle displacement causes systolic anterior motion of the mitral valve. Experimental validation and insights into the mechanism of subaortic obstruction//Circulation. 1995. Vol. 91. Ns 4. P. 1189-95.
- Wigle E.D., Sasson Z, Henderson M.A., Ruddy T.D., Fulop J., Rakowski H., Williams W.G. Hypertrophic cardiomyopathy. The importance of the site and the extent of hypertrophy. A review//Prog. Cardiovasc. Dis. 1985. Vol. 28. МИ.Р. 1-83.
- Shah P.M., Taylor R.D., Wong M. Abnormal mitral valve coaptation in hypertrophic obstructive cardiomyopathy: proposed role in systolic anterior motion of mitral valve//Am J. Cardiol. 1981. Vol. 48. № 2. P. 258-62.
- Grigg L.E., Wigle E.D., Williams W.G., Daniel L.B., Rakowski H. Transesophageal Doppler echocardiography in obstructive hypertrophic cardiomyopathy: clarification of pathophysiology and importance in intraoperative decision making//J. Am. Coll. Cardiol. 1992. Vol. 20. № 1. P. 42-52.
- Bonow R.O. Determinants of exercise capacity in hypertrophic cardiomyopathy//J. Am. Coll. Cardiol. 1992. Vol. 19. № 3. P. 513-515.
- Enriquez-Sarano M., Avierinos J.F., Messika-Zeitoun D., Detaint D., Capps M., Nkomo V., Scott C, Schaff H.V., Tajik A.J. Quantitative determinants of the outcome of asymptomatic mitral regurgitation II N. Engl. J. Med. 2005. Vol. 352. P. 875-83.
- Ferrazzi P., Spirito P., lacovoni A., Calabrese A., Migliorati K., Simon C, Pentiricci S., Poggio D., Grillo M., Amigoni P., lascone M., Mortara A., Maron B.J., Senni M., Bruzzi P. Transaortic Chordal Cutting. Mitral Valve Repair for Obstructive Hypertrophic Cardiomyopathy With Mild Septal Hypertrophy II J. Am. Coll. Cardiol. 2015. Vol. 66. P. 1687-96.
- Balaram S.K., Sherrid M.V., Derose J.J. Jr., Hillel Z, Winson G., Swistel D.G. Beyond extended myectomy for hypertrophic cardiomyopathy: resection-plication-release (RPR) repair//Ann. Thorac. Surg. 2005. Vol. 80. P. 217-23.
- Minakata K., Dearani J.A., Nishimura R.A., Maron B.J., Danielson G.K. Extended septal myectomy for hypertrophic obstructive cardiomyopathy with anomalous mitral papillary muscles or chordae//J. Thorac. Cardiovasc. Surg. 2004. Vol. 127. P. 481-9.
- A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. 2011 АССҒ/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy//J. Thorac. Cardiovasc. Surg. 2011. Vol. 142. P. 153-203.
- Maslow A.D., Regan M.M., Haering J.M., Johnson R.G., Levine R.A. Echocardiographic predictors of left ventricular outflow tract obstruction and systolic anterior motion of the mitral valve after mitral valve reconstruction for myxomatous valve disease II J. Am. Coll. Cardiol. 1999. Vol. 34. P. 2096-104.
- Lee K.S., Stewart W.J., Lever H.M., Underwood P.L., Cosgrove D.M. Mechanism of outflow tract obstruction causing failed mitral valve repair. Anterior displacement of leaflet coaptation II Circulation. 1993. Vol. 88. P. N24-9.
- Карiе R.K., Murphy R.T., DiPaola L.M., Houghtaling P.L., Lever H.M., Lytle B.W., Blackstone E.H., Smedira N.G. Mitral valve abnormalities in hypertrophic cardiomyopathy: echocardiographic features and surgical outcomes II Ann. Thorac. Surg. 2008. Vol. 85. P. 1527-35,1535.e1-2.
- Cooley D.A. Surgical technique for hypertrophic left ventricular obstructive myopathy including mitral valve plication II J. Cardiac. Surg. 1991. Vol. 6. P. 29-33.
- Balaram S.K., Тугiе L, Sherrid M.V., Afthinos J., Hillel Z, Winson G., Swistel D.G. Resection-plicationrelease for hypertrophic cardiomyopathy: clinical and echocardiographic follow-up II Ann. Thorac. Surg. 2008. Vol. 86. P. 1539-44.
- Nasseri В. A, Stamm С., Siniawski Н., Kukucka М., Komoda Т., Delmo Walter Е.М., Hetzer R. Combined anterior mitral valve leaflet retention plasty and septal myectomy in patients with hypertrophic obstructive cardiomyopathy//Eur.J. Cardiothorac. Surg. 2011. Vol. 40. № 6. P. ISIS-20.
- Schoendube F.A., Klues H.G., Reith S., Flachskampf F.A., Hanrath P., Messmer B.J. Long-term clinical and echocardiographic follow-up after surgical correction of hypertrophic obstructive cardiomyopathy with extended myectomy and reconstruction of the subvalvular mitral apparatus II Circulation. 1995. Vol. 92. Suppl. 9. P. N122-7.
- McIntosh C.L., Maron B.J., Cannon R.O. 3rd, Klues H.G. Initial results of combined anterior mitral leaflet plication and ventricular septal myotomy-myectomy for relief of left ventricular outflow tract obstruction in patients with hypertrophic cardiomyopathy II Circulation. 1992. Vol. 86. Suppl. 5. P. N60-7.
- Kofflard M.J., van Herwerden LA, Waldstein D.J., Ruygrok P., Boersma E., Taams M.A., Ten Cate F.J. Initial results of combined anterior mitral leaflet extension and myectomy in patients with obstructive hypertrophic cardiomyopathy//J. Am. Coll. Cardiol. 1996. Vol. 28. № 1. P. 197-202.
- Wan C.K., Dearani J.A., Sundt T.M. 3rd, Ommen S.R., Schaff H.V. What Is the Best Surgical Treatment for Obstructive Hypertrophic Cardiomyopathy and Degenerative Mitral Regurgitation/II Ann. Thorac. Surg. 2009. Vol. 88. P. 727-732.
- Богачев-Прокофьев A.B., Железнев С.И., Фоменко M.C., Афанасьев А.В., Шарифулин Р.М., Пивкин АН., Демидов Д.П., Караськов А.М. Первый опыт расширенной миоэктомии при хирургическом лечении обструктивной гипертрофической кардиомиопатии: непосредственные и промежуточные результаты II Патология кровообращения и кардиохирургия. 2015. Т. 19. № 2. С. 20-25.
- Sherrid M.V., Chaudhry F.A., Swistel D.G. Obstructive hypertrophic cardiomyopathy: Echocardiography, pathophysiology, and the continuing evolution of surgery for obstruction//Ann. Thorac. Surg. 2003. Vol. 75. P. 620-32.
- Klues H.G., Roberts W.C., Maron B.J. Anomalous insertion of papillary muscle directly into anterior mitral leaflet in hypertrophic cardiomyopathy: significance in producing left ventricular outflow obstruction II Circulation. 1991. Vol. 84. P. 1188-97.
- Klues H.G., Maron B.J., Dollar A.L., Roberts W.C. Diversity of structural mitral valve alterations in hypertrophic cardiomyopathy II Circulation. 1992. Vol. 85. P. 1651-60.
- Sherrid M.V., Gunsberg D.Z., Moldenhauer S., Pearle G. Systolic anterior motion begins at low left ventricular outflow tract velocity in obstructive hypertrophic cardiomyopathy//J. Am. Coll. Cardiol. 2000. Vol. 36. P.1344-54.
- Patel P., Dhillon A, Popovic ZB., Patel P., Dhillon A., Popovic ZB., Smedira N.G., Rizzo J., Thamilarasan M., Agler D., Lytle B.W., Lever H.M., Desai M.Y. Left ventricular outflow obstruction in hypertrophic cardiomyopathy patients without severe septal hypertrophy: implications of mitral valve and papillary muscle abnormalities assessed using cardiac magnetic resonance and echocardiography II Circ. Cardiovasc. Imaging. 2015. Vol. 8. P. e003132.
- Desai M.Y., Bhonsale A, Smedira N.G., Naji P., Thamilarasan M., Lytle B.W., Lever H.M. Predictors of long-term outcomes in symptomatic hypertrophic obstructive cardiomyopathy patients undergoing surgical relief of left ventricular outflow tract obstruction II Circulation. 2013. Vol. 128. P. 209-16.
- McIntosh C.L., Maron B.J. Current operative treatment of obstructive hypertrophic cardiomyopathy//Circulation. 1988. Vol. 78. P. 487-95.
- Walker W.S., Reid K.G., Cameron E.W., Walbaum P.R., Kitchin AH. Comparison of ventricular septal surgery and mitral valve replacement for hypertrophic obstructive cardiomyopathy II Ann. Thorac. Surg. 1989. Vol. 48. Nfe 4. P. 528-34.
- McIntosh C.L, Greenberg G.J., Maron B.J., Leon M.B., Cannon R.O,3rd, Clark R. E. Clinical and Hemodynamic Results After Mitral Valve Replacement in Patients With Obstructive Hypertrophic Cardiomyopathy//Ann. Thorac. Surg. 1989. Vol. 47. P. 23646.
- Stassano P., Di Tommaso L., Triggiani D., Contaldo A., Gagliardi C, Spampinato N. Mitral valve replacement and limited myectomy for hypertrophic obstructive cardiomyopathy: a 25-year follow-up//Tex. Heart Inst J. 2004. Vol. 31. P. 137-142.


