Противоопухолевое действие наночастиц металлов (экспериментальное исследование)
Автор: Сидоренко Ю.С., Златник Е.Ю., Передреева Л.В., Бородулин В.Б.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биологические науки
Статья в выпуске: 5-2 т.11, 2009 года.
Бесплатный доступ
Проведено экспериментальное изучение действия введения наночастиц (НЧ) металлов (Zn, Cu, Fe и их сплава) на рост перевиваемых опухолей мышей: асцитной саркомы 37 и солидной саркомы 180. НЧ вводили в область опухоли в суммарной дозе 20 мкг на мышь. Контрольным группам вводили физиологический раствор. Изучали динамику роста опухоли, состояние опухолевых клеток, выживаемость и продолжительность жизни мышей. Установлено, что НЧ обладают выраженным противоопухолевым эффектом, вызывая регрессию опухоли вплоть до полной, повышение процента погибших и дистрофически измененных опухолевых клеток и способствуя увеличению продолжительности жизни подопытных мышей без внешних признаков интоксикации.
Наночастицы, металлы, противоопухолевый эффект
Короткий адрес: https://sciup.org/148198774
IDR: 148198774 | УДК: 616?006.04:615.2
Текст научной статьи Противоопухолевое действие наночастиц металлов (экспериментальное исследование)
представляющие собой ультрадисперсные порошки металлов (Cu, Zn, Fe) и их сплава, синтезированные на Саратовском плазмохимическом комплексе ГНЦ ГНИИХТЭОС. Экспериментальное исследование проводили на моделях двух перевиваемых опухолей мышей: быстрорастущей асцитной саркоме 37 и медленнорастущей солидной саркоме 180. На обеих моделях изучали влияние введения НЧ металлов на регрессию опухоли; кроме того, на первой оценивали состояние опухолевых клеток, а на второй – выживаемость и продолжительность жизни опухоленосителей. В опытах использовали 40 белых беспородных мышей-самцов массой 18-20 г, содержащихся в стандартных условиях вивария. Для перевивки саркомы 37 20 мышам вводили внутрибрюшинно по 0,1 мл асцитической жидкости опухолено-сителя, разведенной в 0,2 мл среды 199, после чего опухоль росла в течение 4-х суток. Затем, когда происходило очевидное увеличение объема живота мышей, начинали ежедневное внутрибрюшинное введение взвеси НЧ металлов (Zn, Cu или Fe) в концентрации 10 мкг/мл по 0,5 мл. Контрольная группа мышей аналогичным образом получала по 0,5 мл физиологического раствора. НЧ вводили в течение 4-х дней, суммарная доза составляла 20 мкг/мышь. Затем введение прекращали и наблюдали животных еще в течение 4-х дней, чтобы оценить стойкость полученного эффекта. Таким образом, опухоль развивалась 12 дней, из них первые 4 дня и последние 4 дня НЧ мышам не вводили. Доза НЧ была выбрана исходя из средних доз современных металлосодержащих цитостатиков (препаратов платины), применяемых в клинической практике, и составила 1 мг/кг массы. На 13-е сутки у каждой мыши шприцом удаляли асцитическую жидкость (АЖ), измеряли ее объем. В пробах АЖ определяли количество опухолевых клеток путем подсчета в камере Горяева и процент погибших клеток, окрашивающихся трипановым синим; рассчитывали абсолютное количество живых опухолевых клеток на каждое животное по формуле:
N=VАЖ х n х %ЖК, где N - абсолютное количество живых опухолевых клеток на каждую мышь; V - объем АЖ; n - количество опухолевых клеток в 1 мл АЖ; ЖК – живые опухолевые клетки.
Солидный компонент опухоли, развивающийся в брюшной полости, измеряли, фиксировали формалином, окрашивали гематоксилином Карачи и изучали с помощью световой микроскопии. Саркому 180 перевивали 20 мышам под кожу спины, где она росла в течение 3-х недель до размера 20-40 мм3. Затем мышам начинали введение взвеси НЧ металлов в опухоль по 0,2 мл в концентрации 10 мкг/мл НЧ Zn, НЧ Cu и НЧ сплава (Zn+Cu+Fe), животным контрольной группы вводили физиологический раствор. Введение НЧ осуществляли в течение 5 недель 1 раз в 3-4 дня, всего было выполнено 10 инъекций, суммарная доза НЧ составила 20 мкг на каждую мышь. Объем опухолей еженедельно измеряли и выражали в мм3. Кроме того, отмечали общее состояние и падеж животных. Срок наблюдения после начала введения НЧ составил 15 недель, в том числе, 10 недель после завершения введения НЧ. Статистическую обработку всех исследованных показателей проводили с использованием t-критерия Стьюдента и критерия Уил-коксона-Манна-Уитни.
Результаты. Результаты изучения влияния введения НЧ металлов на рост саркомы 37 и количество ее клеток у мышей опытных и контрольной групп представлены в таблице 1.
Таблица 1. Влияние введения НЧ металлов на рост саркомы 37 у мышей
|
Группы мышей |
Объем |
Количество опухолевых клеток |
||
|
АЖ (мл) |
солидной опухоли (мм3) |
n (106/мл АЖ) |
N (106/ мышь) |
|
|
Контроль |
1,79±0,36 |
574±95 |
27,7±2,86 |
23,98±10,5 |
|
НЧ Zn |
0,78±0,31* |
154±88* |
1,67±0,5* |
0,636±0,2* |
|
НЧ Cu |
2,16±0,68** |
374±90 |
8,13±1,54* ** |
11,1±3,53** |
|
НЧ Fe |
3,3±1,0** |
322±112 |
8,26±2,37* ** |
17,7±5,7** |
Примечание : * - статистически достоверные отличия от контроля; ** - статистически достоверные отличия от данных, полученных с НЧ Zn (Р<0,05)
Как видно из таблицы 1, у мышей всех групп с перевивной саркомой 37 в брюшной полости обнаружена АЖ, минимальный объем ее отмечен у животных, получавших НЧ Zn, а максимальный – у животных, получавших НЧ Fe. При этом статистически достоверные отличия от контрольной группы, демонстрируют только мыши, которым вводили НЧ Zn: у них объем АЖ был статистически значимо ниже, чем в контрольной группе. У животных этой же опытной группы объем АЖ был меньше, чем у мышей, которым вводили НЧ других металлов (Cu и Fe).
Аналогичные различия установлены по количеству опухолевых клеток в АЖ мышей. Минимальное количество живых опухолевых клеток как на 1 мл АЖ, так и на каждую мышь определялось у животных, получавших НЧ Zn, а максимальное – у животных контрольной группы. Введение НЧ Zn приводит к статистически значимому снижению абсолютного количества живых клеток саркомы 37 не только по сравнению с контрольной группой (их уровень составлял всего 2,6% от контроля), но и по сравнению с мышами, которым вводили НЧ Cu и НЧ Fe. Количество живых опухолевых клеток у мышей, получавших НЧ Cu и НЧ Fe, рассчитанное на 1 мл АЖ, было статистически достоверно ниже, чем у контрольных животных. Однако в пересчете на каждую мышь указанные различия были статистически недостоверны из-за вариабельности индивидуальных данных. Показатели, характеризующие количество опухолевых клеток в АЖ мышей, которым вводили НЧ Cu и Fe, не имели статистически достоверных различий между собой.
Солидный компонент саркомы 37 был также наименьшим у мышей, получавших НЧ Zn (табл. 1). Результаты его гистологического исследования у опытных и контрольных животных представлены в таблице 2 и на рисунках 1-4. В опухолях мышей, получавших НЧ Zn, капсула была значительно толще, чем у контрольных. При действии НЧ Zn между очагами опухолевых клеток наблюдались обширные поля некроза (рис. 2А) и жировой дистрофии (рис. 2Б), тогда как у контрольных животных отмечались крупные очаги с плотным или разреженным расположением опухолевых клеток (рис. 1).
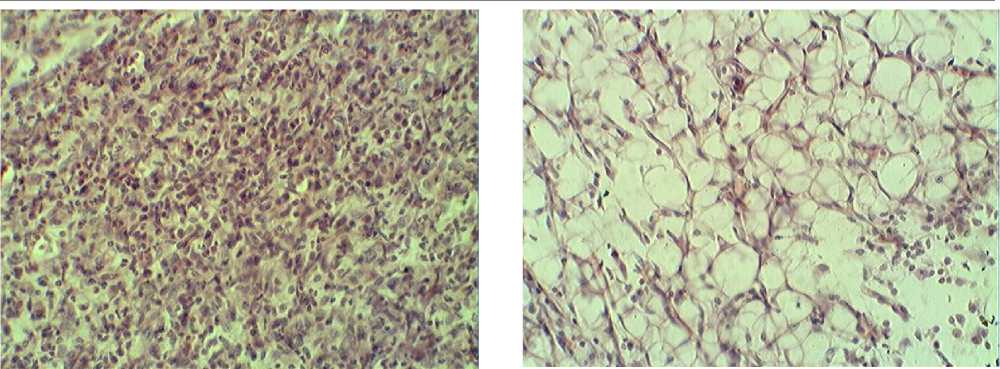
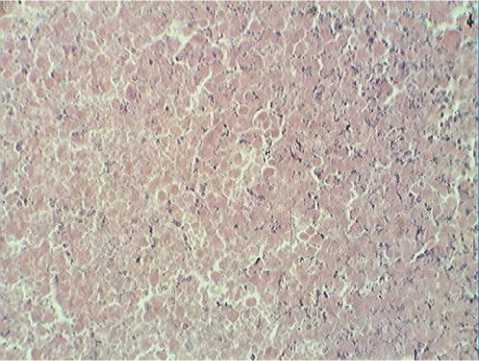
Рис.1 . Саркома 37 (контроль). Окраска гематоксилином. Ув. х400.
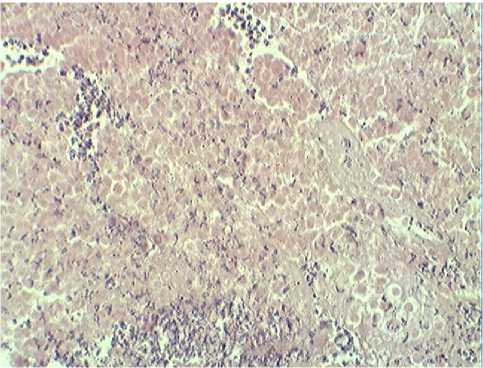
Б
Рис. 3. Саркома 37 (введение НЧ Cu).
Окраска гематоксилином. Ув.х400.
А –жировая дистрофия, Б – поле некроза
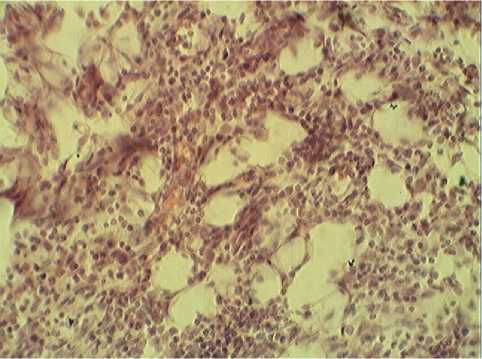
Б
Рис.2. Саркома 37 (введение НЧ Zn). Окраска
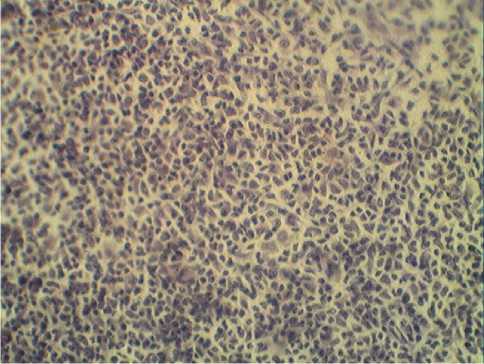
Рис. 4. Саркома 37 (действие НЧ Fe). Окраска гематоксилином. Ув. х400.
гематоксилином. Ув. х400.
А – поле некроза, Б – жировая дистрофия
Введение НЧ Cu приводило к сходным изменениям (рис. 3А, 3Б), а после введения НЧ Fe участки некроза были незначительными, а размер и характер очагов опухоли были близки к контрольным пробам (рис. 4).
Клетки саркомы 37 представлены двумя генерациями: крупными полигональными с оксифильной цитоплазмой и небольшими овальными с базофильной цитоплазмой, каждый из видов образует разные очаги. У животных, получавших НЧ Fe, преобладали клетки первой генерации, а у мышей, которым вводили НЧ Cu, – второй. Встречались гигантские клетки, количество которых в контроле составляло до 20 в поле зрения, при действии НЧ Fe до 17, НЧ Cu – до 10, НЧ Zn – до 8 в поле зрения. Количество опухолевых клеток, находящихся в состоянии митоза, также было минимально при действии НЧ Zn и составляло 1-2 в поле зрения, при действии НЧ Cu – 3-4, Fe – 6-7 в поле зрения, последнее значение было на уровне контроля. Количество дистрофически измененных опухолевых клеток при введении различных НЧ представлено в таблице 2.
Таблица 2. Сравнительная характеристика дистрофических изменений в клетках саркомы 37 при введении НЧ различных металлов
|
Группы мышей |
Дистрофически измененные клетки, % |
Виды дистрофических изменений (%) |
|||
|
Кариопик-ноз |
Кариорексис |
Кариолизис |
Вакуолизация ядра и цитоплазмы |
||
|
Контроль |
13,74±2,3 |
22,53±1,18 |
29,41±1,79 |
29,41±1,79 |
17,65±1,52 |
|
НЧ Zn |
71,69±8,74* |
16,67±1,5* |
29,17±2,02 |
50,0±6,11* |
4,16±0,73* |
|
НЧ Cu |
48,2±5,58* |
21,43±1,88 |
28,57±3,37 |
42,86±3,2* |
7,14±1,05* |
|
НЧ Fe |
21,66±4,31 |
17,65±2,22 |
35,29±4,35 |
29,41±2,78 |
17,65±1,32 |
Примечание: * - статистически достоверные отличия от контроля (Р<0,05)
Как видно из таблицы 2, введение НЧ Zn и НЧ Cu вызывает резкое повышение процента дистрофически измененных опухолевых клеток саркомы 37; действие НЧ Zn является более выраженным. Среди отдельных видов дистрофии при действии НЧ Zn преобладает ка-риолизис, т.е., наиболее грубые повреждения клеток, при этом меньше, чем в других группах, таких изменений, как кариопикноз и вакуолизация. Таким образом, введение НЧ Zn способствует наибольшему повреждению опухолевых клеток асцитной саркомы. Далее по своему разрушительному действию следуют НЧ Cu, а у НЧ Fe такое действие минимально и статистически недостоверно. Итак, на модели саркомы 37 установлено, что максимальным повреждающим эффектом на асцитную опухоль обладают НЧ Zn, затем НЧ Cu, а наименьшим эффектом – НЧ Fe.
Результаты изучения динамики регрессии опухоли, выживаемости и продолжительности жизни мышей-опухоленосителей с саркомой 180, получавших НЧ металлов, представлены в таблице 3.
Таблица 3. Влияние введения НЧ металлов на динамику регрессии саркомы 180
|
Группы мышей |
Показатели |
Сроки наблюдения (недели после начала введения НЧ) |
||||||||
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
||
|
и 5 |
V (мм3) М±m |
38±1,76 |
50±18,7 |
78±29,7 |
131±37,8 ** |
191±83,6 ** |
283±128 ** |
297±56,1 ** |
298 |
- |
|
N |
5/0 |
5/0 |
5/0 |
5/0 |
5/0 |
5/0 |
4/0 |
1/0 |
0 |
|
|
НЧ Zn |
V (мм3) М±m |
22±7,1* |
11±6,4* |
6,2±5,06 * |
8 |
12,5 |
8 |
2 |
0 |
0 |
|
N |
5/0 |
5/0 |
5/0 |
5/2 |
5/3 |
5/4 |
5/4 |
5/5 |
5/5 |
|
|
НЧ Cu |
V (мм3) М±m |
29±8,4 |
15,6±7,1 |
7,8±3,96 *** |
16±12,9* |
14,5±8,2 * |
3,75±2,2** * |
6 |
0 |
0 |
|
N |
5/0 |
5/0 |
5/0 |
5/1 |
5/1 |
5/1 |
5/4 |
5/5 |
5/5 |
|
|
НЧ cпла ва |
V (мм3) М±m |
27±6,2 |
10,8±3,9 6* ** |
6,2±3,96 * ** |
3,5±1,4* ** |
0,73±0,4 2*** |
1 |
0 |
0 |
0 |
|
N |
5/0 |
5/0 |
5/0 |
5/1 |
5/2 |
5/4 |
5/5 |
5/5 |
5/5 |
|
Примечание: * - статистически достоверные отличия от контроля (Р<0,05); ** - статистически достоверные отличия от первоначального срока исследования (0); V - объем опухоли; N - число животных (число живых мышей/число мышей с полной регрессией опухоли)
Из данных, представленных в таблице 3, видно, что у мышей контрольной группы опухоль растет в течение всего срока наблюдения (за 1 мес. ее объем увеличивается в 5,02 раз, а за 7 недель – в 7,8 раз). При этом у животных опытных групп отмечается ее выраженная регрессия (при введении НЧ Zn объем опухоли за 1 мес. уменьшается в 1,76 раза, НЧ Cu – в 1,8 раза, НЧ сплава НЧ – в 37 раз). Она регистрируется у всех мышей, получавших НЧ, уже через
1 неделю после их начала введения и последовательно продолжается вплоть до полного исчезновения опухоли, несмотря на то, что у разных животных даже в пределах одной группы происходит с неодинаковой скоростью. Первые случаи полной регрессии саркомы 180 обнаружены, начиная с 3-й недели наблюдения (табл. 3). Через 1,5 мес. наблюдения в контрольной группе на фоне роста опухоли начинается падеж мышей, а из животных опытных групп пальпируемые опухоли сохраняются только у 2-х мышей – у одной, получавшей НЧ Zn, и у одной, получавшей НЧ Cu. Все мыши, которым вводили НЧ сплава, к этому времени демонстрируют полную регрессию опухоли (табл. 3). К 8-й неделе наблюдения все контрольные мыши пали, а у всех мышей всех опытных групп регистрируется полная регрессия саркомы 180. Все они живы, активны, без видимых признаков интоксикации. Следует отметить, что введение НЧ закончено на 5-й неделе, а регрессия продолжается вплоть до 7й, т.е., по-видимому, имеет место кумулятивный эффект или последействие. К 15-й неделе ни у одной из опытных мышей не происходит рецидивирования опухоли; наблюдение продолжается.
Выводы: НЧ металлов проявляют противоопухолевое действие на двух экспериментальных моделях: перевивных мышиных саркомах 37 и 180. Введение взвеси НЧ непосредственно в опухоль вызывает гибель и дистрофические изменения опухолевых клеток, выраженное уменьшение объема асцитной опухоли, особенно демонстративное при действии
НЧ Zn, а также способствует увеличению выживаемости и продолжительности жизни жи-вотных-опухоленосителей, приводя к полной регрессии солидной опухоли. В отношении последней все использованные НЧ показывают сходную активность, однако, наибольшая отмечена у НЧ сплава металлов (Cu+Zn+Fe). Высокая эффективность, показанная в эксперименте, и отсутствие видимых признаков интоксикации при применении НЧ металлов позволяет говорить об их перспективности в качестве противоопухолевых препаратов.
Список литературы Противоопухолевое действие наночастиц металлов (экспериментальное исследование)
- Мешалкин, Ю.П. Перспективы и проблемы использования неорганических наночастиц в онкологии./Ю.П. Мешалкин, Н.П. Бгатова//Journal of Siberian Federal University. Biology. -2008. -Т. 1, №3 -С. 204-208.
- Чехун, В.Ф. Нанотехнологии в онкологии: настоящее и будущее.//Онкология. -2008. -Т.10, №1. -С. 7-8.
- Кудрин, А.В. Микроэлементы в иммунологии и онкологии/А.В. Кудрин, О.М. Громова. -М.: ГЭОТАР-Медиа, 2007. -544 с.
- Златник, Е.Ю. Цитотоксическое действие наночастиц металлов на опухолевые клетки in vitro/Е.Ю. Златник, Г.И. Закора, Л.В. Передреева и др.//«Нанотехнологии в онкологии 2008». Тез. докл. Всеросс. науч. конф. с междунар. участием. -М., 2008. -С. 22.
- Златник, Е.Ю. Иммунотропное и противоопухолевое действие наночастиц металлов./Е.Ю. Златник, Г.И. Закора, В.Б. Бородулин, Л.В. Передреева//Росс. аллергол. журнал. -2009. -Вып. 1, №3. -С. 201.


