Противораковые МРНК-вакцины на основе неоантигенов
Автор: Старостина Е.В., Низоленко Л.Ф., Карпенко Л.И., Ильичев А.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 6 т.23, 2024 года.
Бесплатный доступ
Цель исследования - обобщение имеющихся данных о клинических испытаниях вакцин, основанных на мРНК, кодирующих неоантигены. материал и методы. Поиск опубликованных с января 2013 г. по май 2024 г. данных проводился на сайтах https://classic.clinicaltrials.gov и https://pubmed.ncbi.nlm.nih. gov/ по ключевым словам «neoantigen» и «vaccine», а затем отбиралась информация о препаратах на основе мРНК. Из 148 найденных исследований 54 было отобрано для написания систематического обзора.
Рак, иммунотерапия, мрнк-вакцины, неоантигены, клинические испытания, обзор
Короткий адрес: https://sciup.org/140308730
IDR: 140308730 | УДК: 616-006.6:615.038:615.277.3 | DOI: 10.21294/1814-4861-2024-23-6-149-158
Текст обзорной статьи Противораковые МРНК-вакцины на основе неоантигенов
Цель исследования – обобщение имеющихся данных о клинических испытаниях вакцин, основанных на мРНК, кодирующих неоантигены. Материал и методы. Поиск опубликованных с января 2013 г. по май 2024 г. данных проводился на сайтах и gov/ по ключевым словам «neoantigen» и «vaccine», а затем отбиралась информация о препаратах на основе мРНК. Из 148 найденных исследований 54 было отобрано для написания систематического обзора. Результаты. Библиометрический анализ данных в области терапевтических противораковых вакцин за 2013–24 гг. показал, что большая часть исследований посвящена мРНК-вакцинам, кодирующим неоантигены. В обзоре представлены краткое описание мРНК-платформы и обзор клинических испытаний противораковых мРНК-вакцин, проходивших в период с 2013 по 2024 г. Рассматриваются препараты ведущих биотехнологических фирм Европы и США, занимающихся разработкой противораковых мРНК-вакцин, таких как Цевумеран (BioNTech), mRNA-4157/V940 (Moderna), а также вакцин компаний КНР – Stemirna Therapeutics, NeoCura, Hangzhou Neoantigen Therapeutics и др. Заключение. Использование технологии создания вакцин на основе мРНК, кодирующих опухолевые неоантигены, способно в значительной степени повысить потенциал противоопухолевой иммунотерапии.
Несмотря на значительный прогресс в борьбе с онкологическими заболеваниями, они остаются второй причиной смертности во всем мире [1]. Традиционные методы лечения злокачественных новообразований (ЗНО) включают хирургию, радиотерапию, химиотерапию, таргетную терапию, иммунотерапию и их комбинации. Толчком к появлению новых идей в области иммунотерапии рака послужило эффективное лечение ряда ЗНО с помощью ингибиторов иммунных контрольных точек [2]. Иммунотерапия рака направлена на активацию специфического иммунитета хозяина, что приводит к угнетению роста опухоли и, в конечном итоге, к уменьшению ее размеров, а также повышению общей выживаемости [3].
Многообещающие перспективы борьбы со злокачественными новообразованиями ожидаются от противораковых вакцин. Они могут быть как профилактическими, предотвращающими развитие рака у лиц с высоким риском, так и терапевтическими. Вакцины, нацеленные на ассоциированные с опухолью антигены, которые предпочтительно экспрессируются в раковых клетках, например факторы роста, или антигены, уникальные для злокачественных клеток из-за соматических мутаций, обладают как профилактическим, так и терапевтическим потенциалом. Разработка противораковых вакцин способна произвести революцию в лечении, предложив более целенаправленный подход с меньшим количеством побочных эффектов по сравнению с традиционными методами [4].
Весьма перспективно выглядят вакцины на основе нуклеиновых кислот (ДНК или мРНК). Во-первых, они позволяют одновременно доставлять несколько различных опухоль-специфических антигенов с необходимыми соматическими мутациями, вызывая как гуморальный, так и клеточноопосредованный иммунный ответ. Во-вторых, вакцины на основе нуклеиновых кислот могут кодировать полноразмерные антигены, позволяя одновременно представлять множество эпитопов, стимулируя более широкий иммунный ответ [5, 6]. Вакцины на основе нуклеиновых кислот отличаются легкостью производства, масштабируемостью, простотой хранения и безопасностью. Таким образом, они отвечают всем требованиям современности [7, 8].
Особенно привлекательны вакцины на основе матричной РНК (мРНК), поскольку мРНК могут транслироваться как в делящихся, так и в неде-лящихся клетках; скорость и величина синтеза белка с мРНК обычно выше, чем у ДНК-вакцин; в отличие от ДНК-вакцин, мРНК-вакцины не могут интегрироваться в последовательность генома, что исключает инсерционный мутагенез; производство мРНК-вакцин отличается быстротой и относительно низкой стоимостью [4, 9].
Исследования последних десятилетий помогли избавиться от ряда недостатков, при- сущих мРНК-вакцинам. Модификации остова мРНК и нетранслируемых областей сделали мРНК менее чувствительной к РНКазам, более стабильной и высокотранслируемой. Общепринятый метод получения мРНК противораковых терапевтических вакцин включает синтез РНК на матрице ДНК с последующим 5′-кэпированием и 3′-полиаденилированием. Это относительно простая технология, однако получение высококачественных терапевтических мРНК, не вызывающих сильного воспаления, представляет собой серьезную проблему. В последнее время она решается за счет совершенствования методов кэпирования и полиаденилирования, включения модифицированных нуклеозидов, оптимизации кодирующих последовательностей и тщательной очистки мРНК. Эти методы позволяют уменьшить воспалительные реакции и улучшить трансляцию [3, 10–12].
мРНК в иммунотерапии рака
В качестве основного компонента вакцин против рака и инфекционных заболеваний мРНК, синтезированная in vitro, впервые была использована в доклинических исследованиях в 1990-е годы [13–16]. В 1995 г. было показано, что защитный противоопухолевый иммунитет у мышей может быть достигнут путем внутримышечной инъекции мРНК, кодирующей ген карциноэмбрионального антигена (СЕА) [14]. В 1999 г. на модели мышиной меланомы показано, что иммунизация путем введения мРНК gp100 в селезенку задерживает рост опухоли и значительно продлевает выживаемость по сравнению с контрольными мышами [16].
С тех пор разработаны и исследованы десятки препаратов мРНК в качестве потенциальных вакцин против онкологических заболеваний, для некоторых из них проведены клинические испытания. CV9103, вакцина против рака простаты, содержащая аутоадъювантную мРНК (RNAktive®), кодирующую антигены PSA, PSCA, PSMA и STEAP1 [17], E7-TriMix вакцина против рака шейки матки [18], вакцина на основе раковых/тестикулярных антигенов [19], вакцина против гепатоцеллюлярной карциномы, кодирующая костимулятор лиганда Oxford 40 [20], – вот лишь несколько произвольно выбранных примеров таких мРНК.
Для обеспечения защиты мРНК от внеклеточной деградации РНКазами и ее эффективного поглощения клетками вакцины нуждаются в эффективных носителях, которые в то же время должны быстро метаболизироваться и выводиться из организма, что снижало бы их потенциальную системную токсичность и обеспечивало возможность повторного введения [21–23]. Это могут быть полимерные наночастицы [24], биологические наноматериалы на основе пептидов/белков [25], наночастицы протамина [26, 27] и др. Однако в настоящее время в качестве средств доставки, несмотря на определенные недостатки, чаще всего используются липидные наночастицы [3, 28, 29].
В роли мишеней для мРНК-вакцин против рака часто выступают немутантные общие опухоль-ассоциированные антигены (ТАА). Типичным примером может служить вакцина, кодирующая антигены, ассоциированные со злокачественной меланомой. В качестве ТАА для меланомы использовались NY-ESO-1, тирозиназа, MAGE-A3, MAGE-C2 и TPTE. В результате была создана BNT111 – противораковая вакцина на платформе BioNTechFixVac, в которой используется фиксированная комбинация ТАА, призванная вызвать мощный и точный иммунный ответ. Другим примером могут служить вакцины на основе антигенов, экспрессирующихся преимущественно в легких при немелкоклеточном раке, – CV9201 и CV9202 [27, 30, 31].
Однако ТАА присутствуют не только в опухолевых, но и в нормальных тканях, вакцины, экспрессирующие их, могут вызывать реакцию толерантности в иммунном ответе, что снижает эффективность вакцинации. Кроме того, широкому использованию ТАА в иммунотерапии опухолей препятствует нехватка таргетных антигенов. Поэтому большинство вакцин, экспрессирующих ТАА, используются в качестве дополнительной терапии в сочетании с ингибиторами иммунных контрольных точек [30, 32, 33].
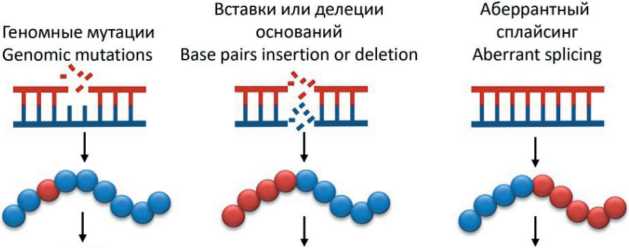
Считается, что потенциал противораковых вакцин мог быть в значительной степени повышен за счет поиска и применения высокоспецифичных для конкретной опухоли антигенов – неоантигенов. Неоантигены продуцируются опухолевыми клетками в результате различных опухолеспецифических изменений, таких как геномные мутации, аберрантная экспрессия некоторых генетических элементов, аномально регулируемый сплайсинг РНК, нарушение посттрансляционных модификаций белков, интегрированные вирусные открытые рамки считывания и ряд других причин [32, 34–36] (рис. 1).
Неоантигены можно разделить на две категории: общие и персонализированные [36, 37]. Общие неоантигены относятся к мутировавшим антигенам, которые являются общими для разных больных ЗНО, но не присутствуют в нормальном геноме. Общие неоантигены, обладающие высокой иммуногенностью, потенциально могут быть использованы в качестве терапевтических противораковых вакцин широкого спектра действия [38, 39]. Персонализированные неоантигены относятся к мутировавшим антигенам, которые уникальны для каждого пациента. Таким образом, персонализированный препарат неоантигена может быть только индивидуальным [40]. Поскольку неоантигены не экспрессируются в нормальных тканях, они обладают высокой иммуногенностью, а Т-лимфоциты, специфичные к ним, избегают негативного отбора в тимусе, значительно усиливая опухолеспецифический иммунный ответ. Благодаря более сильной иммуногенности и более высокой аффинности к молекулам главного комплекса гистосовместимости, а также тому, что они не подвержены влиянию центральной иммунологической толерантности, неоантигены представляют собой идеальные эпитопы для эффективного персонифицированного лечения онкологических заболеваний [32, 41]. Индивидуализированные противораковые вакцины могут работать отдельно или в сочетании с
Посттрансляционная модификация Posttranslational modification
Рис. 1. Механизмы возникновения неоантигенов в опухолевых клетках. Примечание: рисунок выполнен авторами Fig. 1. Mechanisms of the emergence of neoantigens in tumor cells. Note: created by the authors
другими методами лечения, повышая силу и длительность противоопухолевого эффекта, улучшая выживаемость и качество жизни и, в конечном итоге, улучшая результаты лечения рака [42].
Эффективная и быстрая идентификация неоантигенов стала возможной благодаря развитию технологий секвенирования нового поколения, таких как полноэкзомное или полногеномное секвенирование, при котором ДНК или РНК сравниваются из парных опухолевых и неопухолевых образцов [43]. Неоантигены прогнозируются с использованием биоинформатики и вычислительных алгоритмов. Выбирают геномные мутации/изменения, выявленные при секвенировании нормальной и опухолевой клеток. Преобразуют их в «неопептиды» соответствующей длины, прогнозируют сродство связывания неопептидов с HLA-аллелями конкретного пациента, оценивают иммуногенность и подтверждают Т-клеточный ответ на раковые клетки [44].
По данным библиометрического анализа по терапевтическим противораковым вакцинам с 2013 по 2022 г., фокус исследований в этой области сместился с пептидных и дендритноклеточных вакцин на мРНК-вакцины на основе неоантигенов [45]. В обзоре мы сосредоточили внимание на таких мРНК- вакцинах.
Клинические испытания мРНК-вакцин, кодирующих неоантигены
IVAC® MUTANOME
Первое официально зарегистрированное клиническое испытание неоантигенной мРНК-вакцины (NCT02035956) началось в декабре 2013 г. Это была вакцина IVAC® MUTANOME компании BioNTech. Название вакцины происходит от термина IVAC®, означающего индивидуализированную иммунотерапию рака. Концепция IVAC® MUTANOME состоит в идентификации опухолеспецифических мутаций у конкретного пациента, производство на основе неоантигенов мРНК для персонифицированной терапии.
Исследовались безопасность, переносимость и иммуногенность сочетания двух мРНК-препаратов: RBL001 (или RBL002) и IVAC® MUTANOME на 13 больных с меланомой III–IV стадий. RBL001/ RBL002 представляют собой вакцины на основе мРНК, оптимизированные для индукции антиген-специфических ответов CD8+ и CD4+ Т-клеток против ретинобластомаподобных белков, ассоциированных с меланомой. Эти два антигена к тому времени были уже хорошо охарактеризованы, а их безопасность и иммуногенность подтверждены в независимых клинических испытаниях. Общая цель исследования состояла в оценке безопасности новой стратегии вакцинации – сочетания введения в паховые лимфатические узлы этих двух препаратов мРНК-вакцины, а также количественное и функциональное определение индуцированного вакциной антиген-специфического иммунного ответа. Параллельно с процессом производства вакцины IVAC® MUTANOME пациенты с опухолями получали вакцину RBL001/RBL002. Возможные нежелательные явления отслеживались до 189 дней, мониторинг клеточного иммунного ответа, вызванного вакциной, проводился 161 день.
Первичные результаты исследования, опубликованные в 2017 г., показали, что у всех пациентов развивался Т-клеточный ответ против нескольких неоэпитопов вакцины. Инфильтрация Т-клеток, индуцированная вакциной, и неоэпитоп-специфическое уничтожение аутологичных опухолевых клеток были показаны в резецированных после вакцинации метастазах у 2 пациентов. Сравнение документированных рецидивов до и после неоэпитопной вакцинации показало значимое снижение кумулятивных рецидивирующих метастатических событий, что привело к устойчивой выживаемости без прогрессирования (ВБП). Т-клетки, индуцированные вакциной, сохранялись до 9 мес после окончания вакцинации [47].
В октябре 2016 г. компания BioNTech начала I фазу клинического исследования NCT02316457, оценивающего осуществимость, безопасность и иммуногенность при внутривенном введении мРНК-вакцин, кодирующих различные опухолевые антигены, упакованные в липосомы, у 42 пациенток с трижды негативным раком молочной железы (TNBC) после хирургического лечения. В двух группах исследования больные получали персонализированный набор заранее изготовленных немутированных общих опухоль-ассоциированных антигенов с универсальными Т-хелперными эпитопами или без них. В третьей группе пациентки были дополнительно вакцинированы препаратом IVAC_M_uID, представляющим индивидуализированную мРНК, кодирующую неоэпитопы, полученные из 20 мутантных эпитопов. Отбор мутаций представлял собой многоэтапный процесс, включающий идентификацию соматических мутаций, подтверждение и определение приоритетности мутации, производство мРНК.
Авторы представили иммунотерапию MERIT (MutanomeEngineered RNA Immuno-Therapy) с использованием мутаномной РНК как новую концепцию индивидуализированной терапии рака. В исследовании NCT02316457, получившем название TNBC-MERIT, использовались две взаимодополняющие стратегии: концепция WAREHOUSE (коллекция РНК, специфичных для опухоли в целом) и IVAC® MUTANOME для персонифицированного лечения. Комбинация двух подходов основана на предположении, что иммунотерапия, которая, с одной стороны, признает гетерогенность опухоли на уровне одного пациента, а с другой – воздействует на весь спектр антигенов, экспрессируемых в опухолях, обладает наибольшим потенциалом для лечения.
По данным о предварительных результатах исследования, имевшихся к 2020 г. [48], у всех 14 пациенток, получавших IVAC_M_uID, наблюдался индуцированный вакциной CD4+ и/или CD8+Т-клеточный ответ против неоэпитопов, обнаруженных с помощью IFN-γ ELISpot, ex vivo . Значительный уровень Т-клеточного ответа против отдельных неоэпитопов был индуцирован de novo в 10,3 % периферических CD8+ Т-клеток. У одной из пациенток более подробно охарактеризован CD4+ и/или CD8+ Т-клеточный ответ против 10 из 20 неоэпитопов. Специфический ответ CD8+ Т-клеток включал в совокупности около 30 % от общего числа периферических CD8+ Т-клеток и сохранялся на высоких уровнях в течение 6 мес после последней вакцинации. Индуцированные вакциной CD8+ Т-клетки имели фенотип эффекторных Т-клеток памяти и проявляли высокий уровень синтеза IFN-γ/TNFα/Mip-1a&b. Эти данные позволяют предположить, что вакцина действительно эффективно индуцирует высокоспецифический Т-клеточный ответ у пациенток с TNBC в пост(нео) адъювантной терапии.
ЦЕВУМЕРАН
Аутогенный цевумеран (BNT122, RO7198457) – индивидуализированная мРНК-онковакцина, разработанная компанией BioNTech на собственной биотехнологической платформе iNeST (individualized Neoantigen Specific Therapies), заключенная в наночастицы липоплекса по оригинальной технологии Lipo-MERIT, содержала до 20 иммунодоминант-ных неоантигенов, высокоаффинных к главному комплексу гистосовместимости – как MHC-I, так и MHC-II [46].
В декабре 2019 г. инициировано открытое многоцентровое исследование NCT03289962 фазы I с участием 272 добровольцев для изучения безопасности и переносимости, оценки иммунного ответа и фармакокинетики цевумерана как в виде монотерапии, так и в комбинации с атезолизумабом (синтетическим антителом анти-PD-L1 при очень широком спектре ЗНО: меланоме, немелкоклеточном раке легких, колоректальном раке, TNBC и других солидных опухолях). Участники получали аутогенный цевумеран в повышенных дозах внутривенно 21-дневными циклами в монотерапии или вместе с атезолизумабом в фиксированной дозе 1200 мг. Исследование проводится до настоящего времени, поскольку переносимость вакцины оценивается в весьма широких временных рамках: доля участников с дозолимитирующей токсичностью – до 21 дня после вакцинации, а участников с нежелательными явлениями, в том числе иммуно-опосредованными, а также изменениями целевых показателей жизнедеятельности – до 3 лет. Оцениваются также последствия вакцинации, например, доля полных или частичных объективных ответов в соответствии с критериями RECIST v1.1. Временные рамки не менее 90 дней после последней дозы; продолжительность ответа согласно RECIST v1.1 от первого появления документированного объективного ответа до прогрессирования заболевания или смерти по любой причине; время без прогрессирования (ВБП), общая выживаемость (ОВ) и др. в течение 3 лет.
Подчеркнем еще раз, что наблюдения за пациентами, участвующими в клинических испытаниях противораковых вакцин, продолжаются в течение длительного времени – до 5 лет. Таким образом, ни одно исследование, инициированное после 2019 г., еще не завершено. Тем не менее предварительные результаты I фазы клинических исследований цевумерана позволили разработчикам перейти ко II фазе [3, 31]. Исследования второй фазы по оценке эффективности, безопасности и фармакокинетики аутогенного цевумерана проводятся у пациентов со строго определенными видами опухолей.
В исследовании NCT03815058 задействован 131 пациент с ранее не леченной меланомой поздних стадий. Цевумеран в сочетании с пембролизумабом (моноклональным анти-PD-1-антителом) сравнивается с монотерапией пембролизумабом в дозе 200 мг. Оба препарата вводили путем внутривенной инфузии. В первую очередь оценивали ВБП по RECIST v.1.1 после рандомизации. Каждый пациент находится под наблюдением до 24 мес, если раньше не наступит прогрессирование заболевания или смерть. У всех наблюдаемых отслеживали частоту и продолжительность объективного ответа, среднее изменение показателя состояния здоровья и качества жизни, доля участников с нежелательными явлениями от 90 дней и до 27 мес после последней дозы препарата учитывается отдельно.
В многоцентровом открытом рандомизированном исследовании NCT04486378 участвовали более 200 пациентов после радикальных операций по поводу рака прямой кишки II/III стадии или рака толстой кишки II стадии с высоким риском перехода в III стадию. Больные в основной группе получали рекомендуемую дозу цевумерана внутривенно. В контрольной группе пациенты находились под динамическим наблюдением, что является стандартом для таких больных. В исследовании оценивали выживаемость без рецидива сроком до 5 лет. Дополнительно фиксировали время до рецидива, выявления метастазов или смерти от того же рака. В течение 5 лет также будут оцениваться изменения статуса циркулирующей опухолевой ДНК и частота нежелательных явлений во время лечения, в особенности повлекших снижение дозы и прекращение приема препарата (15 мес), в соответствии с критериями нежелательных явлений (Национальный институт рака, версия 5.0 (CTCAE v. 5.0)).
Особо следует отметить клиническое исследование NCT04161755 фазы I (нерандомизированное, открытое, многоцентровое), поскольку его результаты хорошо описаны. Целью исследования была оценка безопасности лечения протоковой аденокарциномы поджелудочной железы (ПАПЖ) после радикальной операции. Используя наночастицы мРНК-липоплекс, из удаленных опухолей в реальном времени синтезировали мРНК-неоантигенные вакцины. После операции последовательно назначали атезолизумаб, аутогенный цевумеран и модифицированную версию схемы химиотерапии mFOLFIRINOX, включающую фолиновую кислоту, фторурацил, иринотекан и оксалиплатин.
Несмотря на то, что опухоль характеризуется низким уровнем мутаций, т.е. образует мало неоантигенов [49], лишь у 5 % оперированных пациентов не удалось выделить достаточное количество неоантигенов для производства вакцины. И лишь у 1 пациента из 16, получивших инъекции цевуме-рана, возникли побочные эффекты ≥III степени – лихорадка и гипертензия. Аутогенный цевумеран индуцировал IFN-γ продуцирующие неоантиген-специфические CD8+ Т-клетки у 8 из 16 пациентов, причем половина из них была нацелена на более чем один вакцинный неоантиген, и Т-клетки, индуцированные вакцинацией, составляли до 10 % всех Т-клеток крови. Таким образом, показано, что вакцина безопасна, ее можно производить в соответствующие сроки, она иммуногенна по отношению к ПАПЖ.
За 18 мес у пациентов, ответивших на вакцинацию, безрецидивная выживаемость не была достигнута, в то время как у 8 больных, не ответивших на лечение, она составила 13,4 мес. Различия в иммунной подготовленности пациентов не искажали эту корреляцию, поскольку у ответивших и не ответивших на вакцину был установлен эквивалентный иммунитет к неродственной мРНК-вакцине против SARS-CoV-2. Таким образом, возникновение Т-клеточного ответа коррелирует с улучшением прогноза заболевания [50]. Через 3 года после применения цевумерана 6 из 8 пациентов оставались в ремиссии, а в их крови были выявлены CD8+ T-клетки памяти, по-прежнему способные продуцировать IFN-γ и TNF-α в ответ на введение соответствующих неоантигенов [51]. Это серьезное достижение, учитывая высокую агрессивность ПАПЖ. В частности, у 7 из 8 пациентов, не ответивших на лечение, возникли рецидивы заболевания.
Полученные результаты позволили в октябре 2023 г. приступить ко II фазе исследований (NCT05968326) той же схемы лечения (атезолизу-маб + аутогенный цевумеран + mFOLFIRINOX) по сравнению с комбинацией mFOLFIRINOX у 260 добровольцев, оперированных по поводу ПАПЖ, которые не получали ранее системного противоракового лечения и не имели признаков заболевания после операции. За пациентами планируется наблюдать до 6 лет.
mRNA-4157 (V940)
В первую очередь фиксировалось количество участников с нежелательными явлениями (НЯ), возникшими в течение 90–100 дней от последней инъекции в зависимости от схемы лечения. Далее наблюдение осуществляется в течение нескольких лет с оценкой частоты и продолжительности ответа на терапию, ОВ и ВБП с момента первого введения препарата. Также фиксируется количество участников с наличием или отсутствием циркулирующей опухолевой ДНК. Результатов данного исследования в открытой печати не найдено. Но о его успехе говорит тот факт, что для ряда ЗНО испытания вакцины перешли во II и III фазы.
В первую очередь, это меланома кожи. В середине 2019 г. начата II фаза клинических испытаний мРНК-4157 (NCT03897881), продолжительностью 10 лет. Целью исследования является ответ на вопрос, улучшит ли послеоперационная терапия мРНК-4157 с пембролизумабом безрецидивную выживаемость по сравнению с монотерапией пембролизумабом. В исследование включено 257 больных с высоким риском рецидива после удаления меланомы кожи. Инъекции препаратов проводились каждые 21 день. Участники получили до 9 доз мРНК-4157 и до 18 доз пембролизумаба при отсутствии рецидива заболевания или токсичности на пембролизумаб. Далее проводилось наблюдение в течение 5 лет с оценкой безрецидивной выживаемости, которая определялась как время между датами введения первой дозы пембролизумаба и рецидивом заболевания (локального, регионального или отдаленного метастаза), возникновением новой первичной меланомы или смерти. Учитывалась частота НЯ, возникших в срок до 100 дней после последней дозы мРНК-4157 и до 90 дней после последней дозы пембролизумаба, в особенности приведших к прекращению лечения. Показано, что большинство НЯ не превышали I–II степени. Нежелательные явления ≥III степени наблюдались у 25 % пациентов в группе комбинированной терапии и у 18 % пациентов в группе монотерапии, при этом не было НЯ IV–V степени, связанных с мРНК-4157. По истечении 18 мес наблюдения метастазы или смертельный исход в группе комбинированного лечения отмечены у 8 %, при монотерапии пем-бролизумабом – у 24 % пациентов. По прошествии 23–24 мес комбинированное лечение значимо улучшило безрецидивную выживаемость, снизив риск рецидива или смерти на 44 % по сравнению с монотерапией [52]. Через 3 года после лечения комбинированная терапия по сравнению с назначением только пембролизумаба снизила риск рецидива или смерти на 49 %, а развития отдаленных метастазов или смерти – на 62 % [53].
Наконец, в 2023 г. запущено клиническое испытание NCT05933577 фазы III, в которое планируется включить 1 000 пациентов с меланомой IIB–C, III или IV стадий после резекции, без признаков заболевания, но с высоким риском рецидива. Исследование NCT06077760 фазы III оценивает эффективность комбинации mRNA-4157 (V940) и пембролизумаба в плане увеличения безрецидивной выживаемости с участием почти 900 добровольцев, болеющих немелкоклеточным раком легкого (НМРЛ) после хирургической резекции, без признаков заболевания, которые ранее получали хотя бы одну линию адъювантной платиносодержащей химиотерапии. В 2024 г. начат ряд исследований II–III фазы, сравнивающих безрецидивную выживаемость, выживаемость без метастазирования, общую выживаемость и ряд других параметров при лечении комбинацией mRNA-4157 (V940) и пембро-лизумаба и одним пембролизумабом (NCT06307431, NCT06295809, NCT06305767).
Вакцины, разрабатываемые китайскими исследователями
Следует отметить фирму NeoCura – высокотехнологичное предприятие, использующее методы искусственного интеллекта и биоинформатики для углубленного анализа целевых лекарственных средств и полностью автоматизированного проектирования лекарств, в том числе для модернизации инновационной технологической платформы РНК. Несколько ученых, разработавших собственные неоантигенные мРНК вакцины, проводят их клинические испытания в сотрудничестве с этой компанией.
На данный момент в Китае проходят десятки клинических испытаний, которые находятся на этапе набора добровольцев или на этапе исследования безопасности и переносимости мРНК-вакцин (NCT03908671, NCT05949775, NCT05227378, NCT05940181, NCT06019702, NCT06026774, NCT05916248, NCT0519246, NCT05359354, NCT06141369, NCT06156267).
Заключение
Несомненно, мРНК-вакцины для иммунотерапии онкологических заболеваний имеют многообещающие перспективы. Анализ литературы показывает ежегодное увеличение числа клинических исследований, особенно в отношении персонализированных вакцин. По мере развития мРНК-вакцины получают преимущества перед другими методами вакцинации, благодаря быстрому недорогому производству и крупномасштабному внедрению. Для дальнейшего повышения эффективности противоопухолевых мРНК-вакцин
Список литературы Противораковые МРНК-вакцины на основе неоантигенов
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209-49. https://doi.org/10.3322/caac.21660.
- Salama A.K., Moschos S.J. Next steps in immuno-oncology: enhancing antitumor effects through appropriate patient selection and rationally designed combination strategies. Ann Oncol. 2017; 28(1): 57-74. https://doi.org/10.1093/annonc/mdw534.
- Deng Z., Tian Y., Song J., An G., Yang P. mRNA Vaccines: The Dawn of a New Era of Cancer Immunotherapy. Front Immunol. 2022; 13. https://doi.org/10.3389/fimmu.2022.887125.
- Miao L., Zhang Y., Huang L. mRNA vaccine for cancer immunotherapy. Mol Cancer. 2021; 20(1): 41. https://doi.org/10.1186/s12943-021-01335-5.
- Esprit A., de Mey W., Bahadur Shahi R., Thielemans K., Franceschini L., Breckpot K. Neo-Antigen mRNA Vaccines. Vaccines (Basel). 2020; 8(4): 776. https://doi.org/10.3390/vaccines8040776.
- Borobova E.A., Antonets D.V., Starostina E.V., Karpenko L.I., Ilyichev A.A., Bazhan S.I. Design of Artificial Immunogens Containing Melanoma-associated T-cell Epitopes. Curr Gene Ther. 2018; 18(6): 375-85. https://doi.org/10.2174/1566523218666181113112829.
- Suschak J.J., Williams J.A., Schmaljohn C.S. Advancements in DNA vaccine vectors, non-mechanical delivery methods, and molecular adjuvants to increase immunogenicity. Hum Vaccin Immunother. 2017; 13(12): 2837-48. https://doi.org/10.1080/21645515.2017.1330236.
- Liu M.A. A Comparison of Plasmid DNA and mRNA as Vaccine Technologies. Vaccines (Basel). 2019; 7(2): 37. https://doi.org/10.3390/vaccines7020037.
- Qin S., Tang X., Chen Y., Chen K., Fan N., Xiao W., Zheng Q., Li G., Teng Y., Wu M., Song X. mRNA-based therapeutics: powerful and versatile tools to combat diseases. Signal Transduct Target Ther. 2022; 7(1): 166. https://doi.org/10.1038/s41392-022-01007-w.
- Thess A., Grund S., Mui B.L., Hope M.J., Baumhof P., Fotin-Mleczek M., Schlake T. Sequence-engineered mRNA Without Chemical Nucleoside Modifications Enables an Effective Protein Therapy in Large Animals. Mol Ther. 2015; 23(9): 1456-64. https://doi.org/10.1038/mt.2015.103.
- Trepotec Z., Geiger J., Plank C., Aneja M.K., Rudolph C. Segmented poly(A) tails significantly reduce recombination of plasmid DNA without affecting mRNA translation efficiency or half-life. RNA. 2019; 25(4): 507-18. https://doi.org/10.1261/rna.069286.118.
- Nelson J., Sorensen E.W., Mintri S., Rabideau A.E., Zheng W., Besin G., Khatwani N., Su S.V., Miracco E.J., Issa W.J., Hoge S., Stanton M.G., Joyal J.L. Impact of mRNA chemistry and manufacturing process on innate immune activation. Sci Adv. 2020; 6(26). https://doi.org/10.1126/sciadv.aaz6893.
- Martinon F, Krishnan S., Lenzen G., Magne R., Gomard E., Guillet J.G., Levy J.P., Meulien P. Induction of virus-specific cytotoxic T lymphocytes in vivo by liposome-entrapped mRNA. Eur J Immunol. 1993; 23(7): 1719-22. https://doi.org/10.1002/eji.1830230749.
- Conry R.M., LoBuglio A.F., Wright M., Sumerel L., Pike M.J., Johanning F., Benjamin R., Lu D., Curiel D.T. Characterization of a messenger RNA polynucleotide vaccine vector. Cancer Res. 1995; 55(7):1397-400.
- Mandl C.W., Aberle J.H., Aberle S.W., Holzmann H., Allison S.L., Heinz F.X. In vitro-synthesized infectious RNA as an attenuated live vaccine in a flavivirus model. Nat Med. 1998; 4(12): 1438-40. https://doi.org/10.1038/4031.
- Zhou W.Z., Hoon D.S., Huang S.K., Fujii S., Hashimoto K., Morishita R., Kaneda Y. RNA melanoma vaccine: induction of antitumor immunity by human glycoprotein 100 mRNA immunization. Hum Gene Ther. 1999; 10(16): 2719-24. https://doi.org/10.1089/10430349950016762.
- Kübler H., Scheel B., Gnad-Vogt U., Miller K., Schultze-Seemann W., vom Dorp F., Parmiani G., Hampel C., Wedel S., Trojan L., Jocham D., Maurer T., Rippin G., Fotin-Mleczek M., von der Mülbe F., Probst J., Hoerr I., Kallen K.J., Lander T., Stenzl A. Self-adjuvanted mRNA vaccination in advanced prostate cancer patients: a first-in-man phase I/IIa study. J Immunother Cancer. 2015; 3: 26. https://doi.org/10.1186/s40425-015-0068-y.
- Bialkowski L., van Weijnen A., van der Jeught K., Renmans D., Daszkiewicz L., Heirman C., Stange G., Breckpot K., Aerts J.L., Thielemans K. Intralymphatic mRNA vaccine induces CD8 T-cell responses that inhibit the growth of mucosally located tumours. Sci Rep. 2016; 6. https://doi.org/10.1038/srep22509.
- Fan C., Qu H., Wang X., Sobhani N., Wang L., Liu S., Xiong W., Zeng Z., Li Y. Cancer/testis antigens: from serology to mRNA cancer vaccine. Semin Cancer Biol. 2021; 76: 218-31. https://doi.org/10.1016/j.semcancer.2021.04.016.
- Deng Z., Yang H., Tian Y., Liu Z., Sun F., Yang P. An OX40L mRNA vaccine inhibits the growth of hepatocellular carcinoma. Front Oncol. 2022; 12. https://doi.org/10.3389/fonc.2022.975408.
- Pietersz G.A., Tang C.K., Apostolopoulos V. Structure and design of polycationic carriers for gene delivery. Mini Rev Med Chem. 2006; 6(12): 1285-98. https://doi.org/10.2174/138955706778992987.
- Hajj K.A., Whitehead K.A. Tools for translation: non-viral materials for therapeutic mRNA delivery. Nat Rev Mater. 2017; 2. https://doi.org/10.1038/natrevmats.2017.56.
- Al Fayez N., Nassar M.S., Alshehri A.A., Alnefaie M.K., Almughem F.A., Alshehri B.Y., Alawad A.O., Tawfik E.A. Recent Advancement in mRNA Vaccine Development and Applications. Pharmaceutics. 2023; 15(7): 1972. https://doi.org/10.3390/pharmaceutics15071972.
- Tan L., Zheng T., Li M., Zhong X., Tang Y., Qin M., Sun X. Optimization of an mRNA vaccine assisted with cyclodextrin-polyethyleneimine conjugates. Drug Deliv Transl Res. 2020; 10(3): 678-89. https://doi.org/10.1007/s13346-020-00725-4.
- Maassen S.J., van der Schoot P., Cornelissen J.J.L.M. Experimental and Theoretical Determination of the pH inside the Confinement of a Virus-Like Particle. Small. 2018; 14(36). https://doi.org/10.1002/smll.201802081.
- Scheel B., Aulwurm S., Probst J., Stitz L., Hoerr I., Rammensee H.G., Weller M., Pascolo S. Therapeutic anti-tumor immunity triggered by injections of immunostimulating single-stranded RNA. Eur J Immunol. 2006; 36(10): 2807-16. https://doi.org/10.1002/eji.200635910.
- Papachristofilou A., Hipp M.M., Klinkhardt U., U., Früh M., Sebastian M., Weiss C., Pless M., Cathomas R., Hilbe W., Pall G., Wehler T., Alt J., Bischoff H., Geifiler M., Griesinger F, Kallen K.J., Fotin-Mleczek M., Schroder A., Scheel B., Muth A., Seibel T., Stosnach C., Doener F., Hong H.S., Koch S.D., Gnad-Vogt U., Zippelius A. Phase Ib evaluation of a self-adjuvanted protamine formulated mRNA-based active cancer immunotherapy, BI1361849 (CV9202), combined with local radiation treatment in patients with stage IV non-small cell lung cancer. J Immunother Cancer. 2019; 7(1): 38. https://doi.org/10.1186/s40425-019-0520-5.
- Reichmuth A.M., Oberli M.A., Jaklenec A., Langer R., Blankschtein D. mRNA vaccine delivery using lipid nanoparticles. Ther Deliv. 2016; 7(5): 319-34. https://doi.org/10.4155/tde-2016-0006.
- Hou X., Zaks T., Langer R., Dong Y. Lipid nanoparticles for mRNA delivery. Nat Rev Mater. 2021; 6(12): 1078-94. https://doi.org/10.1038/s41578-021-00358-0.
- Sahin U., Oehm P., Derhovanessian E., Jabulowsky R.A., Vormehr M., Gold M., Maurus D., Schwarck-Kokarakis D., Kuhn A.N., Omokoko T., Kranz L.M., Diken M., Kreiter S., Haas H., Attig S., Rae R., Cuk K., Kemmer-Bruck A., Breitkreuz A., Tolliver C., Caspar J., Quinkhardt J., Hebich L., Stein M., Hohberger A., Vogler I., Liebig I., Renken S., Sikorski J., Leierer M., Muller V., Mitzel-Rink H., Miederer M., Huber C., Grabbe S., Utikal J., Pinter A., Kaufmann R., Hassel J.C., Loquai C., TUreci O. An RNA vaccine drives immunity in checkpoint-inhibitor-treated melanoma. Nature. 2020; 585(7823): 107-12. https://doi.org/10.1038/s41586-020-2537-9.
- Sebastian M., Schröder A., Scheel B., Hong H.S., Muth A., von Boehmer L., Zippelius A., Mayer F., Reck M., Atanackovic D., Thomas M., Schneller F, Stohlmacher J., Bernhard H., Groschel A., Lander T., Probst J., Strack T., Wiegand V., Gnad-Vogt U., Kallen K.J., Hoerr I., von der Muelbe F., Fotin-Mleczek M., Knuth A., Koch S.D. A phase I/IIa study of the mRNA-based cancer immunotherapy CV9201 in patients with stage IIIB/ IV non-small cell lung cancer. Cancer Immunol Immunother. 2019; 68(5): 799-812. https://doi.org/10.1007/s00262-019-02315-x.
- Xie N., Shen G., Gao W., Huang Z., Huang C., Fu L. Neoantigens: promising targets for cancer therapy. Signal Transduct Target Ther. 2023; 8(1): 9. https://doi.org/10.1038/s41392-022-01270-x.
- Leko V., Rosenberg S.A. Identifying and Targeting Human Tumor Antigens for T Cell-Based Immunotherapy of Solid Tumors. Cancer Cell. 2020; 38(4): 454-72. https://doi.org/10.1016/j.ccell.2020.07.013.
- Hu Z., Ott P.A., Wu C.J. Towards personalized, tumour-specific, therapeutic vaccines for cancer. Nat Rev Immunol. 2018; 18(3): 168-82. https://doi.org/10.1038/nri.2017.131.
- Buonaguro L., Tagliamonte M. Selecting Target Antigens for Cancer Vaccine Development. Vaccines (Basel). 2020; 8(4): 615. https://doi.org/10.3390/vaccines8040615.
- Sahin U., Tureci O. Personalized vaccines for cancer immunotherapy. Science. 2018; 359 (6382): 1355-60. https://doi.org/10.1126/science.aar7112.
- Schumacher T.N., Schreiber R.D. Neoantigens in cancer immunotherapy. Science. 2015; 348 (6230): 69-74. https://doi.org/10.1126/science.aaa4971.
- Zhao W., Wu J., Chen S., Zhou Z. Shared neoantigens: ideal targets for off-the-shelf cancer immunotherapy. Pharmacogenomics. 2020; 21(9): 637-45. https://doi.org/10.2217/pgs-2019-0184.
- Klebanoff C.A., Wolchok J.D. Shared cancer neoantigens: Making private matters public. J Exp Med. 2018; 215(1): 5-7. https://doi.org/10.1084/jem.20172188.
- Türeci Ö., Löwer M., Schrörs B., Lang M., Tadmor A., Sahin U. Challenges towards the realization of individualized cancer vaccines. Nat Biomed Eng. 2018; 2(8): 566-69. https://doi.org/10.1038/s41551-018-0266-2.
- Blass E., Ott P.A. Advances in the development of personalized neoantigen-based therapeutic cancer vaccines. Nat Rev Clin Oncol. 2021; 18(4): 215-29. https://doi.org/10.1038/s41571-020-00460-2.
- Zhang Z., Lu M., Qin Y., Gao W., Tao L., Su W., Zhong J. Neoantigen: A New Breakthrough in Tumor Immunotherapy. Front Immunol. 2021; 12. https://doi.org/10.3389/fimmu.2021.672356.
- Zhao X., Pan X., Wang Y., Zhang Y. Targeting neoantigens for cancer immunotherapy. Biomark Res. 2021; 9(1): 61. https://doi.org/10.1186/s40364-021-00315-7.
- Zhou W., Yu J., Li Y., Wang K. Neoantigen-specific TCR-T cell-based immunotherapy for acute myeloid leukemia. Exp Hematol Oncol. 2022; 11(1): 100. https://doi.org/10.1186/s40164-022-00353-3.
- Zhao J., Liao B., Gong L., Yang H., Li S., Li Y. Knowledge mapping of therapeutic cancer vaccine from 2013 to 2022: A bibliometric and visual analysis. Hum Vaccin Immunother. 2023; 19(2). https://doi.org/10.1080/21645515.2023.2254262.
- ClinicalTrials.gov [Internet]. URL: https://www.clinicaltrials.gov [cited 31.05.2024].
- Sahin U., Derhovanessian E., Miller M., Kloke B.P., Simon P., Lower M., Bukur V., Tadmor A.D., Luxemburger U., Schrörs B., Omokoko T., Vormehr M., Albrecht C., Paruzynski A., Kuhn A.N., Buck J., Heesch S., Schreeb K.H., Müller F., Ortseifer I., Vogler I., Godehardt E., Attig S., Rae R., Breitkreuz A., Tolliver C., Suchan M., Martic G., HohbergerA., SornP., Diekmann J., Ciesla J., Waksmann O., Bruck A.K., Witt M., Zillgen M., Rothermel A., Kasemann B., Langer D., Bolte S., Diken M., Kreiter S., Nemecek R., Gebhardt C., Grabbe S., Höller C., Utikal J., Huber C., Loquai C., Türeci O. Personalized RNA mutanome vaccines mobilize polyspecific therapeutic immunity against cancer. Nature. 2017; 547(7662): 222-26. https://doi.org/10.1038/nature23003.
- Schmidt M., Vogler I., Derhovanessian E., Omokoko T., GodehardtE., Attig S., Cortini A., Newrzela S., Grützner J., Bolte S., Langer D., Eichbaum M., Lindman H., Pascolo S., Schneeweiss A., Sjöblom T., Türeci Ö., Sahin U. T-cell responses induced by an individualized neoantigen specific immune therapy in post (neo)adjuvant patients with triple negative breast cancer. Ann. Oncol. 2020; 31(s4): 276. https://doi.org/10.1016/j.annonc.2020.08.209.
- Yarchoan M., Hopkins A., Jaffee E.M. Tumor Mutational Burden and Response Rate to PD-1 Inhibition. N Engl J Med. 2017; 377(25): 2500-01. https://doi.org/10.1056/NEJMc1713444.
- Rojas L.A., Sethna Z., Soares K.C., Olcese C., Pang N., Patterson E., Lihm J., Ceglia N., Guasp P., Chu A., Yu R., Chandra A.K., Waters T., Ruan J., Amisaki M., Zebboudj A., Odgerel Z., Payne G., Derhovanessian E., Muller F, Rhee I., YadavM., Dobrin A., SadelainM., LukszaM., Cohen N., Tang L., Basturk O., Gonen M., Katz S., Do R.K., Epstein A.S., Momtaz P., Park W., Sugarman R., Varghese A.M., Won E., Desai A., Wei A.C., D'Angelica M.I., Kingham T.P., Mellman I., Merghoub T., Wolchok J.D., Sahin U., Türeci Ö., Greenbaum B.D., Jarnagin W.R., Drebin J., O'Reilly E.M., Balachandran V.P. Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer. Nature. 2023; 618(7963): 144-50. https://doi.org/10.1038/s41586-023-06063-y.
- CT025 - Personalized RNA neoantigen vaccines induce long-lived CD8+ T effector cells in pancreatic cancer. [Internet]. URL: https://www.abstractsonline.com/pp8/#!/20272/presentation/11403 [cited 31.05.2024].
- Weber J.S., Carlino M.S., Khattak A., Meniawy T., Ansstas G., Taylor M.H., Kim K.B., McKean M., Long G.V., Sullivan R.J., Faries M., Tran T.T., Cowey C.L., Pecora A., Shaheen M., Segar J., Medina T., Atkinson V., Gibney G.T., Luke J.J., Thomas S., Buchbinder E.I., Healy J.A., Huang M., Morrissey M., Feldman I., Sehgal V., Robert-Tissot C., Hou P., Zhu L., Brown M., Aanur P., Meehan R.S., Zaks T. Individualised neoantigen therapy mRNA-4157 (V940) plus pembrolizumab versus pembrolizumab monotherapy in resected melanoma (KEYNOTE-942): a randomised, phase 2b study. Lancet. 2024; 403(10427): 632-44. https://doi.org/10.1016/S0140-6736(23)02268-7.
- Moderna and Merck Announce mRNA-4157 (V940) In Combination with Keytruda(R) (Pembrolizumab) Demonstrated Continued Improvement in Recurrence-Free Survival and Distant Metastasis-Free Survival in Patients with High-Risk Stage III/IV Melanoma Following Complete Resection Versus Keytruda at Three Years. 2023. [Internet]. URL: https://inlnk.ru/9P9nlY [cited 31.05.2024].
- Ni L. Advances in mRNA-Based Cancer Vaccines. Vaccines (Basel). 2023; 11(10): 1599. https://doi.org/10.3390/vaccines11101599.


