Протонная терапия в лечении диффузной астроцитомы ствола головного мозга. Случай из практики
Автор: Киреева Т.А., Гуменецкая Ю.В., Гоголин Д.В., Гордон К.Б., Гулидов И.А., Лепилина О.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 1 т.21, 2022 года.
Бесплатный доступ
Актуальность. Несмотря на то, что астроцитома головного мозга относится к глиальным опухолям низкой степени злокачественности (grade ii), она часто является причиной инвалидизации и смерти пациентов. Локализация опухоли определяет выраженность клинической симптоматики заболевания, что существенно влияет на его прогноз. Важнейшей проблемой до настоящего времени остается выбор оптимальной тактики лечения астроцитомы, локализующейся в стволе головного мозга. Расположение опухоли в данной области позволяет относить абсолютное большинство пациентов к категории неоперабельных. В связи с чем основным методом лечения таких больных является лучевая терапия или химиолучевое лечение. При планировании лучевой терапии серьёзной проблемой является локализация опухоли в непосредственной близости от жизненно важных центров. Как известно, подведение высоких доз излучения в таких случаях сопряжено с высоким риском развития осложнений лечения. Описание клинического случая. Представлено клиническое наблюдение успешного лечения молодого, 20-летнего пациента с диффузной астроцитомой ствола головного мозга. В связи с невозможностью проведения радикального хирургического лечения больному была предложена лучевая терапия. Морфология, размеры и локализация первичной опухоли представляли определенную сложность при создании оптимального дозиметрического плана лечения из-за высокой вероятности повреждения жизненно важных центров, что могло привести к инвалидизации и даже гибели пациента. Возможность применения протонной терапии позволила подвести максимально допустимую дозу излучения к опухоли, с минимальным воздействием на окружающие ткани. Запланированный курс протонной терапии был выполнен в полном объеме. При сроке наблюдения за пациентом после завершения лучевой терапии 36 мес, осложнений лечения, а также признаков прогрессирования заболевания не отмечено. заключение. Несмотря на высокий риск развития осложнений лечения, применение протонной терапии позволило в полном объеме реализовать запланированный курс лечения, добиться стабилизации опухоли и значительно улучшить качество жизни пациента молодого возраста.
Протонная терапия, фотонная терапия, диффузная астроцитома, ствол мозга, лучевая терапия, осложнения лечения, головной мозг
Короткий адрес: https://sciup.org/140290551
IDR: 140290551 | УДК: 616.831-006-08:615.849.12 | DOI: 10.21294/1814-4861-2022-21-1-144-150
Текст научной статьи Протонная терапия в лечении диффузной астроцитомы ствола головного мозга. Случай из практики
Несмотря на высокие темпы развития и постоянное совершенствование методов диагностики и лечения в онкологии, статистические данные свидетельствуют о сохраняющейся тенденции к увеличению онкологической заболеваемости в России. В 2018 г. выявлено 624 709 новых случаев злокачественных новообразований (ЗНО) [1]. Около 2 % от числа всех ЗНО составляют первичные опухоли головного мозга, среди которых первое место по распространенности занимают нейроэпителиальные опухоли [2]. Достоверные причины развития глиальных опухолей не известны, но одной из возможных причин считается наличие разного рода клеточных мутаций. Согласно классификации ВОЗ, выделяют глиомы низкой степени злокачественности (Grade I–II) и высокозлокачественные глиомы (Grade III–IV). Астроцитома – опухоль, развивающаяся из астроцитарной части глии, представлена астроцитами. Частота заболеваемости диффузной астроцитомой составляет 0,55 случая на 100 тыс населения в год [2]. Чаще всего данные опухоли относятся к низкой степени злокачественности (Grade II), но, несмотря на высокую степень дифференцировки и относительно медленный рост, астроцитома часто является причиной не только инвалидизации, но и смерти пациентов.
Важным прогностическим фактором в лечении больных является возраст и локализация опухоли. Известно, что пик заболеваемости приходится на возраст от 15 до 35 лет, при этом средняя продолжительность жизни пациентов старше 40 лет составляет 5 лет, а у детей – около 10 лет [3]. Данное обстоятельство подчеркивает не только медицинскую, но и социальную значимость проблемы. От локализации опухоли зависит степень выраженности клинической симптоматики заболевания, что существенно влияет на его прогноз. Чаще всего опухоль локализуется в области больших полушарий мозга, и лишь в 5,6 % может поражать ствол [4]. У взрослых пациентов глиомы ствола головного мозга встречаются редко и составляют около 2 % всех внутричерепных новообразований. В связи с тем, что они представляют собой гетерогенную группу опухолей, основным фактором прогноза и определения подхода к лечению является морфологическая верификация диагноза. Учитывая локализацию опухоли в области ствола головного мозга, её биопсия выполняется редко, что не дает возможности морфологически подтвердить диагноз. В связи с этим данные опухоли классифици- руются в соответствии с их характеристиками, с помощью методов МР-визуализации [5, 6].
Важнейшей проблемой до настоящего времени остается выбор оптимальной тактики лечения данной категории пациентов. Ввиду анатомической особенности структуры ствола головного мозга, наличия в нем жизненно важных центров, контролирующих все процессы жизнедеятельности организма, большинство пациентов относится к категории неоперабельных. Вместе с тем, из-за малой эффективности химиотерапевтических препаратов их использование при диффузно растущих опухолях ствола мозга, как правило, играет вспомогательную роль и часто сопровождается развитием различных токсических эффектов [7, 8].
В связи с изложенным выше основным методом лечения больных с локализацией опухоли в области ствола мозга является лучевая терапия, проведение которой позволяет улучшить контроль над заболеванием и увеличить выживаемость пациентов. Вместе с тем, подобная локализация опухоли является серьезной проблемой при планировании лучевой терапии. Подведение высоких доз облучения в таких случаях ограничено величиной толерантности дозы ствола головного мозга. Для снижения риска осложнений применяют традиционный режим фракционирования в разовой очаговой дозе 1,8–2 Гр, до СОД 45–54 Гр (NCCN. Guidleines. Version 2017).
Вместе с тем, лучевое лечение может привести к различной степени выраженности нарушений функций черепно-мозговых нервов, что негативно влияет на качество жизни пациентов. Выбор оптимального метода облучения для каждого больного представляет объективную сложность. При этом достигаемый эффект, как правило, имеет временный характер, а длительность ремиссии зависит от степени агрессивности опухоли [9].
В каждом случае при определении тактики лечения необходимо учитывать размеры, локализацию опухоли и, конечно, соматический статус больного, принимая во внимание высокий риск развития осложнений лечения. Стремление к повышению эффективности лечения и увеличению продолжительности жизни данной категории онкологических больных не должно сопровождаться ухудшением качества жизни.
Мы представляем клиническое наблюдение успешного лечения пациента с диффузной глиомой ствола мозга.
Описание клинического случая
В октябре 2017 г. в Медицинский радиологический научный центр им. А.Ф. Цыба – филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Министерства здравоохранения Российской Федерации обратился на консультацию пациент В., в возрасте 20 лет. При обращении предъявлял жалобы на выраженную слабость, частые головные боли, головокружение, заторможенность, дисфонию, неустойчивость и «шаткость» при ходьбе и тремор в левой руке. Из анамнеза заболевания известно, что в течение последнего года стали беспокоить частые головные боли, головокружения. В июне 2017 г., после эпизода потери сознания, появились неустойчивость и «шаткость» при ходьбе, тремор в левой руке и нарушение речи. Пациент обратился в ФГБУ «Национальный медицинский исследовательский центр нейрохирургии им. Н.Н. Бурденко» Минздрава России. При обследовании по данным МРТ головного мозга с внутривенным контрастированием выявлено объемное образование ствола головного мозга размерами 2,9×2,6×4,0 см (V=30,1 см3) (рис. 1). В июле 2017 г. проведено хирургическое лечение в объеме частичного эндоскопического удаления опухоли. Гистологическое заключение: «диффузная астроцитома WHO grade 2». По результатам молекулярно-генетического исследования мутации гена IDH1 не выявлено. Установлен диагноз: Диффузная астроцитома ствола головного мозга G2. МКБ 10: D33.
При контрольном послеоперационном обследовании в июле 2017 г. по данным МРТ головного мозга с внутривенным контрастированием «…определяется объемное образование ствола головного мозга размерами 2,4×2,6×3,4 см (V=27,8 см3)». Учитывая невозможность радикального удаления опухоли, пациент был направлен на консультацию радиотерапевта. В МРНЦ им. А.Ф. Цыба тактика лечения обсуждена на консилиуме с участием онколога, нейрохирурга, радиотерапевта и химиотерапевта. Принято решение о возможности проведения лучевой терапии.
На этапе подготовки к лечению, для исключения возможности изменения положения пациента во время лечебной процедуры, изготовлено индивидуальное фиксирующее приспособление, состоящее из специальной подставки и подголовника, обеспечивающих комфортное и неподвижное положение пациента во время сеанса лечения, а также индивидуальной сетчатой маски из термопластмассы с дополнительными ребрами жесткости, которые закрепляют маску и тем самым обеспечивается воспроизводимость укладки пациента во время сеансов лучевой терапии на протяжении всего курса.
Перед созданием дозиметрического плана лечения было выполнено поэтапное оконтуривание необходимых объемов облучения: объема опухоли (GTV), клинического объема мишени (CTV: GTV + 1 см), планируемого объема облучения (PTV + 0,3 см) и критических структур. При планировании дозных ограничений на критические структуры были использованы рекомендации Quantec (Brain stem: Dmax<54 Гр, Chiasm: Dmax<55 Гр, Brain: Dmax<60 Гр, Optic nerves: Dmax<55 Гр, Cohlea: Dmax≤45 Гр) с поправкой на относительную биологическую эффективность протонов 1.1.
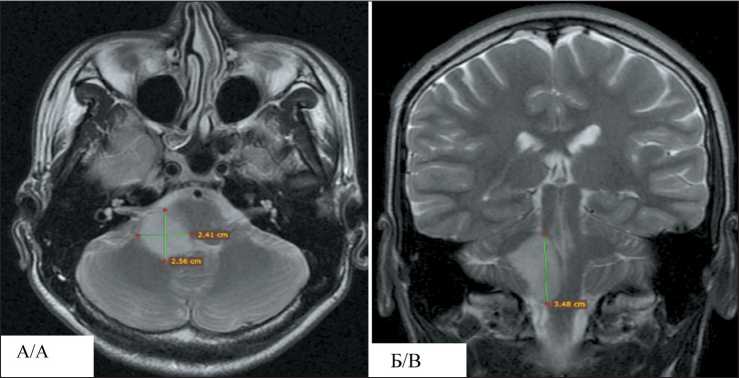
Рис. 1. МРТ головного мозга с контрастным усилением (до лечения):
А – режим T2, аксиальная проекция; Б – режим T2, фронтальная проекция
Fig. 1. Contrast-enhanced brain MR imaging (before treatment): A – T2 mode, axial projection;
B – T2 mode, frontal projection
Дозиметрическое планирование проводили на системе планирования, созданной для протонного комплекса «Прометеус». Оптимизация дозового распределения проводилась для каждого поля отдельно с целью достижения однородности дозы. Для создания плана были выбраны направления пучка протонов 0,55 и 255 градусов. Планирование проводилось на суммарную очаговую дозу 54 ГрОБЭ с критерием оценки плана 95–107 % от предписанной дозы [10, 11]. Сочетание таких факторов, как морфология, локализация и размеры первичной опухоли, является серьезной проблемой для создания дозиметрического плана лучевой терапии у больных с опухолями ствола мозга. Жизненно важные центры, находящиеся в непосредственной близости от опухоли, также чувствительны к излучению, и их повреждение может существенно ухудшить качество жизни, а иногда приводит и к летальному исходу. В связи с чем у данной группы больных максимально возможная СОД ограничена величиной радиационной толерантности ствола мозга.
При создании дозиметрического плана протонной лучевой терапии за счет пика Брегга, позволяющего уменьшить лучевую нагрузку на здоровые ткани в 2–3 раза, а также применения метода сканирования с переменной интенсивностью (IMPT – Intensity Modulated Particle Therapy), мы получили конформное дозовое распределение в мишени, что позволило уменьшить воздействие ионизирующего излучения не только на ствол мозга, но и на весь объем головного мозга. В связи с чем было принято решение о проведении пациенту курса протонной терапии, с применением технологии объемной визуализации мишени и активного сканирующего пучка протонов. Полученный дозиметрический план протонной терапии был принят в качестве лечебного плана (рис. 2).
В период с ноября по декабрь 2017 г. проведен курс протонной терапии на комплексе протонной терапии «Прометеус», в режиме традиционного фракционирования, в РОД 2 ГрОБЭ, до СОД 54 ГрОБЭ. Лечение проводилось на фоне дегидра-тационной терапии (диакарб 250 мг, через день; дексаметазон 4 мг, ежедневно). В процессе лечения наблюдалось усиление симптомов отека головного мозга, в связи с чем доза глюкокортикостероидов была увеличена до 8 мг в день. Весь период лечения пациент находился под постоянным наблюдением медицинского персонала из-за отсутствия способ-
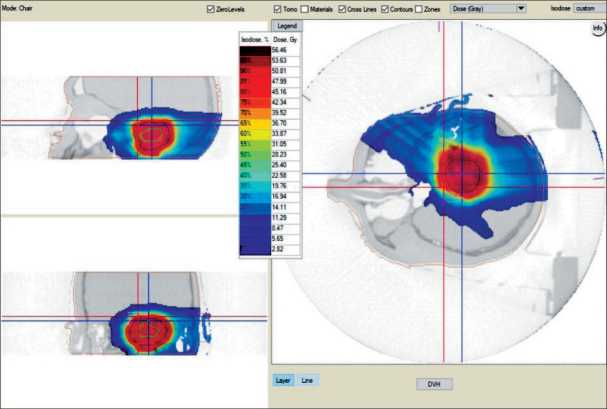
Рис. 2. Схема изодозного распределения при планировании курса протонной терапии Fig. 2. Diagram of isodose distribution for planning proton therapy
ности к самообслуживанию и самостоятельному передвижению.
Запланированный курс протонной терапии был реализован в полном объеме, без перерывов в лечении. После завершения лучевой терапии пациент выписан в удовлетворительном состоянии (с учетом тяжести основного заболевания) под наблюдение онколога и невролога по месту жительства, оставаясь под динамическим наблюдением специалистов МРНЦ им. А.Ф. Цыба.
При контрольном обследовании, по данным МРТ головного мозга с внутривенным контрастированием (24.01.2018) «…определяется объемное образование правой и средней ножки мозжечка и продолговатого мозга размерами 2,6×2,8×3,7 см, не накапливающее контрастный препарат, со сдавлением полости четвертого желудочка и церебро-медулярной цистерны». Необходимо отметить, что непосредственно после завершения курса протонной терапии пациент отметил улучшение самочувствия за счет уменьшения частоты возникновения и интенсивности головной боли, отсутствия головокружения. Таким образом, проведение облучения позволило достигнуть стабилизации процесса и сохранить приемлемое качество жизни пациента.
Учитывая удовлетворительную переносимость курса лучевой терапии, молодой возраст и отсутствие мутации гена IDH1, с целью улучшения эффекта лечения принято решение о проведении химиотерапии. С марта по май 2018 г. реализовано 3 курса химиотерапии (темозоламид 350 мг, ежедневно, в течение 5 нед, перерыв между курсами – 23 сут). При контрольном обследовании в июне 2018 г. по данным МРТ головного мозга с внутривенным контрастированием: «…сохраняется объемное образование правой и средней ножки мозжечка и продолговатого мозга, без динамики к росту». Принято решение об изменении режима химиотерапии. С июля по декабрь 2018 г. дополнительно проведено 6 курсов химиотерапии (карбоплатин 450 мг; этопозид 100 мг; 1–3 дня). Пациент перенес лечение удовлетворительно.
Осуществляется постоянное динамическое наблюдение за пациентом: в настоящее время он способен к самостоятельной деятельности, не нуждается в постоянном наблюдении со стороны родственников, память и мышление не нарушены. Посещает занятия по лечебной физкультуре, отмечает постепенное увеличение мышечной силы в левой верхней конечности.
При контрольном обследовании в июле 2020 г. по данным МРТ головного мозга с внутривенным контрастированием: «…в области правой средней ножки мозжечка и правой половине продолговатого мозга определяется новообразование размерами 2,0×1,9×3,2 см, без динамики к росту». Состояние удовлетворительное, поведение
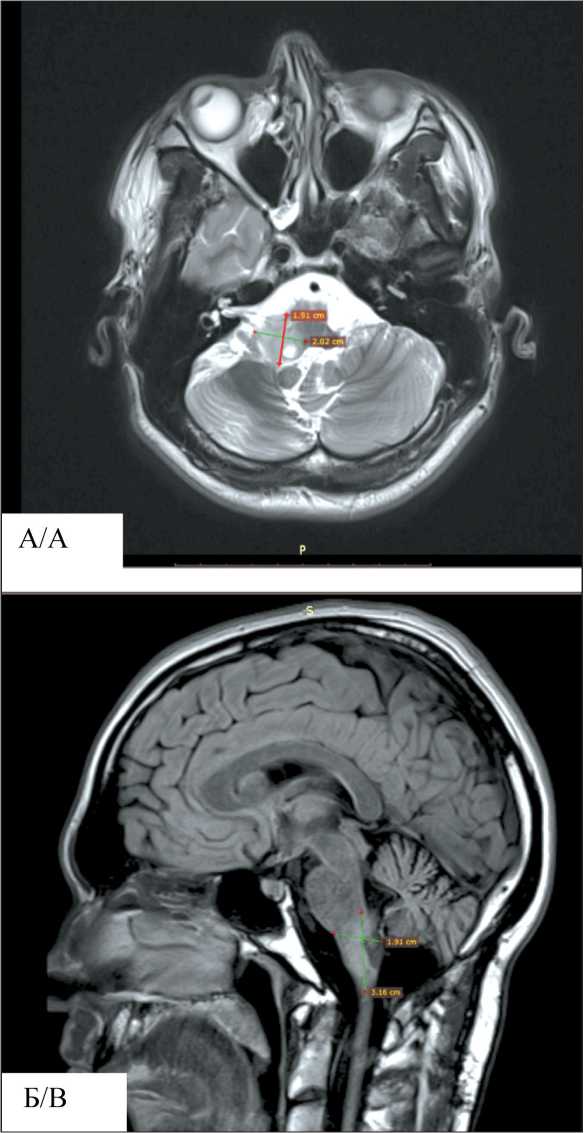
Рис. 3. МРТ головного мозга с контрастным усилением (после лечения):
А – режим T2, аксиальная проекция;
Б – режим T2, сагиттальная проекция
Fig. 3. Contrast-enhanced brain MR imaging (after treatment): A – T2 mode, axial projection; B – T2 mode, sagittal projection адекватное, пациент правильно ориентирован во времени и месте, собственной личности, эмоционально стабилен. Головные боли беспокоят редко, эпизодов потери сознания не наблюдали. Молодой человек социально активен: читает книги, активно пользуется компьютером, не нуждается в постоянном наблюдении родственников, очно получает высшее образование по профилю «адаптивная физическая культура», постоянно посещает бассейн. Осложнений лечения до настоящего времени не наблюдали. Данных за прогрессирование заболевания не получено (рис. 3). Наблюдение за пациентом продолжается.
Заключение
Представленный клинический случай демонстрирует пример успешного применения протонной терапии в лечении диффузно растущей астроцитомы ствола головного мозга. Использование протонной терапии позволило подвести максимально возможную в подобных случаях дозу излучения к опухоли с минимальным воздействием на окружающие здоровые ткани. Несмотря на
Список литературы Протонная терапия в лечении диффузной астроцитомы ствола головного мозга. Случай из практики
- Состояние онкологической помощи населению России в 2017 году. М., 2018. 236 с. [The state of oncological care for the population of Russia in 2017. Moscow, 2018. 236 p. (in Russian)].
- Каприн А.Д., Мардынский Ю.С. Терапевтическая радиология: национальное руководство. М., 2018. 704 с. [Kaprin A.D., Mardynsky Yu.S. Therapeutic radiology: national guidelines. Moscow, 2018. 704 p. (in Russian)].
- Мартынов Б.В., Парфенов В.Е., Свистов Д.В., Труфанов Г.Е., Фокин В.А., Холявин А.И., Низковолос В.Б. Влияние вида и объема хирургического вмешательства на течение послеоперационного периода у больных с глиальными опухолями. Бюллетень сибирской медицины. 2008; 7(5–1): 231–5. [Martynov B.V., Parfenov V.Y., Svistov D.V., Trufanov G.Y., Fokin V.A., Kholyavin A.I., Nizkovolos V.B. Influence of type and volume of surgical resection on postoperative period in patients with gliomas. Bulletin of Siberian Medicine. 2008; 7(5–1): 231–5. (in Russian)].
- Олюшин В.Е. Глиальные опухоли головного мозга: краткий обзор литературы и протокол лечения больных. Нейрохирургия. 2005; 4: 41–7. [Olyushin V.E. Glial brain tumors: a brief review of the literature and a protocol for the treatment of patients. Neurosurgery. 2005; 4: 41–7. (in Russian)].
- Guillamo J.S., Monjour A., Taillandier L., Devaux B., Varlet P., Haie-Meder C., Defer G.L., Maison P., Mazeron J.J., Cornu P., Delattre J.Y.; Association des Neuro-Oncologues d’Expression Française. Brainstem gliomas in adults: prognostic factors and classification. Brain. 2001; 124 (Pt 12): 2528–39. doi: 10.1093/brain/124.12.2528.
- Grimm S.A., Chamberlain M.C. Anaplastic astrocytoma. CNS Oncol. 2016; 5(3): 145–57. doi: 10.2217/cns-2016-0002.
- Щербенко О.И. Диффузно растущие опухоли ствола мозга у детей и подростков: изменила ли результаты изменяющаяся тактика лечения? Вестник рентгенологии и радиологии. 2015; (1): 43–51. [Shcherbenko O.I. Diffusely growing brainstem tumors in children and adolescents: Has alternating treatment policy changed results? Journal of Radiology and Nuclear Medicine. 2015; (1): 43–51. (in Russian)].
- Reithmeier T., Kuzeawu A., Hentschel B., Loeffler M., Trippel M., Nikkhah G. Retrospective analysis of 104 histologically proven adult brainstem gliomas: clinical symptoms, therapeutic approaches and prognostic factors. BMC Cancer. 2014; 14(1): 115. doi: 10.1186/1471-2407-14-115.
- Регентова О.С., Щербенко О.И. Современное состояние проблемы диагностики и лечения диффузно растущих глиом ствола мозга у детей и подростков. Вестник Российского научного центра рентгенорадиологии Минздрава России. 2019; 1: 95–130. [Regentova O.S., Shcherbenko O.I. The current state of the problem of diagnosing and treating diffusely growing gliomas of the brainstem in children and adolescents. Bulletin of the Russian Scientific Center for Roentgen Radiology of the Ministry of Health of Russia. 2019; 1: 95–130. (in Russian)].
- Grosshans D.R., Mohan R., Gondi V., Shih H.A., Mahajan A., Brown P.D. The role of image-guided intensity modulated proton therapy in glioma. Neuro Oncol. 2017; 19. doi: 10.1093/neuonc/nox002.
- Каприн А.Д., Мардынский Ю.С., Смирнов В.П., Иванов С.А., Костин А.А., Полихов С.А., Решетов И.В., Фатьянова А.С., Денисенко М.В., Эпатова Т.В., Коренев С.В., Терещенко А.В., Филоненко Е.В., Гафаров М.М., Романко Ю.С. К истории развития лучевой терапии (часть I). Biomedical Photonics. 2019; 8(1): 52–62. [Kaprin A.D., Mardinskiy Yu.S., Smirnov V.P., Ivanov S.A., Kostin A.A., Polikhov S.A., Reshetov I.V., Fatianova A.S., Denisenko M.V., Epatova T.V., Korenev S.V., Tereshchenko A.V., Filonenko E.V., Gafarov M.M., Romanko Yu.S. The history of radiation therapy (part I). Biomedical Photonics. 2019; 8(1): 52–62. (in Russian)].


