Провоспалительные цитокины и аутоантитела к кардиомиоцитам у пациентов с пароксизмальными наджелудочковыми тахикардиями
Автор: Дедкова А.А., Суслова Т.Е., Кологривова И.В., Баталов Р.Е., Антонченко И.В., Попов С.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3-1 т.25, 2010 года.
Бесплатный доступ
Проведена оценка уровня сывороточных IL-1β, TNF-α, аутоантител к ткани сердца и маркеров повреждения миокарда (тропонина I и сБСЖК) у пациентов с пароксизмальными наджелудочковыми тахикардиями. Обследовано 95 пациентов (40 женщин и 55 мужчин) в возрасте от 26 до 55 лет (средний возраст 49,6±2,8 лет). У 39 из них диагностирована пароксизмальная форма фибрилляции предсердий (ПФП), у 29 - синдром Вольфа-Паркинсона-Уайта (ВПУ), у 27 - атрио-вентрикулярная узловая тахикардия (УТ). Контрольную группу составили 30 практически здоровых добровольцев. Определяли интерлейкин 1β (IL-1β), фактор некроза опухолей α (TNF-α), сердечный белок, связывающий жирные кислоты (сБСЖК), и тропонин I методом твердофазного иммуноферментного анализа, аутоантитела к ткани сердца методом непрямой иммунофлуоресценции. ПФП и синдром ВПУ сопровождались увеличением концентрации сывороточных TNF-α (медиана составила 23,1 пг/мл и 39,25 пг/мл при ПФП и синдроме ВПУ соответственно) и IL-1β (48,5 пг/мл и 55,26 пг/мл при ПФП и синдроме ВПУ соответственно). При УТ увеличения содержания провоспалительных цитокинов в свободной циркуляции по сравнению с группой контроля не наблюдалось. Концентрация сБСЖК была повышена при ПФП. Антиядерные аутоантитела с наибольшей частотой выявлялись при ПФП, антисарколеммные - только при ВПУ, антифибриллярные аутоантитела определялись с высокой частотой при всех исследованных видах нарушений ритма сердца.
Пароксизмальные наджелудочковые тахикардии, цитокины, тропонин i, сердечный белок, аутоантитела к ткани сердца, связывающий жирные кислоты
Короткий адрес: https://sciup.org/14919224
IDR: 14919224 | УДК: 616.12-008.311
Текст научной статьи Провоспалительные цитокины и аутоантитела к кардиомиоцитам у пациентов с пароксизмальными наджелудочковыми тахикардиями
В настоящее время в качестве неотъемлемой части патогенеза многих заболеваний сердечно-сосудистой системы, таких как атеросклероз, сердечная недостаточность, сахарный диабет, рассматривается системная воспалительная активность, проявляющаяся повышенным уровнем сывороточных провоспалительных цитокинов [12]. Имеются единичные работы, касающиеся изучения участия воспаления в развитии наджелудочковых нарушений ритма сердца (НРС) [1, 5]. В качестве показателей воспалительной реакции используется определение С-ре-активного белка (СРБ) и провоспалительных цитокинов. Известно, что последние способны модулировать функции сердечно-сосудистой системы и могут вырабатывать- ся непосредственно в ткани сердца при определенных патологических состояниях, и на поверхности кардиомиоцитов имеются специфические к ним рецепторы [8, 10, 12]. Повышение уровня сывороточных провоспали-тельных цитокинов [интерлейкин 1в (IL-1в), фактор некроза опухолей б (TNF-б)] является чувствительным маркером воспаления, однако все же носит неспецифический характер. Возрастание титра аутоантител (АТ) к ткани сердца указывает на воспалительный процесс с аутоиммунным компонентом, локализованный непосредственно в миокарде [4]. В случае неспособности регулирующих систем к поддержанию гомеостаза цитокины и аутореактивные АТ могут оказывать цитотоксическое дей- ствие, приводя к деструктивным процессам и выходу маркеров повреждения миокарда в кровоток. Сердечные формы тропонина I (сТнI) и белка, связывающего жирные кислоты (сБСЖК), являются наиболее современными маркерами повреждения миокарда. Определение данных показателей в совокупности позволяет судить о протекании в миокарде субклинического аутоиммунного воспаления.
В связи с этим целью работы явилась оценка уровня сывороточных IL-1в, TNF-б, аутоантител к ткани сердца и маркеров повреждения миокарда (сТнI и сБСЖК) у пациентов с пароксизмальными наджелудочковыми тахикардиями.
Материал и методы
Обследовано 95 пациентов (40 женщин и 55 мужчин) в возрасте от 26 до 55 лет (средний возраст 49,6±2,8 лет). У 39 из них диагностирована пароксизмальная форма фибрилляции предсердий (ПФП), у 29 – синдром Воль-фа–Паркинсона–Уайта (ВПУ), у 27 – атриовентрикулярная узловая тахикардия (УТ). Контрольная группа была сопоставима по полу и возрасту с клиническими группами и состояла из 30 практически здоровых добровольцев. У всех обследованных в качестве основной либо сопутствующей патологии не было выявлено острых заболеваний воспалительного характера, и традиционные лабораторные показатели воспаления были в пределах нормальных значений. Критериями исключения явились: наличие острых воспалительных заболеваний или обострения хронических воспалительных заболеваний в течение 2 недель до включения в исследование; тяжелая сердечная недостаточность ФК III, IV по классификации NYHA; острый инфаркт миокарда, перенесенный менее 2 месяцев назад; стенозирующий атеросклероз коронарных артерий без реваскуляризации; заболевания щитовидной железы, сахарный диабет, ревматическая болезнь сердца.
Материалом для исследования служила сыворотка крови. Исследуемую сыворотку хранили при температуре –70 °С. Образцы, в которых произошел гемолиз, исключались из исследования.
Определение концентрации провоспалительных цитокинов (IL-1в и TNF-α), тропонина I и сБСЖК в сыворотке крови проводили с помощью иммуноферментно-го анализа (тест-системы ООО “Протеиновый контур”, Санкт-Петербург; “Hycult biotechnology”, Нидерланды и “Biomerica”, Германия соответственно). Антитела к мио- карду определяли методом непрямой иммунофлуоресценции (тест-система “IMMCO Diagnostics”, USA). По локализации флуорохрома на гистологическом препарате методом флуоресцентной микроскопии учитывали наличие антифибриллярных, антисарколеммных и антинук-леарных антител.
Статистическую обработку результатов проводили с помощью пакета программ SPSS 11.5 for Windows. Использовали метод Шапиро–Вилкса, критерии Крускала–Уоллиса, Манна–Уитни с поправкой Бонферронни, точный критерий Фишера; корреляционный анализ проводили по методу Спирмена. Различия считали достоверными при р<0,05. Результаты представляли в виде медианы (Ме) с интерквартильным размахом (25–75-й процентиль).
Результаты
Содержание провоспалительных цитокинов отличалось в разных клинических группах и было наибольшим при ПФП и синдроме ВПУ. Концентрация IL-1 β изменялась наиболее значительно (таблица).
При вышеуказанных суправентрикулярных тахикардиях повышение уровня данного цитокина было достоверным по сравнению с группой здоровых добровольцев (р=0,005 для ПФП и синдрома ВПУ). Концентрация TNF- α при ПФП и синдроме ВПУ была также выше, чем в контрольной группе (р=0,005 для ПФП и синдрома ВПУ). При ПФП медиана превышала медиану в группе здоровых доноров в 3,8 раз, при синдроме ВПУ – в 6,51 раз. При атриовентрикулярной УТ наблюдалось увеличение концентрации TNF- α по сравнению с контрольной группой (р=0,035), достоверного увеличения концентрации IL-1 β не отмечалось (р=0,165).
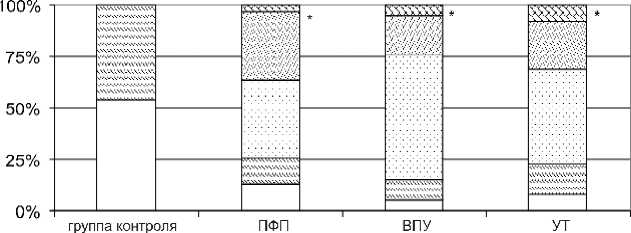
У всех обследуемых определялись АТ к компонентам кардиомиоцитов. Частота выявления АТ к ткани сердца в группе здоровых добровольцев была невысокой. У большинства из них АТ найдено не было, у остальных – выявлены в диагностически незначимом титре 1:20. Во всех группах пациентов с пароксизмальными суправентрикулярными тахикардиями наблюдалось достоверное увеличение частоты обнаружения АТ к фибриллярным структурам миокарда (р=0,005 для всех групп), рисунок 1.
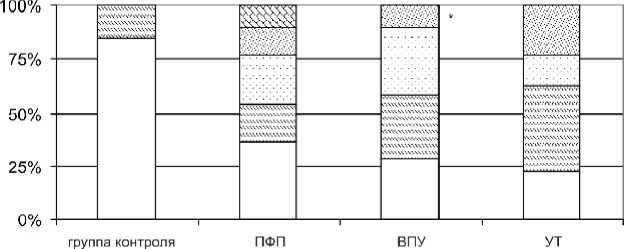
Частота появления АТ к сарколеммным структурам миокарда была повышена достоверно только при синдроме ВПУ (р=0,035), рисунок 2.
При исследовании уровня АТ к ядрам кардиомиоцитов выявлено достоверное увеличение АТ данной специфичности во всех группах пациентов с НРС. При ПФП
Таблица
Концентрация провоспалительных цитокинов у пациентов с пароксизмальными наджелудочковыми тахикардиями
|
Обследованные группы |
Концентрация фактора некроза опухолей-α, пкг/мл, Me (Q1–Q3) |
Концентрация интерлейкина-1β, пкг/мл, Me (Q1–Q3) |
|
Контрольная группа, n=30 |
6,02 (3,02–17,62) |
1,09 (0,001–20,08) |
|
Пациенты с пароксизмальной фибрилляцией предсердий, n=39 |
23,1* (18,94–45,09) |
48,5* (23,87–391,6) |
|
Пациенты с синдромом Вольфа–Паркинсона–Уайта, n=29 |
39,25* (27,04–68,59) |
55,26* (15,09–880,55) |
|
Пациенты с атриовентрикулярной узловой тахикардией, n=27 |
26,71* (21,48–37,01) |
28,62 (1,20–238,06) |
Примечание: * – p<0,05 по сравнению с контрольной группой; Ме – медиана; Q1 – 25-й процентиль; Q3 – 75-й процентиль; n – число обследованных.
наблюдался самый высокий титр и максимальная частота встречаемости АТ к ядрам. Различия частот по сравнению с контрольной группой были достоверными (р=0,005), рисунок 3. При синдроме ВПУ частота выявления АТ к ядрам кардиомиоцитов была достоверно выше, чем в контрольной группе (р=0,025). При УТ антинуклеарные АТ также определялись достоверно чаще, чем в группе здоровых доноров (р=0,035).
С помощью корреляционного анализа мы проследили взаимоотношения между маркерами повреждения миокарда, провоспалительными цитокинами и аутоантителами различной специфичности при пароксизмальных суправентрикулярных тахикардиях.
При ПФП умеренная корреляционная связь обнаружена между аутоантителами к фибриллярным структурам миокарда и аутоантителами к сарко-леммным структурам (r=0,48). Корреляционная связь средней силы наблюдалась между сБСЖК и IL-1 β (r=0,53). Тесная взаимосвязь была выявлена между исследуемыми провоспалительными цитокинами TNF- α и IL-1 β (r=0,78), а также между IL-1 β и аутоантителами к фибриллярным структурам миокарда (r=0,76).
При синдроме ВПУ корреляционной связью средней силы между собой были связаны исключительно провоспали-тельные цитокины IL-1 β и TNF- α (r=0,70).
При УТ были найдены тесные корреляционные связи в основном между блоками провоспалительных цитокинов и индикаторов аутоиммунного воспаления. TNF- α коррелировал с антителами к фибриллярным структурам миокарда (r=0,89) и с антисарколеммными аутоантителами (r=0,89). Сильная связь обнаружена между IL-1 β и антинуклеарны-ми аутоантителами (r=0,89). Кроме того, была выявлена положительная тесная корреляционная связь внутри блока
| □аши!ела uicyiciBytoi Qinip1;20 □"1И1р1;40 Q титр 1.80 QiMipLWO |
Рис. 1. Частота выявления антител к фибриллярным структурам миокарда (* – p<0,05 по сравнению с группой контроля)
(jантитела отсутствуют м титр 1:20 ититр1:40 ^титр 1:80 щ титр 1:160
Рис. 2. Частота выявления антител к сарколеммным структурам миокарда (* – p<0,05 по сравнению с группой здоровых добровольцев)
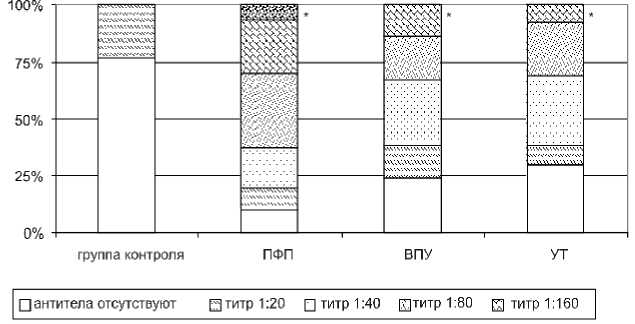
Рис. 3. Частота выявления антител к ядрам кардиомиоцитов (* – p<0,05 по сравнению с группой здоровых добровольцев)
индикаторов аутоиммунного воспале ния между антифибриллярными и антисарколеммными антителами (r=0,85).
Подобных корреляционных связей в группе здоровых доноров установлено не было.
При исследовании концентрации маркеров повреждения миокарда было обнаружено достоверное увеличение содержания сБСЖК при ПФП по сравнению с группой здоровых доноров (р=0,04). Различия между концентрацией сТнI у пациентов с ПФП и в контрольной группе были недостоверными (р=0,18).
В группе пациентов с УТ увеличение концентрации маркеров повреждения миокарда по сравнению с контрольной группой было недостоверным (р=0,975, р=1,845 для сТнI и сБСЖК соответственно). При ВПУ повышения уровня сТнI и сБСЖК также не наблюдалось (р=0,14, р=4,42 для сТнI и сБСЖК соответственно). Следует отметить, что ранее мы проводили определение концентрации сБСЖК с помощью тест-систем фирмы “НВО Иммунотех”, для которых верхней границей допустимых зна- чений является концентрация сБСЖК 20 нг/мл [13]. В настоящей работе использовались тест-системы фирмы “Hycult biotechnology” (Нидерланды), в которых верхняя граница нормы значительно ниже – 1,6 нг/мл. Данная величина согласуется с большинством сведений литературы и, на наш взгляд, более достоверна.
Обсуждение
Нами была проведена оценка содержания провоспа-лительных цитокинов, маркеров повреждения миокарда и антимиокардиальных аутоантител у пациентов с пароксизмальными наджелудочковыми тахикардиями.
ПФП сопровождалась увеличением концентрации провоспалительных цитокинов, сБСЖК и аутоантител к ткани сердца различной специфичности. Мы предполагаем, что при данном виде НРС инициирующим аритмо-генным фактором является субклиническое воспаление, сопровождающееся синтезом провоспалительных цитокинов. Известно, что TNF- α и IL-1 β могут синтезироваться непосредственно в ткани сердца, и на поверхности кардиомиоцитов имеются специфические к ним рецепторы [2, 6]. При связывании цитокинов с последними может запускаться программируемая клеточная гибель в виде некроза или апоптоза, в результате чего сБСЖК поступает в кровоток [11]. Некроз кардиомиоцитов сопровождается дальнейшим развитием локального субклинического воспаления в миокарде, приводящего к появлению аритмогенного субстрата. Уже на данном этапе возможно развитие ФП. Также возможен срыв аутотолерантности при появлении аутореактивных клонов В-лимфо-цитов. АТ при связывании со специфическими миокардиальными антигенами могут приводить к нарушению нормального функционирования клеток миокарда.
Изменения исследуемых показателей при УТ соответствовали таковым при ПФП, однако были менее выражены. Предположительно, это связано с тем, что локальное аутоиммунное воспаление при УТ охватывает меньшую область миокарда, по всей видимости, локализованную в зоне атриовентрикулярного узла.
Нами показано участие субклинического воспалительного процесса с аутоиммунным компонентом при синдроме ВПУ, развитие которого до настоящего времени объясняли исключительно особенностями проводящей системы сердца. Вероятно, срыв аутотолерантности в данном случае является наследственно обусловленным и сопровождается нарушением клеточного метаболизма кардиомиоцитов, вследствие чего становится возможным проведение импульса по добавочным путям проведения.
Таким образом, результаты нашей работы позволяют предположить, что аутоиммунные реакции могут способствовать развитию аритмий и являются компонентом патогенеза пароксизмальных наджелудочковых тахикардий, однако взаимосвязь этих процессов требует дальнейшего изучения.
Выводы
-
1. Полученные нами данные позволяют сделать предположение, что повышенная экспрессия цитокинов при пароксизмальных наджелудочковых тахикардиях может быть связана непосредственно с патогенезом данных аритмий и указывает на наличие субклинического воспаления.
-
2. Повышение аутоантител к компонентам кардиомиоцитов свидетельствует о том, что в развитии нарушений ритма сердца могут принимать участие воспалительные процессы аутоиммунного характера даже у пациентов с синдромом ВПУ, существование которого до настоящего времени связывали исключительно с морфологическими особенностями проводящей системы сердца.
Список литературы Провоспалительные цитокины и аутоантитела к кардиомиоцитам у пациентов с пароксизмальными наджелудочковыми тахикардиями
- Aviles R.J. Inflammation as a risk factor for atrial fibrillation/R.J. Aviles, D.O. Martin et al.//Circulation. -2003. -Vol. 108. -P. 3006-3010.
- Birks E.J. Elevated tumor necrosis factor-α and interleukin-6 in myocardium and serum of malfunctioning donor hearts/E.J. Birks, P.B.J. Burton, V. Owen, et al.//Circulation. -2000. -Vol. 7. -P. III352-III358.
- Boos C.J. Is atrial fibrillation an inflammatory disorder?/C.J. Boos, R.A. Anderson, G.Y.H. Lip//European Heart Journal. -2006. -Vol. 27. -P. 136-149.
- Caforio A.L.P. Prospective familial assessment in dilated cardiomyopathy: cardiac autoantibodies predict disease development in asymptomatic relatives/A. L.P. Caforio, N.G. Mahon, M.K. Baig et al.//Circulation. -2007. -Vol. 115. -P. 76-83.
- Chung, M.K. C-reactive protein elevation in patients with atrial arrhythmias. Inflammatory mechanisms and persistens of atrial fibrillation/M.K. Chung, D.O. Martin et al.//Circulation. -2001. -Vol. 104. -P. 2886-2891.
- Goette A. Signal transduction systems and atrial fibrillation/A. Goette, U. Lendeckelb, H.U. Klein//Cardiovascular Research. -2002. -Vol. 54(2). -P. 247-258.
- Lazzerini P.E. Autoantibody-mediated cardiac arrhythmias: mechanisms and clinical implications/P.E. Lazzerini, P.L. Capecchi, F. Guideri et al.//Basic. Res. Cardiol. -2008. -Vol. 103. -P. 1-11.
- Long C.S. The role of interleukin-1 in the failing heart/C.S. Long//Heart Failure Reviews. -2001. -Vol. 6(2). -P. 81-94.
- Morgan M.J. TNF-α and reactive oxygen species in necrotic cell death/M.J. Morgan, Y.-S. Kim, Z. Liu//Cell Research. -2008. -Vol. 18. -P. 343-349.
- Nattel S. Atrial electrophysiology and mechanisms of atrial fibrillation/S. Nattel//J. Cardiovasc. Pharmacol. Therapeutics. -2003. -Vol. 8 (1). -P. S5-S11.
- Бурместер Г.-Р. Наглядная иммунология/Г.-Р. Бурместер. -М.: Бином. Лаборатория знаний, 2007. -320 с.
- Насонов Е.Л., Самсонов М.Ю., Беленков Ю.Н. и др. Иммунопатология застойной сердечной недостаточности: роль цитокинов//Кардиология. -1999. -№ 3. -С. 66-73.
- Рябов В.В. Определение белка, связывающего жирные кислоты, в диагностике инфаркта миокарда/В.В. Рябов, Т.Е. Суслова, В.А. Марков//Бюллетень СО РАМН. -2005. -№3(117). -С. 26-29.


